氧糖剥夺再灌注引起的SH-SY5Y细胞凋亡与NF-κBp65和COX-2蛋白表达的关系
黄 赟, 董艳军, 肖 雁, 官志忠
氧糖剥夺再灌注引起的SH-SY5Y细胞凋亡与NF-κBp65和COX-2蛋白表达的关系
黄 赟1, 董艳军2, 肖 雁1, 官志忠1
目的 探讨氧糖剥夺再灌注(oxygen-glucose deprivation/reperfusion,OGD/R)后SH-SY5Y细胞凋亡情况及NF-κB信号通路NF-κBp65、COX-2蛋白的表达。方法 将SH-SY5Y细胞分为正常对照组、氧糖剥夺4 h/再灌注24 h组(OGD/R)组。利用流式细胞术分别检测各组细胞凋亡率,蛋白印记法(Western blot)检测p65和COX-2的蛋白表达情况。结果 与正常对照组比较,OGD/R组细胞凋亡率明显增高(P<0.05),p65和COX-2的蛋白表达也明显增高(P<0.05)。结论 氧糖剥夺4 h/再灌注24 h能够促进细胞凋亡,其机制可能是通过NF-κBp65对COX-2调控的信号通路来实现。
氧糖剥夺再灌注; 细胞凋亡; NF-κBp6; COX-2
缺血是引起细胞死亡的一个重要原因,然而医学研究发现,真正造成细胞死亡的原因并不是缺血本身,而是恢复血供后,过量的自由基对缺血细胞的攻击造成的损伤,这种损伤叫做“缺血再灌注损伤”。而缺血再灌注损伤引起的细胞凋亡则是造成细胞死亡的一个重要原因[1]。众多研究表明,缺血再灌注后细胞凋亡率明显增高[2,3]。然而细胞凋亡的相关机制及其涉及到的信号通路尚不十分明确。本研究以人神经母细胞瘤细胞株(SH-SY5Y)为研究对象,通过构建氧糖剥夺再灌注模型,模拟缺血再灌注损伤,对缺血再灌注损伤后神经细胞的凋亡及可能机制进行研究。
1 材料与方法
1.1 材 料 细胞SH-SY5Y细胞株,为本实验室本课题组稳定保存。试剂:DMEM高糖培养基、双抗(青霉素、链霉素)、0.25%胰酶购自美国Hyclone公司;胎牛血清、DMEM无糖培养基购自美国Gibco公司;Annexin V-FITC/PI细胞凋亡检测试剂盒购自上海贝博生物;p65抗体购自美国Cell Signaling公司;COX-2抗体购自美国Gentex公司;GAPDH购自美国Proteintech公司;HRP标记的抗鼠二抗、抗兔二抗均购自北京中杉金桥生物技术有限公司;蛋白定量试剂盒、5×蛋白上样缓冲液、SDS-PAGE凝胶配制试剂盒、封闭液、一抗稀释液、二抗稀释液、显影定影试剂盒均购自碧云天生物技术有限公司;PVDF膜、ECL-Plus发光试剂购自美国Millipore公司;成像胶片购自柯达公司。仪器:流式细胞仪,美国BD公司;ELX800UV酶标仪,美国Bio-Tec公司;Western blot跑胶装置,北京百晶生物技术有限公司。
1.2 方 法
1.2.1 SH-SY5Y细胞培养 采用常规细胞培养方法复苏SH-SY5Y细胞,然后用含10%胎牛血清的DMEM高糖培养基将细胞稀释至一定密度后置于37 ℃,5%CO2恒温培养箱中培养。约2~3 d传代一次,取对数生长期细胞进行后续实验。
1.2.2 SH-SY5Y细胞氧糖剥夺模型的建立 实验前1 d向三气培养箱内充入94%N2+5%CO2混合气体,使培养箱内气体浓度为94%N2、%CO2、1%O2。将细胞按0.5×106个/ml的密度接种于6孔板。24 h后,观察细胞已贴壁且生长良好,将细胞分为正常对照组和OGD/R组,每组均设3个复孔。正常对照组于普通培养箱中继续培养;而OGD/R组则将细胞取出,倒掉原培养基,用PBS清洗3次(1 min/次)以除去原培养基中的葡萄糖和胎牛血清对后续实验的影响。然后加入只含1%双抗,不含血清的无糖培养基,最后将细胞置于三气培养箱中培养4 h。之后取出细胞,再以PBS清洗3次(1 min/次)后更换含10%胎牛血清的DMEM高糖培养基于普通二氧化碳恒温培养箱中继续培养24 h。
1.2.3 流式细胞术检测细胞凋亡 OGD/R结束后,收集两组细胞。用0.25%不含EDTA的胰酶消化后终止消化,用PBS清洗两次,每次以1000 rpm/min的速度离心5 min。然后用400 μl 1×Annexin V结合液悬浮细胞。在细胞悬浮液中加2.5 μl Annexin V-FITC染色液,轻轻混匀后于4 ℃冰箱孵育15 min。之后再加入10 μl PI染色液后轻轻混匀于4 ℃冰箱孵育5 min。立即用流式细胞仪进行检测。
1.2.4 Western blot检测p65和COX-2的蛋白表达 RIPA蛋白裂解液与PMSF按100∶1的比例混合后,每孔加入100 μl蛋白裂解液,将细胞于冰上裂解1 h。之后于4 ℃低温离心机12000 r/min离心20 min,取上清,BCA法进行蛋白定量后以25 μg的蛋白总量上样。制备8%-聚丙烯酰胺凝胶,以80 V电压跑至蛋白Marker条带分开后,将电压调至120 V至电泳结束。然后以200 mA的电流转膜100 min,转膜结束后用TBST洗膜两次,5 min/次,之后封闭液封闭2 h。封闭结束后TBST洗膜3次,5 min/次,最后一抗p65(1∶1000)、COX-2(1∶1000)、GAPDH(1∶20000)孵育于4 ℃冰箱过夜。第2天回收一抗,TBST洗膜5次,5 min/次,p65和COX-2蛋白以抗兔二抗(1∶10000)孵育1 h,GAPDH蛋白以抗鼠二抗(1∶100000)孵育1 h,TBST洗膜1 h,最后暗室曝光,扫描条带后使用Image J软件对数据进行分析。

2 结 果
2.1 细胞凋亡检测结果 细胞凋亡情况用凋亡率表示,为早期凋亡与晚期凋亡之和。在流式细胞仪的散点图上,左下象限显示活细胞,为FITC-/PI-;右上象限为晚期凋亡细胞,为FITC+/PI+;而右下象限为早期凋亡细胞,FITC+/PI-(见图1)。从图上看出,对照组细胞主要分布在左下象限,只有少量细胞分布在右上象限和右下象限;而OGD/R组细胞在右上象限和右下象限都有明显增加,说明早期凋亡细胞、晚期凋亡和坏死细胞增加。统计结果表明,OGD/R组与正常对照组相比细胞凋亡率明显增加且有统计学意义(P<0.05)(见图2)。
2.2 NF-κBp65与COX-2蛋白表达情况 Western blot结果显示,与正常对照组相比,OGD/R组p65和COX-2蛋白表达量均有显著增高且有统计学意义(P<0.05)(见图3)。
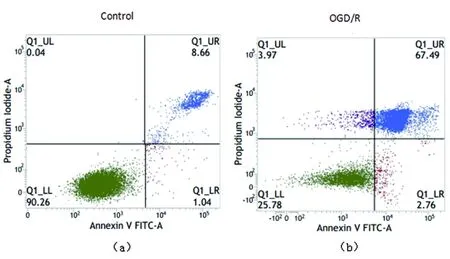
a:正常对照组(Control组);b:氧糖剥夺再灌注组(OGD/R组)
图1 AnnexinV-FITC /PI双染流式细胞术检测凋亡
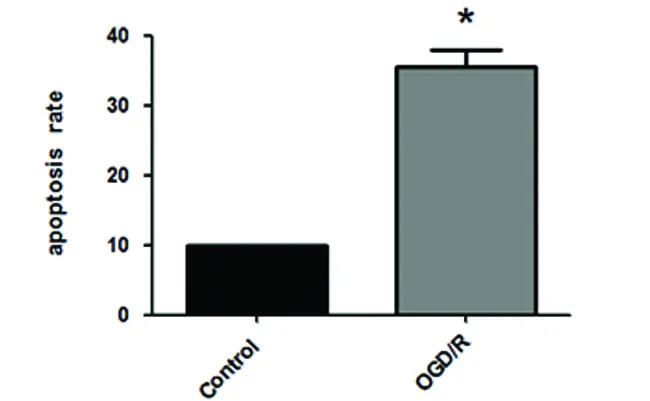
与Control组比较*P<0.05
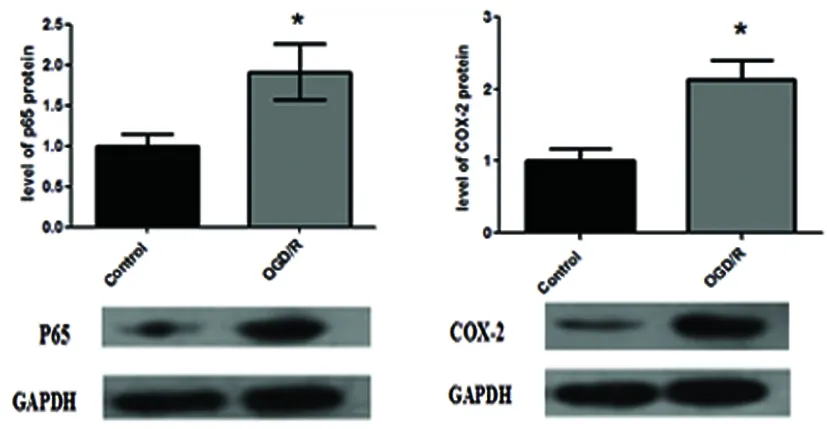
与Control组比较*P<0.05
3 讨 论
缺血再灌注造成的脑损伤是导致死亡和长期残疾的一个主要因素[4],在体外研究中,OGD/R模型是体外模拟脑缺血再灌注的常用模型。SH-SY5Y细胞株是人神经母细胞瘤细胞,具有神经细胞及肿瘤细胞的特点,因而广泛应用于神经系统疾病研究。细胞凋亡(apoptosis)或程序化细胞死亡(programmed cell death,PCD)是多细胞有机体为调控机体发育、维护内环境稳定、由基因控制的细胞主动死亡的过程[5]。凋亡过程中细胞发生一系列形态学及生物化学的改变,目前在体内体外均有多种方法可以检测这些改变以反映凋亡过程,如形态学检测法、DNA片段化检测、TUNEL检测法等;流式细胞术、线粒体膜电位检测等[6]。
本实验研究以SH-SY5Y细胞为研究对象构建OGD/R模型,以AnnexinV-FITC/PI双标记流式细胞术为检测手段检测细胞凋亡。从实验结果可以看到,正常对照组细胞只有少量细胞凋亡。当OGD/R发生时,早期凋亡细胞和晚期凋亡细胞数明显增多,表明SH-SY5Y细胞凋亡率明显增高,说明对细胞进行OGD/R处理后可明显诱发SH-SY5Y细胞凋亡。
核因子-κB(NF-κB)是细胞内普遍存在的转录因子,是多种信号通路转导途径的汇聚点,其典型代表是p50/p65异源二聚体,NF-κBp65在缺血引起的程序性细胞死亡包括细胞凋亡和自噬中起重要作用[7~9]。Zhang等在研究短暂性脑缺血发作的实验中发现,NF-κBp65激活与神经元损伤密切相关,且抑制NF-κBp65活化对神经细胞凋亡有保护作用[10]。COX-2为诱生型环氧化酶,是炎性反应的标志物,也是脑缺血导致神经元死亡的关键酶[11]。它是NF-κB信号通路中一种重要的蛋白分子,对脑缺血损伤有重要作用,也对激活NF-κB有重要意义[12]。有报道指出,当缺血再灌注损伤发生时,大鼠脑组织中COX-2表达增加[13]。本课题组前期研究表明,缺血再灌注大鼠海马NF-κBp65及COX-2的表达均高于正常SD大鼠[14]。本次研究利用Western blot技术对NF-κBp65和COX-2在SH-SY5Y细胞中的表达量进行测定,发现OGD/R后,细胞NF-κBp65和COX-2的表达量较正常对照组都有明显增高。说明当OGD/R发生时可能激活了NF-κB信号通路,NF-κBp65又对其下游的COX-2产生作用,使其表达量增高。
综上所述,当对SH-SY5Y细胞进行氧糖剥夺4 h、再灌注24 h处理后,细胞凋亡率较正常细胞明显上升,且NF-κB信号通路被激活,说明其产生凋亡的机制可能是通过NF-κBp65激活COX-2实现的。
[1]张 雯,宋俊科,杜冠华.缺血再灌注损伤与细胞凋亡信号转导通路[J].中国药学杂志,2015,50(7):565-569.
[2]Guo K,Yin G,Zi XH,et al.A study on expression and tyrosine 705 phosphorylation of STAT3 in focal cerebral ischemia-reperfusion rat model and its role in neuronal apoptosis[J].Tropical J Pharmaceuti Res Feb,2016,15(2):267-274.
[3]Zheng L,Ding JL,Wang JW,et al.Effects and mechanism of action inducible nitric oxide synthase on apoptosis in a rat model of cerebra ischemia-reperfusion Injury[J].The Anatomical Record,2016,299:246-255.
[4]Yu SJ,Kim JR,Lee CK,et al.Gastrodia elata blume and an active component,p-hydroxybenzyl alcohol reduce focal ischemic brain injury through antioxidant related gene expressions[J].Biol Pharm Bull,2005,28:1016-1020.
[5]Martin DA,Elkon KB.Mechanisms of apoptosis [J].Rheum Dis Clin North Am,2004,30(3):441-454.
[6]高 超,华子春.细胞凋亡检测方法新进展[J].中国细胞生物学学报,2011,33(5):564-569.
[7]You WC,Wang CX,Pan YX,et al.Activation on nuclear factor-κB in the brain after experimental subarachnoid hemorrhage and its potential role in delayed brain injury[J].PLos One,2013,8(3):e60290.
[8]Chu W,Li M,Li F,et al.Immediate splenectomy down regulates the MAPK NF-κB signaling pathway in rat brain after severe traumatic brain injury[J].J Trauma Acute Care Surg,2013,74(6):1446-1453.
[9]Bu QX,Liu XY,Zhu YJ,et al.w007B protects brain against ischemia-reperfusion injury in rats through inhibiting inflammation,apoptosis and autophagy[J].Brain Res,2014,1558:100-108.
[10]Zhang W,Potmrita I,Tarabin V,et al.Neuronal activation of NF-kappa B contributes to cell death in cerebral ischemia[J].Joumal of Cerebral Blood Flow and Metabolism,2005,25(1):30-40.
[11]杨 彬,余丽娟,王 佳,等.COX-2在全脑缺血再灌注大鼠皮质时程表达变化[J].第三军医大学学报,2014,36(2):135-139.
[12]肖爱娇,罗小泉.艾灸对脑缺血再灌注损伤模型大鼠大脑皮质NF-κBp65蛋白表达的影响[J].中华中医药杂志,2013,28(12):3532-3535.
[13]Rizwana T,Kumar V,Pallavi S,et al.Perillyl alcohol improves functional and histological outcomes against ischemia-reperfusion injury by attenuation of oxidative stress and repression of COX-2,NOS-2 and NF-κB in middle cerebral artery occlusion rats[J].European Journal of Pharmacology,2015,747:190-199.
[14]董艳军,黄 赟,田 茂,等.外源性H2S对血管性痴呆大鼠海马核因子-κB、环氧合酶-2表达的影响[J].中风与神经疾病杂志,2015,32(12):1064-1067.
The relationship between the apoptosis of SH-SY5Y cells and NF-κBp65,COX-2 after oxygen-glucose deprivation/reperfusion
HUANGYun,DONGYanjun,XIAOYan,etal.
(TheKeyLaboratoryofMolecularBiology,GuizhouMedicalUniversity,Guiyang550004,China)
Objective To explore the relationship between the apoptosis of SH-SY5Y cells and NF-κBp65,COX-2 after oxygen-glucose deprivation/reperfusion (OGD/R).Methods Cells were divided into normal control group and oxygen glucose deprivation 4 h/reperfusion 24 h groups.The cell apoptosis rate was analyzed using flowcytometry,and Western blot assay was used to evaluate the expression of p65 and COX-2 proteins in control group and OGD/R group.Results Compared with the normal control group,the apoptosis rate of OGD/R group was significantly higher (P<0.05),and the protein expression of p65 and COX-2 was also significantly increased (P<0.05).Conclusion Oxygen glucose deprivation 4 h/reperfusion 24 h can induced apoptosis,which may be through the signaling pathway that NF-κB p65 regulates COX-2 to achieve.
Oxygen-glucose deprivation/reperfusion; Apoptosis; NF-κBp65; COX-2
2016-10-09;
2016-11-29
国家自然科学基金(No. 81160149);贵州省科技厅基金项目[黔科合J字(2014)2012]
(1.贵州医科大学分子生物学重点实验室,贵州医科大学地方病与少数民族疾病教育部重点实验室,贵州 贵阳 550004;2.贵州省人民医院病理科,贵州 贵阳 550004)
肖 雁,E-mail:xiaoyanhonan@hotmail.com
1003-2754(2017)02-0119-03
R743.3
A

