半抗原-琼脂扩散试验鉴别布鲁氏菌感染抗体和S2、Rev.1免疫抗体的研究与应用
杨 珍,尼 博,田莉莉,范伟兴
半抗原-琼脂扩散试验鉴别布鲁氏菌感染抗体和S2、Rev.1免疫抗体的研究与应用
杨 珍,尼 博,田莉莉,范伟兴
目的 布鲁氏菌病严重威胁着我国畜牧业生产和公共卫生安全,现有的常规血清学检测方法虽具有较高的敏感性与特异性,但无法区分布鲁氏菌感染抗体和S2、Rev.1疫苗免疫抗体(以下简称“鉴别诊断”),给我国执行扑杀布病感染动物的政策带来阻力。 因此在S2和Rev.1疫苗免疫背景下研究天然半抗原-琼脂扩散试验(NH-GD)的鉴别诊断能力。方法
布鲁氏菌病;半抗原-琼脂扩散试验;鉴别诊断
Supported by the Construction Program of Modern Agricultural (cows) Industrial Technology System(CARS-37)
Correspondence authors:FAN wei-xing,Email:fwx521@126.com
近年来,我国人畜间布鲁氏菌病(以下简称“布病”)病例呈现上升趋势,严重威胁畜牧生产、食品安全和卫生安全。布病作为一种人兽共患病,人的感染风险极高,仅在2015年一年全国报告的人间布病病例就接近60 000例。常规的血清学诊断方法以光滑型脂多糖(S-LPS)抗原为基础,包括虎红平板凝集试验(RBT)、试管凝集试验(SAT)、酶联免疫吸附试验(ELISA)、补体结合试验(CFT)等,能够检测到S-LPS抗体,但动物接种疫苗后同样产生针对S-LPS的抗体,不能达到区分布鲁氏菌感染抗体和疫苗免疫抗体的目的。在我国执行布病防控 “检测-扑杀” 政策背景下,急需一种能够鉴别布鲁氏菌感染抗体和疫苗免疫抗体的诊断技术,以促进“检测-扑杀”政策的贯彻执行。因此,寻找区分布鲁氏菌感染抗体和疫苗免疫抗体的鉴别诊断技术不仅仅是一项科研任务,对我国布病防控政策的实施亦具重要意义。
除了S-LPS分子外,光滑型布鲁氏菌表面还有一种天然半抗原(Native Hapten,NH)。有研究表明,接种S19疫苗的动物血清中检测不到NH抗体的存在[1],而野毒感染血清中能够检测到NH抗体的存在。所以,基于NH建立的检测方法可以为鉴别诊断提供新的思路。之前有报道称,在欧洲利用NH抗原的琼脂扩散试验(Gel Diffusion, GD)可以很好地区别Rev.1疫苗免疫与野毒感染。西班牙布病专家BLASCO对布鲁氏菌NH抗原进行很多研究,肯定其在布病感染和疫苗免疫中的鉴别诊断作用[2]。在BLASCO的帮助下,研究NH-GD试验在S2、Rev.1免疫背景下对布病感染抗体和S2、Rev.1免疫抗体的鉴别诊断能力,为我国布病防控政策的执行提供一种鉴别诊断技术。
1 材料与方法
1.1 血清与菌株 61份布病阳性血清 采自无布病疫苗接种史的绵羊群,且经RBT、SAT和CFT检测为阳性的血清;300份布病阴性血清:采自无布病发病史的绵羊群,经RBT、SAT和CFT检测为阴性的血清。S2、Rev.1疫苗免疫血清:S2口服免疫、Rev-1点眼免疫各接种20只健康绵羊,分别在免疫后第7 d、14 d、21 d、28 d、58 d、90 d、122 d采集血清。B.mehitensis16M菌株由本实验室保存。布鲁氏菌病阳性血清国家标准品(Z112)、布鲁氏菌病阴性血清(Z3):购自中国兽医微生物菌种保藏管理中心(CVCC)。
1.2 试剂 琼脂(DifcoTMAgar Noble)购自BD公司;硼酸、氯化钾、氯化钠购自国药集团化学试剂有限公司;标准NH抗原由西班牙阿拉贡食品研究与技术中心(CITA)馈赠;布鲁氏菌荧光偏振测定法(FPA)试管型抗体检测试剂盒购自哈尔滨平河生物技术有限公司。
1.3 实验方法
1.3.1 布鲁氏菌扩增与灭活B.mehitensis16M接种于BS斜面培养基,5%~10% CO2培养箱37 ℃培养3-4 d,待布鲁氏菌生长至对数生长期时,用PBS(pH7.2)洗涤菌苔,收集菌液,加入苯酚至终浓度0.5%,37℃培养24 h灭活,将灭活后的菌液接种BS平皿,观察细菌灭活效果。
1.3. 2 抗原制备 根据之前已报道的方法[3],我们对抗原进行了制备,步骤简写如下:将灭活后的菌液,12 000 r/min 4 ℃离心10 min,弃去上清;沉淀物加灭菌生理盐水重悬,12 000 r/min 4 ℃离心10 min,洗涤两次;按体积比1∶4加双蒸水重悬沉淀物,121 ℃高压30 min;12 000 r/min 4 ℃离心20 min,取上清,加入3倍体积无水乙醇,4℃搅拌过夜;15 000 r/min 4 ℃离心20 min,取沉淀物,用适量双蒸水重悬,透析、冻干、称重,所得产物为NH-LPS抗原混合物,-20℃保存备用。
1.3.3 优化试验
1.3.3.1 硼酸缓冲液的配制 称取硼酸6.2 g、氯化钾7.25 g,向其中加入800 mL ddH2O,搅拌至溶化,用浓度为1 mol/L的NaOH将溶液pH调节值至8.3后将溶液定容至1 000 mL。
1.3.3.2 琼脂平皿的制备 每100 mL硼酸缓冲液加入不同浓度琼脂,10 g氯化钠,水浴加热至完全溶解,在直径为90 mm的一次性塑料平皿中加入14 mL琼脂溶液,待琼脂凝固后备用。
1.3.3.3 抗原工作浓度与感作温度的优化 将制备好的抗原稀释为0.5 mg/mL、1.0 mg/mL、1.5 mg/mL、2.0 mg/mL、2.5 mg/mL、3.0 mg/mL 6个不同浓度,每个浓度分别用6份羊布病阳性血清(强阳性、中等强度阳性、弱阳性血清各2份)进行测定。用孔径3 mm、孔距3 mm的梅花型打孔器进行打孔,加热封底,中央孔加入20 μL半抗原,周边6个孔中各加入20 μL血清。将平皿放置于湿盒中,分别在22 ℃、25 ℃、30 ℃、37 ℃ 4个条件下进行孵育,连续观察,记录结果。选择所有血清均出现清晰沉淀带的最低半抗原浓度和感作温度为最佳反应条件。
1.3.3.4 琼脂平皿浓度的优化 依次制备0.6%、1.0%、1.2%、1.5%、1.7%、2% 6种浓度的琼脂平皿,如1.3.3.3打孔、封底,孔中央孔加入最佳浓度半抗原,周边孔加入羊布病阳性血清,放置湿盒中在最佳温度下感作,连续观察,记录结果。以出现最清晰沉淀带的琼脂浓度为最佳琼脂浓度。
1.3.4 敏感性与特异性试验 对61份羊布病阳性血清和300份羊布病阴性血清按优化后的实验条件进行NH-GD试验,设NH-GD阴性、阳性血清为对照,连续观察,记录感作时间和实验结果。
1.3.5 羊免疫血清NH-GD试验 对实验室收集的S2、Rev.1疫苗接种后第7 d、14 d、21 d、28 d、58 d、90 d、122 d的羊免疫血清(每个时间节点各20份)进行NH-GD试验,设NH-GD阴性、阳性血清为对照,连续观察,记录实验结果。
1.3.6 结果判读 由于NH分子量小,在琼脂凝胶中扩散速度比S-LPS快,因此靠近血清一侧的白色沉淀带为NH沉淀带,靠近半抗原一侧的白色沉淀带为S-LPS沉淀带。出现NH、S-LPS两条带(如图1)或出现NH一条带为布病阳性动物或免疫动物;出现S-LPS一条带,为免疫动物。当梅花孔中均为阳性血清时NH沉淀带与S-LPS沉淀带分别相互融合形成环状,此时S-LPS沉淀带在抗原孔周边成环,不易拍摄出。

图1 标准阳性血清(周边孔)与半抗原(中心孔)的沉淀反应Fig.1 Precipitation reaction between standard positive sera (in border wells) and NH (in center well)
1.3.7 荧光偏振试验(FPA) 按布鲁氏菌荧光偏振测定法(FPA)试管型抗体检测试剂盒说明书进行操作,对61份羊布病阳性血清、300份羊布病阴性血清及S2、Rev.1疫苗免疫血清进行检测,比较两种方法的检测结果。
2 结 果
2.1 抗原工作浓度、感作温度的优化试验 选取6份布病阳性羊血清,分别编号为1-6,其中1号、2号为强阳性血清,3号、4号为中等强度阳性血清,5号、6号为弱阳性血清。结果表明,阳性血清能够在抗原浓度为0.5 mg/mL、1.0 mg/mL、1.5 mg/mL时均能与NH形成沉淀带,并联结成沉淀环(如图2)。因此,选择1.0 mg/mL为最佳抗原工作浓度。在22 ℃、25 ℃、30 ℃、37 ℃ 4个感作温度中,25 ℃条件下弱阳性血清(5、6号)出现的NH沉淀带最为完整、清晰见图2B,因此选择25 ℃为最佳感作温度。

A: 22 ℃ B: 25 ℃ C: 30 ℃ D:37 ℃图2 半抗原工作浓度、感作温度的优化试验Fig.2 Optimization of antigen concentration and temperature
2.2 琼脂浓度优化试验 琼脂浓度优化试验结果表明,1.2%琼脂平皿中的NH沉淀带最为清晰且5号、6号弱阳性血清均出现的沉淀带最为清晰(如图3),因此最佳琼脂平皿浓度为1.2%。

A:0.6% B:1.0% C:1.2% D:1.5% E:1.7% F:2.0%图3 琼脂浓度优化试验Fig.3 Optimization of agar concentration
2.3 敏感性和特异性 用NH-GD试验对61份羊布病阳性血清和300份羊布病阴性血清进行检测,至第4 d NH沉淀带的数量不再增加,检测结果见表1。
2.4 重复性 利用同一批次的抗原对羊布病阳性血清、羊布病阴性血清进行3次独立重复检测,所得结果一致。
用2个批次的抗原对上述血清进行重复检测,所得结果一致。因此NH-GD试验有较好的重复性。
表1 NH-GD试验的敏感性与特异性
Tab.1 Sensitivity and specificity of NH-GD Assay
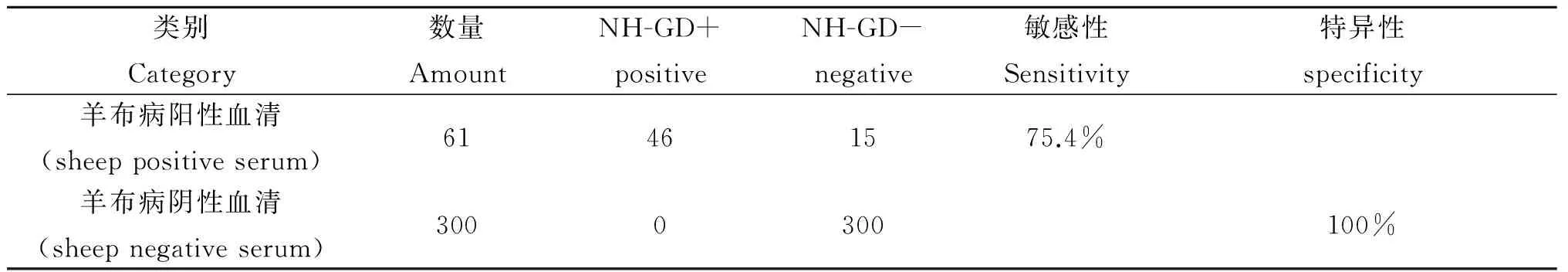
类别Category数量AmountNH-GD+positiveNH-GD-negative敏感性Sensitivity特异性specificity羊布病阳性血清(sheeppositiveserum)61461575.4%羊布病阴性血清(sheepnegativeserum)3000300100%
2.5 比对试验结果 NH-GD和FPA对61份羊布病阳性血清和300份羊布病阴性血清检测结果比较分析发现:NH-GD虽敏感性低于FPA的敏感性,但两种方法的特异性均达到100%,见表2,并且两种方法比较Kappa≥0.75(P<0.01),一致性较好,见表3。
表2 NH-GD与FPA的敏感性与特异性
Tab.2 Sensitivity and specificity of NH-GD and FPA
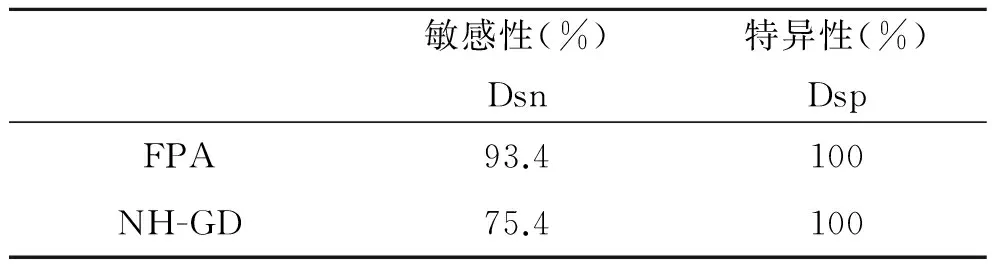
敏感性(%)Dsn特异性(%)DspFPA93.4100NH-GD75.4100
表3 NH-GD与FPA结果比较
Tab.3 Comparing results of NH-GD and FPA

NH-GDTotalKappavalue+-FPA+4611570.876-0304304Total46315361
2.5 NH-GD的鉴别诊断试验 利用NH-GD、RBT、SAT、FPA 4种方法,对接种疫苗后不同时间点采集的羊血清进行检测,结果表明接种S2疫苗的羊血清中检测不出NH抗体存在(如图4A),而接种Rev.1疫苗122 d后NH-GD试验阳性率为0(如图4B)。除FPA在接种S2疫苗58 d后的羊血清中检测不到S2免疫抗体外,这3种方法在不同的时间点都能检测到疫苗免疫抗体。
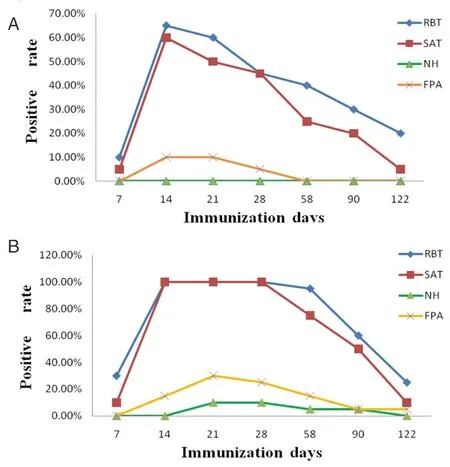
A: S2口服免疫 B:Rev.1点眼免疫A: oral immunized by S2 B: conjunctival immunized by Rev.1图4 鉴别诊断试验Fig.4 Differentiation test of natural infection and vaccination
3 讨 论
通过优化试验,我们确定NH-GD试验最佳反应条件为:抗原浓度1 mg/mL、25 ℃感作、琼脂平皿浓度1.2%、感作时间3 d。利用优化后的实验条件,我们测定NH-GD试验的敏感性为75.4%,特异性为100%且具有较好的重复性。与FPA试验比对发现,两种检测方法一致性较好。分析不同时间点的S2、Rev.1免疫血清的检测结果发现:口服S2免疫血清呈NH-GD检测阴性,点眼接种Rev.1疫苗122 d以后NH-GD检测阳性率为0;而RBT、SAT在相同的时间点都能检测出较高的免疫抗体阳性率;FPA除在S2免疫58 d后的羊血清检测不到免疫抗体外,也能检测到免疫抗体。因此,NH-GD试验比RBT、SAT和FPA具有更强的鉴别诊断能力。
半抗原多糖(Native Hapten, NH),分子量小,无内毒素活性,位于布鲁氏菌表面,与O链相互缠绕[4]。由于半抗原缺乏核心糖(N-formyperosamine)位点,且分子量小所以其免疫原性较低。有报道称在S19疫苗免疫的动物血清中检测不到半抗原多糖抗体的存在,所以NH抗原应该能够鉴别野毒感染与疫苗免疫。由于NH抗原是布鲁氏菌所特有的,因此利用NH半抗原构建的检测方法,在鉴别假阳性方面有不错的表现[5-6]。
NH-GD试验与常规布病的血清学检测方法相比,具有以下的优势:首先操作技术和仪器设备简单,结果可肉眼直观,成本低;其次,NH-GD试验具有鉴别布病感染抗体与S2、Rev.1疫苗免疫抗体的诊断能力,可以从免疫动物中筛选出布病感染动物。当然,NH-GD试验也有不足,主要表现在以下两方面:一是NH-GD敏感性低(75.4%),这与布鲁氏菌产生的抗原刺激强弱有关[7],因此没有出现NH沉淀带不一定是布病阴性动物;二是布鲁氏菌培养需要在符合生物安全三级(BSL-3)要求的实验室中进行,多数地方不具备这个条件。
虽然NH-GD试验的敏感性不具有太大的优势,但其特异性非常高,且在S2和Rev.1免疫背景下,能够鉴别布病感染抗体和疫苗免疫抗体。没有一种实验方法能够达到100%的敏感性和特异性,因此可用敏感性高的RBT进行初筛实验,再用特异性高的NH-GD试验进行确诊。两种实验方法的组合能够更有效地从接种S2和Rev.1疫苗的羊群中鉴别出自然感染布鲁氏菌的羊,便于布病防控措施的实施、及时切断布病传染源头以控制或减少布病疫情的发生。综上所述,NH-GD试验是一个不错的鉴别诊断方法,可以为布病防控政策“检测-扑杀”的实施提供技术支持。
[1] Diaz R,Levieux D.Respective role in the serology of bovine Brucellosis antigens and of immuneglobulins G1and G2in the tests of agglutination of Coombs and of Rose Bengal and in the zone phenomenon[J].C R Acad Sci Hebd Seances Acad Sci D,1972,274(10):1593-1596.
[2] Marín CM,Moreno E,Moriyón I,et al.Performance of competitive and indirect enzyme-linked immunosorbent assays,gel immunoprecipitation with native hapten polysaccharide,and standard serological tests in diagnosis of sheep brucellosis[J].Clin Diagn Lab Immunol,1999,6(2):269-272.
[3] Diaz R,Toyos J,Salvó MD,et al.A simple method of the extraction ofBrucellacells for use in the radial immunodiffusion test diagnosis of bovine brucellosis[J].Ann Rech Vet,1981,12(1):35-39.
[4] Aragón V,Díaz R,Moreno E,et al.Characterization ofBrucellaabortus andBrucellamelitensisnative hapten as outer memberane O-type polysaccharides independent from the smooth lipopolysaccharide[J].J Bacteriol,1996,178(4):1070-1079.
[5] Ramírez-Pfeiffer C,Díaz-Aparicio E,Rodríguez-Padilla C,et al.Improved performance ofBrucellamelitensisnative hapten overBrucellaabortusOPS tracer on goat antibody detection by the fluorescence polarization assay[J].Vet Immunol Immunopathol,2008,123(3-4):223-229.
[6] Ramírez-Pfeiffer C,Díaz-Aparicio E,Gomez-Flores R,et al.Use of theBrucellamelitensisnative hapten to diagnose brucellosis in goats by a rapid, simple, and specific fluorescence polarization Assay[J].Clin Vaccine Immunol,2008,15(6):911-915.
[7] Diaz R,Toyos J,Salvo MD,et al.Studies on the polysaccharide B and native hapten ofBrucellaandYersiniaenterocoliticaserotype 9[J].Dev Biol Stand,1984,56:213-220.
Application of native hapten-gel diffusion test in differential diagnosis ofBrucella-infected antibody and S2 or Rev.1-vaccinated antibody
YANG Zhen,NI Bo,TIAN Li-li,FAN Wei-xing
(ChinaAnimalHealthAndEpidemiologyCenter,Qingdao266000,China)
The aim of the present study was to work on the efficiency of differential diagnosis of native hapten-gel diffusion assay (NH-GD) on the background of vaccination with S2 or Rev.1. The conditions of NH-GD assay was firstly optimized, its sensitivity, specificity, repeatability and ability of differential diagnosis were determined respectively, and its test result was compared with that of fluorescence polarization assay (FPA).The results showed NH-GD assay with good specificity and repeatability could differentiateBrucella-infected antibody from vaccinated antibody after vaccination with S2 or 122 days after vaccination with Rev.1.And the result of NH-GD assay was highly consistent with that of FPA ,which was simple to operate and needed a few simple equipment. Therefore, NH-GD assay was a good method for sheep brucellosis surveillance in China and especially suitable for application in grass-roots areas.
brucellosis;NH-GD;differential diagnosis
10.3969/j.issn.1002-2694.2017.02.007
范伟兴,Email: fwxsjl@126.com
中国动物卫生与流行病学中心,青岛 266000
R378
A
1002-2694(2017)02-0126-05
2016-11-12 编辑:李友松
现代农业(奶牛)产业技术体系建设项目专项经费(CARS-37)资助
优化NH-GD试验条件,测定其敏感性、特异性、重复性及鉴别诊断能力,并与荧光偏振测定法(FPA)作比较。结果 NH-GD试验具有很好的特异性和重复性,对S2免疫羊群从疫苗接种开始就具有鉴别诊断能力,而对Rev.1免疫羊群从疫苗接种122 d开始具有鉴别诊断能力;与FPA作比较,一致性较好,且操作技术和所需仪器都非常简单,特别适合在基层推广使用,为我国羊布病监测提供了一个很好的检测方法。

