低氧条件对小鼠ADSCs膜片形成及其生物学特性的影响
周宇超 高晓彤 刘向伟 谭乃文 魏洪波 宋应亮
目前,不受伦理学制约的间充质干细胞是再生医学领域的热门种子细胞,而脂肪间充质干细胞(ADSCs)是其典型代表[1]。为了更好地控制干细胞的增殖分化进而解决临床问题,越来越多的研究集中于影响干细胞生存与功能的 “干细胞龛”[2-3],例如细胞膜片技术就因在高度密集细胞的同时保存了丰富的细胞外基质(ECM),从而为干细胞提供适宜微环境而受到人们青睐[4-5],广泛应用于包括口腔领域在内的多种组织器官再生[6-8]。而氧含量是干细胞龛的重要组成部分。不同于传统细胞培养时的常氧环境,体内各组织氧分压往往较低[9];脂肪组织中<3%[10]。因此,有学者提出低氧环境可能更贴近ADSCs的生理环境而更利于其生存。事实上,已有研究表明体外低氧培养会影响ADSCs的增殖、分化和功能[11-13];但其对ADSCs细胞膜片的影响尚未见报道。
本研究利用不同浓度的氯化钴(CoCl2)模拟体内低氧环境,观察其对ADSCs膜片构建和生物学特性的影响,以期找到ADSCs膜片体外培养的最适条件。
1 材料与方法
1.1 主要试剂和仪器
OriCellTMC57BL/6小鼠ADSCs完全培养基(赛业);Ⅰ型胶原酶(Gibco,美国);抗坏血酸(科昊);六水合氯化钴CoCl2、β- actin一抗(Sigma,美国); RIPA(Beyotime);HIF- 1α一抗(三鹰),抗兔、鼠二抗(博士德);Trizol(Invitrogen);反转录、qPCR试剂盒(Takara);引物合成(尼桑)。CO2培养箱(Heraeus,德国);倒置相差显微镜(Olympus,日本);qPCR仪(AB 7500,美国);垂直电泳槽、电泳仪、转膜仪(Bio- Rad,美国);细胞培养皿和培养板(Thermo,美国)。C57BL/6小鼠(8 周,SPF级),购于第四军医大学实验动物中心。
1.2 ADSCs膜片的构建
1.2.1 ADSCs的分离培养 颈椎脱位处死小鼠,无菌条件下取腹股沟处腹腔内脂肪,胶原酶消化法提取组织细胞。37 ℃,5%CO2细胞孵箱中常规培养48 h换液,以后每3 d换液直至细胞融合80%~90%传代。
1.2.2 ADSCs膜片的构建 常规培养P3ADSCs至融合90%,加入成膜诱导液(ADSCs完全培养基+50 μg/ml Vit C),以后每3 d换液。肉眼和倒置显微镜下观察成膜情况。
1.3 CoCl2模拟低氧环境的剂量效应
含不同浓度CoCl2(0、50、100 μmol/L)的完全培养基处理P3ADSCs 48 h。Trizol和RIPA裂解液分别提取总RNA和蛋白,用于qPCR和Western Blot。以β- actin为内参检测HIF- 1α的表达。反转录、qPCR反应体系及条件、抗体稀释及使用方法参照说明书。引物序列见表 1。
1.4 低氧环境对构建ADSCs膜片的影响
成膜诱导过程中,分别添加0、50、100 μmol/L CoCl2。2 周后,用镊子将细胞膜片小心揭起,常规处理切片,行组织学染色(HE染色和天狼星红染色)或TEM观察。
1.5 低氧环境对ADSCs及其细胞膜片特性和功能的影响
1.5.1 低氧环境对ADSCs干性的影响 不同程度低氧处理P3ADSCs 48 h,qPCR检测干性相关基因Sox2,Oct4的表达情况。方法同上;引物序列见表 1。
1.5.2 低氧环境对ADSCs细胞膜片分泌功能的影响
成膜诱导1 周,期间施以不同浓度CoCl2处理,qPCR检测胶原Col- Ⅰ、粘附分子Cdh1、保护性生长因子bFGF和VEGF。方法同上;引物序列见表 1。
1.6 统计学分析
用SPSS 19.0软件进行统计分析。多样本间比较采用单因素方差分析;检验水准为P<0.05。

表 1 qPCR引物序列
2 结 果
2.1 ADSCs和ADSCs膜片的形态学观察
2.1.1 ADSCs形态学观察 倒置显微镜下,分离培养获得的第三代细胞为贴壁良好的梭形、三角形或多角形细胞(图 1A)。
2.1.2 ADSCs膜片形态学观察 随成膜诱导时间的延长,培养板底部透明性逐渐降低而呈乳白色,诱导10 d左右,膜片边缘开始向中部蜷曲;14 d后,可用镊子将之完整揭下。揭下的膜片缩卷成团(图 1B、C)。倒置显微镜下,膜片中ADSCs 形态狭长;密集生长而排列成束(图 1D)。
2.2 CoCl2体外模拟缺氧环境具有剂量效应
qPCR和Western Blot结果显示,同常氧对照组相比,CoCl2模拟低氧组高表达HIF- 1α且其表达量随CoCl2浓度的增加而升高(图 2)。
2.3 体外低氧环境对构建ADSCs膜片的影响
2.3.1 组织学染色结果 HE染色可见,成膜诱导2 周后,ADSCs形成了“细胞-胶原纤维-细胞”的三明治样结构。而CoCl2模拟低氧组形成的细胞膜片明显较对照组薄,主要表现为中间层胶原成分减少,而细胞数量未见明显改变(图 3A~C)。天狼星红染色(图 3D~F)结果类似,即低氧组胶原减少。
2.3.2 TEM观察结果 常氧膜片组ADSCs胞浆和ECM中均有大量丝状胶原纤维(图 4A、D)。而低氧组明显减少,且缺氧程度越重(CoCl2浓度越高)越少(图 4)。但是,相较于对照组,低氧组的细胞连接显著增加,尤其是轻度缺氧组不仅细胞-细胞、细胞-ECM之间存在大量高密度细胞融合的阻射条带,同一细胞胞膜反折处也形成密集的点状或条带状连接(图 4B、E);高度缺氧组虽较低度缺氧组少,却仍明显多于对照组(图 4C、F)。
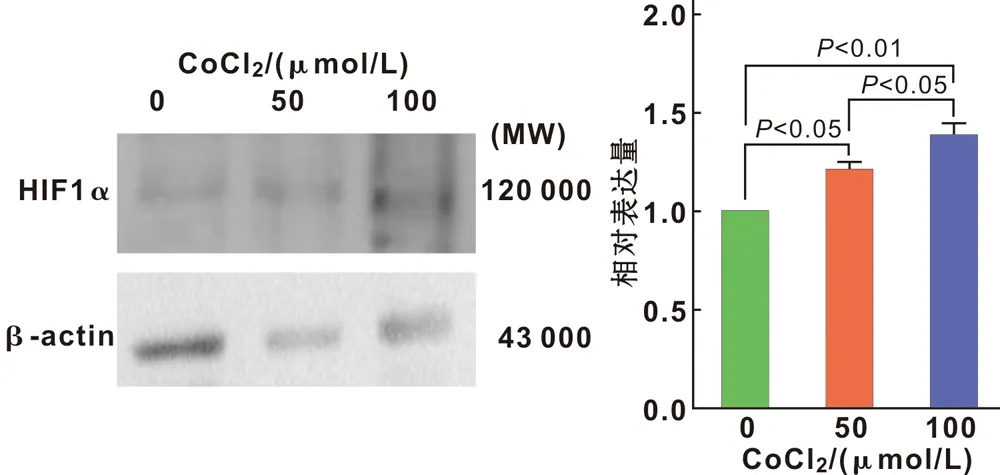
图 2 不同浓度CoCl2作用48 h对HIF- 1α表达的影响
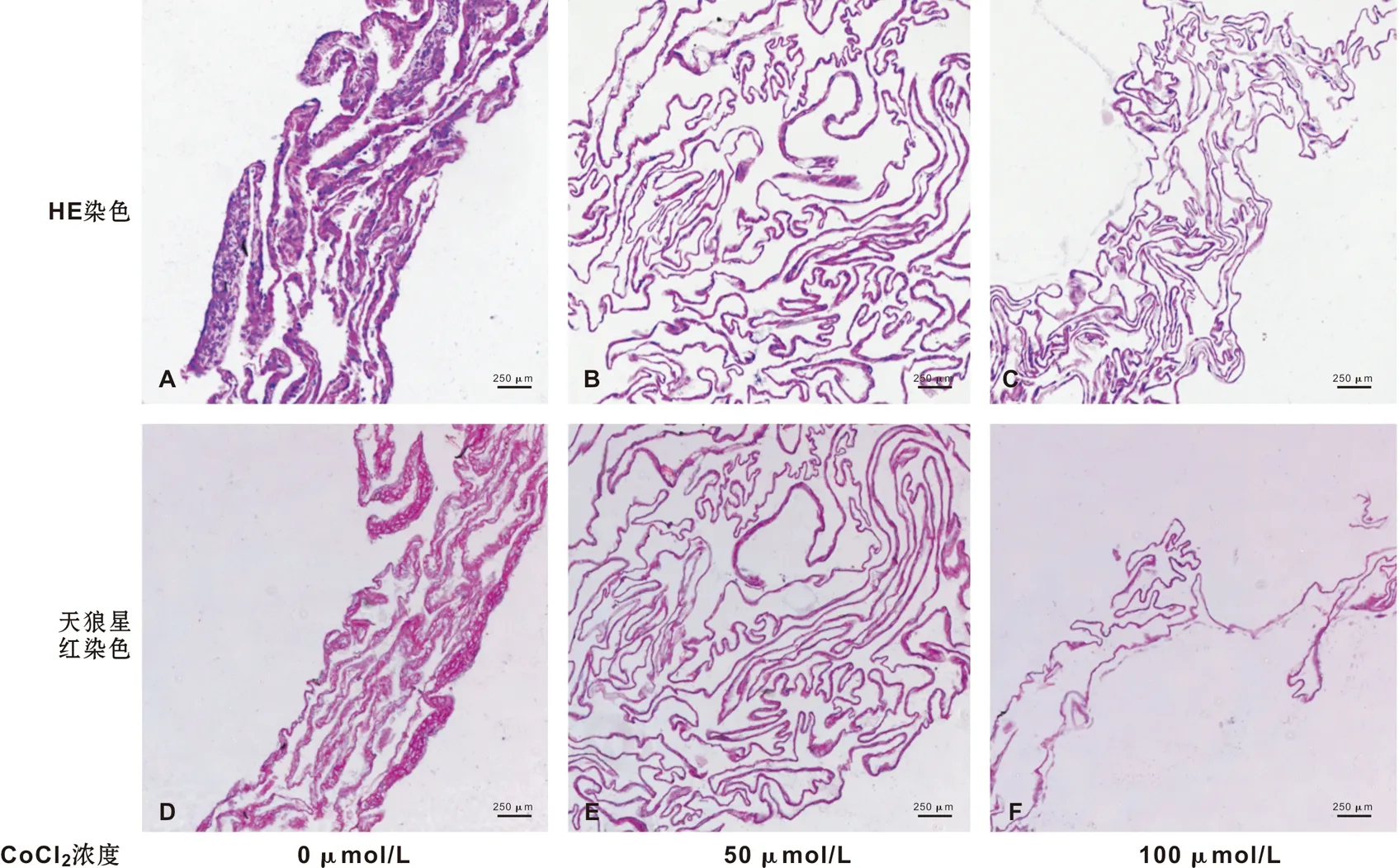
A~C: HE染色(普通光学显微镜); D~F: 天狼星红染色,粉红色部分为Ⅰ型胶原(偏振光显微镜)
2.4 低氧环境对ADSCs及其细胞膜片功能的影响
2.4.1 低氧环境提高ADSCs干性基因的表达
qPCR结果表明经低氧处理的ADSCs对干性相关基因Sox2和Oct4的表达都明显上调,且低氧程度越重(CoCl2浓度越高)上调越明显(图 5)。
2.4.2 低氧环境减少ADSCs细胞膜片中胶原的表达而提高黏附分子的表达 同TEM观察结果一致,低氧组ADSCs膜片对Col- Ⅰ的表达降低,而参与形成黏附连接的主要蛋白成分E- Cadherin(Cdh1)的表达在低度缺氧组提高约1.7 倍,高度缺氧组提高约2.6 倍(图 5)。
2.4.3 低氧环境促进ADSCs细胞膜片生长因子的表达 同对照组相比,各CoCl2处理组ADSCs细胞膜片对bFGF和VEGF的表达量都升高;且各浓度组两两比较均有统计学差异(图 5)。
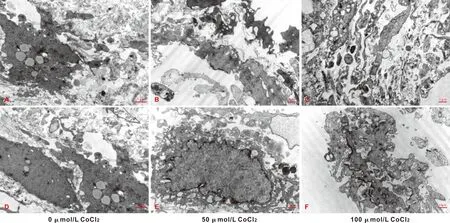
图 4 TEM观察ADSCs膜片超微结构

图 5 CoCl2作用48 h对ADSCs干性及功能相关基因表达的影响
3 讨 论
干细胞治疗在多种医疗领域具有广阔应用前景,但干细胞移植过程中的细胞流失和死亡极大地限制了疗效。细胞膜片技术可解决单细胞移植中细胞流失问题[4-5];而众多关于干细胞龛的研究也提示从体外到体内的骤然缺氧可能是导致移植干细胞死亡的主要原因[14]。本研究利用CoCl2在体外模拟体内低氧环境,探讨其对ADSCs膜片构建和生物学特性的影响。
HIF- 1α是组织低氧的标志物[15];而Co2+可通过细胞内离子置换使亚铁螯合酶失活、抑制细胞氧化反应,从而达到模拟细胞缺氧的目的[16]。用梯度浓度的CoCl2处理ADSCs,结果发现随着CoCl2浓度的增加,ADSCs对HIF- 1α的表达的上调也越明显,说明CoCl2能有效模拟低氧环境且具有剂量依赖性。
常氧条件下Vit C法能便捷地构建细胞密集排列且富含ECM的ADSCs膜片[17],在成膜诱导2 周时即可从培养皿中完整揭下。低氧环境中诱导相同时间后,由于ADSCs合成分泌的Col- Ⅰ减少,导致形成的膜片相对较薄;但膜片中细胞数量并不减少且细胞连接更紧密,标志着其抵抗外源性破坏的能力增强。
CoCl2使ADSCs干性基因表达上调,提示低氧微环境更利于维持干细胞未分化特性;低氧下诱导形成的ADSCs膜片合成更多保护性生长因子(bFGF,VEGF),意味着该膜片在植入体内时可能具有更强的生存能力。
综上所述,在适当低氧环境下诱导形成的ADSCs膜片用于再生医疗可能会获得更好的临床效果。

