高粱幼穗再生体系建立的研究
陈晓木+李欧静+施利利
摘要:高粱是重要的杂粮作物之一,其组织培养研究对高粱再生体系建立以及高粱转基因育种具有重要意义。以6个基因型的高粱幼穗为外植体,研究光照、激素、基本培养基以及基因型对幼穗愈伤组织诱导和分化的影响。结果表明:对于高粱幼穗愈伤组织的诱导培养,光照有利于幼穗愈伤组织的诱导;2,4-D和KT混合使用的效果比2,4-D单独使用好;3种基本培养基对幼穗愈伤诱导影响差异不显著;不同基因型对幼穗愈伤诱导影响差异显著,且5种不同基因型材料的愈伤诱导能力大小为M81-E>07-27 > BJ-285=考利>罗马。对于高粱幼穗愈伤组织的分化培养,3种培养基中只有MS培养基和NB培养基分化出再生苗;6种基因型中只有忻粱52分化出绿苗,分化率为11.49%。
关键词:高粱;幼穗;组织培养;基因型
中图分类号: S514.043 文献标志码: A
文章编号:1002-1302(2016)11-0040-03
高粱是一种高光效的C4植物,具有生物产量高、耐旱、耐盐、耐贫瘠、适应性强、种植范围广等特点[1],且高粱是重要的杂粮作物之一,其籽粒可以作为粮食,在非洲等干旱地区是主要的粮食作物之一,茎秆是良好的青贮饲料[2-3]。但是,高粱种质资源比较匮乏[4],传统的育种应用受到限制,致使其品种改良和新品种选育进程缓慢。转基因育种的快速发展,为高粱育种带来生机。然而,高粱被认为是组织培养比较困难的植物之一,虽然高粱的幼胚[5-14]、花药[15-18]、幼穗[11,18-22]、幼叶[10,23]、茎尖[19,24-29]、成熟胚[10-11,30-31]、未成熟胚[12]、成熟种子[11,30,32-33]、原生质体[34]的体外培养可以初步获得再生植株,但是以组织培养为基础的高效再生体系建立比较困难。
目前,高粱幼穗被认为是建立再生体系比较容易的外植体之一。本试验以6个基因型的高粱幼穗为外植体,研究光照、激素、基本培养基以及基因型对幼穗愈伤组织诱导及分化的影响,试图建立幼穗高效再生体系,从而为高粱转基因育种提供参考。
1 材料与方法
1.1 材料
6个高粱品种及品系:忻粱52、BJ-285、07-27、M81-E、罗马及考利,均由天津农学院作物遗传重点实验室提供,种植于天津农学院东校区作物标本园,取旗叶期的幼穗先用75%乙醇擦拭苞叶,用保鲜膜包装后置于4 ℃预处理12~24 h 备用。
1.2 方法
1.2.1 培养基 所有培养基用1 mol/L的NaOH调节pH值为5.8,分化培养基和生根培养基加3 g植物凝胶、8.0 g山梨醇和0.2 g天冬氨酸,其他培养基均加0.3 g酸水解酪蛋白、0.5 g脯氨酸、0.5 g谷氨酰胺以及6.8 g琼脂,继代培养基为MS培养基,在1.1 MPa大气压113 ℃下灭菌20 min (表1)。
1.2.2 幼穗愈伤组织的诱导
将预处理后的幼穗用75%乙醇表面消毒,在超净工作台内小心取出约7 cm长幼穗,在无菌滤纸上用解剖刀切成0.1~0.2 cm的茎段,接种于诱导培养基上。除忻粱52有处理置于(25±1) ℃的恒温培养箱中,每天光照16 h,光照度为2 000 lx。其余皆置于(25±1) ℃ 的黑暗条件下培养,10~14 d统计出愈率。
1.2.3 愈伤分化、生根培养及移栽
继代培养7~14 d,挑取黄色、质地紧密的愈伤组织转接到分化培养基上,置于(25±1) ℃的恒温培养箱中,每天光照16 h,光照度为2 000 lx。经过28~35 d的分化培养,再生芽长到3 cm左右时,并统计分化率。待再生芽长到5 cm左右时,转移到生根培养基上。待再生苗根系健壮时,移栽到含有蛭石和营养土的盆中于温室中培养至植株成熟。
1.2.4 数据统计分析
愈伤诱导率=(愈伤组织块数/外植体数)×100%;
愈伤分化率=(出再生芽愈伤组织数/接种愈伤组织数)×100%。
数据经转换后,用DPS统计软件进行方差分析,用Duncans新复极差法进行显著性水平分析。
2 结果与分析
2.1 高粱幼穗愈傷诱导
2.1.1 光照条件和激素对高粱幼穗愈伤组织诱导的影响
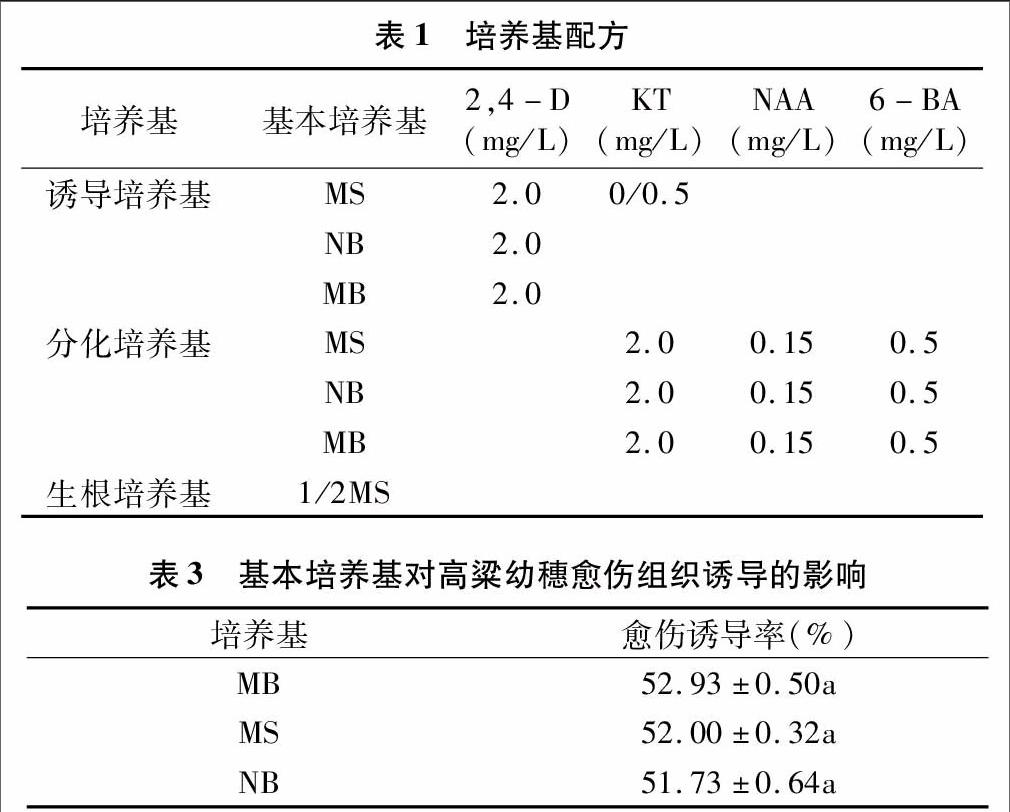
经过10~14 d的愈伤诱导培养,幼穗切段在切口处产生淡黄色或白色的愈伤组织。除忻粱52以外其他5个材料均不同程度产生褐色物质(图1)。
光照和激素对忻粱52幼穗愈伤组织诱导影响的方差分析结果(表2)表明,忻粱52在光照条件的愈伤诱导率与黑暗条件下的愈伤诱导率差异显著,说明光照有利于幼穗愈伤组织的诱导。而在相同条件下,忻粱52 在添加 0.5 mg/L KT+2.0 mg/L 2,4-D情况下的愈伤诱导率显著高于只添加 2.0 mg/L 2,4-D的愈伤诱导率,表明2,4-D和KT混合使用的效果比2,4-D单独使用要好。
2.1.2 基本培养基对高粱幼穗愈伤组织诱导的影响
本试验将MB、MS、NB等培养基对幼穗愈伤组织诱导的统计数据进行方差分析,结果(表3)表明,高粱幼穗在不同基本诱导培养基上的愈伤诱导率差异不显著(P<0.05)。说明MB、MS、NB 3种培养基对幼穗愈伤组织诱导影响不大。
2.1.3 基因型对高粱幼穗愈伤组织诱导的影响
本试验将5种基因型材料幼穗愈伤组织诱导的统计数据进行方差分析,结果(表4)表明,不同基因型幼穗愈伤诱导率差异显著(P<0.05),其中M81-E的平均愈伤诱导率最高,为75.78%,其次依次为07-27>BJ-285>考利>罗马,BJ-285 和考利差异不显著。
2.2 高粱幼穗愈伤分化
2.2.1 基本培养基、基因型对高粱幼穗愈伤组织分化的影响
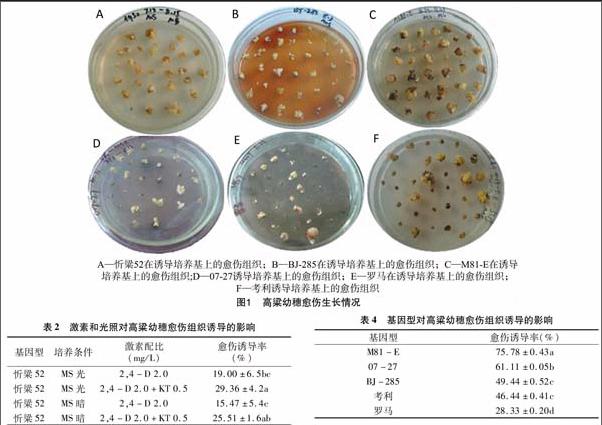
将幼穗愈伤组织接种到含有3种基本培养基的分化培养基上培养,除忻粱52产生绿苗之外,其他材料的愈伤则大量形成根(图2)。对3种基本培养基的愈伤分化率进行统计,结果(表5)表明,忻粱52在NB分化培养基上的分化率明显高于MS,而其他材料无论是在MS分化培养基还是MB分化培养基上均不出现绿点,没有再生苗的出现。说明基本培养基、基因型对愈伤分化影响较大。
2.2.2 再生苗生根培养及移栽
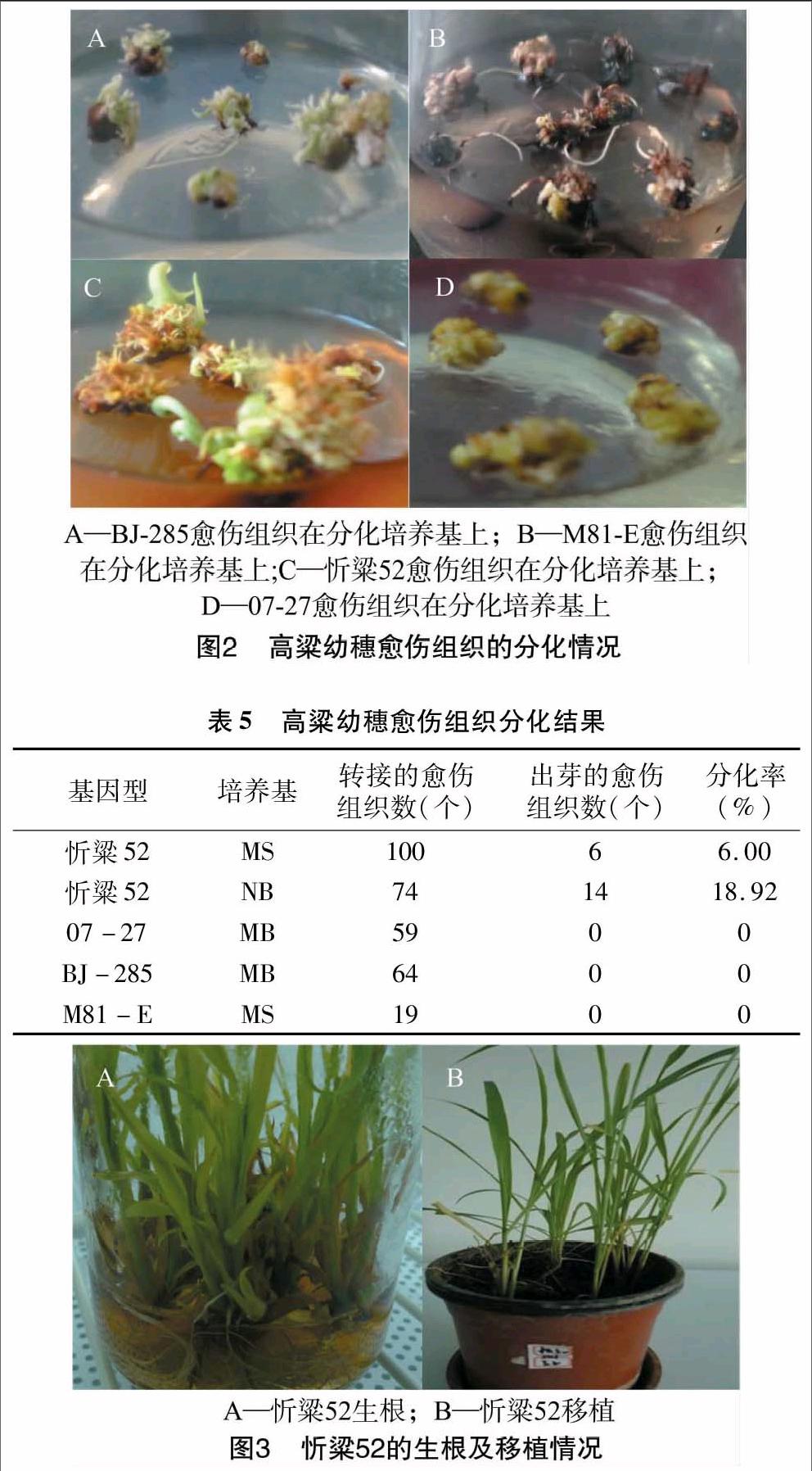
待丛生芽幼苗长到3~5 cm 时,剪去假根,并将其转接到1/2MS生根培养基上,待长3~4条根时,将瓶盖打开适应1~2 d后,洗净根部的培养基,移栽到含蛭石和营养土的盆中生长14~21 d,其间通过浇营养液来维持植株生长所需营养物质,然后移栽到温室生长至植株成熟(图3)。移栽时注意不伤及根系,并保持营养土湿润。
3 结论与讨论
幼穗是高粱组织培养中1个重要的外植体,对愈伤组织诱导非常有利,韩福光等的研究认为幼穗也是高粱优良的外植体[10-11,34]。本研究取旗叶期7 cm的幼穗为外植体进行组织培养,愈伤诱导率达84%,分化率为11.49%。而石太渊等研究认为3 cm长的幼穗比较适合愈伤组织的诱导,诱导率可达100%[20],由此可见,幼穗的取材时期对愈伤诱导非常关键。同时本研究在愈伤诱导过程中,发现2,4-D和KT配合使用的效果比单独使用2,4-D好,而且基因型对愈伤诱导和分化的影响很大,研究结果与石太渊等的结果[35]比较一致。同时本研究利用的MB、MS、NB 3种基本培养基对愈伤诱导的影响差异不显著,但石太渊等认为MS培养基更适合高粱组织培养[35]。至于光照对愈伤诱导的影响,Van Nguyen等认为愈伤在诱导阶段培养7 d后转移至低光条件下继续培养,有利于愈伤的诱导[22],同样本试验研究也证明光照有利于幼穗愈伤组织的诱导。
参考文献:
[1]常金华,夏雪岩,张 丽,等. 高粱抗蚜基因的遗传分析和SSR标记定位[J]. 草业学报,2005,15(2):113-118.
[2]Girijashankar V,Swathisree V. Genetic transformation of Sorghum bicolor[J]. Physiol Mol Biol Plants,2009,15(4):287-302.
[3]高士杰,李继洪,李玉发. 高粱——大有发展潜力的饲料作物[J]. 牧草与饲料,2007,1(1):23-24.
[4]邹剑秋,宋仁本,卢庆善,等. 新型绿色可再生能源作物——甜高粱及其育种策略[J]. 杂粮作物,2003,23(3):134-135.
[5]Gamborg O L,Shyluk J.P,Brar D.S,Constable F. Morphogenesis and plant regeneration callus of immature embryos of sorghum[J]. Plant Science Letter,1977,10(1):67-74.
[6]Dunstan D I,Short K C,Thomas E. The anatomy of and secondary morphogenesis in cultured scutellum tissues of Sorghum bicolor[J]. Protoplasma,1978,97(2):251-260.
[7]Murty U R,Visarada A A,Bharathi M,et al. Developing tissue culture system for sorghum,Sorghum bicolor (L.) Moench. Ⅰ. Embryogenic callus induction for elite genotypes[J]. Cereal Research Communications,1990,18(3):257-262.
[8]马鸿图,Liang G H. 高粱幼胚培养及再生植株变异的研究[J]. 遗传学报,1985,12(5):350-357.
[9]郭建华. 高粱幼胚小盾片愈伤组织的诱导及其再生植株性状的变异分析[J],辽宁农业科学,1989(3):7-14.
[10]韩福光,张 颖. 高粱不同外植体愈伤组织诱导的研究[J]. 辽宁农业科学,1993(1):45-48.
[11]白志良,王良群,郑丽萍,等. 高粱不同外植体离体培养[J]. 华北农学报,1995,10(1):60-63.
[12]石太渊,杨立国,张 华,等. 高粱体细胞培养中不同基因型和外植体的反应[J]. 国外农学:杂粮作物,1995(6):26-28.
[13]Elkonin L.A.氨基酸诱导高粱胚胎发生愈伤组织的开始与维持[J]. 国外农学:杂粮作物,1996(2):20-22.
[14]Liu G Q,Godwin I D. Highly efficient sorghum transformation[J]. Plant Cell Rep,2012,31(6):999-1007.
[15]錦州农业科学研究所.高粱花药培养研究初报[J]. 辽宁农业科学,1978(5):19-20.
[16]Rose J B,Dunwell J M. Anther culture of sorghum bicolor[J]. Plant Cell,Tissue and Organ Culture,1986,6(1):15-22.
[17]Kumaravadivel N,Rangsamy S R. Plant regeneration from sorghum anther culture and field evaluation of progeny[J]. Plant Cell Report,1994,13:286-290.
[18]Wen F S,Sorensen EL,Barnett FL,et al. Callus induction and plant regeneration from anther and inflorescence culture of sorghum[J]. Euphytica,1991,52(3):177-181.
[19]Sarada N M,Sudhakar R P. Multiple shoot induction from immature inflorescence in sorghum[J]. Cytologia,2003,68(2):199-204.
[20]Tadesse Y,Sagi L,Swennen R,et al. Optimization of transformation Condition sand production of transgenic sorghum(Sorghum bicolor) via microparticle bombardment[J]. Plant Cell,Tissue and Organ Culture,2003,75(1):1-18.
[21]王良群,王呈祥,白志良,等. 高粱骨干恢复系体细胞变异系的筛选与应用[J]. 华北农学报,2004,19(1):8-9.
[22]Van Nguyen T,Thu T T,Claeys M,et al. Agrobacterium-mediated transformation of sorghum using an improved in vitro regeneration system[J]. Plant Cell Tiss Organ Cult,2007,91(2):155-164.
[23]Wernicke W,Brettell R. Somatic embryogenesis from sorghum bicolor leaves[J]. Nature,1980,287(5778):138-139.
[24]Masteller V J,Holden. The growth of and organ formation from callus tissue of sorghum[J]. Plant Physiol,1970(45):362-364.
[25]Cai T S,Barbara D,Larry B. Callus induction and plant regeneration from shoot portions of mature embryos of high tannin sorghum[J]. Plant Cell,Tissue and Organ Culture,1987,9(3):245-252.
[26]石永顺,石太渊,王艳秋,等. 抗生素对高粱茎尖再生的影响及再生体系的建立[J]. 杂粮作物,2004,24(2):78-79.
[27]林 凤,张春宇,王洪岩,等. 抗生素对高粱茎尖再生的影响及再生体系的建立[J]. 中国生态農业学报,2005,13(2):74-76.
[28]张明洲,崔海瑞,舒庆尧,等. 高粱茎尖再生体系及其遗传转化影响因子的研究[J]. 核农学报,2006,20 (1):23-26.
[29]刘宣雨,刘树君,宋松泉. 建立甜高粱高频、高效再生体系的研究[J]. 中国农业科学,2010,43(23):4963-4969.
[30]赵利铭,刘树君,宋松泉. 甜高粱再生体系的建立[J]. 植物学通报,2008,25(4):465-468.
[31]丛靖宇,董婷婷,刘国军,等. 甜高粱组织再生研究[J]. 作物杂志,2011(3):24-28.
[32]Smith R H,Bhaskaran S,Schertz K. Sorghum plant regeneration from aluminum selection medium[J]. Plant Cell Report,1983,2(3):129-132.
[33]禤维言,葛玉红,冯斗等. 不同基因型甜高粱愈伤组织与丛生芽诱导条件优化[J]. 南方农业学报,2011,42(6):586-590.
[34]卫志明,许智宏. 高粱原生质体培养再生植株[J]. 植物生理学通讯,1989(6):45-48.
[35]石太渊,杨立国. 基因型和培养基对高粱幼穗离体培养的影响[J]. 国外农学:杂粮作物,1995(4):27-29.

