马铃薯干腐病拮抗菌Pseudomonas sp.YL11发酵液理化性质测定及发酵条件优化
张紊玮,王艳玲,贠建民
1.甘肃农业大学 食品科学与工程学院 甘肃 兰州 730070;2.兰州理工大学 生命科学与工程学院 甘肃 兰州 730050
马铃薯干腐病是一种由镰刀菌引起的田间和储藏期都普遍发生的病害,主要引起块茎腐烂,致使马铃薯品质降低,严重影响了其食用价值和经济价值 [1]。我国是马铃薯生产大国,随着“马铃薯主粮化战略”的提出,马铃薯种植面积在逐年扩大,干腐病的发生也越来越严重,常年发病率高达30%,由此造成马铃薯产量损失40%-50%[2]。甘肃是我国马铃薯主产区之一,硫色镰刀菌、腐皮镰刀菌和接骨木镰刀菌是造成马铃薯干腐病的优势病原菌[3,4]。目前,对马铃薯干腐病以化学防治为主,化学农药虽然短期有效,但长期反复施用,会造成药剂残留、产生耐药性菌株以及环境污染等问题而逐渐受到限制[5,6]。因此,使用高效、合理、环保的方法控制病害的发生显得尤为重要,生物防治便成了国内外研究的热点[7-9]。
生物防治在农业生态系统中是一种很有前景的防治方法,这种从自然界中分离、筛选有益微生物并用于病原菌的拮抗、病害控制的防治方法,具有高效、无毒、无残留等特点[10]。拮抗菌株用于生物防治时,首先要考虑该菌株易于实现工业化生产,同时要求菌剂具有稳定性好、活性高、环保等特点[11-13]。为此,本试验以前期分离获得的一株对马铃薯干腐病病原菌——硫色镰刀菌有拮抗作用的Pseudomonas sp.YL11为研究对象,进行发酵液抑菌成分理化性质的探索,并以LB培养基作为YL11菌株发酵条件优化的基础培养基,通过添加辅助碳源、氮源及无机盐,对温度、pH值、转速、接种量、装液量及培养时间进行优化,旨在为该菌株的田间应用和活性产物的开发提供必要的前期基础。
1 材料与方法
1.1 菌株
菌株Pseudomonas sp.YL11为甘肃定西地区马铃薯根际土壤中分离获得;供试病原真菌硫色镰刀菌(Fusarium sulphureum)由甘肃农业大学采后生物学与技术实验室保藏。
1.2 培养基
PDA培养基:马铃薯200g、葡萄糖20g、琼脂20g、蒸馏水1000mL,pH自然,121℃高压灭菌20min。
LB培养基:蛋白胨10g、酵母提取物5g、氯化钠10g、琼脂15g、蒸馏水1000mL,pH7.0,121℃高压灭菌20min。
LB液体培养基:LB固体培养基中不加琼脂。
1.3 方法
1.3.1 预处理
1.3.1.1 指示菌的活化
将在PDA培养基,28℃培养7d的F. sulphureum用无菌水冲洗孢子,制备孢子悬浮液,用血球计数板计数,调整孢子浓度为1.5×105CFU/mL,分装至1mL,无菌离心管中于4℃保存,一周内使用[14]。
1.3.1.2 供示菌的活化
将-20℃保藏Pseudomonas sp.YL11菌株在LB固体培养基上划线,30℃培养48h,挑单菌落接种到LB液体培养基中,30℃培养24h,反复传代接种培养3~4次。
1.3.1.3 无菌发酵液的制备
Pseudomonas sp.YL11发酵液10000r/min离心15min后,收集上清液即为发酵上清液。将上清液用0.22μm无菌滤膜过滤,收集滤液即为无菌发酵液。
1.3.2 菌株Pseudomonas sp. YL11代谢产物理化性质测定
1.3.2.1 热稳定性测定
将发酵液分别置于30℃,50℃,60℃,70℃,80℃,90℃,100℃下处理30min,未经处理的发酵液作对照,以F.sulphureum为指示菌,牛津杯法测抑菌活性。
1.3.2.2 pH稳定性测定
将发酵液用0.5M HCl和0.5M NaOH处理依次调节pH至3,4,5,6,7,8,9,10,静置2h后将pH调回自然pH(原始发酵液pH值为7),未经处理的发酵液作对照,以F. sulphureum为指示菌,牛津杯法测抑菌活性。
1.3.2.3 紫外光照稳定性测定
将发酵液分装于1.5mL离心管中置于20W紫外灯下距离20cm处敞口照射1h,2h,4h,6h,8h,10h,12h后,未经处理的发酵液作对照,以F. sulphureum为指示菌,牛津杯法测抑菌活性。
1.3.3 培养基组分的优化
在LB培养基中,以酵母提取物为基本碳源物质,分别添加1%的其他碳源物质(葡萄糖、蔗糖、淀粉、乳糖、麦芽糖);以蛋白胨为基本氮源物质,分别添加1%其他氮源物质(尿素、硫酸铵、硝酸铵、磷酸二氢铵、磷酸氢二铵);以氯化钠为基本无机盐,分别添加0.5%其他无机盐(氯化钾、硫酸镁、氯化镁、磷酸二氢钠、磷酸氢二钠),以不额外添加碳源、氮源、无机盐的LB液体培养基作对照,30℃,120r/min振荡培养4d后,测定发酵上清液对F. sulphureum的抑菌活性,每个处理重复3次。
1.3.4 发酵条件的优化
在上述最佳培养基基础上,在装液量为30mL/100mL、转速120r/min和30℃条件下分别改变培养基的发酵时间(12h、24h、36h、48h、60h、72h、96h、100h、120h)、发酵温度(25℃、28℃、30℃、37℃、40℃)和初始pH值(pH5、pH5.5、pH6、pH6.5、pH7、pH7.5、pH8),以发酵液对F. sulphureum的抑菌活性为指标,确定最佳发酵时间、发酵温度和pH值。在筛选出最佳pH值、发酵温度和发酵时间的条件下改变接种量(1%、3%、5%、7%、9%)、装液量(10 mL、20 mL、30 mL、40 mL、50mL/100mL)、转速(100、120、150、180r/min),以发酵液对F. sulphureum的抑菌活性为指标,确定最佳接种量、装液量和转速。同时用分光光度法测定波长600nm处的吸光度值,每个处理重复3次。
2 结果与分析
2.1 发酵液理化性质
2.1.1 热稳定性
YL11发酵液代谢产物具有较好的热稳定性,经过30℃-50℃各处理30min后活性基本保持稳定,60℃-80℃各处理30min活性略有降低,抑菌活性为对照的90.1%-87.3%。90℃-100℃各处理30min活性下降的比较明显,抑菌活性为对照的63.9%-59.1%。
2.1.2 pH稳定性
在pH值低于4时,发酵液抑菌活性完全丧失,表明发酵液代谢产物对酸敏感;pH4-5范围和pH9-10范围内活性均有降低,抑菌活性为对照的45.1%-88.7%。pH6-8的范围内活性保持稳定,说明YL11适合于中性或弱碱性环境,分离纯化的最佳pH为6-8之间。
2.1.3 紫外光照稳定性
在紫外光下连续照射12h后,YL11发酵液活性基本保持不变,抑菌活性仍然能达到对照的83.7%,表明YL11发酵液具有良好的紫外光照稳定性。
2.2 发酵培养基组分的优化
由图1可见,葡萄糖作为辅助碳源时发酵液的抑菌活性最高,抑菌圈直径达到26.7mm,利用麦芽糖和蔗糖的发酵液抑菌活性相当不存在显著性差异p>0.05,抑菌圈分别为25.2mm和24.9mm,其次是淀粉。表明YL11利用单糖的能力要强于二糖和多糖,所以选择葡萄糖为最佳碳源。
由图2可见,当磷酸二氢铵作为辅助氮源时,发酵液抑菌活性最大,抑菌圈直径为28.0mm,表明对磷酸二氢铵的利用效率最高。尿素最低,抑菌圈直径为22.9mm,甚至低于LB基本培养基对照(25.4mm),可能尿素不利于YL11对氮源的利用或者产生了其他化学物质抑制了其抑菌活性产物的活性。
由图3可见,当硫酸镁作为辅助无机盐时,抑菌活性最高,抑菌圈直径达到29.7mm,所以选择硫酸镁为发酵液的无机盐。因此,以LB培养基为基础培养基,确定YL11的最佳配方组成为:葡萄糖1%,酵母提取物0.5%,蛋白胨1%,磷酸二氢铵1%,氯化钠1%,硫酸镁0.5%。抑菌圈大小为29.7mm,采用传统LB培养基,抑菌圈大小为25.4mm,由此可见,培养基优化后能明显提高发酵液的抑菌活性。

图2 不同氮源对YL11抑菌活性的影响Fig.2 Effect of nitrogen source on the antagonistic activity of YL11

图3 不同无机盐对YL11抑菌活性的影响Fig.3 Effect of inorganic salt on the antagonistic activity of YL11
2.3 发酵条件的优化
由图4可知,随着发酵时间的延长,抑菌活性逐步增大,发酵时间为100h时,抑菌活性最高,抑菌圈直径为30.7mm,而后随着时间延长抑菌活性逐渐下降。发酵时间短,抑菌活性物质产量低,抑菌性能低;发酵时间过长,抑菌活性也逐渐下降,可能原因是随着培养时间的延长,YL11菌体的大量繁殖及营养基质的逐步消耗,菌体开始衰老、自溶,所以确定发酵时间为100h。
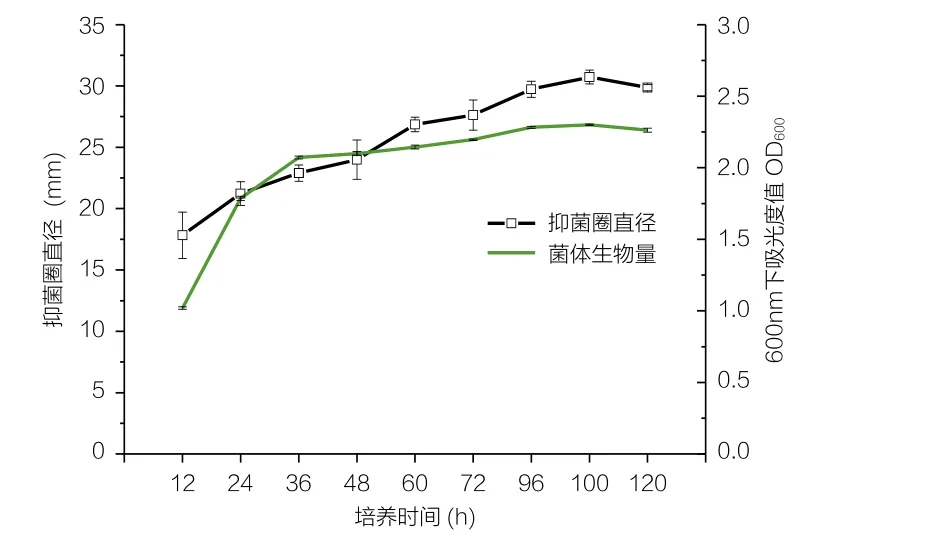
图4 培养时间对YL11生长及抑菌活性的影响Fig.4 Effect of fermentation time on the growth and antagonistic activity of YL11
由图5可知,YL11菌株在25℃-40℃时均可产生抑菌活性物质。在28℃时,抑菌活性最大,抑菌圈直径为30.7mm,37℃及40℃时,抑菌活性均有降低,这可能是温度升高不利于YL11菌体生长所致。所以确定发酵温度为28℃。
由图6可知,发酵液初始pH在5和8时对活性物质的影响较小,当初始发酵液pH为7时抑菌活性最大,抑菌圈直径为30.7mm,在弱酸及弱碱条件下抑菌活性均有轻微下降。所以确定发酵pH为7。

图5 温度对YL11生长及抑菌活性的影响Fig.5 Effect of temperature on the growth and antagonistic activity of YL11

图6 不同初始pH值对YL11生长及抑菌活性的影响Fig.6 Effect of initial pH on the growth and antagonistic activity of YL11
由图7可知,YL11发酵液的接种量在1%-9%范围内均能达到较高的抑菌效果,当接种量为3%时抑菌圈直径最大,达到30.7mm,接种量大于3%时,菌株生物量及抑菌活性开始逐渐降低,确定接种量为3%。
由图8可知,在100mL的锥形瓶中装液量为30mL,发酵液抑菌活性最强,随着装液量的增加,发酵液抑菌活性逐渐降低,说明摇瓶内空气含量对YL11产活性代谢产物影响较大,但过低的装液量会导致营养物质供应不足菌体生物量下降进而影响抑菌活性。所以确定装液量为30ml。

图7 接种量对YL11生长及抑菌活性的影响Fig.7 Effect of inoculation amount on the growth and antagonistic activity of YL11

图8 装液量对YL11生长及抑菌活性的影响Fig.8 Effect of liquid volume on the growth and antagonistic activity of YL11
由图9可知,YL11菌株的生物量随转速的增加先增加后减少,在转速120r/min时生物量和抑菌活性均达到峰值,转速进一步增大菌体生物量略有下降,抑菌活性略有升高,表明高转速对菌体结构产生破坏从而导致活性物质释放。120r/min-180r/min均不存在显著性差异p>0.05,综合考虑,选择120r/min为最佳摇床转速。

图9 摇床转速对YL11生长及抑菌活性的影响Fig.9 Effect of rotational speed on the growth and antagonistic activity of YL11
3 结论与讨论
本研究以前期分离获得的一株对马铃薯干腐病病原菌——F. sulphureum有拮抗作用的Pseudomonas sp.YL11为研究对象,对发酵液理化性质进行测定,并以LB培养基作为YL11菌株发酵条件优化的基础培养基,通过添加辅助碳源、氮源及无机盐,对温度、pH值、转速、接种量、装液量及培养时间进行优化。
结果表明:YL11抑菌活性成分具有较好的热稳定性,经过30℃-50℃各处理30min后活性基本保持稳定,60℃-80℃各处理30min活性略有降低,抑菌活性为对照的90.1%-87.3%;pH6-8的范围内活性保持稳定,适合于中性或弱碱性环境;紫外灯照12h后抑菌活性基本不变,仍然能达到对照的83.7%,具有良好的紫外光照稳定性。
最佳培养基配方为:葡萄糖1%,酵母提取物0.5%,蛋白胨1%,NH4H2PO4 1%,NaCl 1%,MgSO4 0.5%,发酵温度28℃,初始pH7,接种量3%,装液量30 mL /100mL,摇床转速120r/min,发酵时间100h,在此条件下发酵上清液对F. sulphureum的抑菌活性最强,抑菌圈直径达到30.7mm,与优化前25.4mm相比,显著提高了抑菌效果,为今后工业化生产提供理论依据和参考。本研究仅探讨了拮抗菌株发酵培养的条件及其影响因素,我们今后将对抑菌机制及活性物质的分离提取进行系统的研究,为马铃薯干腐病的生物防治打下基础。
[1]李金华, 柴兆祥, 王蒂, 等. 甘肃马铃薯贮藏期真菌性病害病原菌的分离鉴定[J]. 兰州大学学报, 2007, 43(2): 39-42
[2]候忠艳. 马铃薯干腐病的发生与防治[J]. 现代农业科技, 2012, 10: 173-179
[3]何苏琴, 金秀琳, 魏周全, 等.甘肃省定西地区马铃薯块茎干腐病病原真菌的分离鉴定[J]. 云南农业大学学报, 2004,19(5): 550-552
[4]李金华, 王蒂, 柴兆祥, 等. 甘肃省马铃薯镰刀菌优势病原菌的分离鉴定[J]. 植物病理学报, 2011, 41:456-463
[5]Shin JH, Han JH, Lee JK, Kim KS. Characterization of the maize stalk rot pathogens Fusarium subglutinans and F.temperatum and the effect of gungicides on their mycelial growth and colony formation[J]. The Plant Pathology Journal, 2014,30:397-406
[6]Lucas JA, Hawkins NJ, Fraaije BA. The evolution of fungicide resistance[J]. Advance in Applied Microbiology, 2015, 90: 29-92
[7]左静, 廖晓兰. 应用假单胞菌防治植物真菌性病害研究进展[J]. 现代农业科技, 2011, 22: 164-167
[8]方俊松. 农业生物防治的特点及方法[J]. 现代农业科技, 2014, 07: 112
[9]张礼生, 陈红印. 生物防治作用物研发与应用的进展[J]. 中国生物防治学报, 2014, 30(5): 581-586
[10]王全, 李术娜, 王树香, 等. 白菜黑斑病菌拮抗细菌LBC-2的筛选鉴定、发酵条件优化及田间防效[J]. 中国生物防治学报, 2015, 31(1): 96-105
[11]丛铭, 施渺筱, 张传萍, 等. 烟草疫霉街抗菌筛选、鉴定及发酵条件研究[J]. 中国酿造, 2013, 32(12): 30-34
[12]蒋海霞, 周莲, 何亚文. 铜绿假单胞菌生防菌株抑菌代谢产物及其生防应用研究进展[J]. 微生物学通报, 2015, 42(7):1338-1349
[13]杨光富, 魏云林. 假单胞菌研究现状及应用前景[J]. 生物技术通报, 2011(1): 37-39
[14]陈芳, 贠建民, 艾对元, 等. 拮抗扩展青霉菌株的筛选及其抗菌活性物质分离[J]. 食品工业科技, 2014(9): 160-164

