一株猪源B型多杀性巴氏杆菌的分离与鉴定
■文/山东绿都生物科技有限公司 李天芝 于新友
一株猪源B型多杀性巴氏杆菌的分离与鉴定
■文/山东绿都生物科技有限公司 李天芝 于新友
对山东惠民某猪场猪病料进行病原菌的分离,对分离菌进行形态学观察、生化试验、药敏试验、致病性试验和PCR鉴定。结果成功分离到一株荚膜血清B型多杀性巴氏杆菌,该菌的分离鉴定为自家灭活菌苗的制备提供了候选菌株。
多杀性巴氏杆菌;荚膜血清B型;分离鉴定
多杀性巴氏杆菌(Pasteurella multocida,Pm)是一种重要的病原菌,对多种动物和人均有致病性。Pm可引起猪巴氏杆菌病(Swine pasteurellosis),该病又叫猪肺疫,俗称“锁喉风”或“肿脖子瘟”。急性病例为出血性败血病、咽喉炎和肺炎的病状,慢性病例主要为慢性肺炎症状,散发性发生,给养猪业造成严重的经济损失[1]。Pm分为A、B、D、E和F等5个荚膜血清型[2],其中B型是导致我国猪巴氏杆菌病的主要病原[3,4]。Townsend等[5]建立了多杀性巴氏杆菌PCR鉴别和分型方法,已得到国内研究者的广泛应用[6,7]。2016年8月山东省惠民某猪场,猪呼吸困难、咳嗽、食欲废绝、腹泻,开始个别死亡,然后病情迅速蔓延,出现大量死亡。剖检可见鼻腔有脓性分泌物,咽喉部黏膜充血、水肿;支气管、气管出血,内有多量泡沫状粘液;内脏器官广泛出血,胸腔、心包内有大量积液,肺脏与胸壁粘连,充血、水肿并伴有不同程度的实变,肝肿大、有小坏死灶,胃、肠黏膜出血,淋巴结水肿。本试验采集病死猪的心血、肝脏、脾脏等病料,对采集病料进行细菌分离培养、形态学观察、生化试验、药敏试验、致病性试验及PCR鉴定,确定此分离株是猪源B型多杀性巴氏杆菌。
1 材料
1.1 病料
对山东省惠民某猪场疑似巴氏杆菌病死猪进行剖检,无菌采取心血、肝脏、脾脏等病料。
1.2 试验用动物
20只16~20g清洁级昆明系小鼠,购自山东省实验动物中心。
1.3 试剂
草酸铵结晶紫、革兰氏碘液、石炭酸复红染液、普通琼脂平板、鲜血琼脂平板及血清肉汤培养均由山东绿都生物科技有限公司质量监察部提供;生化试验用各种试剂及糖发酵管、药敏纸片均购自杭州天和微生物试剂有限公司;DL2000 Marker、Taq酶均购自宝生物工程(大连)有限公司;基因组DNA小量抽提试剂盒购自上海华舜生物技术有限公司。
1.4 PCR引物设计
参照文献[5]设计猪多杀性巴氏杆菌PCR鉴定和分型引物,鉴定引物用于扩增KMT1基因片段,扩增片段长度为460bp,分型引物分别用于扩增A、B、D、E、F荚膜血清型特异性基因hyaD-hyaC、bcbD、dcbF、ecbJ、fcbD,扩增片段长度分别为1,044bp、760bp、657bp、511bp和851bp。引物由生工生物工程(上海)股份有限公司合成。引物信息见表1。

表1 引物信息
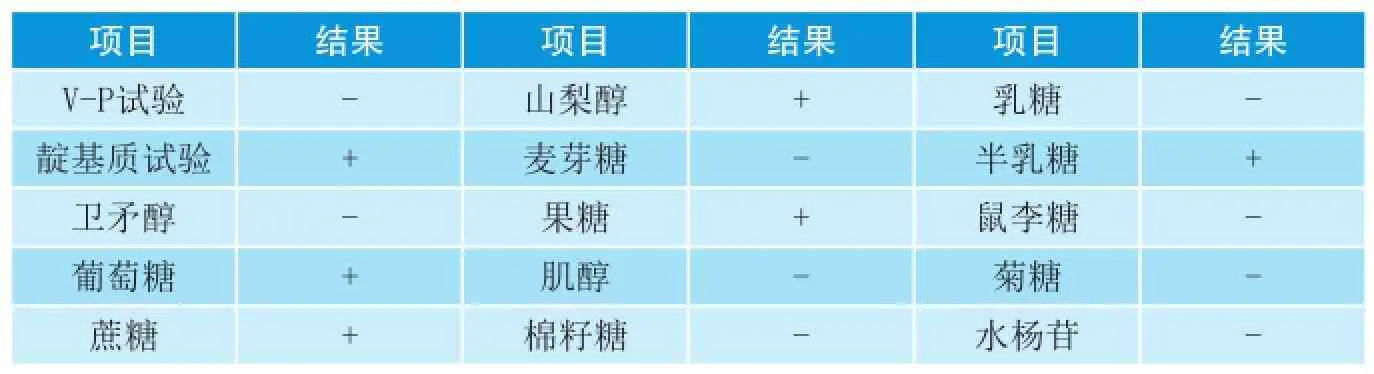
表2 分离菌的生化反应结果
2 方法
2.1 直接涂片镜检
在无菌条件下,分别将无菌采取病死猪的心血、肝脏、脾脏涂片或触片,干燥、固定、革兰氏染色、镜检,观察其形态特征。
2.2 细菌分离培养
将采集的猪心血、肝脏、脾脏无菌划线接种于血液琼脂平板,37℃培养24h,观察生长情况,对可疑菌落进行涂片,革兰氏染色镜检[8]。挑取单个可疑菌落接种于麦康凯营养琼脂培养基上,37℃培养24h。
2.3 生化鉴定
分别将分离菌经24h鲜血琼脂平板纯培养后,进行糖发酵试验及其他生化试验。
2.4 药敏试验
采用纸片琼脂扩散法(K-B法)将所分离的巴氏杆菌24h血清肉汤纯培养物10倍稀释后,接种于鲜血琼脂平板上,每个平板接种0.2mL,并将其涂布均匀。然后用无菌镊子将各种药敏片分别平放在培养基表面,保持纸片间适度距离,37℃温箱24h。观察结果并测量抑菌圈直径。
2.5 致病性试验
20只小白鼠,随机分两组,每组10只。无菌吸取上述经生化鉴定的分离菌培养物,腹腔分别注射10只试验组小白鼠,每只注射0.2mL(2×109CFU/mL),10只对照分别腹腔注射0.2mL血清肉汤作对照。注射后小白鼠隔离饲养,观察发病及死亡情况。并对死亡小白鼠的心血、脑、脾进行细菌分离。
2.6 PCR鉴定及分型
挑取血液琼脂平板上单个菌落,接种于含5%小猪血清的马丁液体培养基中,37℃ 200rpm,振荡培养20h,用基因组DNA小量抽提试剂盒(上海华舜生物技术有限公司)提取分离菌株的基因组DNA作为PCR的模板,进行PCR扩增。反应体系(50μL):10×Buffer(含MgCl2)5μL、上下游引物各2μL(20pmol/L)、dNTP 4μL、TagDNA聚合酶0.5μL、模板1μL,加水补足至50μL。扩增反应程序:94℃ 5min;94℃ 30s,55℃ 30s,72℃ 45s,30个循环;72℃ 7min。分型采用多重PCR,反应体系与条件同上。取5μL PCR产物于1.0%琼脂糖凝胶电泳检测。将PCR产物回收,连接到pMD18-T载体,转化大肠杆菌感受态DH5a,挑取单菌落,摇床培养,将鉴定阳性的质粒送生工生物工程(上海)股份有限公司测序。
3 结果与分析
3.1 直接涂片镜检结果
心血涂片肝脏、脾脏触片革兰氏染色镜检,可见革兰氏阴性短小杆菌,瑞氏染色成典型的两极着色。
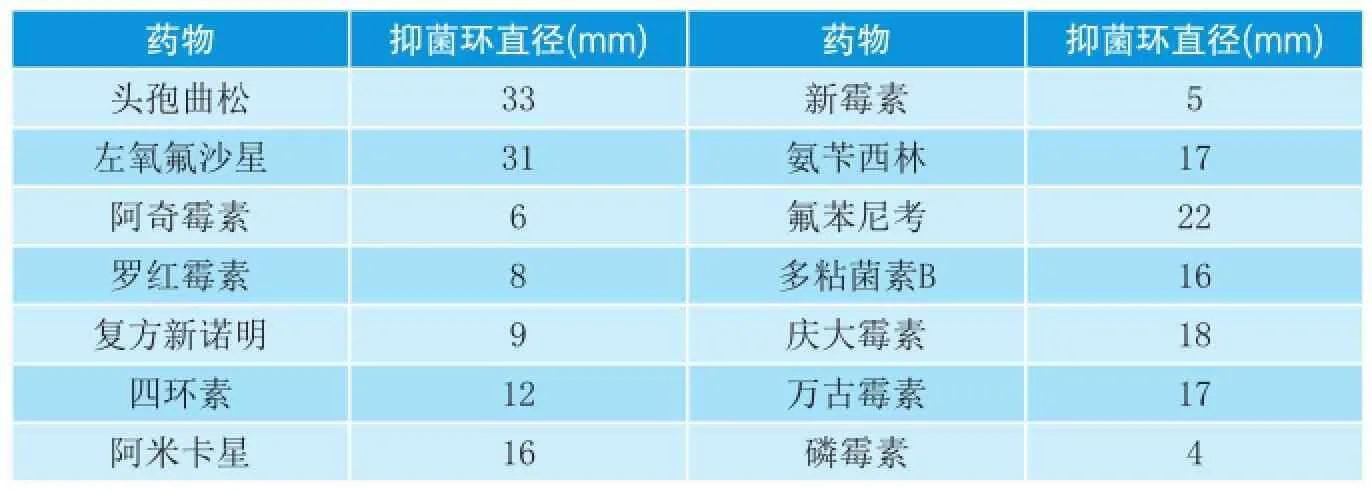
表3 分离菌株的药物敏感性试验结果

图1 分离菌株的PCR鉴定

图2 分离菌株的PCR分型

图3 测序结果
3.2 细菌分离培养结果
在鲜血琼脂平板上37℃培养24h后,形成表面光滑湿润、圆形隆起、边缘整齐、微蓝色闪光的菌落,菌落周围不溶血。挑取单个菌落涂片进行革兰氏染色,镜检为革兰氏阴性短小杆菌,瑞氏染色成典型的两极着色。在麦康凯营养琼脂培养基上未见生长。
3.3 生化试验结果
由表2可知,从病死猪中分离的巴氏杆菌能发酵葡萄糖、蔗糖、果糖、半乳糖、山梨醇,不能发酵肌醇、水杨苷、鼠李糖、卫矛醇、麦芽糖、菊糖、棉籽糖、乳糖,靛基质试验阳性,V-P试验阴性,与巴氏杆菌的生化特征一致。
3.4 药物敏感性试验结果
由表3可知,分离菌对头孢曲松、氟苯尼考、左氧氟沙星高度敏感,对氨苄西林、万古霉素、多粘菌素B、庆大霉素、阿米卡星低度敏感,对阿奇霉素、罗红霉素、四环素、新霉素、磷霉素、复方新诺明耐药。
3.5 致病性试验
分离菌的血清肉汤纯培养物注射试验组的小白鼠24h后,均表现精神沉郁、活动减弱、呼吸急促、采食减少,对照组无此现象。试验组小鼠在接种72h内全部死亡。剖检死亡小鼠可见胸腔有浆液性纤维素性渗出物,心外膜有出血点,肺出血、坏死。取肺组织涂片,革兰氏染色镜检为革兰氏阴性短小杆菌。对照组小白鼠未见异常。
3.6 PCR鉴定及分型
采用鉴定引物对分离菌进行PCR检测,结果显示,在460bp处有一特异性条带(见图1),说明分离到的菌为多杀性巴氏杆菌,用5对分型引物混合进行多重PCR,结果显示该分离菌株在760bp左右有一条特异性条带(见图2),说明所分离到的病原菌为猪B型多杀性巴氏杆菌。
3.7 基因克隆的测序分析
目的基因回收后,连pMD18-T载体,转化DH5a,采用PCR方法筛选阳性菌落,同时将含有插入片段的阳性质粒送去测序。测序结果见图3,将测得序列与GenBank中的进行同源性比较,与巴氏杆菌B型序列(登录号AF169324)同源性为100%。
4 讨论
本试验对山东惠民猪场病料进行细菌分离,以表型特征为依据初步鉴定为Pm,采用常规的鉴定方法如生化试验、药敏试验和动物致病性试验进行鉴定,并参照Townsend等[5]建立了多杀性巴氏杆菌鉴定和分型方法,对分离菌进行分子水平的鉴定,表明分离菌为多荚膜B型多杀性巴氏杆菌,PCR方法极大地缩短了从病原上诊断该病的时间,从而为猪多杀性巴氏杆菌病的快速诊断提供了有力的工具。生化试验结果表明,该分离菌生化特征与巴氏杆菌的一致,可发酵葡萄糖、蔗糖、果糖、半乳糖、山梨醇,不能发酵肌醇、水杨苷、鼠李糖、卫矛醇、麦芽糖、菊糖、棉籽糖、乳糖,靛基质试验阳性,V-P试验阴性,药敏试验结果表明,该分离株对头孢曲松、氟苯尼考、左氧氟沙星高度敏感,对氨苄西林、万古霉素、多粘菌素B、庆大霉素、阿米卡星低度敏感,对阿奇霉素、罗红霉素、四环素、新霉素、磷霉素、复方新诺明有明显耐药性。建议猪场在防治巴氏杆菌病时,对分离病源菌进行药敏试验,找到最有效的药物,用2~3种敏感药物交替使用,才能收到事半功倍的效果。动物回归试验表明,小白鼠致死后,再次分离细菌仍然为荚膜血清B型多杀性巴氏杆菌,表明该菌株具有较强的毒力。该菌的成功分离鉴定,为临床诊断和治疗提供可靠依据,为进一步开展巴氏杆菌的分子生物学研究、诊断试剂研制以及自家灭活菌苗的制备等方面的研究奠定了基础。■
[1] 徐引弟,王治方,朱文豪,等.猪多杀性巴氏杆菌的分离鉴定和药敏试验[J].中国兽药杂志,2011,45(5):5~7.
[2] Carter GR. Pasteurellosis:Pasteurella multocida and Pasteurella hemolytica[J]. Adv Vet Sci, 1967,11:321~379.
[3] 吴范庚.我国多杀性巴氏杆菌血清学鉴定及交互免疫试验[J].中国兽医杂志,1997,23(8):14~15.
[4] 郭大和,郑明,潘松年.我国多杀性巴氏杆菌荚膜抗原的血清学鉴定[J].畜牧兽医学报,1979,10(2):67~77.
[5] Townsend KM, Boyce JD, Chung JY, et al. Genetic organization of Pasteurella multocida cap Loci and development of a multiplex capsular PCR typing system[J]. J Clin Microbiol,2001,39(3):924~929.
[6] 马文戈,于力.猪源荚膜血清B型多杀性巴氏杆菌的分离鉴定[J].中国预防兽医学报,2008,30(10):747~754.
[7] 李永明,罗阿东,徐景峨,等.猪源多杀性巴氏杆菌的生物学鉴定与荚膜PCR分型[J].中国预防兽医学报,2007,29(7):506~509.
[8] 胡桂学.兽医微生物实验教程[M].北京:中国农业大学出版社,2006:35~38.
山东省现代农业产业技术体系生猪产业创新团队项目(SDAIT-08-17)。

