miR-425-5p在宫颈癌中的表达及临床意义
朱军 赵琴
宫颈癌是世界上第二大妇科恶性肿瘤疾病,发病率已占到全球所有癌症的12%左右[1]。由于基因水平表观遗传的改变,宫颈癌患者细胞增殖分化侵袭均不受机体控制[2]。尽管越来越多的研究显示,宫颈癌早期检出能够大大降低死亡率,但一旦病情到中晚期才开始干预治疗时,其预后疗效往往不佳[3-4]。已有的报道表明,宫颈癌患者年龄、肿瘤大小、FIGO分期、淋巴结转移、淋巴管血管浸润以及血红蛋白浓度与生存周期相关,然而这些指标对于宫颈癌预后的指导作用不大[5-7]。miRNA是一类较为保守的非编码小RNA,主要通过靶向作用miRNA降解或抑制翻译调节转录后基因表达[8]。miRNA参与调节细胞增殖、凋亡等与肿瘤发生密切相关的机体生理过程,已在许多不同类型的肿瘤类型中发现miRNA表达水平出现失调现象[9]。研究表明,miRNA可作为多种癌症预后的生物标志物[10]。因此,对于新的分子生物学标志物的研究来作为该疾病的预后治疗指标具有重要的临床意义。本文就宫颈癌患者miR-425-5p的表达情况进行分析,并探讨两者的相关性。
资料与方法
1.临床资料:选择2014年1月—2016年4月在本院妇产科就诊的宫颈癌患者共38例作为观察组,年龄范围为48~72岁,平均年龄(62.7±17.5)岁,其中宫颈癌I期患者7例、II期患者13例、III期患者18例。所有患者均通过病理医生对病变组织切片HE染色的观察,分期标准采用UICC/AJCC系统进行确认[11]。同时,手术获取各患者癌旁组织。选择同期38例正常健康人为对照组,年龄范围45~74岁,平均年龄(63.1±16.3)岁,经统计两组年龄、体重以及BMI等一般临床指标差异均无统计学意义。所有纳入的宫颈癌患者之前均未接受手术、化疗或放疗等相关治疗手段。
2.检测方法:收集所有入组患者的病变和癌旁组织以及促凝血5 ml,促凝血通过水平离心机3 000 rpm离心15 min后收集上清。采用QIAGEN miRNAeasy Mini kit试剂盒进行抽提各组织和血清总RNA。随后使用NanoDrop 2000仪器对提取的各样本RNA浓度进行检测,OD值在1.8~2.0之间。通过ABI TaqMan miRNA逆转录试剂盒将提取的10 ng总RNA反转录为cDNA。QRT-PCR运用ABI公司合成miR-425-5p和内参RNU6B的Taqman探针。ABI 7500荧光定量PCR仪对靶miRNA和内参进行qRT-PCR,每个标本均有3个复孔。结果统计采用相对表达水平,采用2-ΔCT方法,ΔCT=CT目的-CT内参。
3.统计学处理:应用SPSS17.0进行数据统计,数据分析采用χ2检验和t检验,以P﹤0.05为差异有统计学意义。
结果
1.宫颈癌患者miR-425-5p在癌旁正常组织和肿瘤组织中的表达情况:由图1可以看出,宫颈癌组织中的miR-425-5p表达水平明显高于癌旁组织,平均值的差异倍数大于3倍,且差异有统计学意义。同时,宫颈癌患者临床分期为II/III期的miR-425-5p表达水平则显著高于I期患者,差异有统计学意义。

图1 宫颈癌患者不同组织和临床分期miR-425-5p表达水平对比
2.两组患者血清miR-425-5p水平的表达对比:图2所示,与宫颈癌患者癌旁组织和肿瘤组织类似,观察组宫颈癌患者血清miR-425-5p表达水平显著高于对照组健康人群,差异明显且有统计学意义。
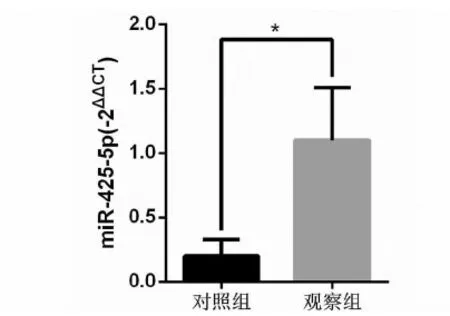
图2 两组患者血清miR-425-5p水平的表达对比
3.宫颈癌患者病变组织miR-425-5p的表达水平与临床病理特征的关系对比:与癌旁正常组织miR-425-5p表达水平比较,肿瘤组织中其表达上调小于150%的共有20例(表1所示的低表达组),而大于等于150%共有18例(表1所示的高表达组)。由表1可以看出,宫颈癌患者miR-425-5p病理组织中表达水平与临床分期和淋巴结转移密切相关,即当患者临床分期在II-III期或淋巴结转移为阳性时,其病变组织miR-425-5p表达水平较高,miR-425-5p高低表达组和低表达组之间差异有统计学意义。另外,患者年龄和肿瘤大小则与miRNA-425-5p表达水平无明显相关性。
表1宫颈癌患者病变组织miR-425-5p高表达和低表达组临床指标对比[例(%)]

指标低表达组(n=20)高表达组(n=18)年龄(岁) >607(467)8(533) ≤6013(565)10(435)肿瘤大小(cm) <2010(500)10(500) ≥2010(556)8(444)临床分期 I9(818)2(182) II⁃III11(407)16(593)∗淋巴结转移 阳性3(200)12(800)∗ 阴性17(680)6(320)
注:与低表达组比较,*P<0.05
4.宫颈癌患者血清miR-425-5p水平与临床病理特征的关系对比:表2显示,血清miRNA-425-5p表达水平同样与临床分期和淋巴结转移相关,呈现出明显的正相关性,且低表达组和高表达组的差异有统计学意义,年龄和肿瘤大小则与血清miRNA-425-5p表达水平无明显相关性。
表2宫颈癌患者血清miR-425-5p水平与临床病理特征的关系对比[例(%)]

指标低表达组(n=20)高表达组(n=18)年龄(岁) >606(467)9(533) ≤6014(565)9(435)肿瘤大小(cm) <209(500)11(500) ≥209(556)9(444)临床分期∗ I9(818)2(182) II⁃III10(407)17(593)淋巴结转移∗ 阳性2(200)13(800) 阴性17(680)6(320)
注:*P<0.05
讨论
miRNA在肿瘤发生和发展过程中密切相关[12]。近年来,有研究报道miRNA分别参与促进或抑制不同类型肿瘤形成的生物学过程,其中包括女性高发肿瘤宫颈癌[13]。研究显示,miR-182在宫颈癌的发生和恶化过程中呈现明显的上调,表现出明显的正相关性[14]。同样,miR-150也参与宫颈癌肿瘤细胞的增殖[15]。另一方面,miRNA-506通过调控Hedgehog通路中一些转录因子表达进而抑制宫颈癌的生成[16]。此外,miR-195可以靶向抑制宫颈癌的增殖、迁移和侵袭等生物学过程[17]。因此,通过以上现有的研究发现,不同miRNA在宫颈癌的形成和发展过程中可以起到相反的生物学作用。miR-425-5p已在肾癌、肺癌、乳腺癌和膀胱癌中有报道指出其可作为潜在的肿瘤标志物,而在宫颈癌的表达情况需要进一步研究。
本研究显示,宫颈癌患者病变组织中的miR-425-5p表达水平显著高于癌旁组织,同时患者与健康人群相比血清miR-425-5p表达水平也呈现出明显的上调,以上结果推测miR-425-5p可能参与宫颈癌的发生,为促肿瘤发生因子。本研究发现,宫颈癌II-III期和淋巴结转移表现为阳性的患者病变组织miR-425-5p的表达水平显著高于I期和淋巴结阴性患者,其表达水平的高低与临床分期和淋巴结转移呈正相关性,且同样的趋势在患者外周血血清样本中得到进一步的确认,表明miR-425-5p在宫颈癌形成和恶化过程中起到一定的促进作用。因此,检测宫颈癌患者病变组织和血清的miR-425-5p表达水平均能够作为一个可能的标志物检查,以辅助临床上对该疾病的诊断。
总之,miR-425-5p在宫颈癌患者病变组织中呈现明显的上调现象,与临床分期和淋巴结转移呈明显的相关性。miR-425-5p可作为临床宫颈癌患者确诊的潜在生物学标志物之一。
1 Dasari S,Wudayagiri R,Valluru L.Cervical cancer:Biomarkers for diagnosis and treatment.Clin Chim Acta,2015,445:7-11.
2 焦淑娟.Nrf2对宫颈癌细胞增殖、侵袭、迁移等作用的研究.新疆医科大学,2016:23-24.
3 谢海霞,常淑芳,孙江川.前哨淋巴结活检对早期宫颈癌盆腔淋巴结转移诊断的Meta分析.实用妇产科杂志,2016,32:275-278.
4 乔志伟,王安娜,王纯雁,等.磁共振成像检查对早期宫颈癌分期价值研究.中国实用妇科与产科杂志,2015,31:247-250.
5 Kyung MS,Kim HB,Seoung JY,et al.Tumor size and lymph node status determined by imaging are reliable factors for predicting advanced cervical cancer prognosis.Oncol Lett,2015,9:2218-2224.
6 Zhou J,Yang HY,Wu SG,et al.The local treatment modalities in FIGO stage I-II small-cell carcinoma of the cervix are determined by disease stage and lymph node status.Cancer Med,2016,5:1108-1115.
7 Kim HS,Yoon G,Ryu JY,et al.Sphingosine kinase 1 is a reliable prognostic factor and a novel therapeutic target for uterine cervical cancer.Oncotarget,2015,6:26746-26756.
8 Palanichamy JK,Rao DS.miRNA dysregulation in cancer:towards a mechanistic understanding.Front Genet,2014,5:54.
9 Hayes J,Peruzzi PP,Lawler S.MicroRNAs in cancer:biomarkers,functions and therapy.Trends Mol Med,2014,20:460-469.
10 Huang JT,Wang J,Srivastava V,et al.MicroRNA Machinery Genes as Novel Biomarkers for Cancer.Front Oncol,2014,4:113.
11 陈曼玲,金松,何超蔓.宫颈癌临床分期与术后病理分析.中华妇幼临床医学杂志(电子版),2008,4:35-36.
12 Di Leva G,Croce CM.miRNA profiling of cancer.Curr Opin Genet Dev,2013,23:3-11.
13 Lin S,Gregory RI.MicroRNA biogenesis pathways in cancer.Nat Rev Cancer,2015,15:321-333.
14 Tang T,Wong HK,Gu W,et al.MicroRNA-182 plays an onco-miRNA role in cervical cancer.Gynecol Oncol,2013,129:199-208.
15 Li J,Hu L,Tian C,et al.microRNA-150 promotes cervical cancer cell growth and survival by targeting FOXO4.BMC Mol Biol,2015,16:24.
16 Wen SY,Lin Y,Yu YQ,et al.miR-506 acts as a tumor suppressor by directly targeting the hedgehog pathway transcription factor Gli3 in human cervical cancer.Oncogene,2015,34:717-725.
17 Du X,Lin LI,Zhang L,et al.microRNA-195 inhibits the proliferation,migration and invasion of cervical cancer cells via the inhibition of CCND2 and MYB expression.Oncol Lett,2015,10:2639-2643.

