梨幼果多酚的纯化及其抗氧化性
朱 洁,王红宝,孔佳君,宋小飞,陶书田
(南京农业大学园艺学院,江苏 南京 210095)
梨幼果多酚的纯化及其抗氧化性
朱 洁,王红宝,孔佳君,宋小飞,陶书田*
(南京农业大学园艺学院,江苏 南京 210095)
采用5 种大孔吸附树脂分离纯化梨幼果多酚,并测定其抗氧化性。结果表明,综合分析吸附与解吸效果,NKA-9大孔树脂性能较好,最适合用来纯化梨幼果多酚;NKA-9大孔树脂对梨幼果多酚进行纯化时,最适宜的条件为:将2 mg/mL的多酚提取液调至pH值为5.0,设定进样流速为1 mL/min,充分吸附,然后用70%的乙醇为洗脱液进行动态洗脱,洗脱流速为1 mL/min,用此方法纯化后的梨幼果多酚的纯度从6.23%提高到30.68%;梨幼果多酚粗品对1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl radicals,DPPH)自由基、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐自由基(2,2’-azinobis-(3-ethylbenzthiazoline-6-sulphonate) radicals,ABTS+·)、亚硝酸基的IC50值分别为:151.07、152.48、490.35 μg/mL;梨幼果多酚纯品对DPPH自由基、ABTS+•、亚硝酸基的IC50值分别为:122.12、130.78、392.09 μg/mL;纯化后的多酚样品抗氧化能力比粗品有所增强。
大孔树脂;梨幼果多酚;纯化;抗氧化性
朱洁, 王红宝, 孔佳君, 等. 梨幼果多酚的纯化及其抗氧化性[J]. 食品科学, 2017, 38(5): 14-20. DOI:10.7506/spkx1002-6630-201705003. http://www.spkx.net.cn
ZHU Jie, WANG Hongbao, KONG Jiajun, et al. Purification and antioxidant activity of polyphenols from young pear fruits[J]. Food Science, 2017, 38(5): 14-20. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201705003. http://www.spkx.net.cn
梨属于蔷薇科梨属,在我国栽培历史悠久,已种植3 000多年。梨中不仅富含蛋白质、维生素、碳水化合物等营养物质[1],还含有如儿茶素、没食子酸等酚类物质[2-3]。研究证明,多酚类物质在梨幼果中广泛存在[4]。在农业生产过程中,因为疏花疏果或梨树本身正常的生理落果,许多梨幼果被丢掉,使多酚类物质被大量浪费。因此应当对梨幼果加以充分利用。
植物多酚(plant polyphenol)别名单宁,包含所有多羟基类化合物,通过植物体的次生代谢过程产生,含量很高,主要存在于植物的根、茎、叶、皮、核和果肉中[5-7]。因为植物多酚中含有大量的酚羟基,所以其具有清除自由基等抗氧化活性。多酚类物质对自由基的清除作用在其他物种上已有很多报道,比如苹果皮渣多酚能够还原Fe3+,清除2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐自由基(2,2’-azinobis-(3-ethylbenzthiazoline-6-sulphonate) radicals,ABTS+·)、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基和超氧阴离子自由基[8];板栗总苞多酚能够清除DPPH自由基和ABTS+·[9];玫瑰果多酚对DPPH自由基、超氧阴离子自由基、羟自由基都有清除作用[10]。但是,关于梨多酚对自由基的清除作用的报道却较少。
植物多酚具有抗氧化、抗肿瘤等多种生理功能[11-13],但因为普通的溶剂提取法提取的多酚粗提液中杂质较多,会对多酚含量及其活性的测定产生干扰,所以将多酚粗提液进行纯化,得到纯度更高的多酚物质,对其后续研究至关重要。目前多酚的纯化方法主要有:层析法、沉淀分离法、色谱分离法、大孔树脂吸附法等。大孔吸附树脂是一种性质稳定的高分子材料,不会受到酸碱和有机溶剂的影响,其具有的巨大比表面积,使得吸附容量很大,多孔性的结构还能起到筛分的作用。同时,大孔树脂还能再生可以重复利用,既环保又降低了成本,是目前分离纯化多酚类物质应用较广泛的一种方法[14]。虽然大孔树脂纯化多酚类物质的研究很多,但是在梨多酚的纯化上却鲜有报道。
因为在生产上梨幼果被大量丢弃,其所含的多酚类资源被浪费,所以本实验以梨幼果为材料,采用5 种大孔吸附树脂分离纯化梨幼果多酚,筛选出最适树脂,并对梨多酚纯化的工艺条件进行优化,对其抗氧化活性进行测定,为梨幼果的充分利用和梨多酚的纯化及其进一步研究提供理论依据。
1 材料与方法
1.1 材料与试剂
梨幼果:‘翠冠’幼果(花后一个月)采自南京农业大学江浦梨资源圃。
A B-8型、D 1 0 1型、S-8型大孔吸附树脂上海源叶生物公司;X-5型大孔吸附树脂 安徽三星树脂有限公司;NKA-9型大孔吸附树脂 郑州华溢有限公司;没食子酸、福林-酚、无水碳酸钠、DPPH、VC、ABTS等均为分析纯。
1.2 仪器与设备
JA1203精密电子天平 上海良平仪器仪表有限公司;台式高速冷冻离心机 美国贝克曼库尔特公司;台式恒温振荡器 江苏太仓市华美生化仪器厂;水浴锅 上海新苗医疗器械有限公司;玻璃层析柱(25 mm×300 mm) 上海沪西分析仪器厂。
1.3 方法
1.3.1 梨幼果多酚粗提液的制备
将梨幼果果肉用液氮速冻研磨成粉末,加入60%的乙醇溶液,溶液和样品比为30∶1(V/m),70 ℃水浴避光浸提2 h,然后12 000 r/min离心20 min,取上清液,就是梨幼果多酚粗提液[15]。
1.3.2 多酚含量的测定
将没食子酸作为基准物质,用福林-酚法[16]测定梨幼果多酚含量。回归方程为y=0.003 3x+0.064 3,R2=0.999 3。
1.3.3 大孔吸附树脂纯化梨幼果多酚
1.3.3.1 树脂的预处理
用95%的乙醇浸泡各种大孔吸附树脂24 h,再用去离子水冲洗至无酒精味道。接着用5%的NaOH溶液浸泡8 h,然后蒸馏水冲洗至中性,再用5%的HCl溶液浸泡8 h,蒸馏水处理至中性,预处理活化结束[17]。
1.3.3.2 最佳树脂类型的选择
将活化后的5 种树脂各称取1 g,加入50 mL梨多酚粗提液,放在25 ℃、120 r/min的恒温摇床上避光充分振荡24 h,测定上清液的多酚质量浓度。过滤,所得树脂用蒸馏水冲洗几次,再加入50 mL 70%的乙醇溶液进行解吸,对解吸液的多酚质量浓度进行测定。吸附量、吸附率、解吸率的计算见公式(1)~(3):
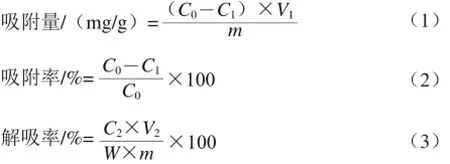
式中:C0为吸附前粗提液的多酚质量浓度/(mg/mL);Cl为吸附后梨幼果多酚质量浓度/(m g/m L);V1为加入梨幼果多酚粗提液体积/mL;m为树脂质量/g;C2为解吸液中梨幼果多酚质量浓度/(mg/mL);V2为解吸液体积/mL;W为吸附量/(mg/g)。
1.3.3.3 静态吸附曲线的测定
称取活化后的NKA-9树脂1 g,加入50 mL的多酚粗提液,放在25 ℃、120 r/min的恒温摇床上避光充分振荡24 h,隔一段时间取一次样,测定多酚质量浓度。分别以时间和吸附率为横纵坐标,绘制静态吸附曲线。
1.3.3.4 静态解吸曲线的测定
将吸附饱和的树脂,用蒸馏水冲洗几次,放在100 mL锥形瓶中,加入50 mL 70%的乙醇,在25 ℃、120 r/min的恒温摇床上避光充分振荡24 h,隔一段时间取一次样,测定多酚质量浓度。分别以时间和解吸率为横纵坐标,绘制静态解吸曲线。
1.3.3.5 pH值对吸附效果的影响
将活化后的NKA-9树脂称取5 份,每份各1 g,并加入20 mL多酚粗提液,然后用0.01 mol/L 的氢氧化钠溶液和盐酸溶液调节梨多酚粗提液的pH值至 3、4、5、6、7。于25 ℃、120 r/min 恒温摇床避光充分振荡吸附24 h后,测定多酚质量浓度,计算树脂对多酚的吸附率。
1.3.3.6 上样液质量浓度对吸附效果的影响
将活化后的NKA-9树脂称取7份,每份各1 g,加入不同质量浓度(0.5、1.0、1.5、2.0、2.5、3.0、3.5 mg/mL)的梨幼果多酚粗提液,于25 ℃、120 r/min恒温摇床避光充分振荡吸附24 h后,测定多酚质量浓度,计算树脂对多酚的吸附率。
1.3.3.7 上样速率对吸附效果的影响
称取活化的树脂20 g,湿法装进内径2.5 cm、高30 cm的层析柱中,首先用去离子水平衡层析柱,后将多酚粗提液分别以0.5、1.0、1.5、2.0、2.5 mL/min的流速进行上样吸附,将流出液进行收集,并对其多酚质量浓度进行测定。
1.3.3.8 洗脱剂种类对解吸率的影响
将活化后的NKA-9树脂称取5份,每份各1 g,加入20 mL多酚粗提液,于25 ℃、120 r/min恒温摇床避光充分振荡吸附24 h后,测定其多酚质量浓度,并计算其吸附量。把吸附饱和的树脂取出用蒸馏水冲洗几次,然后放到100 mL的锥形瓶中,分别加入体积分数为70%的甲醇、乙醇和乙酸乙酯溶液50 mL,于25 ℃、120 r/min恒温摇床避光充分振荡解吸24 h后,对解吸液中多酚的质量浓度进行测定,并计算其解吸率。
1.3.3.9 洗脱剂体积分数对解吸率的影响
将活化后的NKA-9树脂称取5 份,每份各1 g,加入20 mL多酚粗提液,于25 ℃、120 r/min恒温摇床避光充分振荡吸附24 h后,测定其多酚质量浓度,并计算其吸附量。把吸附饱和的树脂取出用蒸馏水冲洗几次,然后放到100 mL的锥形瓶中,分别加入体积分数为 40%、50%、60%、70%、80%的乙醇溶液50 mL,于25 ℃、120 r/min恒温摇床避光充分振荡解吸24 h后,对解吸液中多酚的质量浓度进行测定,并计算其解吸率。
1.3.3.10 洗脱剂洗脱流速对解吸率的影响
将20 g树脂放在烧杯中,加入100 mL的多酚粗提液,充分振荡吸附24 h,测定吸附后溶液的多酚质量浓度,并计算其吸附量。将吸附饱和的树脂湿法装进内径2.5 cm、高30 cm的层析柱中,用去离子水冲洗树脂去除杂质,然后用70%乙醇溶液分别以0.5、1.0、1.5、2.0、 2.5 mL/min的流速进行洗脱,将洗脱液进行收集,并对其多酚质量浓度进行测定。
1.3.4 梨幼果多酚的抗氧化性测定
1.3.4.1 总抗氧化能力测定
总抗氧化能力测定采用亚铁还原能力(ferric reducing antioxidant power,FRAP)法,梨幼果多酚的总抗氧化能力测定参照章丹丹等[18]的方法。先将3.6 mL的FRAP溶液(现配)加入到试管中,然后加入35 μL不同质量浓度的梨幼果多酚提取液,静置10 min后于593 nm波长处测定吸光度。FRAP溶液由3 种溶液配制:0.3 mol/L的pH 3.6醋酸盐缓冲液,溶于40 mmol/L HCl溶液的2,4,6-三(2-吡啶基)三嗪(2,4,6-tris(2-pyridyl)-striazine,TPTZ)和FeCl3溶液以10∶1∶1(V/V)混合。吸光度越高说明总抗氧化能力越强。
1.3.4.2 DPPH自由基清除率测定
分别取不同质量浓度的样品溶液0.2 mL,加入0.8 mL 60 μmol/L的DPPH溶液(无水乙醇配制),混匀后反应30 min(避光),在517 nm波长处测定吸光度为A1,用70%乙醇溶液代替样品测定吸光度为A0,无水乙醇代替DPPH溶液测定吸光度为A2。DPPH自由基清除率的计算见公式(4):

1.3.4.3 ABTS+·清除率测定
ABTS母液配制:ABTS溶液(7 mmol/L)和过硫酸钾溶液(2.45 mmol/L)以1∶1(V/V)混合摇匀。室温放置12~16 h(避光)。然后将ABTS母液用10 mmol/L、pH 7.4的磷酸盐缓冲液稀释,稀释液在734 nm波长处测定吸光度A0,要达到0.70±0.002。分别取不同质量浓度的样品溶液50 μL,加入750 μL的ABTS测定液,混合均匀,充分反应6 min,734 nm波长处测定吸光度为A1,用无水乙醇溶液代替ABTS溶液测定吸光度为A2,ABTS+·清除率的计算同公式(4)。
1.3.4.4 亚硝酸基清除率测定
分别取不同质量浓度的样品溶液500 μL,加入亚硝酸钠溶液(5 μg/mL)250 μL,振荡摇匀,37 ℃水浴30 min,然后加入0.4%对氨基苯磺酸溶液250 μL,摇匀静置15 min,再加入0.2%盐酸萘乙二胺溶液125 μL,混合均匀显色15 min,在536 nm波长处测定吸光度A1,将样品换为乙醇其他条件不变测的吸光度为A0,无水乙醇代替显色剂测定吸光度A2,亚硝酸基清除率的计算同公式(4)。
2 结果与分析
2.1 大孔吸附树脂的筛选
对X-5、AB-8、D101、S-8、NKA-9 5 种树脂的吸附解吸效果进行比较,筛选最适树脂。所用的5 种树脂的物理性质见表1,这5 种大孔树脂对于梨幼果多酚的吸附率和解吸率的结果如图1所示。

表 1 5 种大孔树脂的物理特性Table 1 Physical properties of fi ve macroporous resins

图 1 5 种大孔树脂的吸附率和解吸率Fig. l Adsorption and desorption rates of 5 macroporous resins
从图1可以看出,吸附率最高的是S-8树脂,为85.13%,NKA-9树脂次之;S-8树脂虽然吸附率很高,但是解吸率很低,仅为53.89%,D101树脂和NKA-9树脂的解吸率都较高。综合考虑,NKA-9树脂的吸附率和解吸率都较高,故NKA-9树脂为纯化梨幼果多酚的最适树脂。
以上结果说明大孔树脂吸附性能的好坏与树脂的极性有较大关系。李鸿江等[19]指出极性树脂对极性物质有较强的吸附效果。S-8和NKA-9树脂都是极性树脂,所以容易吸附极性的梨幼果多酚。艾志录等[20]研究发现对于苹果多酚的纯化效果最佳的也是NKA-9树脂。
2.2 NKA-9树脂的静态吸附解吸分析
2.2.1 NKA-9树脂的静态吸附曲线

图 2 NKA-9树脂静态吸附曲线Fig. 2 Static adsorption curve of NKA-9 resin
如图2所示,随着时间的延长树脂的吸附率变化越来越小,逐渐趋于平缓,2 h后NKA-9树脂的吸附基本达到饱和,即使时间继续延长,吸附率也几乎不再变化,所以NKA-9大孔树脂的静态吸附时间为2 h。

图 3 NKA-9大孔树脂静态解吸曲线Fig. 3 Static desorption curve of NKA-9 resin
2.2.2 NKA-9树脂的静态解吸曲线如图3所示,在2 h时NKA-9树脂基本已经达到解吸平衡,解吸时间继续延长解吸率也几乎不再变化,此时其解吸率可以达到74.45%。所以NKA-9大孔树脂的静态解吸时间为2 h。
2.2.3 pH值对吸附效果的影响

图 4 pH值对吸附效果的影响Fig. 4 Effect of pH on adsorption eff i ciency
如图4所示,溶液的酸性或碱性太强都会降低NKA-9树脂对梨幼果多酚的吸附率。在pH值较低时,NKA-9树脂对多酚的吸附率逐渐增加,pH 5时吸附率最大,达到85.19%;pH>5以后,溶液碱性越来越强,NKA-9树脂对多酚的吸附率下降,所以最适pH值为5。
pH值不同之所以能够导致树脂吸附效果的不同,是由多酚类物质的酸碱性造成的。在酸性条件下,树脂对于酸性物质的吸附效果好;在碱性溶液中,树脂对于碱性物质的吸附效果好[21]。梨幼果多酚中由于存在咖啡酸、绿原酸等酚酸类物质,所以其溶液呈弱酸性,在弱酸性条件下梨幼果多酚多数呈分子态,且形成共价结构,以氢键的方式与树脂结合吸附,故在pH值为5时吸附效果较好。
2.2.4 上样液质量浓度对吸附效果的影响
将不同质量浓度梨幼果多酚粗提液充分振荡吸附。上样液质量浓度对树脂吸附效果的影响如图5所示。当上样液质量浓度较低时,NKA-9树脂对梨幼果多酚的吸附率逐渐增加,当质量浓度达到2.0 mg/mL时吸附率最大,为51.78%;质量浓度超过2.0 mg/mL后,吸附率几乎不再变化,所以2.0 mg/mL为最适的质量浓度。当多酚溶液质量浓度较低时,被树脂吸附的多酚分子较少,不能使树脂达到饱和状态,增大多酚溶液的浓度,可以使更多的多酚分子与树脂接触,从而被其吸附[10]。但是随着多酚溶液的质量浓度增大,树脂吸附的多酚分子越来越多最终达到饱和,再增大多酚的质量浓度,其吸附率也不会改变,反而会出现沉淀,阻塞树脂。

图 5 上样液质量浓度对吸附效果的影响Fig. 5 Effect of sample concentration on adsorption eff i ciency
2.2.5 上样速率对吸附效果的影响

图 6 上样速率对吸附效果的影响Fig. 6 Effect of sample loading fl ow rate on adsorption eff i ciency
如图6所示,上样速率为0.5 mL/min时的吸附率与1.0 mL/min时的吸附率差距不大,随后上样流速逐渐加快,其吸附率反而呈下降趋势。当上样速率较慢时,多酚分子能有更多的时间与树脂接触,使其被充分吸附,增加吸附率。随着上样速率的加快,多酚分子与树脂接触的时间越来越短,还来不及被吸附,就已经通过了树脂,其吸附率迅速下降[22]。但是上样速率过慢会延长工作时间,增加成本。综合考虑以上因素,本实验选择上样速率为1.0 mL/min。

图 7 洗脱剂种类对静态解吸率的影响Fig. 7 Effect of eluent type on static desorption eff i ciency
2.2.6 洗脱剂种类对解吸率的影响由图7可知,洗脱剂的种类不同,解吸效果也不同,乙醇的解吸率显著高于甲醇和乙酸乙酯(P<0.05),洗脱效果最好,所以选择乙醇为洗脱剂。梨多酚是混合物,含有很多成分,各成分极性不同,所以不同极性溶剂对多酚物质的解吸率不同。
2.2.7 洗脱剂体积分数对解吸率的影响

图 8 乙醇体积分数对静态解吸率的影响Fig. 8 Effect of ethanol concentration on static desorption eff i ciency
如图8所示,当乙醇体积分数小于70%时,其解吸率逐渐增大。当乙醇体积分数达到70%时解吸率最高为
92.95 %;随后乙醇体积分数再增大,其解吸率反而下降。梨幼果多酚与树脂间形成氢键从而被吸附,乙醇体积分数增大,会增强对氢键的破坏作用,使多酚类物质被洗脱下来[23]。但是随着乙醇体积分数的增加,其中含有的水分越来越少,一些水溶性多酚类物质不能被溶解[24],
所以解吸率降低。因此70%的乙醇溶液为梨幼果多酚的最佳解吸剂。
2.2.8 洗脱剂洗脱流速对解吸效果的影响

图 9 乙醇洗脱流速对解吸效果的影响Fig. 9 Effect of ethanol fl ow rate on desorption eff i ciency
如图9所示,当洗脱流速为1.0 mL/min时其解吸率最高,为91.8%;当洗脱流速超过1.0 mL/min时,继续加快流速,解吸率开始下降。洗脱流速较慢时,解吸液与树脂接触充分,能够更好地破坏氢键,使多酚类物质被解吸出来。随着洗脱流速的加快,洗脱液与树脂接触的时间缩短,使得一部分多酚类物质来不及被解吸出来,所以解吸率降低[25]。所以选择1.0 mL/min做为解吸流速。
2.2.9 NKA-9树脂对梨幼果多酚的纯化效果
取梨幼果多酚粗提液及在最优条件下纯化的精提液进行冷冻干燥,得到粗提物与纯化物的粉末。分别将两种粉末配成溶液,测定其质量浓度,计算多酚纯度,发现粗提物纯度为6.23%,而纯化物可达到30.68%,纯度提高5 倍。
2.3 梨幼果多酚的抗氧化性
2.3.1 梨幼果多酚的总抗氧化能力

图 10 梨幼果多酚的总抗氧化能力Fig. 10 Total antioxidant capacity of polyphenols from young pear fruits
抗氧化物在酸性溶液中可以将Fe3+-TPTZ还原成蓝色的Fe2+-TPTZ,然后在593 nm波长处测定其吸光度,就能得到被测液的总抗氧化能力[26]。梨幼果多酚粗提物、纯化物和VC的总抗氧化能力如图10所示,随着多酚质量浓度的增大,吸光度一直在增加,说明多酚质量浓度越高总抗氧化能力越强。纯化物的总抗氧化能力低于VC,高于粗提物。梨幼果多酚经NKA-9树脂纯化后,总抗氧化能力增强。
2.3.2 梨幼果多酚对DPPH自由基的清除效果
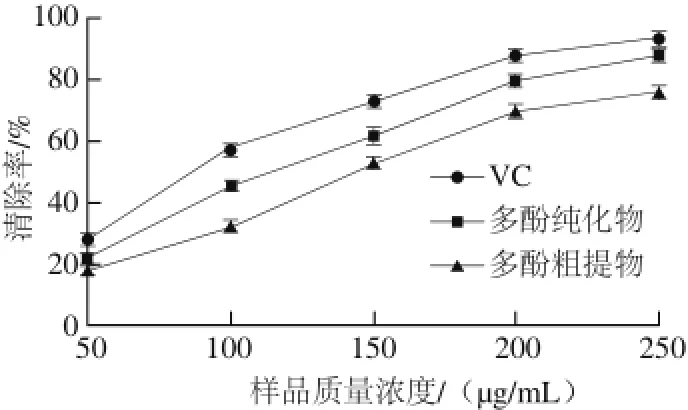
图 11 梨幼果多酚对DPPH自由基的清除效果Fig. 11 DPPH radical scavenging capacity of polyphenols from young pear fruits
多酚清除DPPH自由基的原理:多酚类物质可以与DPPH自由基中存在的单电子配对,使其被还原,减弱其紫色醇溶液的颜色,然后在517 nm波长处测定其吸光度,吸光度变化越大则其清除能力越强[27]。由图11可知,梨幼果多酚粗提物、纯化物和VC都有清除DPPH自由基的能力,VC的清除效果最好,多酚纯化物次之,多酚粗提物的效果最差。而且多酚的质量浓度越大,对DPPH自由基的清除效果越好。梨幼果多酚经树脂纯化后,对DPPH自由基的清除效果增强。
2.3.3 梨幼果多酚对ABTS+·的清除效果

图 12 梨幼果多酚对ABTS+·的清除效果Fig. 12 ABTS radical scavenging capacity of polyphenols from young pear fruits
ABTS与氧化剂反应会变成ABTS+·自由基(蓝绿色),多酚类物质会将ABTS+·还原成无色的ABTS,在734 nm或405 nm波长处测定其吸光度。吸光度变化越大,其清除能力越强。由图12可知,梨幼果多酚粗提物、纯化物和VC清除ABTS+·的效果都很显著,多酚纯化物的清除率高于VC和多酚粗提物,最高能够达到90%
以上,其清除效果最好。
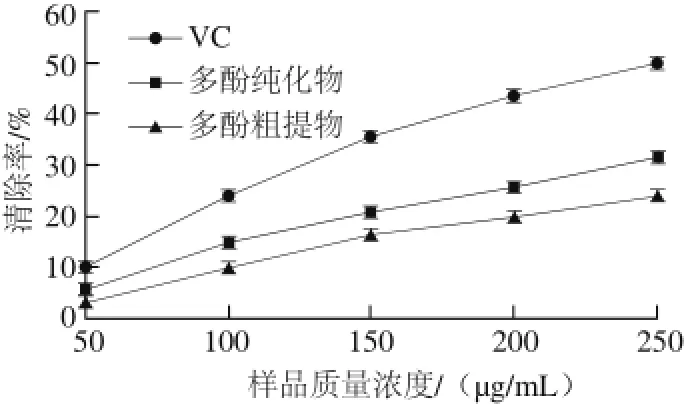
图 13 梨幼果多酚对亚硝酸基的清除效果Fig. 13 Nitritel scavenging capacity of polyphenols from young pear fruits
2.3.4 梨幼果多酚对亚硝酸基的清除效果梨幼果多酚粗提物、纯化物和VC对亚硝酸基的清除效果如图13所示,VC的清除效果高于多酚粗提物和纯化物;多酚质量浓度越高,对亚硝酸基的清除能力越强。梨幼果多酚经NKA-9树脂纯化后对亚硝酸基的清除效果更佳。
2.3.5 IC50值法比较样品的抗氧化活性
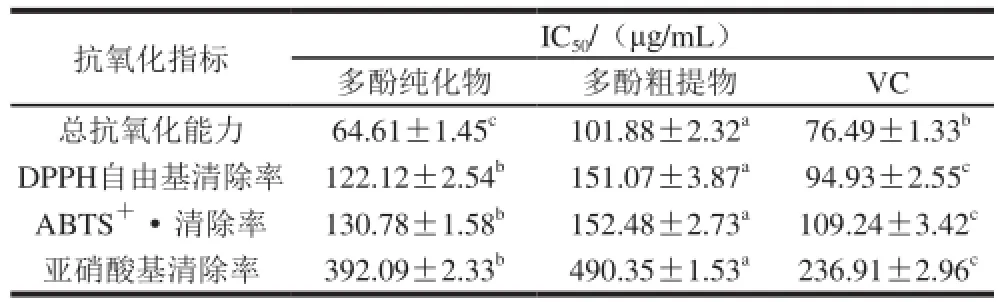
表 2 3 种样品在不同抗氧化方法下的IC50值Table 2 IC50values of three samples in different radical scavenging assays
IC50可以用来判断样品的抗氧化活性,该值表示当清除率达到50%时所对应的样品浓度。结果如表2所示,梨幼果多酚经过纯化后,抗氧化活性显著增强,在这4 种方法中,纯化物的清除能力均强于粗提物;在总抗氧化能力上,多酚纯化物能力比VC强,在DPPH自由基、ABTS+·和亚硝酸基的清除能力上,多酚纯化物与VC相差不多,所以说明梨幼果多酚具有抗氧化活性。
3 讨论与结论
目前关于多酚类物质的纯化,在苹果、葡萄和茶等物种中研究较多,在梨上却鲜有报道。贺金娜等[28]对苹果多酚的纯化条件进行了优化,得到的结果为:上样质量浓度1.46 mg/mL、上样pH 5.50、上样速率1.25 mL/min,洗脱剂种类丙酮、洗脱剂体积分数90%、洗脱速率1 mL/min;袁林颖等[29]研究发现,茶多酚纯化的最优条件为:上样质量浓度0.46 mg/mL、上样流速1.4 mL/min、溶液pH 3.0、洗脱剂种类乙醇、洗脱剂体积分数80%、洗脱流速2.0 mL/min。这2 个研究结果与本实验结论都不相同,这可能是由于物种不同,其中含有的多酚类物质种类不同所致。
梨中含有儿茶素、没食子酸等多酚类物质,所以具有抗氧化活性。赵金伟等[30]研究证明苹果梨酚类物质可以有效清除羟自由基、DPPH自由基和亚硝酸基;李丽梅等[31]研究发现,梨的果皮、果肉、果心中含有的多酚类物质对DPPH自由基和羟自由基都有清除能力。他们的研究结果和本实验结果相符。但是他们所研究的是梨多酚的粗提物,其中所含的杂质较多,对多酚抗氧化活性的测定会有影响,本实验将梨多酚粗提物进行纯化,对粗提物和纯化物的抗氧化活性进行比较,发现梨多酚纯化后其抗氧化活性显著增强。
本实验通过对X-5、AB-8、D101、S-8、NKA-9 5 种树脂的吸附率和解吸率进行比较,筛选出吸附率和解吸率都较高的NKA-9树脂为纯化梨幼果多酚的最佳树脂;通过静态和动态吸附实验得到NKA-9大孔树脂对梨幼果多酚进行纯化时,最适宜的条件为:将2 mg/mL的多酚提取液调至pH值为5.0,设定进样流速为1 mL/min,充分吸附,然后用70%的乙醇为洗脱液进行动态洗脱,洗脱流速为1 mL/min;经过NKA-9树脂在最优工艺条件下的纯化,梨幼果多酚的纯度从6.23%提高到了30.68%,纯度提高5 倍;梨幼果多酚粗提物和纯化物都有很强的总抗氧化能力,对DPPH自由基、ABTS+·、亚硝酸基都有清除作用,经NKA-9树脂纯化后的梨幼果多酚抗氧化能力明显增强。
[1] 刘旭. 成熟期不同的梨品种果实生长发育机理探讨[D]. 雅安: 四川农业大学, 2008: 12-13.
[2] 马良. 东方梨生理活性成分的HPLC分析研究[D]. 保定: 河北农业大学, 2004: 2-5.
[3] 袁江, 张绍铃, 曹玉芬, 等. 梨果实酚类物质与酶促褐变底物的研究[J].园艺学报, 2011, 38(1): 7-14.
[4] 赵金伟, 李范洙, 崔泰花, 等. 苹果梨生育期酚类物质的分析[J]. 食品工业科技, 2009, 30(6): l05-107. DOI:10.13386/j.issn1002-0306.2009.09.081.
[5] 冯丽, 宋曙辉, 赵霖, 等. 植物多酚种类及其生理功能的研究进展[J].江西农业学报, 2007, 19(10): 105-107.
[6] 左丽丽, 王振宇, 樊梓鸾, 等. 植物多酚类物质及其功能研究进展[J]. 中国林副特产, 2012(5): 39-43. DOI:10.13268/j.cnki. fbsic.2012.05.002.
[7] 石碧, 狄莹. 植物多酚[M]. 北京: 科学出版社, 2000: 171-172.
[8] 李珍. 苹果皮渣多酚提取、纯化及抗氧化活性研究[D]. 北京: 中国农业科学院, 2014: 30-36.
[9] 石恩慧, 郭凯军, 李红, 等. 板栗总苞多酚提取工艺优化及其抗氧化性研究[J]. 动物营养学报, 2013(2): 406-414.
[10] 甘芝霖, 倪元颖, 郭悦, 等. 大孔树脂分离纯化玫瑰果多酚及其抗氧化性[J]. 农业工程学报, 2015, 31(24): 298-306. DOI:10.11975/ j.issn.1002-6819.2015.24.045
[11] PULIDO R, BRAVO L, SAURA-CALIXTO F. Antioxidant activity of dietary polyphenols as determined by a modif i ed ferric reducing/ antioxidant power assay[J]. Journal of Agricultural and Food Chemistry, 2000, 48(8): 3396-3402. DOI:10.1021/jf9913458.
[12] BALASUNDRAM N, SUNDRAM K, SAMMAN S. Phenolic compounds in plants and agri-industrial by-products: antioxidant activity, occurrence, and potential uses[J]. Food Chemistry, 2006, 99(1): 191-203. DOI:10.1016/j.foodchem.2005.07.042.
[13] UDDIN R, SAHA M R, SUBHAN N, et al. HPLC-analysis of polyphenolic compounds in Gardenia jasminoides and determination of antioxidant activity by using free radical scavenging assays[J]. Advanced Pharmaceutical Bulletin, 2014, 4(3): 273-281. DOI:10.5681/ apb.2014.040.
[14] 汪洪武, 刘艳清. 大孔吸附树脂的应用研究进展[J]. 中药材, 2005(4): 353-356.
[15] 赵梅, 张绍铃, 齐开杰, 等. 梨幼果多酚提取工艺优化及其成分分析[J].食品工业科技, 2013, 34(6): 268-271.
[16] FRANCISCO M L L D, RESURRECCION A V A. Total phenolics and antioxidant capacity of heat-treated peanut skins[J]. Journal of Food Composition and Analysis, 2009, 22: 16-24. DOI:10.1016/ j.jfca.2008.05.012.
[17] 徐怀德, 王临宾, 张立佳. 苹果叶多酚的纯化及其抗氧化性研究[J].食品科学, 2010, 31(20): 72-78.
[18] 章丹丹, 高月红, 潘一峰, 等. 桑枝总黄酮的抗氧化活性研究[J]. 中成药, 2011, 33(6): 943-946.
[19] 李鸿江, 温致平, 赵由才. 大孔吸附树脂处理工业废水研究进展[J].安全与环境工程, 2010(3): 21-24.
[20] 艾志录, 王育红, 王海, 等. 大孔树脂对苹果渣中多酚物质的吸附研究[J]. 农业工程学报, 2007, 23(8): 245-248.
[21] 贺金娜, 曹栋, 史苏佳. 大孔树脂纯化苹果多酚的工艺优化[J]. 食品与发酵工业, 2014, 40(5): 135-141. DOI:10.13995/j.cnki.11-1802/ ts.2014.05.026.
[22] 陶莎, 黄英, 康玉凡, 等. 大孔吸附树脂分离纯化红小豆多酚工艺及效果[J]. 农业工程学报, 2013, 29(23): 276-285. DOI:10.3969/ j.issn.1002-6819.2013.23.038.
[23] 孙晓雪. 甘蔗梢中酚类物质的提取与应用研究[D]. 南宁: 广西大学, 2007: 35-39.
[24] 张海容, 党琦, 赵志刚, 等. 大孔树脂对败酱草多酚的分离及纯化研究[J]. 化学研究与应用, 2015(12): 1822-1828.
[25] 吕群金, 衣杰荣, 丁勇. 大孔吸附树脂对杨桃渣多酚吸附分离的优化[J]. 食品科学, 2010, 31(6): 39-42.
[26] SINGH J P, KAUR A, SINGH N, et al. In vitro antioxidant and antimicrobial properties of jambolan(Syzygium cumini) fruit polyphenols[J]. LWT-Food Science and Technology, 2016, 65: 1025-1030. DOI:10.1016/j.lwt.2015.09.038.
[27] 冉军舰. 苹果多酚的组分鉴定及功能特性研究[D]. 杨凌: 西北农林科技大学, 2013: 61-62.
[28] 贺金娜, 曹栋, 史苏佳. 大孔树脂纯化苹果多酚的工艺优化[J]. 食品与发酵工业, 2014, 40(5): 135-141.
[29] 袁林颖, 高飞虎, 钟应富, 等. 微波辅助提取绿茶茶多酚及纯化工艺研究[J]. 西南农业学报, 2012(3): 1074-1079.
[30] 赵金伟, 李范洙, 崔泰花, 等. 苹果梨生育期酚类物质的分析[J]. 食品工业科技, 2009, 30(6): l05-107.
[31] 李丽梅, 赵哲, 何近刚, 等. 不同品种梨果实酚类物质和抗氧化性能分析[J]. 食品科学, 2014, 35(17): 83-88. DOI:10.7506/spkx1002-6630-201417017.
Purif i cation and Antioxidant Activity of Polyphenols from Young Pear Fruits
ZHU Jie, WANG Hongbao, KONG Jiajun, SONG Xiaofei, TAO Shutian*
(College of Horticulture, Nanjing Agricultural University, Nanjing 210095, China)
The polyphenols from young pear fruits were purif i ed by 5 kinds of macroporous adsorption resins, and their antioxidant activity was determined. The results indicated that NKA-9 resin had better adsorption and desorption properties than four other resins. Therefore, it was the most suitable resin to purify polyphenols from young pear fruits. The optimum conditions for purification were as follows: after pH adjustment to 5.0, the polyphenol at 2 mg/mL was passed through the resin at a fl ow rate of 1 mL/min, followed by desorption with 70% ethanol at a fl ow rate of 1 mL/min. Under these conditions, the purity of the polyphenols from young pear fruits increased from 6.23% to 30.68%. Both the crude and purif i ed samples had the ability to scavenge 1,1-diphenyl-2-picrylhydrazyl (DPPH), 2,2’-azinobis-(3-ethylbenzthiazoline-6-sulphonate) (ABTS) radicals and nitrite, with IC50values of 151.07, 152.48 and 490.35 mg/mL versus 122.12, 130.78 and 392.09 mg/mL, respectively. Conclusively, the antioxidant capacity of the purif i ed polyphenols was better than that of the crude sample.
macroporous resins; polyphenols from young pear fruits; purif i cation; antioxidation
10.7506/spkx1002-6630-201705003
S661.2
A
2016-04-08
国家自然科学基金面上项目(31372044);国家自然科学基金青年科学基金项目(31000888);
国家高技术发展研究计划(863计划)项目(2011AA10020602)
朱洁(1992—),女,硕士研究生,研究方向为果实生理品质。E-mail:458121514@qq.com
*通信作者:陶书田(1980—),男,副教授,博士,研究方向为果品品质发育生理。E-mail:taost@njau.edu.cn

