铅(Pb)胁迫对泥蚶血液MT及Vg基因表达的诱导效应研究
谢清清, 陈彩芳, 吴林德, 林志华
(1. 宁波大学 海洋学院, 浙江 宁波 315211; 2. 浙江万里学院 浙江省水产种质资源高效利用重点实验室,浙江 宁波 315100)
受工业发展及城市废弃物随意排放的影响, 土壤和近海海域的重金属污染日益严重。重金属在环境中极其稳定、不易被消除, 并能通过食物链积累和扩大, 严重威胁着生物的生存及人类的健康。铅(Pb)是环境中最常见的七种重金属之一, 被我国《重金属污染综合防治“十二五”规划》列为重点综合整治对象, 也是目前已筛选出的环境内分泌干扰物(EEDs)的一个重要组成部分[1-2]。已有研究表明 Pb能对许多无脊椎海洋动物, 如腹足纲软体动物和双壳类动物产生影响[3]。作为非必需金属元素, Pb在生物体内富集会促进活性氧自由基的生成, 提高机体的氧化压力, 从而对机体造成氧化损伤。
金属硫蛋白(Metallothionein, MT)是一种低分子量的蛋白质, 广泛存在于大多数生物体内。MT所富含的半胱氨酸巯基可与重金属配位结合并将其排出体外, 在参与非必需金属元素的解毒方面具有重要作用[4-5]。此外, MT在增进机体对外界刺激的应激反应和清除自由基抗氧化保护方面也有重要作用[6]。近年来, 贝类 MT, 不管是在基因还是蛋白水平均已开展了大量研究工作[7-14]。但大部分侧重于探究MT与重金属镉(Cd)之间的关系, 对于 Pb与 MT之间是否具有相同的作用机制, 我们仍知之甚少。
卵黄蛋白原(Vitellogenin, Vg) 是卵生动物卵黄中主要成分的前体, 主要存在于成熟雌性个体中,在雄性个体和幼体中表达量很少, 甚至不表达[15]。而在环境内分泌干扰素(如 Cd、Pb等)诱导下, 雄性和幼体中 Vg也会相应表达[16]。此外, 研究还发现 Vg具有抗氧化能力[17-18]。Nelson等[19]发现蜜峰能够通过Vg清除体内自由基来降低氧化压力而延长寿命。而在贝类中, Zheng等[17]也发现华贵栉孔扇贝Vg具有抗氧化活性。对贝类Vg基因的相关研究主要集中于扇贝、文蛤、泥蚶等少数经济贝类[17-18,20-22]。Chen等[20]克隆得到泥蚶Vg全长, 推测其具有多个金属结合位点, 表明泥蚶Vg具有金属结合能力; 且在1、3、6和9 µg/L Cd暴露28 d后, 泥蚶消化腺和血液Vg均显著上调, 表明其在泥蚶重金属解毒中发挥重要作用。吴林德等[21]发现泥蚶消化腺 Vg表达量和 Pb胁迫具有一定的时间效应和剂量效应, 推测其抗氧化功能在Pb胁迫引起的氧化损伤中起作用。
泥蚶( Tegillarca granosa) , 俗称血蚶、花蚶, 是一种栖息于沿海滩涂的广温性双壳贝类。由于双壳贝类自身用于代谢的混合氧化系统存在缺陷, 导致其体内污染物的释放较慢, 造成体内保持较高的重金属富集程度[23-24]。泥蚶不仅能富集重金属, 且对重金属有极强的耐受性。因此, 本文拟研究不同浓度重金属Pb胁迫下泥蚶血液Vg、MT基因的表达规律, 有助于探索贝类的重金属耐受及其抗氧化解毒机制,同时也是研究环境毒理学、生物健康及海岸保护的重要一环[25]。
1 材料与方法
1.1 实验材料
实验所用泥蚶由宁波甬盛水产种业有限公司提供, 在非繁殖期选取活力好、大小均一且外壳无损伤的2龄泥蚶, 壳长为(2.94±0.16)cm。
1.2 泥蚶攻毒实验
实验所用泥蚶在砂滤海水中暂养7 d, 水温(21±1.0)℃, pH 为 8.1, DO>5 mg/L, NH4-N<0.05 mg/L, 持续充气, 每日换水后投喂适量藻类。
将Pb(NO3)2配制成浓度为1.000 g/L 母液备用;根据《海水水质标准》(GB 3097-1997), 海水养殖用水中Pb的限量值为5 μg/L。设置实验组Pb2+浓度梯度为1、3、6、9 μg/L, 并以未添加Pb2+的自然海水作为对照组, 1 μg/L和3 μg/L为低于水质标准的实验浓度, 6 μg/L及9 μg/L为高于水质标准的实验浓度,各组均设三组平行。攻毒时间为28 d。
开始实验前为消除容器对重金属的吸附作用,先用等浓度Pb2+的实验水体浸泡塑料箱24 h。此后,向每个塑料箱内分别加入20 L实验水体及40个泥蚶,实验期间连续充气, 每24 h换水1次, 并投喂扁藻。采样在实验开始的 0、7、14、21、28 d进行, 每箱取 4个泥蚶, 抽取血液于液氮中速冻后放于-80℃冰箱保存。
1.3 总RNA的提取及cDNA第一链的合成
用CWBIO的Trizol 总RNA 提取试剂, 提取所得泥蚶血液总RNA。再用TaKaRa PrimeScripttmRT reagent Kit with gDNA Eraser(Perfect Real Time)反转录试剂盒反转合成cDNA第一链, 用于泥蚶MT、Vg基因的荧光定量实验。
1.4 泥蚶血液MT、Vg基因在不同浓度Pb2+胁迫下的表达规律研究
用 Primer Premier 5.0 软件根据泥蚶MT、Vg的cDNA序列设计荧光定量引物, 以合成的 cDNA 第一链为模板对引物进行筛选。选择无非特异性扩增和引物二聚体的引物, 最终获得目的基因引物MT-real-F/MT-real-R、Vg-real-F/Vg-real-R(表 1), 根据chen的文章获得泥蚶内参基因引物Tg-β-actin-F、Tg-β-actin-R[20]。使用 ABI 7500 Fast实时荧光定量PCR仪(ABI, USA)和 SYBR@Premix ExTMKit (TaKaRa,Japan)对不同浓度Pb2+胁迫下泥蚶血液 MT及Vg表达进行相对定量分析, 反应体系为 20 µL, 分别为2 µL 的 cDNA、引物各 1 µL、6 µL 的 ddH2O 和 10 µL的SYBR@PCR Mix。反应程序为: 预变性95℃ 15 min;95℃ 5 s, 60℃ 20 s, 72℃ 25 s, 40个循环。循环结束时, 进行溶解曲线分析, 每个样品做3个平行。

表1 实验所用到的qRT-PCR引物序列Tab. 1 The qRT-PCR primer sequences used in the experiment
1.5 数据分析
采用2–ΔΔCt法计算各处理组泥蚶MT、Vg的相对表达量。实验数据采用 SigmaPlot13.0 Two Way ANOVA对各个组同时进行时间效应及浓度效应分析, P<0.05表示显著差异, P<0.01表示极显著差异。
2 结果
2.1 不同浓度 Pb2+胁迫下泥蚶血液 MT的表达规律
经过28d的慢性攻毒实验, 以β-actin为内参基因, 以各时间点对照组泥蚶血液MT基因的表达量为基础值1, 得到各个时间点其它浓度组 MT基因相对表达量, 结果如图 1。
相同Pb浓度水平攻毒时间对泥蚶血液MT基因表达量的影响如下: 在1 μg/L Pb2+胁迫下, 泥蚶MT基因的相对表达量在14 d时达到最高值, 较7 d与28 d而言差异极显著(P<0.01), 然后开始下降, 在28 d时表达回到最初水平。在3 μg/L Pb2+胁迫下, 其血液MT mRNA水平在14 d时到达最高值, 且与其他时间点相比差异极显著(P<0.01); 随着时间推移其表达情况整体呈现先上升后下降再上升的一种波动状态。其他两个浓度组, 泥蚶MT mRNA的表达水平基本上随攻毒时间推移呈现先上升后下降的趋势。不同的是, 6 μg/L实验组其表达量在21d时达到最高值,与14 d时相比具有显著性(P<0.05), 且较7 d与28 d而言差异极显著(P<0.01); 而 9 μg/L实验组在14 d时其 mRNA水平达到最高表达, 与其他时间点相比差异极显著(P<0.01)。
相同攻毒时间下不同重金属浓度对泥蚶血液MT基因表达的影响如下: 第7天, 各实验组均无显著差异。14 d时, 各浓度组泥蚶MT mRNA水平较对照组均显著提高(P<0.01), 9 μg/L实验组其表达水平最高。21 d时, 1、6及9 μg/L实验组泥蚶MT mRNA水平较对照组均显著提高(P<0.01), 且两个高于水质标准限值的实验组其基因表达水平大于1 μg/L实验组的表达水平。28 d时, 各实验组泥蚶MT mRNA水平较对照组无显著性差异。
上述结果表明, 在较长时间低剂量重金属 Pb2+暴露下, 泥蚶血液MT mRNA水平与Pb2+浓度存在较好的正相关剂量效应; 另一方面, 各浓度组泥蚶血液MT mRNA水平随时间推移基本上呈现出先上升后下降的趋势。
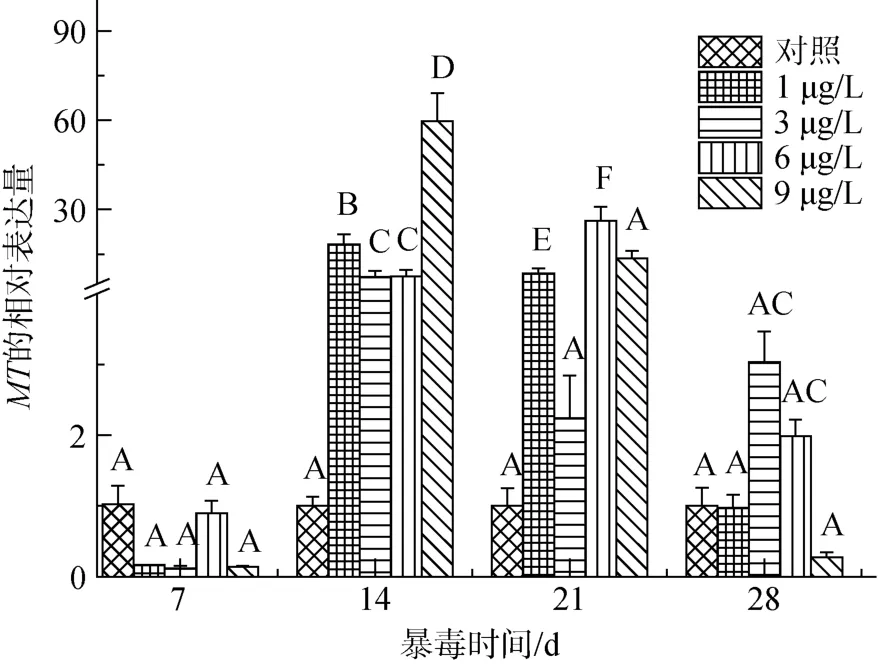
图1 不同Pb2+浓度组泥蚶血液 MT基因相对表达量Fig. 1 Relative expression of MT gene in the blood of T.granosa under different concentrations of Pb2+
2.2 不同浓度Pb2+胁迫下泥蚶血液Vg表达规律
经过28 d的Pb2+暴毒实验, 泥蚶血液Vg mRNA的表达情况变化如图2所示。相同Pb浓度水平攻毒时间对泥蚶血液Vg表达量的影响如下: 1 μg/L Pb2+胁迫下, 各时间点泥蚶血液Vg的表达较对照组均无显著差异。3 μg/L Pb2+胁迫下, 其表达在14 d时被诱导达到最大值, 较其他时间点差异极显著(P<0.01);在随后的 21 d, 泥蚶血液 Vg的表达水平开始降低,但较对照组而言仍具显著性(P<0.01), 到28 d时几乎不表达; 总体上该浓度组泥蚶血液Vg的表达随时间推移呈现先升后降的趋势。6 μg/L Pb2+胁迫下, 各时间点泥蚶血液 Vg表达量与对照组相比均无明显差异。9 μg/L Pb2+胁迫下, 泥蚶血液Vg基因表达水平在前21 d均无显著变化, 但到 28 d时被显著诱导达到较高表达水平, 较其他各时间点均差异显著(P<0.01)。

图2 不同Pb2+浓度组泥蚶血液Vg基因相对表达量Fig. 2 Relative expression of Vg gene in the blood of T.granosa under different concentrations of Pb2+
相同攻毒时间下不同Pb浓度对泥蚶血液Vg表达量的影响如下: 在 7 d时, 各浓度组泥蚶血液 Vg的表达量较对照组均无显著差异; 14 d时, 仅3 μg/L实验组泥蚶血液Vg的表达较同时期对照组而言显著上升(P<0.01); 21 d时, 同样仅3 μg/L实验组泥蚶血液Vg较同期对照组显著表达(P<0.01); 28 d时, 除9 μg/L实验组泥蚶血液 Vg表达显著上升外(P<0.01), 其他浓度实验组较同时期对照组均无显著变化。通过较长时期低剂量重金属暴露下泥蚶血液 Vg表达量比较可知, 3 μg/L Pb2+浓度对其诱导表达的效果最为显著。
3 讨论
近年来, 环境中重金属污染的日益严重, 引发了关于重金属对水产生物抗氧化相关基因或蛋白的“研究热”。包永波等通过对蛋白组学分析发现氧化应激蛋白、钙结合蛋白和硫代谢相关蛋白是泥蚶应对重金属镉胁迫的关键蛋白[26]。但目前关于Pb胁迫下生物体内的免疫防御机制并不清晰。仅有少数研究表明Pb能减弱小鼠[27]、长牡蛎[28]的抗氧化能力。因此在Pb污染日益严重的当下, 探究机体对Pb刺激的应答具有重要意义。
MT活性结构中的金属离子能在体内释放作为抗氧化的促进剂, 并暴露出半胱氨酸残基中的巯基与氧自由基发生反应[29]。此外, MT可螯合机体内部的金属离子, 参与体内金属离子代谢, 调节金属离子稳态, 防止及修复由于金属离子失衡对机体造成的氧化损伤[30]。任玉娟等发现不同浓度的Cd(0.5、5、50 mg/L)胁迫下, 无齿蚌MT基因的表达量均在14d显著上调[5]。Khati等[31]将翡翠贻贝在200 µg/LCd2+胁迫7 d后, 发现实验组MTs相较对照组而言更高。本实验发现泥蚶在各浓度 Pb2+胁迫下 MT基因表达量在14 d显著上调, 表明MT对重金属Pb的作用与Cd相似, 只有机体中的Pb2+积累到一定程度时, MT才会被显著诱导。但在暴毒 14 d后, 相对表达量开始下降, 且在28 d时回落到7 d的水平, 随时间的推移整体呈现先增后减的趋势。周湖明等[9]在对近江牡蛎进行慢性Pb攻毒实验中, 发现MT表达量呈先增后减的模式。霍礼辉等[11]在对缢蛏研究中也发现, 其内脏团MT表达呈现脉冲式波动, 具有较强的时间依赖性。说明Pb2+刺激能诱导MT基因表达, 合成大量的MT与Pb2+结合, 当MT含量太高时又会对自身的转录机制产生负反馈抑制其表达[32-34]。同时 MT参与机体新陈代谢, 会在相关酶的作用下被降解[35],故呈现先上升在下降的趋势。
Vg具有一定的免疫防御功能, 可以通过与金属离子结合、清除体内自由基等方式来发挥其抗氧化作用[36-38]。顾海龙等[39]发现在Cd胁迫下, 泥蚶消化腺 Vg被显著诱导表达, 并维持在较高水平; 吴林德等[21]发现经过 1、3、6 μg/L 的 Pb胁迫 28 d后, 泥蚶内脏团Vg的相对表达呈现先上升后下降的趋势。在本实验中, 泥蚶血液Vg基因表达量随暴毒时间的延长, 3 μg/L和9 μg/L浓度组其被显著诱导表达, 且在暴毒14 d后, 3 μg/L浓度组的相对表达量总体也呈现先增后减的趋势。Corona等[40]发现蜂王在其腹脂肪体合成Vg蛋白作为抗氧化剂, 有助于延长蜂王的寿命。Hiramatsu等[41]研究发现华贵栉孔扇贝Vg是一种强效的免疫保护蛋白, 具有氧化活性。
综上所述, 推测是由于Pb胁迫引起了泥蚶体内的氧化应激反应, 产生了大量 ROS, 机体通过诱导Vg等基因的表达, 清除自由基, 从而缓解氧化压力,防止ROS对机体造成损伤。通过两个基因表达趋势的比较发现, 在28 d时, 各浓度组泥蚶血液MT基因表达均处于较低水平, 而此时泥蚶血液Vg基因显著表达, 猜测两者之间存在一定协调互补关系。而在低浓度长时间Pb2+暴毒下, 泥蚶血液MT基因的敏感性要优于泥蚶血液 Vg基因。综上可见, 从泥蚶血液MT和 Vg基因的表达情况来看, 两者均不同程度地参与贝类重金属解毒。但其具体的诱导机制和解毒机理及相互关系还有待探究。
参考文献:
[1] Han F X, Banin A, Su Y, et al. Industrial age anthropogenic inputs of heavy metals into the pedosphere[J].The Science of Nature, 2002, 89(11): 497-504.
[2] 于庆云, 王悠, 徐彦, 等. 镉和铅对菲律宾蛤仔脂质过氧化及抗氧化酶活性的影响[J]. 生态毒理学报,2013, 8(4): 504-512.Yu Qingyun, Wang You, Xu Yan, et al. Effects of cadmium and lead on the lipid peroxidation and levels of antioxidant enzymes activities in Ruditapes philippinarum[J]. Asian Journal of Ecotoxicology, 2013, 8 (4):504-512.
[3] Shi W, Zhao X, Han Y, et al. Ocean acidification increases cadmium accumulation in marine bivalves: a potential threat to seafood safety[J]. Scientific reports,2016, 6: 20197.
[4] 霍礼辉, 林志华, 包永波. 重金属诱导贝类金属硫蛋白研究进展[J]. 水生态学杂志, 2011, 32(1): 7-13.Huo Lihui, Lin Zhihua, Bao Yongbou. The research advances of Mollusca Metallothione in induced by heavy metals[J]. Journal of Hydroecology, 2011, 32(1):7-13.
[5] 任玉娟, 刘蒙南, 王兰等. 镉对背角无齿蚌组织中金属硫蛋白含量的影响[J]. 山西农业科学, 2017(2):211-214.Ren Yujun, Liu Mengnan, Wang Lan, et al. Effect of Cadmium on the content of metallothionein in the tissues of the freshwater mussel, Anodonta woodiana[J]. Journal of Shanxi Agricultural Sciences, 2017(2): 211-214.
[6] Jacob C, Maret W, Vallee B L. Selenium redox biochemistry of zinc-sulfur coordination sites in proteins and enzymes[J]. Proceedings of the National Academy of Sciences, 1999, 96(5): 1910-1914.
[7] Bebianno M J, Serafim M A. Comparison of metallothionein induction in response to cadmium in the gills of the bivalve molluscs Mytilus galloprovincialis and Ruditapes decussates[J]. Science of the Total Environment, 1998, 214(1-3): 123-131.
[8] 蒋国萍, 程雪艳, 滕爽爽等. 斧文蛤金属硫蛋白基因的克隆与表达分析[J]. 水生生物学报, 2016, 40(5):914-920.Jiang Guopin, Chen Xueyan, Teng Shuangshuang, et al.Cloning and expression of metallothionein gene in Meretrix lamarckii[J]. Acta Hydrobiologica Sinica,2016, 40(5): 914-920.
[9] 周湖明, 李长玲, 陈康等. 近江牡蛎富集、排出Pb、Cd的动力学及其与体内金属硫蛋白的相关性研究[J].广东海洋大学学报, 2012(6): 57-65.Zhou Huming, Li Changling, Chen Kan, et al. Involvement of metallothionein in the study of the kinetics of accumulation and elimination of lead and cadmium in the oyster Crassostrea rivularis[J]. Journal of Guangdong Ocean University, 2012(6): 57-65.
[10] 刘广绪, 邵艳卿, 柴雪良等. 长期低剂量重金属Cu2+、Zn2+、Pb2+、Cd2+对滩涂贝类泥蚶成体滤食率、性腺发育、抗氧化酶系统以及MT基因表达的毒性作用[C]//中国动物学会·中国海洋湖沼学会贝类学分会第九次会员代表大会暨第十五次学术讨论会会议摘要集. 2011.Liu Guangxu, Shao Yanqin, Chai Xueliang, et al. Toxic effect of filtration rate, gonad development, antioxidant enzyme system and MT gene expression in adult tegillarcagranosa under Long term stress of low dose of Cu2+、Zn2+、Pb2+、Cd2+[C]//(CHINA Zoological Society,CZS)(Chinese Society for Oceanology and Limnology,CSOL) meeting summary set of the ninth member congress and fifteenth Academic Symposium of CSOL in CZS. 2011.
[11] 霍礼辉, 陈彩芳, 林志华等. 镉诱导缢蛏 (Sinonovacula constricta) 体内金属硫蛋白基因变化规律研究[J]. 海洋与湖沼, 2012, 43(4): 723-728.Hou Lihui, Chen Caifang, Lin Zhihua, et al. The metallothionein gene expression in Sinonovacula constricta exposing to cadmium[J]. Oceanologia et Limnologia Sinica, 2012, 43(4): 723-728.
[12] Damiens G, Mouneyrac C, Quiniou F, et al. Metal bioaccumulation and metallothionein concentrations in larvae of Crassostrea gigas[J]. Environmental Pollution,2006, 140(3): 492-499.
[13] Smaouidamak W, Hamzachaffai A, Bebianno M J, et al.Variation of metallothioneins in gills of the clam Ruditapes decussatus from the gulf of gabes (Tunisia)[J].Comparative Biochemistry & Physiology Part C Toxicology & Pharmacology, 2004, 139(4): 181-188.
[14] 吴龙涛. 扇贝免疫相关因子基因的克隆与表达分析[D]. 中国科学院大学, 2004.Wu Longtao. Cloning and expression analysis of scallop immune related factor gene[D]. Beijing: University of the Chinese Academy of Sciences, 2004.
[15] Flouriot G, Pakdel F, Ducouret B, et al. Influence of xenobiotics on rainbow trout liver estrogen receptor and vitellogenin gene expression[J]. Journal of Molecular Endocrinology, 1995, 15(2): 143-151.
[16] Mitsui N, Tooi O, Kawahara A. Sandwich ELISAs for quantification of Xenopus laevis vitellogenin and albumin and their application to measurement of estradiol-17 beta effects on whole animals and primarycultured hepatocytes[J]. Comparative Biochemistry &Physiology Toxicology & Pharmacology Cbp, 2003,135(3): 305-313.
[17] Zheng H, Zhang Q, Liu H, et al. Cloning and expression of vitellogenin (Vg) gene and its correlations with total carotenoids content and total antioxidant capacity in noble scallop Chlamys nobilis (Bivalve: Pectinidae)[J]. Aquaculture, 2012, 366–367(2): 46-53.
[18] Zhang Q, Lu Y, Zheng H, et al. Differential immune response of vitellogenin gene to Vibrio anguillarum in noble scallop Chlamys nobilis and its correlation with total carotenoid content[J]. Fish & Shellfish Immunology, 2016, 50: 11-15.
[19] Nelson C. Mindy I. Kate E, et al. The gene vitellogenin has multiple coordinating effects on social organization[J]. PLoS Biologyl, 2007, 5(3): 673-677.
[20] Chen C, Shen W, Gu H, et al. Vitellogenin’s putative role in Tegillarca granosa ’s cadmium detoxification[J].Genes & Genomics, 2017, 39: 143-154.
[21] 吴林德, 陈彩芳, 林志华. 泥蚶卵黄原蛋白基因的克隆及其在Pb胁迫下的表达特征[J]. 宁波大学学报(理工版), 2016, 29(2): 6-11.Wu Linde, Chen Caifang, Lin Zhihua. Molecular cloning and expression of pattern features under Pb stress for vitellogenin from Tegillarca granose[J]. Journal of Ningbo University (nsee), 2016, 29(2): 6-11.
[22] 张倩, 孟范平, 付文超, 等. 市政污水厂尾水对文蛤卵黄蛋白原的诱导效应研究[J]. 中国海洋大学学报(自然科学版), 2014, 44(12): 100-105.Zhang Qian, Meng Fanping, Fu Wenchao, et al. A study on Vitellogenin induction in the bivalves Meretrix meretrix exposed to effluent from a municipal sewage treatm ent plant[J]. Periodical of Ocean University of China, 2014, 44(12): 100-105.
[23] 蔡立哲, 刘琼玉, 洪华生. 菲律宾蛤仔在高浓度锌铅水体中的金属积累[J]. 应用海洋学学报, 1998(4):456-461.Cai Lizhe, Liu Qiongyu, Hong Huasheng. Study on single and joint toxic effects of cadmium and lead on Ruditapes philippinarum[J]. Marine Environmental Science, 1998(4):456-461.
[24] 马藏允, 姚波. 几种大型底栖生物对Cd, Zn, Cu的积累实验研究[J]. 中国环境科学, 1997(2): 151-155.Ma Cangyun, Yao Bo. The Studies on the bioaccumulation of Cd, Cu, Zn in some macrobenthos[J]. China Envibronmental Science, 1997(2): 151-155.
[25] Zhang P, Li C, Zhang P, et al. iTRAQ-Based proteomics reveals novel members involved in pathogen challenge in sea cucumber Apostichopus japonicus[J]. Plos One,2014, 9(6): e100492.
[26] Bao Y, Liu X, Zhang W, et al. Identification of a regulation network in response to cadmium toxicity using blood clam Tegillarca granosa as model[J]. Scientific Reports, 2016, 6: 35704.
[27] 孙超, 王守军. Vc与Pb胁迫对小鼠肾脏抗氧化能力的影响[J]. 西北农业学报, 2007, 16(5): 55-58.Sun Chao, Wang Shou-jun. Effects of Vc and Pb on Kidney Lipid peroxides Activity in Mice[J]. Acta Agriculturae Boreali-occidentalis Sinica, 2007, 16(5): 55-58.
[28] 高强. 栉孔扇贝与海湾扇贝免疫学比较研究[D]. 中国科学院海洋研究所, 2007.Gao Qiang. The comparative immunological study on two scallops Chlamys farreri and Argopecten irradians[D].Qingdao: Instute of Oceanology, Chinese Academy Sciences,2007.
[29] 王颖, 王欣卉, 徐炳政, 等. 金属硫蛋白体内抗氧化功能研究进展[J]. 食品工业科技, 2016, 37(10): 377-382.Wang Yin, Wang Xinhui, Xu Bingzheng, et al. Research progress of metallothionein function in vivo antioxidant[J]. Science and technology of food industry, 2016,37(10): 377-382.
[30] Jara-Biedma, Pueyo. Evolution of metallotionein isoforms complexes in hepatic cells of Mus; musculus along cadmium exposure[J]. Biometals An International Journal on the Role of Metal Ions in Biology Biochemistry & Medicine, 2013, 26(4): 639-650.
[31] Khati W, Ouali K, Mouneyrac C, et al. Metallothioneins in Aquatic Invertebrates: Their Role in Metal Detoxification and their Use in Biomonitoring[J]. Energy Procedia, 2012, 18(1): 784-794.
[32] Escobedofregoso C, Mendezrodriguez L C, Monsalvospencer P, et al. Assessment of metallothioneins in tissues of the clam Megapitaria squalida as biomarkers for environmental cadmium pollution from areas enriched in phosphorite[J]. Archives of Environmental Contamination & Toxicology, 2010, 59(2): 255-263.
[33] Boutet I, Tanguy A, Auffret M, et al. Immunochemical quantification of metallothioneins in marine mollusks:characterization of a metal exposure bioindicator[J].Environmental Toxicology & Chemistry, 2002, 21(5):1009-1014.
[34] Bebianno M J, Langston W J. Metallothionein induction in Mytilus edulis, exposed to cadmium[J]. Marine Biology, 1991, 108(1): 91-96.
[35] Oskarsson A, Squibb K S, Fowler B A. Intracellular binding of lead in the kidney: the partial isolation and characterization of postmitochondrial lead binding components[J]. Biochemical & Biophysical Research Communications, 1982, 104(1): 290-298.
[36] Seehuus S C, Norberg K, Gimsa U, et al. Reproductive protein protects functionally sterile honey bee workers from oxidative stress[J]. Proceedings of the National Academy of Sciences of the United States of America,2006, 103(4): 962-967.
[37] Nakamura A, Yasuda K, Adachi H, et al. Vitellogenin-6 Is a Major Carbonylated Protein in Aged Nematode,Caenorhabditis elegans[J]. Biochemical & Biophysical Research Communications, 1999, 264(2): 580-583.
[38] Ando S, Yanagida K. Susceptibility to oxidation of copper-induced plasma lipoproteins from Japanese eel:protective effect of vitellogenin on the oxidation of very low density lipoprotein[J]. 1999, 123(1): 1-7.
[39] 顾海龙. Cd、Pb、Hg暴毒下泥蚶的分子生态毒理学研究[D]. 上海: 海洋大学, 2013.Gu Hailong. Molecular ecotoxicological studies of blood clam, Tegillarca granosa exposed to Cd, Pb,Hg[D]. Shanghai: Shanghai Ocean University, 2013.
[40] Corona M, Velarde R A, Remolina S, et al. Vitellogenin, juvenile hormone, insulin signaling, and queen honey bee longevity[J]. Proceedings of the National Academy of Sciences of the United States of America,2007, 104(17): 7128.
[41] Hiramatsu N, Matsubara T, Weber G M, et al. Vitellogenesis in Aquatic Animals[J]. Fisheries Science, 2002,68(suppl I): 694-699.

