原发性肾病综合征患儿外周血单个核细胞IL-18、Fas mRNA表达变化及其意义
龙彪,曾冬梅,罗莉
(黔东南州人民医院,贵州黔东南 556000)
原发性肾病综合征患儿外周血单个核细胞IL-18、Fas mRNA表达变化及其意义
龙彪,曾冬梅,罗莉
(黔东南州人民医院,贵州黔东南556000)
目的观察原发性肾病综合征(PNS)患儿外周血IL-18、Fas mRNA表达变化,并探讨其临床意义。方法选择68例PNS患儿为观察组,其中单纯型PNS45例、肾炎型PNS23例,另选47例健康体检儿童为对照组。抽取两组患儿外周血分离单个核细胞,采用实时荧光定量PCR法检测Fas、IL-18 mRNA。结果观察组、对照组儿童外周血单个核细胞IL-18 mRNA表达量分别为0.13±0.02、0.02±0.01,Fas mRNA表达量分别为0.05±0.02、0.48±0.08。观察组外周血单个核细胞IL-18、Fas mRNA与对照组相比P均<0.05。单纯型、肾炎型PNS患儿外周血单个核细胞IL-18 mRNA表达量分别为0.08±0.06、0.19±0.09,Fas mRNA表达量分别为0.51±0.13、0.32±0.11。观察组单纯型PNS患儿外周血单个核细胞IL-18 、Fas mRNA表达量与肾炎型PNS相比P均<0.05。 Pearson相关性分析结果显示观察组患儿、单纯型PNS患儿、肾炎型PNS患儿外周血单个核细胞Fas mRNA表达量与IL-18 mRNA表达量呈负相关(r=-0.468、-0.567、-0.327,P均< 0.05)。结论PNS患儿外周血单个核细胞IL-18表达升高、FAS mRNA表达下降。检测外周血单个核细胞IL-18 、FAS mRNA有助于鉴别判断单纯型和肾炎型PNS。
白细胞介素18;Fas蛋白;原发性肾病综
原发性肾病综合征(PNS)是各种原因引起肾小球的通透性增加,进而导致水肿、高血脂症、大量蛋白尿、低蛋白血症等特征性的临床症状[1]。儿童肾病综合征是泌尿系统常见的疾病[2]。PNS的发病机理目前不是十分明确。IL- 18是重要的炎症因子,Fas是细胞凋亡标志物[3~5]。IL- 18、Fas是否在PNS发生过程中发挥作用尚无定论。我国临床将PNS分为单纯型和肾炎型两种类型[6]。这两种类型的PNS患儿IL- 18、Fas表达情况是否有差异也不明确。为解决上述问题,本研究观察了PNS患儿外周血单个核细胞IL- 18、Fas mRNA表达变化,并比较了单纯型、肾炎型PNS患儿外周血单个核细胞IL- 18、Fas mRNA表达情况。现报告如下。
1 资料与方法
1.1 临床资料 选择2016年1月~2017年3月收治的初治PNS患儿68例为观察组。纳入标准:①年龄14岁;②满足PNS诊断标准[7],即血清白蛋白(ALB)<25 g/L、24 h尿蛋白定量≥50 mg/(kg·d)、尿蛋白≥+++伴有水肿、高脂血症等临床症状。排除标准:①继发性肾病综合征;②心脏、肝脏功能不全者;③身体患有其他可能影响本研究结果的疾病。其中男38例、女30例,年龄3~9(6.15±3.18)岁。按照《儿童常见肾脏疾病诊治循证指南》[8]将患儿分为单纯型45例,肾炎型23例。另选同期体检的健康儿童47例作为对照组,其中男27例、女20例,年龄4~10(7.85±3.71)岁。两组儿童性别、年龄相比P均> 0.05。本研究已获得我院医学伦理委员会批准,患儿及其家属均签署知情同意书。
1.2 外周血单个核细胞Fas 和IL-18 mRNA检测方法 观察组患儿入院第2天,对照组患儿体检时采血5 mL,分离单个核细胞。按照RNA提取试剂盒的说明书进行操作提取RNA。然后反转录为cDNA。采用实时荧光定量PCR法进行扩增,以GAPDH为内参照。Fas上游引物序列为5′-ACCAACTATTGCTTCAGCTC-3′,下游引物序列为5′-CTTGCAGGAGCGCACGATCA-3′;IL-18上游引物序列为5′-GGCCTCTATTTGAAGATATGACTGATT-3′,下游引物序列为5′-CCTCTAGGCTGGCTATCTTTATACATAC-3′;GAPDH上游引物序列为5′-TGGTATCGTGGAAGGACTCATGAC-3′,下游引物序列为5′ - ATGCCAGTGAGCTTCCCGTTCAGC-3′ 。PCR反应条件:94 ℃预变性3 min,然后进行40个循环(94 ℃变性30 s,53 ℃退火30 s,72 ℃延伸45 s),最后72 ℃延伸5 min,产物在4 ℃恒温保存。采用2-ΔΔCt表示Fas 和IL-18 mRNA表达量。
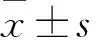
2 结果
2.1 观察组、对照组儿童外周血单个核细胞IL-18、Fas mRNA比较 观察组、对照组儿童外周血单个核细胞IL-18 mRNA表达量分别为0.13±0.02、0.02±0.01,Fas mRNA表达量分别为0.05±0.02、0.48±0.08。观察组外周血单个核细胞IL-18 、Fas mRNA表达量与对照组相比,P均<0.05。
2.2 观察组单纯型、肾炎型PNS患儿外周血单个核细胞Fas、IL-18 mRNA比较 单纯型、肾炎型PNS患儿外周血单个核细胞IL-18 mRNA表达量分别为0.08±0.06、0.19±0.09,Fas mRNA表达量分别为0.51±0.13、0.32±0.11。观察组单纯型PNS患儿外周血单个核细胞IL-18、Fas mRNA表达量与肾炎型PNS相比P均<0.05。
2.3 观察组患儿外周血单个核细胞Fas、IL-18 mRNA表达量的相关性 Pearson相关性分析结果显示观察组患儿外周血单个核细胞Fas mRNA表达量与IL-18 mRNA表达量呈负相关(r=-0.468,P<0.05),单纯型PNS患儿中外周血单个核细胞Fas mRNA表达量与IL-18 mRNA表达量呈负相关(r=-0.567,P<0.05),肾炎型PNS患儿中外周血单个核细胞Fas mRNA表达量与IL-18 mRNA表达量呈负相关(r=-0.327,P<0.05)。
3 讨论
儿童PNS主要由肾小球毛细血管的通透性增加,导致血浆中的白蛋白从尿液中大量丢失。有研究表明,原发性肾病综合征占小儿肾病的90%[7~9],是小儿中比较常见的肾小球疾病,但其发病机制目前尚未清楚。近年来的研究发现,T淋巴细胞亚群可能参与PNS的发生发展过程,PNS患儿的T淋巴细胞分泌的细胞因子异常于正常儿童,并介导细胞的免疫应答过程,进而在儿童体内引发迟发型的超敏反应[10~12]。
IL-18是由活激活后的单核细胞分泌,是近年来新发现的炎症因子,可以加强NK细胞的毒性作用能力,可参与新月体肾炎以及急性缺血性肾功能衰竭过程[13~15]。已有研究报道,PNS患儿在治疗前后的外周血中的IL-18 mRNA差异显著,且与24h尿蛋白定量有着呈显著的正相关性[16]。本研究结果显示观察组患儿外周血单个核细胞IL-18 mRNA高于对照组,与其结果一致。Fas又称细胞凋亡蛋白1,是细胞凋亡过程中重要的细胞信号转导因子,Fas及其配体FasL与细胞外细胞因子,如白细胞介素、转化生长因子等结合,将凋亡信号转导到细胞内,启动细胞凋亡程序。本研究结果显示,观察组患儿外周血单个核细胞Fas mRNA低于对照组,表明PNS患儿外周血单个核细胞的凋亡活性弱于对照组,细胞免疫功能处于亢进状态,这符合已知的PNS的发病机理。本研究结果显示,观察组患儿外周血单个核细胞Fas与IL-18 mRNA表达水平呈负相关,说明在PNS发病过程中Fas与IL-18之间相互作用的方式可能是相互拮抗或者负性调节。结合文献笔者认为IL-18可能是Fas的上游调控因子,对Fas的表达发挥负性调控作用。
肾病综合症的类型中,单纯型主要以肾脏的微小病变为主,而肾炎型主要以非微小型病理改变为主,如系膜增生性肾炎、膜性肾炎、局灶节段性肾小球硬化等等。从病理损伤程度方面分析,肾炎型PNS的病情要比单纯型PNS重,而且更容易引起激素类药物耐药[17]。本研究结果提示,单纯型组PNS患儿外周血单个核细胞IL-18 mRNA表达低于肾炎组、Fas mRNA表达高于肾炎组,也佐证了肾炎型PNS患者的病情比单纯型PNS轻,同时提示我们检测外周血单个核细胞IL-18、Fas mRNA表达有助于鉴别单纯型和肾炎型PNS。
[1] 程力平,张群威,高小玲,等.外周血Fas及IL-18mRNA表达水平在儿童原发性肾病综合征的临床诊断分型及病情评估中的作用[J].临床和实验医学杂志,2017,16(3):257-260.
[2] 肖慧捷,李倩,王芳,等.儿童原发性肾病综合征合并高尿酸血症临床分析[J].中华儿科杂志,2014,52(11):859-862.
[3] Wang B, Jha JC, Hagiwara S, et al. Transforming growth factor-β1-mediated renal fibrosis is dependent on the regulation of transforming growth factor receptor 1 expression by let-7b[J]. Kidney Int, 2014,85(2):352-361.
[4] LeBleu VS, Taduri G, O′connell J, et al. Origin and function of myofibroblasts in kidney fibrosis[J]. Nat Med, 2013,19(8):1047-1053.
[5] Jiang L, Qiu W, Zhou Y, et al. A microRNA-30e/mitochondrial uncoupling protein 2 axis mediates Fas-induced tubular epithelial cell extracellular matrix production and kidney fibrosis[J]. Kidney Int, 2013,84(2):285-296.
[6] 陈英,高岩.白细胞介素在小儿原发性肾病综合征发病机制中作用的研究现状[J].医学综述,2008,14(6):908-911.
[7] 沈晓明,王伟平.儿科学[M] .7 版.北京:人民卫生出版社,2008:318 -319.
[8] 中华医学会儿科学分会肾脏病学组. 儿童常见肾脏疾病诊治循证指南(一):激素敏感、复发/依赖肾病综合征诊治循证指南(试行) [J]. 中华儿科杂志,2009,47(3):167-170.
[9] 张碧丽, 刘涛, 王健. 外周血转化生长因子-β1 白介素-18mRNA 表达与儿童原发性肾病综合征激素耐药关系探讨[J]. 中国实用儿科杂志, 2015,30(7):531-534.
[10] de Fátima Pereira W, Brito-Melo GEA, Guimaraes FTL, et al. The role of the immune system in idiopathic nephrotic syndrome: a review of clinical and experimental studies[J]. Inflamm Res, 2014,63(1):1-12.
[11] Gee HY, Ashraf S, Wan X, et al. Mutations in EMP2 cause childhood-onset nephrotic syndrome[J]. Am J Hum Genet, 2014,94(6):884-890.
[12] Prasad N, Jaiswal AK, Agarwal V, et al. Differential alteration in peripheral T-regulatory and T-effector cells with change in P-glycoprotein expression in Childhood Nephrotic Syndrome: A longitudinal study[J]. Cytokine, 2015,72(2):190-196.
[13] Tall EG, Bernstein AM, Oliver N, et al. TGF-β-stimulated CTGF production enhanced by collagen and associated with biogenesis of a novel 31-kDa CTGF form in human corneal fibroblasts[J]. Invest Ophthalmol Vis Sci, 2010,51(10):5002-5011.
[14] Scharpfenecker M, Floot B, Russell NS, et al. The TGF-β co-receptor endoglin regulates macrophage infiltration and cytokine production in the irradiated mouse kidney[J]. Radiother Oncol, 2012,105(3):313-320.
[15] Kaneko K, Tsuji S, Kimata T, et al. Pathogenesis of childhood idiopathic nephrotic syndrome: a paradigm shift from T-cells to podocytes[J]. World J Pediatr, 2015,11(1):21-28.
[16] Abbas AA, Mahdi YS, Ali SH. Immunoglobulin E, interleukin-17A and transforming growth factor-β1 levels in children with nephrotic syndrome[J]. Int J Curr, 2016,5(6):908-915.
[17] Kurts C, Panzer U, Anders HJ, et al. The immune system and kidney disease: basic concepts and clinical implications[J]. Nat Rev Immunol, 2013,13(10):738-753.
[18] Miyauchi K, Takiyama Y, Honjyo J, et al. Upregulated IL-18 expression in type 2 diabetic subjects with nephropathy: TGF-β 1 enhanced IL-18 expression in human renal proximal tubular epithelial cells[J]. Diabetes Res Clin Pract, 2009,83(2):190-199.
10.3969/j.issn.1002-266X.2017.35.026
R725.7
B
1002-266X(2017)35-0077-03
2017-06-22)
贵州省卫生厅重点基金资助项目(GW-2014B-101237)。

