某地区CFDA药品说明书修订通知落实情况的调查与分析
李广瑞,邱素民,高蒙蒙,毕继宏,孙成镇
(济宁医学院附属金乡人民医院,山东 济宁 272200)
某地区CFDA药品说明书修订通知落实情况的调查与分析
李广瑞,邱素民,高蒙蒙,毕继宏,孙成镇
(济宁医学院附属金乡人民医院,山东 济宁 272200)
目的:了解上市后药品说明书修订情况,为加强药品说明书监管提供参考。方法:根据国家食品药品监督管理总局(CFDA)网站2011 - 2013年发布的药品说明书修订通知,对某县区各级医疗机构使用的相关药品说明书修订情况进行核对、分析。结果:涉及70个品规的药品说明书中,57个品规的药品说明书进行了规范修订(81.43%);中成药和化学药品说明书均存在未按通知规范修订的情况。结论:国家有关管理部门、药品生产企业及医疗机构应重视上市后药品说明书修订工作,以便更好地实现安全、合理用药的目的。
药品说明书;上市后;修订;调查
药品说明书是由药品生产企业提供的,经CFDA批准的,包含药品安全性、有效性等重要信息,是用于指导医师、药师和患者安全用药的重要技术性资料[1],是判断用药行为是否得当最具法律效力的依据,同时也代表着政府的公信力[2]。近年来CFDA根据药品不良反应监测、药品再评价结果,陆续发布了许多上市药品说明书修订的通知,以完善上市后药品监管,确保患者用药安全。本文整理2011 - 2013年CFDA网站发布的有关通知,收集某地区各级医疗机构正在使用的相关药品说明书,旨在了解有关药品说明书修订情况,为进一步加强药品说明书监管、保障患者用药安全提供参考。
1 资料来源
根据CFDA网站2011 - 2013年发布的修订药品说明书通知,收集某县区所有一级以上(含一级)医院目前正在使用的相关药品说明书,对说明书修订情况进行核对、分析。
2 结果
2.1 抽查地区基本情况
该县区人口64万余人,卫生事业发展良好,各级医疗机构较为齐全,一级以上(含一级)医疗机构16家,具有较好的代表性。见表1。
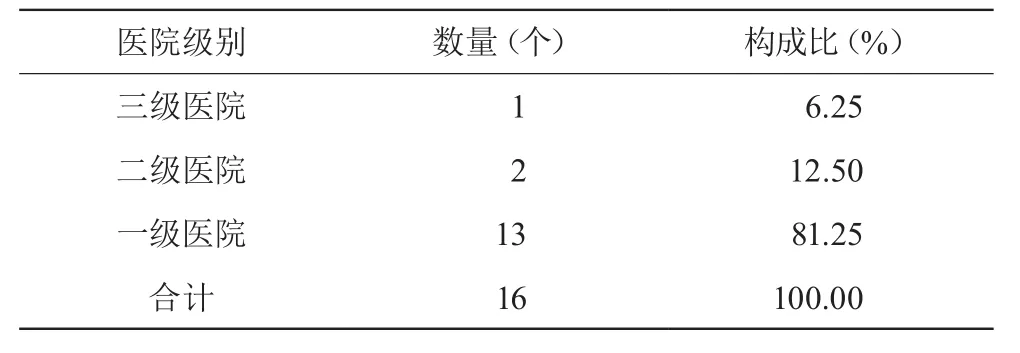
表1 医院构成情况
2.2 药品说明书修订情况
CFDA网站2011年 - 2013年发布药品说明书修订通知共计41条,涉及药品41种(含相同主要成分),该地区在用相关药品31种,占发布修订药品的75.61%;收集有关药品信息,该地区正在使用的品种共计70个品规,其中中成药23个(32.86%),化学药品47个(67.14%)。见表2。
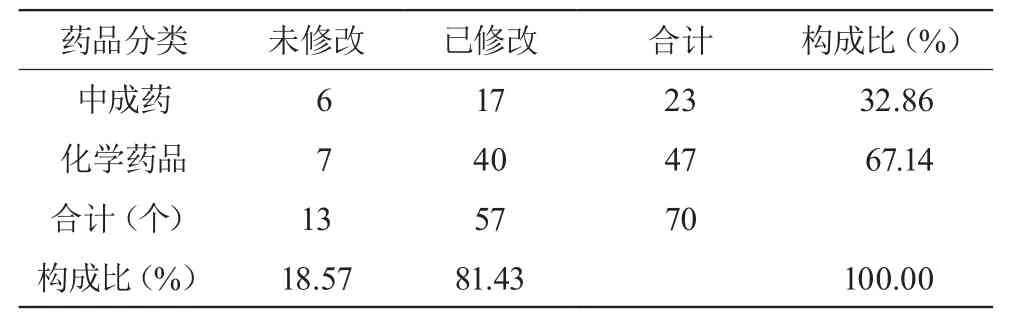
表2 涉及药品种类
2.3 说明书未修订药品情况
分析CFDA发布的药品说明书修订通知,修订内容主要涉及增加警示语,修订药品不良反应、注意事项或禁忌等内容。未按照有关通知规范修订的药品信息见表3。
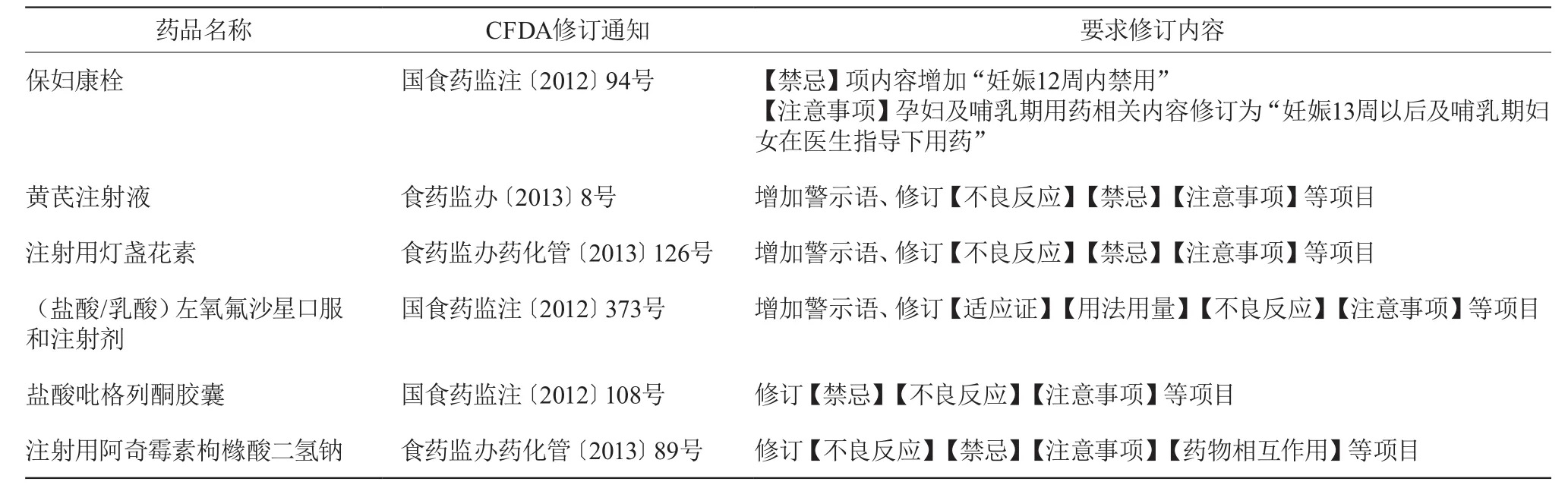
表3 未修订药品情况
药品说明书未及时规范修订有以下几种情况:①药品上市后说明书从未进行过修订,如盐酸吡格列酮胶囊;②药品上市后说明书进行过修订,但在CFDA发布修订通知后未重新修订,如注射用灯盏花素;③在CFDA发布修订通知后进行过修订,但未按照通知规范修订;如保妇康栓、黄芪注射液、(盐酸/乳酸)左氧氟沙星口服和注射剂、注射用阿奇霉素枸橼酸二氢钠等;另外还存在同一厂家生产的不同规格的同种药品,仅对其中一种规格的药品说明书进行规范修订的现象;如湖南某制药有限公司生产的注射用灯盏花素(规格为20 mg的药品说明书按照规定进行了修订、而规格为50 mg的说明书未修订)。
3 讨论
3.1 近年来,随着该地区经济的快速发展,医药卫生事业也得到了较好发展。医疗资源配置形成了以一家三级综合医院为龙头,中医院、社会办医疗机构(二级医院)及乡镇卫生院为补充的、较为合理的医疗机构布局。该地区药品配备、使用情况,具有一定的代表性,能反映出药品流通市场中药品说明书修订情况的现状。
3.2 由表2可见,70个品规的药品说明书中,57个品规的药品说明书进行了规范修订,占总数的81.43%;其中中成药规范修订17例,占所调查中成药比例的73.91%;化学药品规范修订40例,占所调查化学药品比例的85.11%;中成药和化学药品说明书均不同程度的存在未按通知规范修订的情况。
3.3 通过对相关药品说明书修订情况分析发现,不同厂家对上市后药品说明书修订情况差距较大,最多的修订8次(如氢溴酸西酞普兰片),最少的一次未修订(如盐酸吡格列酮胶囊);上市时间基本相同的同一成分的药品(如左氧氟沙星制剂),不同厂家对上市后药品说明书修订的次数也存在明显差异。
CFDA所发布药品说明书修订通知是根据药品不良反应评估结果,为控制药品使用风险而采取的积极应对措施。由表3可见,说明书修订内容主要涉及增加警示语、完善药品不良反应、注意事项及禁忌等项目,意义非常重大。本次调查表明,部分厂家对药品说明书的修订工作不重视应该引起有关管理部门的足够关注,确保这项保障患者用药安全的民生工程得到持续、健康发展。
另外,《药品说明书和标签管理规定》[1]明确指出:药品生产企业应主动跟踪药品上市后的安全性、有效性;如果药品生产企业未及时修订说明书或未将药品不良反应在说明书中充分说明的,应承担由此引发的不良后果;而且药品生产企业有责任将修改的内容通知相关药品经营企业及使用单位。本次调查还对多名医务人员对药品说明书修订工作的知晓情况进行调查,参与调查的医务人员均表示未收到过生产企业药品说明书修订的通知及有关信息提醒;当然,也就很难起到及时提醒医务人员指导患者安全用药的目的。
4 建议
上市药品说明书受医学伦理学的限制,以及药品临床研究阶段研究对象数量少、时间短、目的单一的局限,再加上科技发展水平和人们认知的时限性以及生产企业的产品上市紧迫性等因素的影响,上市前的药品研究不可能非常完整,说明书信息也就不会非常完整[3-4],因此上市后药品说明书规范修订意义重大。一方面,需要国家有关管理部门采取更加强有力的措施,加强上市后药品说明书修订工作的监管,以确保药品说明书内容的完整性及科学性;另一方面,药品生产企业应提高对说明书修订工作的认识,自觉规范上市后药品说明书修订工作,并积极做好宣传,以对产品、对患者高度负责的态度,实现企业更好的持续发展。另外,各级医疗机构及药品零售企业作为药品使用的主体,也应高度重视上市后药品说明书修订工作。尤其对直接接触药品的药学人员,加强对上市后药品说明书修订内容的的收集和宣传,也是药师参与合理用药,体现和提升自身价值的一个非常好的切入点。
[1] 国家食品药品监督管理局.药品说明书和标签管理规定[S].国家食品药品监督管理局第24号.2006-03-15.
[2] 江俊,宋民宪,唐冬蕾.超药品说明书用药的法律责任研究[J].中药与临床,2014,5(2):87-89.
[3] 吕水利,张艳利.门诊306种药品说明书内容调查分析[J].临床合理用药,2014,7(1):157-158.
[4] 唐蕾,韦炳华,何秋毅,等.超说明书用药的现状及其法律风险[J].中国药房,2014,25(45):4225-4228.
本文编辑:鲁守琴
Investigation and Analysis on Implementation of Revision of Package Inserts Informed by CFDA in a County in Shandong Province, China
Li Guang-rui, Qiu Su-min, Gao Meng-meng, Bi Ji-hong, Sun Cheng-zhen
(Jinxiang People’s Hospital Aff liated to Jining Medical College, Shandong Jining, 272200, China)
Objective:To investigate the revision of post-marketing package inserts so as to provide a reference for strengthening the supervision of package inserts.Methods:According to the relevant notifications about the revisions of package inserts issued on the CFDA website from 2011 to 2013, the package inserts used in medical institutions at various levels in a county in Shandong Province, China were checked and analyzed.Results:Of the 70 package inserts, 57 (81.43%) were revised based on CFDA standard. Unrevised package inserts were existed in both Chinese patent drugs and chemical drugs.Conclusion:The relevant departments, pharmaceutical manufacturers and medical institutions should attach great importance to the revision and implementation of post-marketing package inserts so as to achieve the goal of safe and rational drug use.
Package insert; Post-marketing; Revision; Investigation
R926
A
10.3969/j.issn.2096-3327.2017.02.016
2016 - 10 - 18
李广瑞,男,硕士,主管药师。研究方向:医院药事管理。通讯作者E-mail:lgr0537@126.com

