淫羊藿苷对成骨细胞成骨分化的影响及Wnt/-catenin信号系统的关系研究*
涂 艳 熊莉娜柳湘洁 雷 超 李凝旭 张瑞芸
(华中科技大学同济医学院附属梨园医院,湖北 武汉 430077)
·实验报告·
淫羊藿苷对成骨细胞成骨分化的影响及Wnt/-catenin信号系统的关系研究*
涂 艳 熊莉娜△柳湘洁 雷 超 李凝旭 张瑞芸
(华中科技大学同济医学院附属梨园医院,湖北 武汉 430077)
目的探讨淫羊藿苷对成骨细胞分化及其细胞内Wnt/-catenin信号通路的影响。方法取SD大鼠,采用全骨髓贴壁法分离并体外培养骨髓间充质干细胞(rBMSC),并用贴壁筛选法进行体外培养rBMSC,给予淫羊藿苷3、6、9 d后,观察对照组与淫羊藿苷处理组的碱性磷酸酶 (ALP)活性,对碱性磷酸酶阳性克隆(CFUALP-F)以及矿化结节形成的影响。采用Western blot方法检测每组-catenin和Runx2组蛋白表达水,采用RT-PCR方法检测淫羊藿苷对Wnt10b、GSK-3、-catenin及LEF1 mRNA水平的影响。结果淫羊藿苷可以提高ALP的活性,碱性磷酸酶克隆数和矿化结节的形成。Western blot结果显示,淫羊藿苷可以提高-catenin和Runx2的蛋白表达水平;RT-PCR结果显示,淫羊藿苷可以提高Wnt10b、GSK-3、-catenin及LEF1表达水平。结论初步证明淫羊藿苷可以激活Wnt/-catenin信号通路,参与并调控BMSC的成骨分化。
淫羊藿苷 成骨细胞 成骨分化 Wnt/-catenin信号通路
成骨细胞(PB)来源于中胚层内外骨膜、骨髓基质的间充质干细胞(MSCs),MSCs有着多向分化潜能,并在体内复杂的调控因素的作用下可以分化成骨祖细胞,从而形成前成骨细胞(preosteoblast),MSCs的成骨分化是骨形成的重要过程[1]。多项研究表明,Wnt/-catenin信号通路在成骨细胞分化及骨的形成过程中具有重要的作用[2-4]。淫羊藿苷是从中药淫羊藿内提取出的单体,对抗骨质疏松具有显著的效果,可以抑制前体破骨细胞的增殖,进而减少破骨细胞的形成[5]。并且研究表明,淫羊藿苷在治疗骨质疏松的过程中有着显著的效果[6-7]。为探究淫羊藿苷对成骨细胞成骨分化,以及对Wnt/-catenin信号通路调控的关系,本实验取大鼠rBMSC为研究对象,对上述机制进行研究。
1 材料与方法
1.1 实验材料 SD大鼠5只,体质量200~250 g,购自中国医科大学实验动物中心。DMEM/F12培养液(Thermo Scientific Hyclone公司);胎牛血清(FBS,Gibco公司);青链霉素、25%Trypsin-EDTA(上海北诺生物科技有限公司);淫羊藿苷、甘油磷酸钠、地塞米松、抗坏血酸、MTT试剂、DMSO、茜红素(上海源叶生物科技有限公司);总RNA提取试剂盒、碱性磷酸酶测定试剂、SYBR Green荧光定量预混试剂 (浙江爱康生物科技有限公司);引物、-catenin、Runx-2单克隆抗体、辣根过氧化物酶标记的二抗(北京奥科鼎盛生物科技有限公司)。
1.2 rBMSCs的分离培养 用颈椎脱臼法处死大鼠,浸泡于75%乙醇中20 min,在无菌条件下分离股骨和胫骨,用注射器抽取适量DMEM/F12冲洗骨髓腔。用微量移液器吹打收集的冲洗液后静置10 min。将上清液在1000 r/min离心5 min后弃去上清液,用含10% FBS的DMEM/F12培养基使细胞重悬,吹打数次后计数,以106个/cm2的密度接种在6孔板中,并在37℃、5%CO2培养箱中进行培养。3 d后开始更换培养液,每天观察细胞情况,当90%贴壁细胞融合时,用胰酶消化传代培养。当细胞传代至第3代时开始实验,96孔板、24孔板、6孔板接种密度分别为2×104、2×106、4× 106细胞/孔。
1.3 ALP活性检测 取96孔板,接种并培养细胞24 h,然后将细胞进行成骨性诱导。并给予药物处理,淫羊藿苷浓度为分别为0.6、1.2、5、8、10、20 mol/L。对照组和处理组的培养液中均含有0.1%的DMSO。在37℃、5%CO2培养箱中培养3、6、9 d,每3日更换1次培养液,PBS冲洗2次,将基质液和缓冲液各50 L加入每孔中,置于37℃温水中15 min。再加入150 L的显影液,在520 nm波长下检测吸光度(OD)。结果用每孔15 min内产生酚的量表示。
1.4 CFUALP-F分析 取12孔板,接种并培养细胞24h,然后将细胞进行成骨性诱导。处理组加入10 mol/L的淫羊藿苷,对照组给予空白诱导培养液,对照组和处理组的培养液中均含有0.1%的DMSO。7 d后进行ALP组织化学染色,用PBS漂洗2次后加入基质液,静置30 min后再用PBS漂洗,固定。然后用IPP6.0软件进行CFUALP-F灰度值、数量和面积的测定。
1.5 矿化结节的形成 取24孔板,接种并培养细胞24h,然后将细胞进行成骨性诱导。处理组加入10 mol/L的淫羊藿苷,对照组给予空白诱导培养液,对照组和处理组的培养液中均含有0.1%的DMSO。12 d后弃去培养液,用PBS漂洗2次后加入基茜红素,并置于37℃环境中1 h,然后用IPP6.0软件进行矿化结节灰度值、数量和面积的测定。
1.6 RT-CPR检测 取6孔板,接种并培养细胞24 h,然后将细胞进行成骨性诱导。处理组给予淫羊藿苷10 mol/L,对照组给予空白诱导培养液。分别在8、24、48 h候提取总RNA,检测纯度及浓度,并调整RNA的浓度至1 g,再取1L逆转录为cDNA。加入引物和SYBR Green试剂,用两步法对cDNA扩增。并记录CT(cycle threshold)值,ΔΔCT=(CT目的基因-CT内参基因)处理组-(CT目的基因-CT内参基因)对照组,计算各组2-ΔΔCT,结果即为目的基因处理组mRNA表达和对照组mRNA的倍数。
1.7 Western blot检测 取6孔板,接种并培养细胞24 h,然后将细胞进行成骨性诱导。处理组分别给予淫羊藿苷5、10、20 mol/L,对照组给予空白诱导培养液。3 d后,提取细胞总蛋白。BCA法检测蛋白的浓度,加入含溴酚蓝上样缓冲液,95℃水浴5 min。在SDSPAGE凝胶进行电泳,然后将蛋白移至PVDF膜上,PVDF膜置于含5%脱脂奶粉的TBST中,并在室温下摇床封闭2h,再加入-catenin、Runx2、-actin的一抗,在4℃环境下放置过夜。第2日,用TBST漂洗PVDF膜3次,每次10 min。用含标记辣根过氧化物的二抗,在室温下摇晃2 h。漂洗3次后,PVDF膜上涂抹发光液,并置于暗室内曝光。晾干后,用IPP6.0软件测定灰度值。
1.8 统计学处理 应用SPSS17.0软件。计量资料以(s)表示,组间差异分析比较采用方差分析,检验水平=0.05。
2 结 果
2.1 不同浓度的淫羊藿苷对ALP活性的影响 见图1。如图1所示,rBMSC诱导为成骨细胞后,随着时间的增加,ALP活性的也随之增加,在第9天时其活性达到最高。不同浓度淫羊藿苷作用下,第6天和第9天时的ALP活性均有所提高。并且在浓度为10 mol/L淫羊藿苷作用下ALP活性增加至最高,在浓度为20 mol/L淫羊藿苷的作用下ALP活性稍有减少。

图1 不同浓度的淫羊藿苷对ALP活性的影响
2.2 淫羊藿苷对CFUALP-F的影响 见表1。加入淫羊藿苷5、10、20 mol/L后,将3个处理组和对照组形成CFUALP-F的灰度值、数量和面积进行对比分析,3个处理组CFUALP-F的灰度值、数量和面积高于对照组(P<0.05)。
表1 各组CFUALP-F的灰度值、数量和面积的方差分析(s)

表1 各组CFUALP-F的灰度值、数量和面积的方差分析(s)
与对照组比较,△P<0.05。
组别 灰度值 数量 面积对照组 23658.24±7.26 422.38±44.55 31.69±8.33 5 mol/L组 44054.12±4.89△846.01±75.93△56.87±7.12△10 mol/L组 59873.75±6.60△966.51±69.18△77.34±8.96△20 mol/L组 50770.15±5.27△870.23±52.46△69.05±5.45△
2.3 淫羊藿苷对矿化结节形成的影响 见表2。加入淫羊藿苷 5、10、20 mol/L后,3个处理组 Wnt10b、GSK-3、-catenin、LEF1 mRNA表达水平明显提高。且在36 h时,淫羊藿苷对Wnt 10 b和LEF1 mRNA表达水平的影响最显著。
表2 不同时间下10 mol/L淫羊藿苷对Wnt/-catenin的mRNA表达水平影响的方差分析(s)
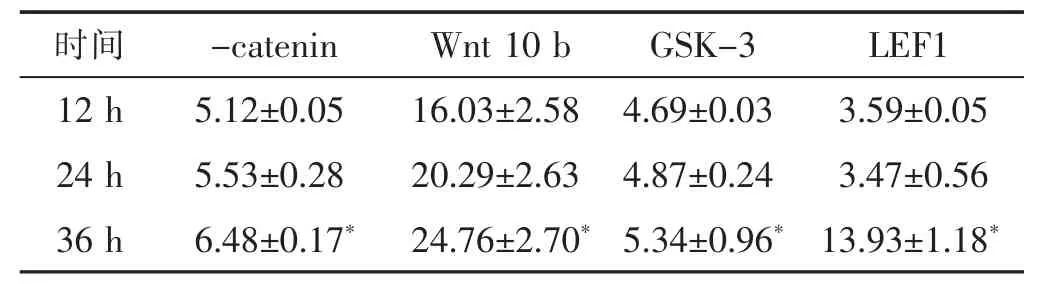
表2 不同时间下10 mol/L淫羊藿苷对Wnt/-catenin的mRNA表达水平影响的方差分析(s)
与12、24 h比较,*P<0.05。
时间 -catenin LEF1 Wnt 10 b GSK-3 12 h 5.12±0.05 3.59±0.05 24 h 5.53±0.28 3.47±0.56 16.03±2.58 4.69±0.03 20.29±2.63 4.87±0.24 36 h 6.48±0.17*13.93±1.18*24.76±2.70*5.34±0.96*
2.4 淫羊藿苷对-catenin和Runx2蛋白表达水平对影响 加入淫羊藿苷 5、10、20 mol/L 3 d后,采用Western blot对-catenin和Runx2蛋白表达水平检测。结果显示,在10 mol/L浓度淫羊藿苷下,Runx2蛋白表达水平的提高较为明显,而-catenin蛋白表达水平在3种浓度下的淫羊藿苷均有提高。
3 讨 论
目前,许多骨质疏松、关节炎等骨关节疾病影响着人们的健康及生活质量。特别是对于绝经期后,体内雌激素下降的女性,更易引发骨质疏松。淫羊藿苷是淫羊藿的主要活性成分。多项研究表明,淫羊藿苷可以有效防治骨质疏松、延缓衰老、抗肿瘤等功效[8-9]。相比较其他药物对防治骨质疏松的过程中,如降钙素、雌激素等,使用淫羊藿苷后的不良反应及并发症较少,服用时更为安全。
Wnt/-catenin信号通路对骨的形成和重建过程中有着重要的作用。该通路可以激活因子,从而促进BMSCs向成骨细胞分化。-catenin在成骨细胞分化过程中起着关键的作用,是成骨细胞分化早期阶段不可或缺的,在-catenin剔除的小鼠中,MSCs前体细胞向软骨细胞分化,而没有形成成骨细胞[10]。当-catenin与 LEF1/TCF和Smad4形成复合物时,可促使Smad4进入细胞核内,调控Wnt靶基因的表达。研究发现,Wnt10b可活化-catenin表达水平,激活Wnt/-catenin信号通路,从而促进成骨细胞形成和成骨细胞向成骨分化以及骨细胞的矿化[11]。Runx2在BMSCs成骨分化中也起到关键的作用,Runx2基因表达活性影响Wnt/ -catenin信号通路调控成骨细胞成骨分化。Runx2可以和OCN启动子上的特异性元件结合调控成骨细胞的分化过程,同时Runx2可以提高Colla1的表达水平。缺失Runx2基因会降低BMSCs向成骨细胞分化的能力。研究发现,Runx2基因突变的小鼠不会形成肋骨,而且出生不久便会死亡,经组织切片发现小鼠没有成骨细胞的形成[12]。此外,淫羊藿苷可以明显增加ALP的活性,而ALP则是成骨细胞分化的早期标志[13]。
体内激素水平可以影响Wnt/-catenin信号通路和Runx2表达水平,从而影响着成骨细胞的增殖与分化。女性绝经后体内雌激素水平明显下降,极易引发骨质疏松。而淫羊藿苷的有效成分为黄酮类化合物,可以预防和治疗因激素水平而造成的骨质疏松。同时本实验结果显示,淫羊藿苷可以使Wnt10b、GSK-3、-catenin、LEF1 mRNA表达水平明显提高。Western blot结果提示,淫羊藿苷可以提高-catenin和Runx2的蛋白表达水平。说明淫羊藿苷可以通过激活Wnt/-catenin信号通路,参与并调控BMSC向成骨细胞分化。
近年来,淫羊藿苷在治疗骨质疏松、关节炎等骨关节疾病的研究取得了很大的进展。研究发现,淫羊藿苷可以激活Wnt/-catenin信号通路能够促进了成骨细胞的增殖与分化。但是,Wnt/-catenin信号通路中一些信号过度增强反而会诱导BMCs衰老[14]。因此,对Wnt/-catenin信号通路信号的强弱把控以及 Wnt/ -catenin信号通路中其他相关因子有待于进一步研究,以期使我们能更深一步的了解淫羊藿苷促进成骨细胞增殖和分化的机制,为临床防治骨关节疾病提供有力依据。
[1] Kasten P,Vogel J,Luginühl R,et al.Influence of platelet-rich plasma on osteogenic differentiation of mesenchymal stem cells and ectopic bone formation in calcium phosphate ceramics[J].Cells Tissues Organs,2006,183(2):68-79.
[2] Cawthorn WP,Bree AJ,Yao Y,et al.Wnt6,Wnt10a and Wnt 10 b inhibit adipogenesis and stimulate osteoblastogenesis through a-catenin-dependent mechanism[J].Bone,2012,50(2):477-489.
[3] Davidson ENB,Vitters EL,Vanderkraan PM,et al.Expression of transforming growth factor-beta(TGFbeta)and TGFbeta signaling molecule SMAD-2P in spontaneous and instabilityinduced osteoarthritis:role in cartilage degradation,chondro-genesis and osteophyte formation[J].Ann Rheum Dis,2006,65(11):1414-1421.
[4] Velasco J,Zarrabeitia MT,Prieto JR,et al.Wnt pathway genes in osteoporosis and osteoarthritis:differential expression and genetic association study[J].Osteoporos Int,2012,21(10):109.
[5] Qin L,Zhang G,Hung W Y,et al.Phytoestrogen-rich herb formula”XLGB”prevents OVX-induced deterioration of musculoskeletal tissues at the hip in old rats[J].J Bone Miner Metab,2005,23(S1):55-61.
[6] 訾慧,李可强,郑洪新.补肾壮骨滴丸中淫羊藿苷在骨质疏松模型与正常大鼠体内组织分布比较[J].中华中医药学刊,2015,33(12):2856-2859
[7] 朱彤彤,黄连弟,李俊玮,等.淫羊藿苷对去卵巢大鼠骨质疏松症等保护作用及其机制[J].吉林大学学报:医学版,2016,42(5):915-919.
[8] 刘波,张睿,徐彭,等.淫羊藿对去卵巢大鼠骨质疏松的影响[J].中国实验方剂学杂志,2013,19(7):178-181.
[9] Wang ZQ,Li JL,Sun YL,et al.Chinese herbal medicine for osteoporosis:a systematic review of a randomized controlled trails[J].Evid Based Complement Alternat Med,2013,2013(1):57-65.
[10]Krishnan V,Bryant HU,Macdougal OA.Regulation of bone mass by Wnt signaling[J].J Clin Invest,2006,116(5):1202-1209.
[11]Bennett CN,Longo KA,Wright WS,et al.Regulation of osteoblastogenesis and bone mass by Wnt10b[J].Proc Acad Sci USA,2005,102(9):3324-3329.
[12]贾忠宝,张柳,田发明.Wnt/-catenin信号通路主要因子于成骨细胞研究进展[J].中国骨质疏松杂志,2012,18(1):90-94.
[13]Enomoto H,Fruuihi T,Zanma A,et al.RUNX2 deficiency in chondrocytes causes adipogenic changes invitro[J].J Cell Sci,2004,117(3):417-425.
[14]Zhang DZ,Wang HJ,Tan YZ,et al.Wnt 3a promotes proliferation and suppresses osteogenic differentiation of adult human mesenchymal stem cells[J].J Cell Biochem,2004,93(6):1210-1230.
Effect of Icariin on Osteogenic Differentiation of Osteoblasts and Research on the Relationship of Wnt/-catenin Signal System
TU Yan,XIONG Lina,LIU XiangJie,et al. Liyuan Hospital Affiliated to Tongji Medical College Huazhong University of Science and Technology,Hubei,Wuhan 430077,China.
Objective:To investigate the effect of icariin on osteogenic differentiation of osteoblasts and Wnt/-catenin signaling pathway in the cells.Methods:SD rats were selected and rat bone marrow derived mesenchymal stem cells(rBMSC)were isolated and cultured by whole bone marrow adherent method in vitro,with adherent screening method.On the 3rd,6th and 9th day being treated with icariin,alkaline phosphatase(ALP)activity was observed in the control group and icariin treatment group,the alkaline phosphatase positive clone(CFUALP-F)and the influence of the formation of mineralized nodules were observed.Western blot method was used to detect the expression of-catenin and Runx2 protein in each group.The effect of Wnt10b,GSK-3,-catenin and LEF1 mRNA levels were detected by RT-PCR method.Results:The activity of ALP,the number of alkaline phosphatase and the formation of mineralized nodules could be enhanced by the activity of the alkaline phosphatase. Western blot results showed that the protein expression levels of-catenin and Runx2 could be improved by the expression of the protein.RT-PCR results showed that the expression levels of Wnt10b,GSK-3,-catenin and LEF1 were increased.Conclusion:Icariin can activate the Wnt/-catenin signaling pathway and participate in and regulate the BMSC osteogenic differentiation.
Icariin;Osteoblast;Osteogenic differentiation;Wnt/-catenin signal pathway
R285.5
A
1004-745X(2017)03-0448-04
10.3969/j.issn.1004-745X.2017.03.023
2016-12-06)
华中科技大学院系自主创新研究基金(2016YXMS127)
△通信作者(电子邮箱:huyanyan@163.com)

