食管鳞癌中骨桥蛋白、表皮生长因子受体与蛋白激酶B蛋白的表达及临床意义
张 卉 杨德生 马许辉 索智敏
(河南大学淮河医院消化内科,河南 开封 475000)
食管鳞癌中骨桥蛋白、表皮生长因子受体与蛋白激酶B蛋白的表达及临床意义
张 卉 杨德生 马许辉 索智敏
(河南大学淮河医院消化内科,河南 开封 475000)
目的 研究骨桥蛋白(OPN)及表皮生长因子受体(EGFR)、蛋白激酶B(Akt)蛋白在食管鳞癌中的表达及与其临床意义。方法 应用S-P免疫组化技术检测70例食管鳞癌及其相应的癌旁正常组织中OPN和EGFR、Akt蛋白的表达。结果 70例食管鳞癌组织中OPN、EGFR、Akt蛋白的阳性表达率72.9%(51/70)、67.1%(47/70)、75.7%(53/70)均高于癌旁正常组织〔5.7%(4/70)、18.6%(13/70)、17.1%(12/70),P<0.05〕;OPN的表达与淋巴结转移、临床分期相关(P<0.05);EGFR蛋白的表达与浸润深度、淋巴结转移、临床分期相关(P<0.05);Akt蛋白的表达与淋巴结转移相关(P<0.05)。OPN与EGFR、Akt蛋白在食管鳞癌组织中的表达呈正相关(r=0.325、0.403,均P<0.05),EGFR与Akt蛋白在食管鳞癌组织中的表达呈正相关(r=0.384,P<0.05)。结论 OPN可能通过激活EGFR /Akt所在的信号系统发挥其抗食管鳞癌作用。
骨桥蛋白;食管鳞状细胞癌;表皮生长因子受体;蛋白激酶B
食管癌在我国肿瘤性死因中占第四位,其中绝大多数为鳞状细胞癌,其发病机制涉及多基因的改变以及多条信号通路异常等〔1〕。骨桥蛋白(OPN)是从最初骨基质中发现的,具有多种功能的一种胞外基质蛋白,参与细胞黏附和细胞迁移,影响肿瘤发生和转移进程。表皮生长因子受体(EGFR)为酪氨酸激酶受体,在体内通过多种信号途径在肿瘤的发生发展中发挥重要作用〔2〕。PI3K/蛋白激酶B(Akt)信号途径是癌细胞存活的首要通路,Akt位于其枢纽部位,位于EGFR下游,是EGFR信号传导的一条主要通路〔3〕。本文应用免疫组化法检测OPN和EGFR、Akt蛋白在食管鳞癌的表达及意义。
1 资料与方法
1.1 一般资料 河南大学淮河医院胸外科2006年1月至2011年12月手术切除食管癌标本70例,均经HE切片病理证实为鳞状细胞癌,所有病例术前均未接受任何放疗或化疗,并排除其他脏器的恶性肿瘤。选取同一病例的癌旁切缘正常组织70例作为对照。70例食管鳞癌中,男39例,女31例;年龄31~74〔平均(46.2±5.6)〕岁;高、中、低分化鳞癌分别为23例、34例和13例;淋巴结转移37例,无转移33例;按TNM分期标准,Ⅰ期15例,Ⅱ期22例,Ⅲ期16例及Ⅳ期17例;按浸润深度分,T1 21例,T2 15例,T3 22例,T4 12例。
1.2 试剂 浓缩型鼠抗人单克隆抗体OPN、EGFR、Akt及免疫组化、DAB试剂盒均购自北京中杉金桥生物技术有限公司。
1.3 实验方法 采用免疫组化S-P法。取厚4 μm石蜡切片,常规脱蜡、水化后,采用电炉加热煮沸修复抗原;OPN与EGFR、Akt蛋白单克隆抗体均按1∶100稀释,操作参照产品说明书,以磷酸盐缓冲液(PBS)代替一抗作为阴性对照。用已证实的OPN、EGFR、Akt染色阳性食管鳞癌切片作阳性对照。
1.4 免疫组化结果判定 OPN与EGFR、Akt蛋白均按照以下标准:①根据染色程度及阳性细胞数来计算评分,a 染色程度:阴性(0分),弱阳性(1分),中等阳性(2分),强阳性(3分);b 阳性细胞数:无阳性细胞(0分),阳性细胞1%~25%(1分),阳性细胞26%~50%(2分),阳性细胞>50%(3分);a+b之和为3~6分者评为免疫组织染色阳性;计数方法,结果判定在双盲法下进行,每张切片由两名病理医师分别判断。两者不一致时重新计数。
1.5 统计学方法 应用SPSS13.0统计软件进行χ2检验,Spearman相关分析。
2 结 果
2.1 OPN、EGFR、Akt蛋白的表达情况 70例食管鳞癌组织中,OPN阳性表达率72.9%(51/70),其阳性表达部位为细胞质;EGFR的阳性表达率67.1%(47/70),阳性表达部位为细胞膜;Akt的阳性表达率75.7%(53/70),阳性表达部位为主要在细胞质,部分在细胞核,均呈强阳性过度表达现象。癌旁正常组织中,OPN、EGFR、Akt蛋白均为弱阳性低表达,阳性表达率分别为5.7%(4/70)、18.6%(13/70)、17.1%(12/70)。两组间表达差异有统计学意义(χ2=51.148、33.717、36.664,P<0.05)。
2.2 OPN与EGFR、Akt蛋白的阳性表达与食管鳞癌临床病理特征的关系 OPN的阳性表达与淋巴结转移程度、临床分期相关(P<0.05),与肿瘤分化程度及浸润深度无关(P>0.05);EGFR蛋白的阳性表达与浸润深度、淋巴结转移、临床分期相关(P<0.05),与肿瘤分化程度无关(P>0.05);Akt蛋白的阳性表达与淋巴结转移相关(P<0.05),与浸润深度、肿瘤分化程度、临床分期无关(P>0.05)。见表1。
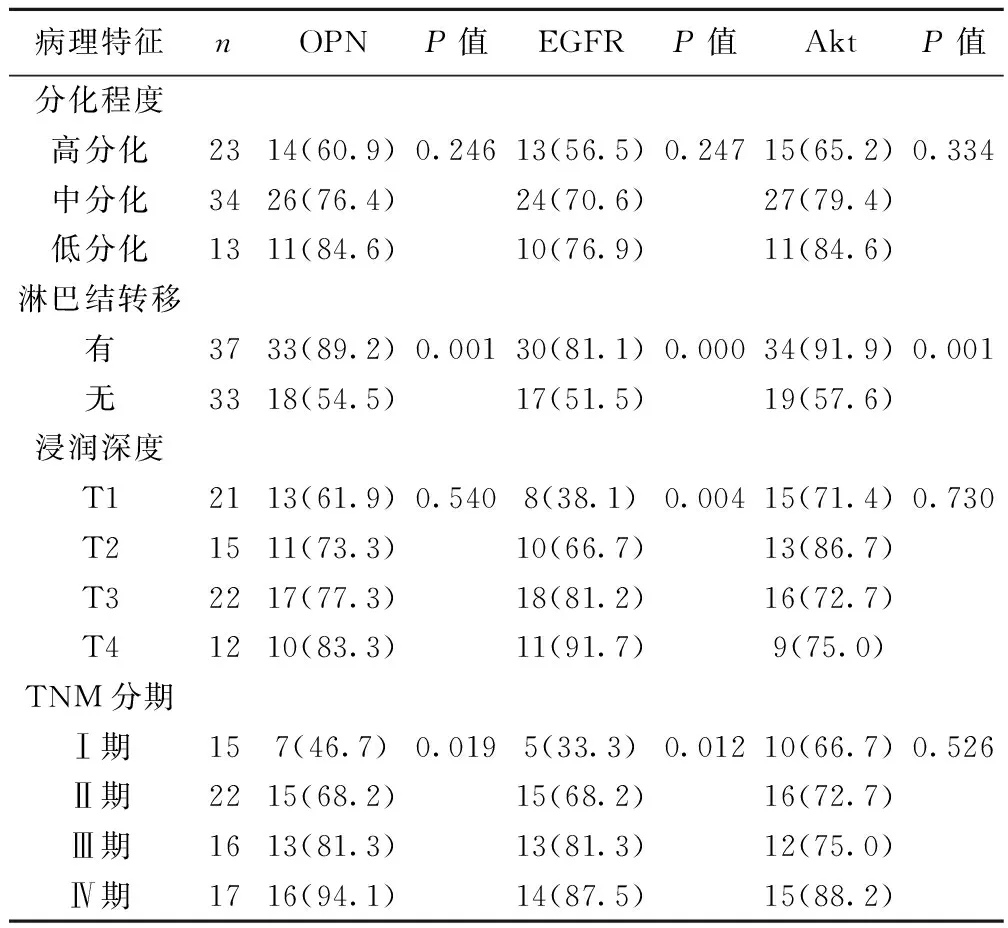
表1 OPN、EGFR、Akt蛋白的阳性表达与食管鳞癌病理特征的关系〔n(%)〕
2.3 OPN与EGFR、Akt 蛋白在食管鳞癌中表达的相关性 OPN与EGFR、Akt蛋白在食管鳞癌组织中的表达呈正相关(r=0.325,P=0.006;r=0.403,P=0.001),EGFR与Akt蛋白在食管鳞癌组织中的表达呈正相关(r=0.384,P=0.001)。
3 讨 论
整合素是一类异源二聚体跨膜蛋白,作为受体,通过特异的Arg-Gly-Asp序列(RGD)识别包括纤维黏连蛋白、层黏连蛋白、胶原蛋白、骨桥蛋白等在内的细胞外基质蛋白。他们作为细胞功能的重要调节器,通过他们的调解黏附到细胞外基质,诱导细胞骨架重排,并激活细胞内的信号转导通路的能力。整合素和生长因子受体调节相同的信号转导通路,和他们一起调节细胞分化、增殖和存活〔4〕。OPN是与整合素结合的糖蛋白,参与各种生理和病理过程,包括炎症,局部缺血-再灌注,骨吸收,动脉硬化和肿瘤进展等。OPN表面受体结合,引起在细胞功能的广泛变化,如增强的移动性和黏附,加速生长和分裂,以及延长细胞的存活,从而肿瘤进展和转移的过程中发挥重要作用〔5〕。Kita等〔6〕用免疫组化方法检测175例食管癌中OPN的表达,发现OPN的表达与淋巴结转移、淋巴管浸润、淋巴结转移、临床分期显著相关。在本研究中OPN表达于细胞质,在食管鳞癌中的阳性率显著高于癌旁正常组织,且其表达与肿瘤的淋巴转移、临床分期相关,这与之前的报道相符。
EGFR是一种跨膜蛋白,属于ErbB家族受体酪氨酸激酶(RTK)。它被激活后与EGF家族的肽生长因子结合,其中包括表皮生长因子(EGF),转化生长因子(TGF)-α等,通过与配体结合诱导ErbB受体聚合物和异二聚体,导致细胞质的激酶结构域的酪氨酸激酶自身磷酸化和激活。激活EGFR结果同时激活多个下游信号转导通路调制的多效性细胞的反应,包括细胞增殖,迁移,侵袭,抑制细胞凋亡。除了配体诱导的信号途径,可以由其他的蛋白激酶,如G-蛋白耦联受体,细胞因子受体和黏附受体式(主要是整合素)激活〔7〕。整合素和生长因子受体之间的相互作用已被确认为肿瘤进展的很多方面至关重要。此外,这种配体-EGFR独立激活EGFR的方式被认为在单克隆抗体抗EGFR治疗发挥重要作用〔8〕。本研究显示,EGFR在食管鳞癌组织中表达率显著高于较正常组织,且与食管鳞癌的分化不良、肿瘤分期、淋巴转移、浸润深度、预后不良相关。与上述文献报道相符。
Akt活化启动由易位到质膜和磷酸化在Thr308位点由PI3K-依赖性蛋白激酶(PDK)1和Ser473的PDK2〔9〕。Akt的易位到不同的亚细胞,磷酸化它的底物,并调节不同的细胞功能,如存活,细胞周期进程和生长。研究表明,Akt蛋白在肿瘤发生发展过程通过多种信号通路被激活〔9,10〕。Akt的活化在肿瘤和其与临床病理特征的相关性已被研究证实〔10〕。Takahashia等〔11〕从23例没有术前化疗的手术切除食管癌组织标本Akt1-3基因和蛋白表达进行了分析。通过免疫组化方法检测,Akt主要表达于细胞质中,其阳性率为77.8%。这些与本实验相符。本实验中,Akt的表达与淋巴结转移相关,提示Akt参与食管鳞癌的细胞增殖和浸润转移过程。
研究发现,OPN和EGFR基因表达上调,增加的NF-κB的活化与很强的相关性〔12〕。由EGF通过与受体结合可以在乳腺癌细胞,大鼠肾上皮细胞〔13〕,HepG2细胞〔14〕和HL60细胞〔15〕中诱导OPN基因的表达。在另一方面,在对乳腺癌细胞的体外研究表明,肿瘤细胞中的下游信号转导途径的激活导致了与整合结合的OPN诱发的c-Src的依赖性的EGFR的转录〔16〕。EGFR酪氨酸激酶信号途径可被内在受体终止。整合素和生长因子受体各种激活和抑制信号的平衡被认为可以确定细胞的命运。然而,整合素和生长因子受体之间的相互作用比简单的独立激活相同的信号通路更复杂。在缺乏配体如EGFR的情况,整合素所诱导多种受体酪氨酸激酶激活都将被中断。在细胞的生长和延长细胞的存活,蛋白质水解等生物学效应方面,骨桥蛋白和表皮生长因子受体配体结合和Akt的活化的信号途径是重叠的〔17〕。
Akt是EGFR下游主要通路之一,是EGFR激活的关键〔18〕。EGFR的激活导致其磷酸化的Akt的活化丝氨酸-473。由于EGFR和Akt所涉及的各个方面,从肿瘤的发生,血管生成和转移肿瘤的生长,EGFR-Akt轴线的是一个有吸引力的干预治疗目标〔18〕。本实验中发现EGFR和Akt蛋白在食管鳞癌中的表达呈正相关,与既往研究理论相符。Wang等〔19〕研究显示,胶质瘤细胞分泌OPN通过的avβ3/PI3-K/Akt的信号转导通路加速内皮细胞血管生成,包括增殖,迁移和管状结构形成,提示OPN通过Akt所在的信号传导途径发挥其在肿瘤发生发展中的作用。在血管生成,转移和抗凋亡等方面,EGFR,Akt也起着非常重要的作用。本实验中,OPN与Akt蛋白在食管鳞癌中的高表达呈正相关,证实了上述观点。
本研究发现,OPN可能通过激活EGFR/PI3K/Akt信号系统发挥其在肿瘤发生发展中的重要作用。
1 赫 捷,邵 康.中国食管癌流行病学现状、诊疗现状及未来对策〔J〕.中国癌症杂志,2011;21(7):501-4.
2 Heuckmann JM,Rauh D,Thomas RK.Epidermal growth factor receptor(EGFR)signaling and covalent EGFR inhibition in lung cancer〔J〕.Clin Oncol,2012;30(27):3417-20.
3 Yamada T,Takeuchi S,Fujita N,etal.Akt kinase-interacting protein 1,a novel therapeutic target for lung cancer with EGFR-activating and gatekeeper mutations〔J〕.Oncogene,2013;32(37):4427-35.
4 Cabodi S,del Pilar Camacho-Leal M,Di Stefano P,etal.Integrin signalling adaptors:not only figurants in the cancer story〔J〕.Nat Rev Cancer,2010;10(12):858-70.
5 张 忠,王旭光.联合检测血清骨桥蛋白和MG7抗原在胃癌诊断中的应用〔J〕.中国老年学杂志,2013;33(2):254-6.
6 Kita Y,Natsugoe S,Okumura H.etal.Expression of osteopontin in oesophageal squamous cell carcinoma〔J〕.Br J Cancer,2006;45(15):634-8.
7 Normanno N,De Luca A,Bianco C,etal.Epidermal growth factor receptor(EGFR)signaling in cancer〔J〕.Gene,2006;366(1):2-16.
8 Wheeler DL,Dunn EF,Harari PM.Understanding resistance to EGFR inhibitors-impact on future treatment strategies〔J〕.Nat Rev Clin Oncol,2010;7(9):493-507.
9 郭 琳,王 强.P13K、Akt以及PrrEN在胃肠道间质瘤的表达及意义〔J〕.中国老年学杂志,2013;33(22):5519-21.
10 Bellacosa A,Kumar CC,Di Cristofano A,etal.Activation of AKT kinases in cancer:implications for therapeutic targeting〔J〕.Adv Cancer Res,2005;94:29-86.
11 Takahashia K,Miyashitaa M,Makinoa H,etal.Expression of Akt and Mdm2 in human esophageal squamous cell carcinoma〔J〕.Exp Mol Pathol,2009;87(1):42-7.
12 Pan D,Lin X. Epithelial growth factor receptor-epithelial growth factor receptor-associated tumors〔J〕.Cancer J,2013;19(16):461-7.
13 Malyankar UM,Almeida M,Johnson RJ,etal.Osteopontin regulation in cultured rat renal epithelial cells〔J〕.Kidney Int,1997;51(6):1766-73.
14 Zhang G,Zhao ZQ,Wang HD,etal.Enhancement of osteopontin expression in HepG2 cells by epidermal growth factor via phosphatidylinositol 3-kinase signaling pathway〔J〕.World J Gastroenterol,2004;10(2):205-8.
15 Chakalaparampil I,Peri A,Nemir M,etal.Cells in vivo and in vitro from osteopetrotic mice homozygous for c-src disruption show suppression of synthesis of osteopontin,a multifunctional extracellular matrix protein〔J〕.Oncogene,1996;12(7):1457-67.
16 Tuck AB,Hota C,Wilson SM,etal.Dstepontin-induced migration of human mammary epithelial cells involves activation of egf receptor and multiple singal transduction pathways〔J〕.Oncogene,2003;22(8):1198-205.
17 Matušan-Ilijaš K,Damante G,Fabbro D,etal.EGFR expression is linked to osteopontin and Nf-κB signaling in clear cell renal cell carcinoma〔J〕.Clin Transl Oncol,2012;10(1):12089-94.
18 Loganathan S,Kandala PK,Gupta P,etal.Inhibition of EGFR-AKT axis results in the suppression of ovarian tumors in vitro and in preclinical mouse model〔J〕.PLoS One,2012;7(8):e43577.
19 Wang YY,Yan W,Lu XM,etal.Overexpression of osteopontin induces angiogenesis of endothelial progenitor cells via the avβ3/PI3K/AKT/eNOS/NO signaling pathway in glioma cells〔J〕.Eur J Cell Biol,2011;90(8):642-8.
〔2015-12-02修回〕
(编辑 苑云杰/曹梦园)
索智敏(1969-),女,教授,硕士生导师,主要从事消化道肿瘤临床研究。
张 卉(1980-),女,硕士,主治医师,主要从事消化道肿瘤临床研究。
R735.1
A
1005-9202(2017)06-1432-03;
10.3969/j.issn.1005-9202.2017.06.056

