酚酸对红肉苹果花色苷辅色效果及稳定性的影响
苏帆,薛佳,杨曦,邓红,孟永宏,郭玉蓉
(陕西师范大学食品工程与营养科学学院,西安 710119)
酚酸对红肉苹果花色苷辅色效果及稳定性的影响
苏帆,薛佳,杨曦,邓红,孟永宏,郭玉蓉
(陕西师范大学食品工程与营养科学学院,西安 710119)
【目的】研究酚酸对‘紫红1号’新疆红肉苹果花色苷的辅色效应,以及辅色后花色苷的稳定性,旨在为红肉苹果花色苷利用提供理论依据和参考。【方法】利用超声辅助法提取红肉苹果花色苷,采用pH示差法测定总花色苷含量,高效液相色谱法(HPLC)分析花色苷组分及含量。在pH 3.0缓冲液体系中,分别选用咖啡酸、阿魏酸、绿原酸、没食子酸对红肉苹果花色苷进行辅色,并将不同处理的样品分别置于水浴加热、光照、H2O2氧化和Fe3+4种不同条件下,研究4种酚酸对红肉苹果花色苷的辅色效果和稳定性的影响。【结果】‘紫红1号’红肉苹果中花色苷含量为268.6 mg·kg-1,主要成分为矢车菊-3-半乳糖苷、矢车菊-3-葡萄糖苷、矢车菊-3-阿拉伯糖苷,其中矢车菊-3-半乳糖苷占总花色苷含量的75.34%。在水体系中,红肉苹果花色苷的最大吸收波长为515 nm,花色苷的颜色和515 nm处吸光度(A515nm)随pH变化而改变。浓度为0.01 mol·L-1的咖啡酸、阿魏酸、绿原酸、没食子酸对红肉苹果花色苷均能产生明显的辅色效应,辅色后花色苷溶液产生了不同程度的增色及红移效应(5—11 nm),其中阿魏酸处理组的红移效应最为显著,红移幅度高达11 nm。各试验组样品分别在60℃、80℃、100℃水浴中加热1 h后,绿原酸和没食子酸对红肉苹果花色苷的保护作用最好,其次是阿魏酸和咖啡酸。在室外自然光照条件下,红肉苹果花色苷溶液的半衰期少于7 d,酚酸辅色后,显著增强了花色苷的光稳定性(P<0.05),其中绿原酸使红肉苹果花色苷半衰期延长了170.87%,咖啡酸、没食子酸、阿魏酸分别使花色苷半衰期延长了142.68%、39.56%、23.05%。浓度为0.1%—0.6%的H2O2使红肉苹果花色苷的红色迅速褪去,加入酚酸后花色苷的抗氧化性显著提高,当花色苷溶液中H2O2浓度为0.1%时,氧化1 h后,对照组花色苷保留率仅为38.39%,而阿魏酸、绿原酸、咖啡酸、没食子酸处理组花色苷保留率分别为63.10%、59.95%、57.95%、48.81%,均显著高于对照组(P<0.05)。浓度为2.5×10-4—1.0×10-3mol·L-1的Fe3+对花色苷有不利影响,加入酚酸后花色苷稳定性明显增强,其中没食子酸处理组红肉苹果花色苷稳定性最强,绿原酸、咖啡酸次之,阿魏酸处理组花色苷稳定性最弱,各处理组花色苷A515nm均显著大于对照组花色苷(P<0.05)。【结论】红肉苹果花色苷颜色受pH影响较大,pH<3.0时,色泽鲜红且性质稳定。咖啡酸、阿魏酸、绿原酸、没食子酸使红肉苹果花色苷产生不同程度的增色及红移效应,且显著增强了花色苷在加热、光照、氧化、Fe3+条件下的稳定性。
红肉苹果;花色苷;酚酸;咖啡酸;阿魏酸;绿原酸;没食子酸;辅色;稳定性
0 引言
【研究意义】新疆红肉苹果(Malus sieversiif.neidzwetzkyana(Dieck)Langenf)是新疆野苹果的变型,因富含花色苷,其枝、叶、花、果皮及果肉均为红色[1]。花色苷(anthocyanin)是植物中广泛存在的一类水溶性天然色素[2],具有强抗氧化性、抗炎性,可以抑制癌症、心血管疾病、糖尿病、肥胖等疾病[3-8]。植物花色苷作为一种天然食用色素,资源丰富、安全健康,在食品加工产业中有较好的应用前景。但由于花色苷结构特殊,极易受pH、氧气、光照、温度、酶等因素影响而降解褪色[9-12],导致其应用受到严重制约。辅色是一种常用的提高花色苷稳定性的方法,探究不同酚酸对‘紫红1号’红肉苹果花色苷的辅色作用,以及在加热、光照、氧化和金属离子环境中对花色苷稳定性的影响,对红肉苹果花色苷的加工利用具有重要意义。【前人研究进展】目前,红肉苹果花色苷的组分已有报道,MAZZA等[13]鉴定了红肉苹果‘Scugog’花色苷组分,王燕等[14]鉴定了‘紫红1号’红肉苹果果肉的花色苷成分,两种红肉苹果中的主要花色苷均为矢车菊-3-半乳糖苷、矢车菊-3-葡萄糖苷、矢车菊-3-木糖苷、矢车菊-3-阿拉伯糖苷,但其含量不同。王延玲等[1]以新疆红肉苹果‘夏红肉’为试材,证明了其果皮和果肉中花色苷的主要成分均为矢车菊-3-半乳糖苷,但其积累模式及调控基因的表达情况不同。WANG等[15]测定了4种红肉苹果和两种非红肉苹果中的总酚、花色苷及抗氧化性。在花色苷辅色方面,国内外学者进行了大量研究。EIRO等[16]研究了阿魏酸、咖啡酸、迷迭香酸、绿原酸、芥子酸对5种花色苷单体的辅色作用,5种酚酸使花色苷产生了不同程度的增色和红移效果,且迷迭香酸可以使锦葵-3-葡萄糖苷的颜色增强260%,阿魏酸和咖啡酸可以显著提高天竺葵-3-葡萄糖苷的储藏稳定性。BAKOWSKA等[17]的研究表明绿原酸、槲皮素等酚类均可以提高矢车菊-3-葡萄糖苷的光热稳定性,且黄芩黄酮效果最佳。董楠等[18]研究了咖啡酸对胭脂萝卜红色素辅色作用及其稳定性的影响,试验表明酸性条件下咖啡酸可使花色苷的Aλmax显著增大,并增加了其在光、热及金属离子环境下的稳定性。【本研究切入点】国内外对红肉苹果花色苷的研究多集中于不同品种红肉苹果中花色苷含量、抗氧化性及其果皮果肉呈色机理等方面,迄今尚未见红肉苹果花色苷辅色及其应用的相关报道。【拟解决的关键问题】以‘紫红1号’新疆红肉苹果为原材料,提取、纯化得到红肉苹果花色苷提取物,研究加热、光照、氧化及金属离子对红肉苹果花色苷的影响,以及4种条件下不同酚酸对红肉苹果花色苷稳定性的增强效果,选出最佳辅色剂,为红肉苹果的加工利用提供参考。
1 材料与方法
试验于2016年5—6月在陕西师范大学食品工程与营养科学学院进行。
1.1 材料与试剂
1.1.1 材料 ‘紫红1号’新疆红肉苹果于2015年8月下旬采摘于新疆伊犁,将成熟度相同、大小均一、无病虫害、无机械损伤的果实带柄采摘,采后将果实装入泡沫箱中,低温冷链运输至实验室,将果实置于-20℃冰箱贮藏,待用。
1.1.2 试剂 矢车菊-3-半乳糖苷、矢车菊-3-阿拉伯糖苷、矢车菊-3-葡萄糖苷标准品(色谱纯),上海Sigma公司;阿魏酸、咖啡酸、绿原酸、没食子酸(分析纯),上海源叶生物科技有限公司;三氯化铁(分析纯),天津市科密欧化学试剂有限公司;过氧化氢(分析纯),天津市兴复精细化工研究所。
1.2 试验仪器
真空冷冻干燥机(LGJ-18C),北京四环科学仪器厂;高效液相色谱(Dionex UPLC),Dionex公司(美国);紫外可见分光光度计(UV—2100),Unico公司(美国);全波长酶标仪(Multiskan Go),Thermo公司(美国);层析柱(内径4 cm,长60 cm),西安市碑林区宏业仪器化玻采供站。
1.3 试验设计与方法
1.3.1 提取红肉苹果花色苷 将冷藏的红肉苹果在室温下解冻30 min后,去除果核、果梗,用打浆机破碎3 min,按料液比1∶4(m/V),用60%乙醇溶液(含0.01% HCl)提取。利用超声波辅助提取2 h,超声功率为300 W,温度40℃,抽滤后收集滤液,再次超声提取滤渣,将两次滤液合并,40℃下旋转蒸发至原体积1/4。将浓缩液于4℃冰箱静置12 h,以4 000 r/min为转速,离心10 min,收集上清液。用AB-8大孔树脂进行洗脱,洗脱溶剂为70%乙醇溶液(含0.01% HCl),收集洗脱液于40℃旋转蒸发,-60℃真空冷冻干燥24 h后得到花色苷提取物。
1.3.2 测定红肉苹果总花色苷含量 参照GIUSTI等[19]的方法,使用分光光度计,采用pH示差法测定红肉苹果中总花色苷含量。
1.3.3 鉴定红肉苹果花色苷成分及含量 参照陈磊[20]的方法,将花色苷样品溶于70%甲醇溶液(pH 3.0),经0.22 µm的有机系滤膜过滤。使用Dionex UPLC液相分析系统(Dionex,美国)和Dikma HPLC柱(250 mm×4.6 mm,5 µm);流动相溶液A为乙腈(色谱纯),流动相溶液B为1‰三氟乙酸。柱温:30℃;流动相速度:1.0 mL·min-1,进样量:20.0 μL,按表1程序进行梯度洗脱,在500 nm波长下进行红肉苹果花色苷成分的检测。重复3次进样。

表1 花色苷HPLC梯度洗脱程序Table 1 The HPLC gradient elution procedure of anthocyanin
1.3.4 不同pH对红肉苹果花色苷吸收光谱的影响配制pH 1.0—7.0的红肉苹果花色苷溶液(1.0 mg·mL-1),用全波长酶标仪对其进行波长扫描(400—700 nm),绘制特征吸收光谱。
1.3.5 不同酚酸对红肉苹果花色苷吸收光谱的影响称取0.2500 g红肉苹果花色苷粉末于250 mL容量瓶中,用pH 3.0磷酸缓冲液(0.2 mol·L-1)定容,使花色苷浓度为1.0 mg·mL-1。将一定量咖啡酸、阿魏酸、绿原酸和没食酸溶于0.5 mL无水乙醇后,分别加入9.5 mL花色苷溶液中混匀,使样品溶液中辅色剂浓度为0.01 mol·L-1。配制5种溶液:对照组花色苷溶液、咖啡酸处理溶液、阿魏酸处理溶液、绿原酸处理溶液、没食子酸处理溶液,用全波长酶标仪对红肉苹果花色苷溶液进行波长扫描(450—650 nm),绘制特征吸收光谱。
1.3.6不同酚酸对红肉苹果花色苷稳定性影响
(1)热稳定性
配制1.3.5所述5种溶液,测定其在λmax处吸光度后,分别倒入10 mL旋盖离心管中,拧紧旋盖,做好标记。将各试验组样品分别置于60℃、80℃、100℃水浴加热1 h,迅速冷却后,用酶标仪测定其吸光度。每个样品进行3次平行试验,结果取平均值。
(2)光照稳定性
配制1.3.5所述5种溶液,测定其在λmax处吸光度后,分别倒入10 mL旋盖离心管中,拧紧旋盖,做好标记。将各试验组样品置于实验室窗台自然光下(白天室外平均气温30℃),每4天取一次样,用酶标仪测定其吸光度。每个样品进行3次平行试验,结果取平均值。
(3)氧化稳定性
配制1.3.5所述5种溶液,测定其在λmax处吸光度后,分别倒入10 mL旋盖离心管中,加入一定体积的H2O2(30%),使样品溶液中H2O2浓度分别为0.1%、0.3%、0.6%。用酶标仪测定各试验组样品在1 h内吸光度变化(每10 min测一次),室温25℃。每个样品进行3次平行试验,结果取平均值。
(4)金属离子稳定性
称取0.1250 g红肉苹果花色苷粉末于250 mL容量瓶中,用蒸馏水定容,使花色苷浓度为0.5 mg·mL-1。将一定量咖啡酸、阿魏酸、绿原酸和没食子酸溶于0.5 mL无水乙醇后,分别加入9.5 mL花色苷溶液中混匀,使样品溶液中辅色剂浓度为0.01 mol·L-1。随后加入硫酸亚铁、三氯化铁、硫酸铜、三氯化铝溶液,由于Fe2+、Cu2+、Al3+对红肉苹果花色苷颜色影响不明显,故选用Fe3+对花色苷进行处理。在各组花色苷中加入三氯化铁溶液,使Fe3+浓度为2.5×10-4、5.0×10-4、1.0 ×10-3mol·L-1,并用HCl调至pH 3.0,于室温(25℃)下静置3 h后,用酶标仪测定各试验组吸光度。每个样品进行3次平行试验,结果取平均值。
1.3.7 红肉苹果花色苷保留率[18]及半衰期[21]计算

式中:A1表示处理后溶液在λmax处吸光度;A0表示原始吸光度;R表示花色苷保留率;k表示一级反应速率;t1/2表示半衰期,即花色苷降解一半所用时间。
1.3.8 统计与分析 数据统计与分析采用DPS 7.05软件,多重比较采用Duncan新复极差法(P<0.05为差异显著)。采用Origin 8.0软件绘制图表。
2 结果
2.1 红肉苹果花色苷含量分析结果
红肉苹果花色苷的最大吸收波长为515 nm,通过pH示差法测得红肉苹果中花色苷含量为268.6 mg·kg-1,与王燕[14]测定‘紫红1号’红肉苹果花色苷的含量228.3 mg·kg-1相近。
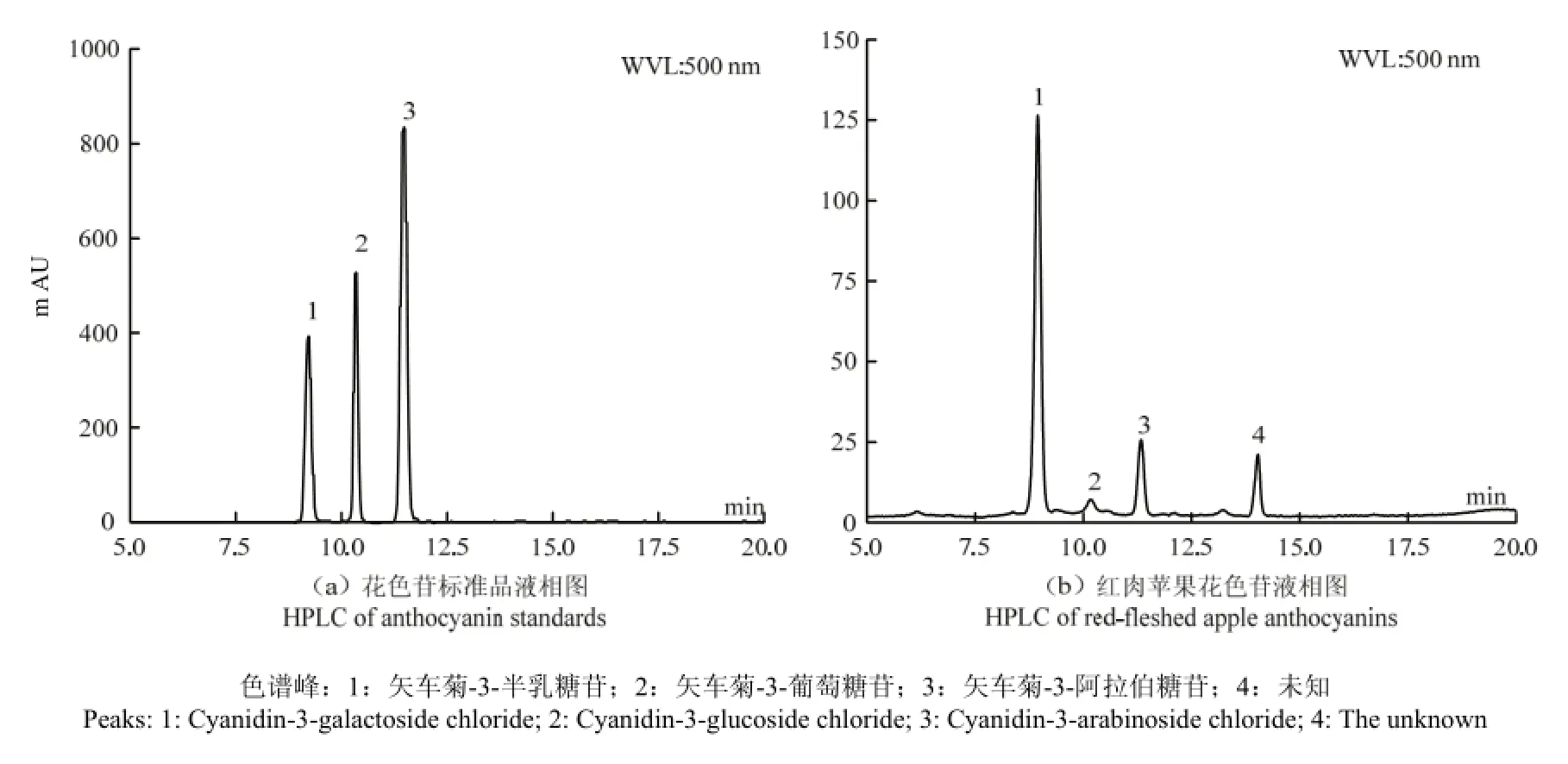
图1 红肉苹果花色苷组成分析Fig. 1 Analysis of constituents in red-fleshed apple anthocyanins
由图1可知,红肉苹果花色苷中主要成分为矢车菊-3-半乳糖苷、矢车菊-3-葡萄糖苷、矢车菊-3-阿拉伯糖苷。矢车菊-3-半乳糖苷标准曲线为y=52984x+ 2003.6,R²=0.9998,计算可得红肉苹果中矢车菊-3-半乳糖苷含量为202.4 mg·kg-1,占总花色苷含量的75.34%,与王燕[14]测定的73.37%基本一致。
2.2 pH对红肉苹果花色苷吸收光谱的影响
红肉苹果花色苷的颜色受pH影响较大,在pH<3.0的酸性溶液中,花色苷呈深红色;当pH逐渐升高时,花色苷的颜色由红色变为淡粉色;当pH>5.0时,花色苷溶液变成黄褐色。如图2,在pH 1.0—5.0磷酸缓冲溶液中,红肉苹果花色苷的最大吸收波长均为515 nm。随着pH增大,花色苷溶液在515nm处的吸光度显著减小(P<0.05);当pH>5.0时,花色苷特征吸收峰消失。

图2 不同pH对红肉苹果花色苷吸收光谱影响Fig. 2 The absorption spectra of red-fleshed apple anthocyanins at different pH values
2.3 不同酚酸对红肉苹果花色苷吸收光谱的影响
在红肉苹果花色苷溶液(pH 3.0)中加入4种酚酸后溶液pH保持稳定,红肉苹果花色苷产生了明显的增色效应和红移现象。如图3所示,处理组花色苷的最大吸光度()均显著高于对照组花色苷(P<0.05),4种酚酸均使红肉苹果花色苷在最大吸收波长处的吸光度增加10%以上。咖啡酸、阿魏酸、绿原酸和没食子酸分别使花色苷最大吸收波长由515 nm变为525、526、524和520 nm,即△分别为10、11、9和5 nm。
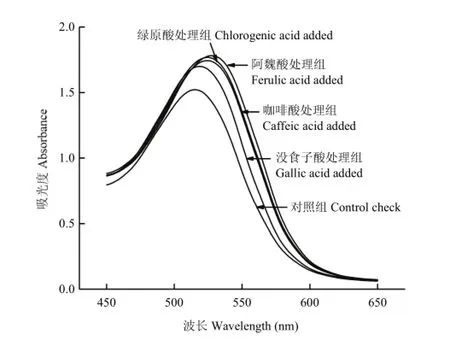
图3 不同酚酸对红肉苹果花色苷吸收光谱的影响Fig. 3 The absorption spectra of red-fleshed apple anthocyanins
2.4 酚酸辅色对红肉苹果花色苷热稳定性的影响
不同温度下加热1 h后,对照组和处理组红肉苹果花色苷的最大吸光度()均显著减小(P<0.05),加热过程中,咖啡酸处理组花色苷的△λmax稍有减小,其他各组花色苷的△基本保持不变。
如图4所示,加热前和加热后,各处理组花色苷的吸光度均显著大于对照组花色苷(P<0.05)。加热温度为60℃时,绿原酸、没食子酸和阿魏酸处理组花色苷的吸光度无显著差异(P>0.05),且大于咖啡酸处理组;80℃时,绿原酸和没食子酸处理组花色苷的吸光度最大且无显著差异(P>0.05),与其余各试验组间存在显著差异(P<0.05);100℃时,绿原酸和没食子酸处理组间无显著差异(P>0.05),阿魏酸和咖啡酸处理组也无显著差异(P>0.05)。
综上所述,在加热条件下,绿原酸和没食子酸可使红肉苹果花色苷溶液保留最大吸光度。
2.5 酚酸辅色对红肉苹果花色苷光照稳定性的影响
在室外自然光照条件下,红肉苹果花色苷很不稳定,容易降解褪色。光照过程中,各试验组花色苷的持续减小,△也有所减小。如图5所示,光照20 d后,对照组花色苷的红色已完全褪尽,咖啡酸处理组呈橙红色,阿魏酸处理组仅有少量红色残余,绿原酸处理组红色较深,没食子酸处理组呈淡红色。
如图6所示,光照0—16 d时,红肉苹果花色苷降解速率较快,16—20 d时,花色苷降解趋于平缓。第20天时,绿原酸处理组花色苷的吸光度显著高于咖啡酸、没食子酸、阿魏酸处理组及空白组花色苷,各试验组间均呈显著性差异(P<0.05)。
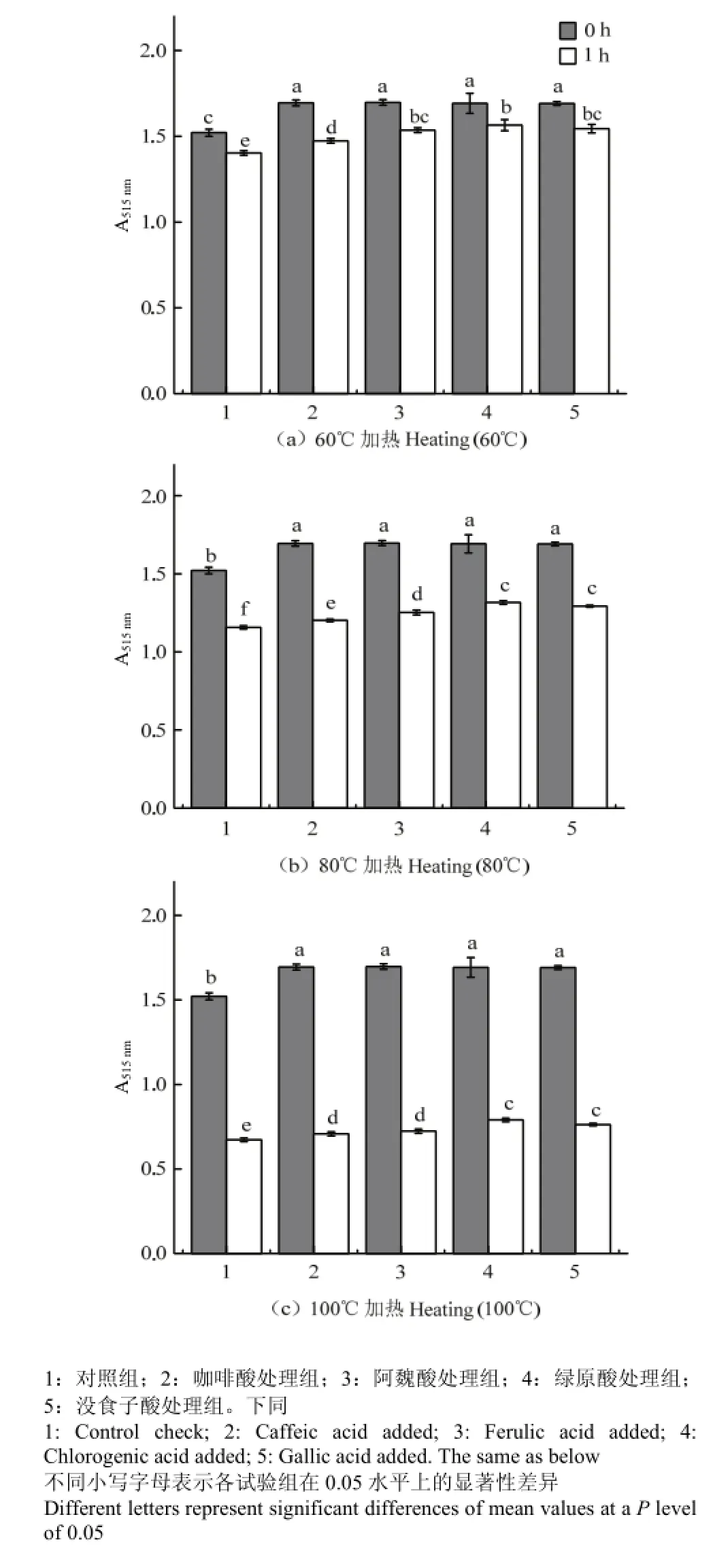
图4 不同酚酸对红肉苹果花色苷热稳定性的影响Fig. 4 Effect of phenolic acids on stability of red-fleshed apple anthocyanins at different temperatures
红肉苹果花色苷的光降解符合一级动力学反应方程,OCHOA等[22]发现光对树莓、甜樱桃及欧洲酸樱桃中花色苷的降解也为一级动力学反应。如图7所示,自然光照下,红肉苹果花色苷降解速率较快,酚酸辅色减缓了花色苷降解速率,绿原酸处理组花色苷降解速率最慢,其次是咖啡酸、没食子酸、阿魏酸处理组,对照组花色苷降解速率最快。
如表2所示,光照条件下空白花色苷半衰期少于7 d,4种酚酸显著(P<0.05)增强了花色苷的光照稳定性。其中,绿原酸对红肉苹果花色苷的保护作用最佳,使其半衰期延长了170.87%,咖啡酸、没食子酸、阿魏酸辅色分别使花色苷半衰期延长了142.68%、39.56%、23.05%。
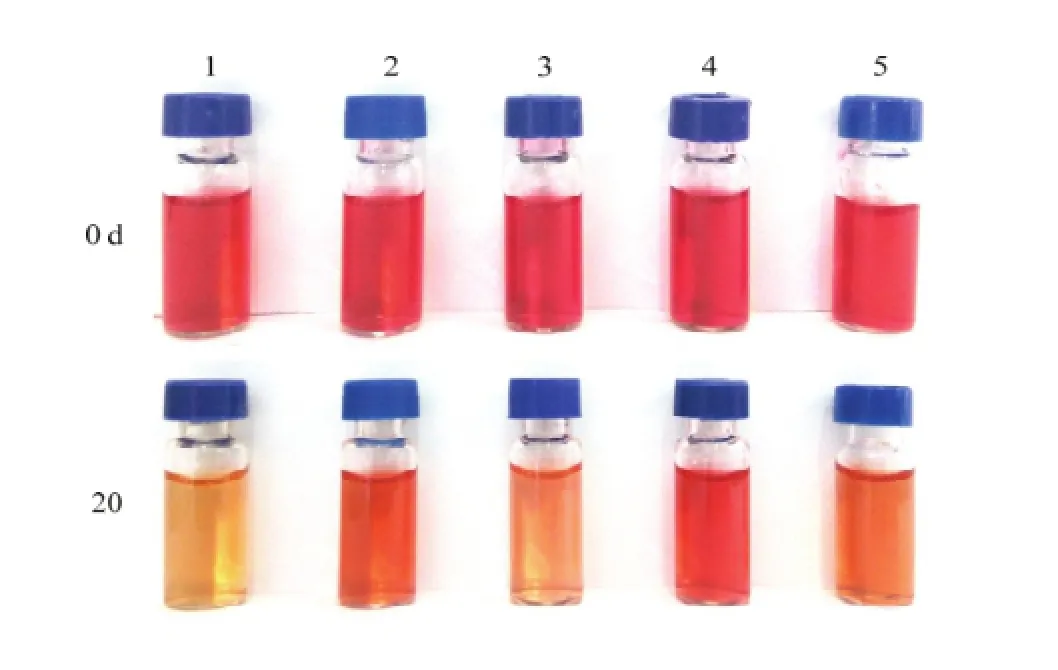
图5 光照前后花色苷的颜色变化Fig. 5 The picture of red-fleshed apple anthocyanins solution before and after lighting
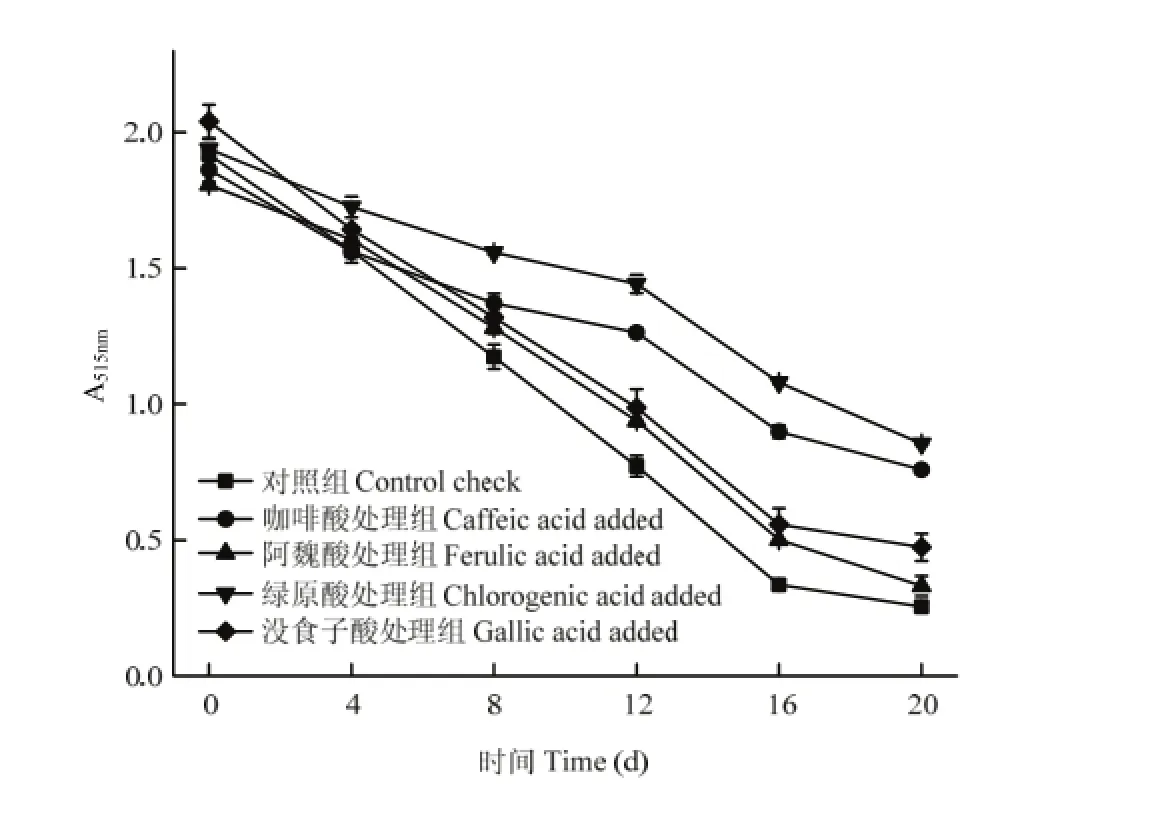
图6 不同酚酸对红肉苹果花色苷吸光度的影响Fig. 6 Effect of phenolic acids on absorbance of red-fleshed apple anthocyanins in light
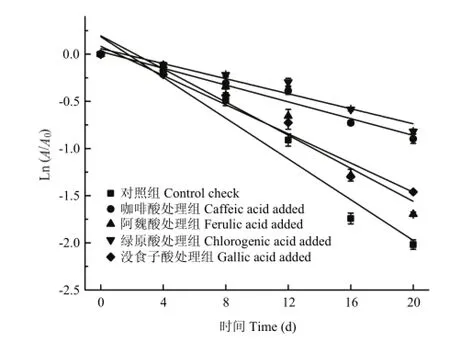
图7 不同酚酸对红肉苹果花色苷光降解速率的影响Fig. 7 Effect of phenolic acids on degradation speed of redfleshed apple anthocyanins in light
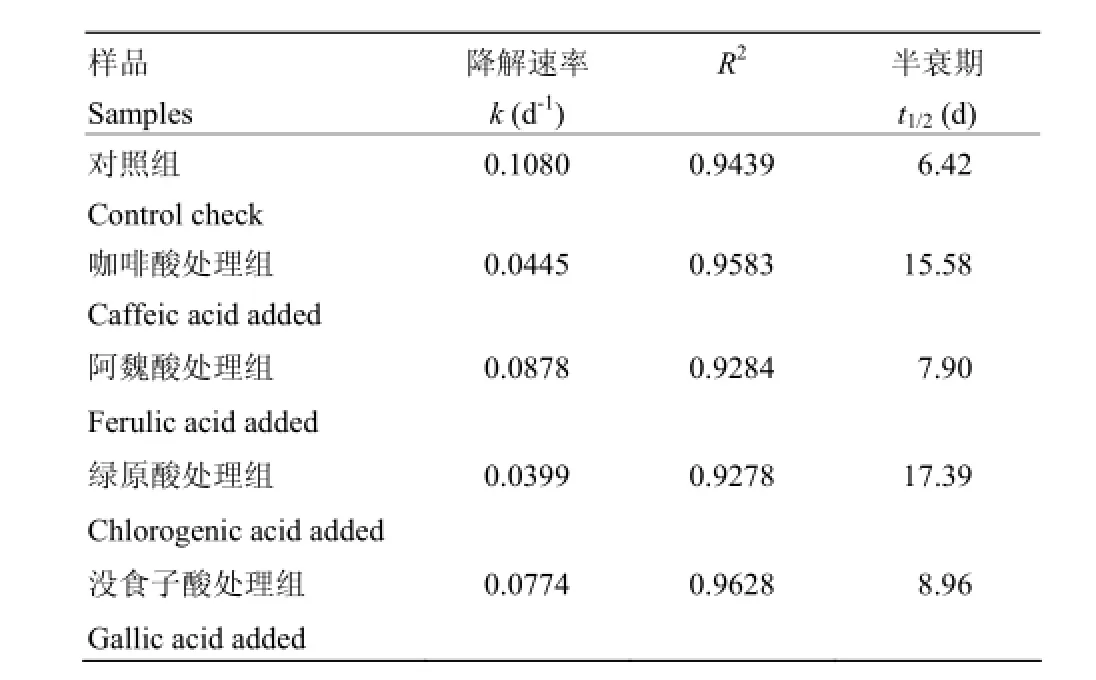
表2 红肉苹果花色苷的降解动力学参数Table 2 Degradation kinetics parameters of red-fleshed apple anthocyanins with different phenolic acids
2.6 酚酸辅色对红肉苹果花色苷氧化稳定性的影响
红肉苹果花色苷溶液中加入H2O2,氧化10 min后,各试验组的Aλmax显著减小(P<0.05),△λmax保持不变。如图8-a所示,样品中H2O2浓度为0.1%时,花色苷氧化速率稍慢,60 min后,对照组花色苷保留率为38.39%,阿魏酸、绿原酸、咖啡酸、没食子酸处理组保留率显著高于对照组(P<0.05),分别为63.10%、59.95%、57.95%、48.81%。
如图8-b所示,H2O2浓度为0.3%时,花色苷氧化速率加快,4种酚酸辅色样品的花色苷保留率均显著高于空白对照组(P<0.05)。反应60 min后,对照组花色苷保留率仅为15.05%;阿魏酸处理组的抗氧化效果最佳,花色苷保留率约为对照组的2倍(30.28%);咖啡酸和绿原酸处理组次之,花色苷保留率分别为27.68%、26.66%;没食子酸处理组的抗氧化效果较弱,花色苷保留率为18.89%。
如图8-c所示,H2O2浓度为0.6%时,红肉苹果花色苷迅速褪色,酚酸显著减缓了花色苷的氧化程度(P<0.05)。氧化60 min后,对照组花色苷保留率仅为10.86%,阿魏酸处理组的抗氧化作用最佳,咖啡酸和绿原酸处理组次之,没食子酸处理组的抗氧化作用较弱,花色苷保留率分别为17.19%、15.81%、14.54%、11.85%。
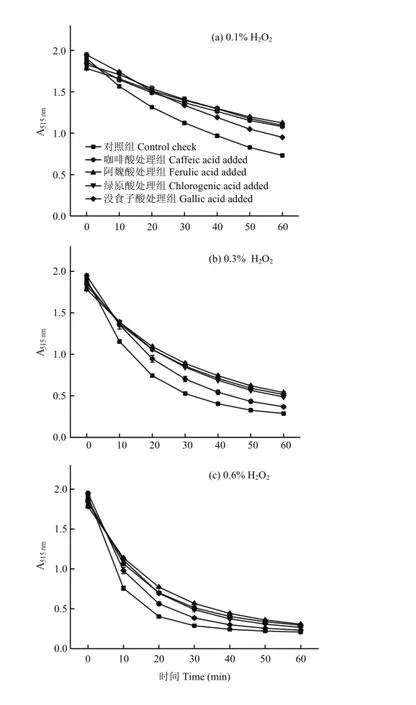
图8 不同酚酸对红肉苹果花色苷氧化稳定性的影响Fig. 8 Effect of phenolic acids on stability of red-fleshed apple anthocyanins in H2O2
2.7 酚酸辅色对红肉苹果花色苷金属离子稳定性的影响
Fe3+对红肉苹果花色苷有不利影响,XIONG等[23]的试验证明Fe3+对黑加仑花色苷也有破坏作用。如图9所示,Fe3+的浓度为2.5×10-4mol·L-1时,对照组红肉苹果花色苷颜色变浅,酚酸处理组样品几乎未受影响;浓度为5.0×10-4mol·L-1时,对照组花色苷颜色变浅、变暗,酚酸处理组颜色变暗仍保留较好的红色;浓度为1.0×10-3mol·L-1时,对照组花色苷迅速变黑(失去特征吸收峰),酚酸处理组样品变为较暗的深红色(仍存在最大吸收峰)。
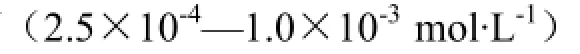
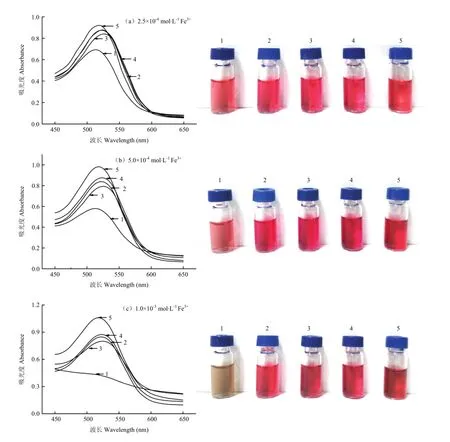
图9 不同酚酸对红肉苹果花色苷金属离子稳定性的影响Fig. 9 Effect of phenolic acids on stability of red-fleshed apple anthocyanins in Fe3+
3 讨论
3.1 pH对红肉苹果花色苷的影响
红肉苹果花色苷在不同pH条件下呈现出不同的颜色,这与其结构变化有关。当溶液酸性很强(pH<3.0)时,由于黄烊盐正离子(AH+)占主导地位[24],红肉苹果花色苷呈深红色。随着pH升高(pH 4.0—5.0),黄烊盐正离子被水亲核攻击变成无色的甲醇假碱[18],红肉苹果花色苷溶液红色减弱。当pH继续升高(pH 6.0—7.0)时,甲醇假碱失去A-环和B-环之间的共轭双键变为查耳酮,因此不能吸收可见光[25],红肉苹果花色苷溶液失去特征性吸收峰。
3.2 酚酸对红肉苹果花色苷的辅色效果
本研究发现,4种酚酸均使红肉苹果花色苷产生了显著的增色和红移效果。这可能是因为酚酸与花色苷发生了分子间辅色,两者以非共价键和氢键结合,形成水平[26]或垂直重叠[27]的复合物,使红肉苹果花色苷呈色加强。“花色苷-辅色剂”分子间上下叠加的π-π共轭作用及一些氢键作用使花色苷极性或电子分布下降,使其在可见光范围内的最大吸收波长红移[28]。辅色效应随花色苷的糖基化、甲氧基化程度增大而增强[29],而羟基化会减弱辅色效应[16]。咖啡酸和阿魏酸是肉桂酸,且阿魏酸有一个甲氧基,绿原酸是共轭肉桂酸的衍生物,没食子酸是三羟基苯甲酸,4种酚酸结构不同,因而产生了不同的辅色效应。本试验中,咖啡酸、阿魏酸、绿原酸、没食子酸使红肉苹果花色苷最大吸收波长红移了10、11、9和5 nm,与EIRO等[16]对矢车菊-3-葡萄糖苷辅色的研究结果相近。
3.3 酚酸对红肉苹果花色苷稳定性的影响
温度对红肉苹果花色苷稳定性影响较大,温度越高,花色苷越不稳定。本试验中,红肉苹果花色苷溶液在60℃水浴条件下降解速率最慢,随着温度升高,花色苷降解速率加快,在100℃条件下红肉苹果花色苷降解速率最快。KAMERER等[30]认为加热过程中花色苷存在着结构互变,黄烊盐离子水化为假碱以及假碱转化为查耳酮均为吸热反应,随着温度升高,平衡向吸热方向进行,当假碱和查尔酮结构为花色苷的主要存在形式时,花色苷溶液褪色。在不同温度条件下加热1 h后,处理组花色苷的吸光度显著(P<0.05)高于对照组花色苷,可能是因为辅色剂和花色苷的分子间作用力减弱了花色苷的热降解作用[31],增强了花色苷的热稳定性。MAZZA等[29]认为花色苷和辅色剂间的反应是放热过程,高温会使“花色苷-辅色剂”分解为无色的混合物。因此,本试验中,酚酸对红肉苹果花色苷的辅色效果随温度升高而有所减弱,KUCHARSKA等[32]也有相似的研究结果。
红肉苹果花色苷对光敏感,光照条件下极易褪色,这可能是因为基态的花色苷吸收光能后转变为激发态的花色苷,激发态的花色苷水解开环形成中间产物,随后继续降解为酚酸和醛类[33],失去色泽。本研究得出,红肉苹果花色苷在室外自然光照下的半衰期(t1/2)仅约为6 d,绿原酸、咖啡酸分别使其半衰期延长了170.87%和142.68%。这与BAKOWSKA[17]、YAN[34]、XU[31]等的试验结果相似,说明酚酸辅色能够有效抑制光照引起的花色苷降解,提高花色苷的光稳定性。此外,由于酚酸本身具有抗紫外光的能力,游离于溶液中时可优先吸收紫外线(UV),因而减少对花色苷的破坏[35]。
H2O2可以使红肉苹果花色苷降解,ÖZKAN等[36]研究发现其作用机制主要是H2O2裂解生成了大量的·OH和·OOH自由基,使花色苷苯环被破坏,迅速褪色。而咖啡酸、阿魏酸、绿原酸、没食子酸均为酚酸类化合物,具有还原性,可与H2O2发生氧化还原反应,减少·OH等自由基的产生,保护花色苷不被降解。本研究中4种酚酸均显著(P<0.05)减弱了H2O2对红肉苹果花色苷的氧化作用。
本试验证明,Fe3+对红肉苹果花色苷有一定的破坏作用,浓度越高,破坏作用越强;在Fe3+离子浓度相同情况下,4种酚酸对红肉苹果花色苷产生了较好的保护效果。XIONG等[23]研究表明,有氧条件下Fe3+催化花色苷发生氧化反应,而酚酸中的酚羟基作为供电子基团具有强抗氧化性,有效减弱了花色苷的氧化分解。
4 结论
红肉苹果花色苷的颜色受pH影响较大,强酸(pH<3.0)环境更利于其加工储藏。咖啡酸、阿魏酸、绿原酸、没食子酸4种酚酸对红肉苹果花色苷有明显增色作用和红移效果,并能显著提高红肉苹果花色苷的稳定性。加热条件下,绿原酸和没食子酸对红肉苹果花色苷溶液具有较好的保护作用;光照时,绿原酸对红肉苹果花色苷的降解具有最佳抑制效果;阿魏酸可有效防止红肉苹果花色苷在H2O2中的氧化;没食子酸可以显著减少Fe3+对红肉苹果花色苷的不利影响。
[1] 王延玲, 张艳敏, 冯守千, 宋杨, 徐玉亭, 张友朋, 陈学森. 新疆红肉苹果果皮果肉呈色差异机理. 中国农业科学, 2012, 45(13): 2771-2778.
WANG Y L, ZHANG Y M, FENG S Q, SONG Y, XU Y T, ZHANG Y P, CHEN X S. The mechanism of red coloring difference between skin and cortex inMalus sieversiif.neidzwetzkyana(Dieck) Langenf.Scientia Agricultura Sinica, 2012, 45(13): 2771-2778. (in Chinese)
[2] WANG H, CAO G, PRIOR R L. Oxygen radical absorbing capacity of anthocyanins.Journal of Agricultural and Food Chemistry, 1997, 45: 304-309.
[3] DIACONEASA Z, LEOPOLD L, RUGINA D, AYVAZ H, SOCACIU C. Antiproliferative and antioxidant properties of anthocyanin rich extracts from blueberry and blackcurrant juice.International Journal of Molecular Sciences, 2015, 16(2): 2352-2365.
[4] KIKURA M, LEVY J H, SAFON R A, LEE M K, SZLAM F. The influence of red wine or white wine intake on platelet function and viscoelastic property of blood in volunteers.Platelets, 2004, 15(1): 37-41.
[5] CHABIR N, IBRAHIM H, ROMDHANE M, VALENTIN A, MOUKARZEL B, MARS M, BOUAJILA J. Seeds ofPeganum harmalaL. Chemical analysis, antimalarial and antioxidant activities, and cytotoxicity against human breast cancer cells.Medicinal Chemistry, 2015, 11(1): 94-101.
[6] JENNINGS A, WELCH A A, FAIRWEATHER-TAIT S J, KAY C, MINIHANE A M, CHOWIENCZYK P, JIANG B, CECELJA M, SPECTOR T, MACGREGOR A, CASSIDY A. Higher anthocyanin intake is associated with lower arterial stiffness and central blood pressure in women.The American Journal of Clinical Nutrition, 2012, 96(4): 781-788.
[7] XIAO J B, CHEN X Q, JIANG X Y, HILCZER M, TACHIYA M. Probing the interaction of trans-resveratrol with bovine serum albumin: A fluorescence quenching study with tachiya model.Journal of Fluorescence, 2008, 18(3/4): 671-678.
[8] BENN T, KIM B, PARK Y K, WEGNER C J, HARNESS E, NAM T G, KIM D O, LEE J S, LEE J L. Polyphenol-rich blackcurrant extract prevents inflammation in diet-induced obese mice.Journal of Nutritional Biochemistry, 2014, 25(10): 1019-1025.
[9] CASTAÑEDA-OVANDO A, PACHECO-HERNÁNDEZ M D L, PÁEZ-HERNÁNDEZ M E, RODRÍGUEZ J A,GALÁN-VIDAL C A. Chemical studies of anthocyanins: A review.Food Chemistry, 2009, 113(4): 859-871.
[10] BORDENAVE N, HAMAKER B R, FERRUZZI M G. Nature and consequences of non-covalent interactions between flavonoids and macronutrients in foods.Food & Function, 2014, 5(1): 18-34.
[11] HUBBERMANN E M, HEINS A, STOCKMANN H, SCHWARZ K. Influence of acids, salt, sugars and hydrocolloids on the colour stability of anthocyanin rich black currant and elderberry concentrates.European Food Research and Technology, 2006, 223(1): 83-90.
[12] JAKOBEK L. Interactions of polyphenols with carbohydrates, lipids and proteins.Food Chemistry, 2015, 175: 556-567.
[13] MAZZA G, VELIOGLU Y S. Anthocyanins and other phenolic compounds in fruits of red-flesh apples.Food Chemistry, 1992, 43(2): 113-117.
[14] 王燕, 陈学森, 刘大亮, 王传增, 宋杨, 陈晓流, 张艳敏.‘紫红1号’红肉苹果果肉抗氧化性及花色苷分析. 园艺学报, 2012, 39(10): 1991-1998.
WANG Y, CHEN X S, LIU D L, WANG C Z, SONG Y, CHEN X L, ZHANG Y M. Antioxidant activity and anthocyanins analysis of pulp in ‘Zihong 1’ red-flesh apple.Acta Horticulturae Sinica, 2012, 39(10): 1991-1998. (in Chinese)
[15] WANG X Q, LI C, LIANG D, ZOU Y, LI P, MA F. Phenolic compounds and antioxidant activity in red-fleshed apples.Journal of Functional Foods, 2015, 18: 1086-1094.
[16] EIRO M J, HEINONEN M. Anthocyanin color behavior and stability during storage: effect of intermolecular copigmentation.Journal of Agricultural and Food Chemistry. 2002, 50: 7461-7466.
[17] BAKOWSKA A, KUCHARSKA A Z, OSZMIANSKI J. The effects of heating, UV irradiation, and storage on stability of the anthocyaninpolyphenol copigment complex.Food Chemistry, 2003, 81: 349-355.
[18] 董楠, 宋会歌, 刘嘉, 赵国华. 咖啡酸对胭脂萝卜红色素辅色作用及稳定性的影响. 食品科学, 2011, 32(7): 61-64.
DONG N, SONG H G, ZHAO G H. Effect of caffeic acid on co-pigmentation and stability of kermes radish red pigment.Food Science, 2011, 32(7): 61-64. (in Chinese)
[19] GIUSTI M M, WROLSTAD R E. Characterization and measurement of anthocyanins by UV-visible spectroscopy.Protocols in Food Analytical Chemistry, 2001. DOI: 10.1002/0471142913.
[20] 陈磊. 采前ALA/GNT处理和气调贮藏方式对苹果花青苷及相关基因表达的影响[D]. 西安: 陕西师范大学, 2015.
CHEN L. The effect of the compound treatment of ALA/GNT at pre-harvest period and controlled atmosphere storage on apple Anthocyanins and the related gene expression [D]. Xi’an: ShaanxiNormal University, 2015. (in Chinese)
[21] ÖZKAN M. Degradation of anthocyanins in sour cherry and pomegranate juices by hydrogen peroxide in the presence of added ascorbic acid.Food Chemistry, 2002, 78(4): 499-504.
[22] OCHOA M R, KESSELER A G, DE MICHELIS A, MUGRIDGE A, CHAVES A R. Kinetics of colour change of raspberry, sweet (Prunus avium) and sour (Prunus cerasus) cherries preserves packed in glass containers: light and room temperature effects.Journal of Food Engineering, 2001, 49(1): 55-62.
[23] XIONG S Y, MELTON L D, EASTEAL A J, SIEW D. Stability and antioxidant activity of black currant anthocyanins in solution and encapsulated in glucan gel.Journal of Agricultural and Food Chemistry, 2006, 54(17): 6201-6208.
[24] GARCÍA-VIGUERA C, BRIDLE P. Influence of structure on colour stability of anthocyanins and flavylium salts with ascorbic acid.Food Chemistry, 1999, 64(1): 21-26.
[25] 王锋, 邓洁红, 谭兴和, 张礼红, 钟浩, 李清明. 花色苷及其共色作用研究进展. 食品科学, 2008, 29(2): 472-476.
WANG F, DENG J H, TAN X H, ZHANG L H, ZHONG H, LI Q M. Research Progress on Anthocyanins and Copigmentation.Food Science, 2008, 29(2): 472-476. (in Chinese)
[26] CHEN H G, HRAZDINA G. Structural aspects of anthocyaninflavonoid complex formation and its role in plant color.Phytochemistry, 1981, 20(2): 297-303.
[27] GOTO T, HOSHINO T, TAKASE S. A proposed structure of commelinin, a sky-blue anthocyanin complex obtained from the flower petals of commelina.Tetrahedron Letters, 1979, 20(31): 2905-2908.
[28] 凌文华, 郭红辉. 植物花色苷. 北京:科学出版社, 2009: 57-67.
LI W H, GUO H H.Plant Anthocyanins. Beijing: Science Press, 2009: 57-67. (in Chinese)
[29] MAZZA G, BROUILLARD R. The mechanism of co-pigmentation of anthocyanins in aqueous solutions.Phytochemistry, 1990, 29(4): 1097-1102.
[30] KAMMERER D R, SCHILLMÖLLER S, MAIER O, SCHIEBERA, CARLE R. Colour stability of canned strawberries using black carrot and elderberry juice concentrates as natural colourants.European Food Research and Technology, 2007, 224(6): 667-679.
[31] XU H G, LIU X, YAN Q L, YUAN F, GAO Y X. A novel copigment of quercetagetin for stabilization of grape skin anthocyanins.Food Chemistry, 2015, 166: 50-55.
[32] KUCHARSKA A Z, OSZMIANSKI J, KOPACZ M, LAMERZARAWSKA E. Application of flavonoids for anthocyanins stabilization//Conference of Flavonoids and Their Employment. Rzeszow, Poland, 1998.
[33] 宋会歌, 刘美艳, 董楠, 张予沛, 赵国华. 食品中花色苷降解机制研究进展. 食品科学, 2011, 32(13): 355-359.
SONG H G, LIU M Y, DONG N, ZHANG Y P, ZHAO G H. Research progress on degradation mechanisms of anthocyanins in foods.Food Science, 2011, 32(13): 355-359. (in Chinese)
[34] YAN Q L, ZHANG L H, ZHANG X F, LIU X, YUAN F, HOU H Q, GAO Y X. Stabilization of grape skin anthocyanins by copigmentation with enzymatically modified isoquercitrin (emiq) as a copigment.Food Research International, 2013, 50: 603-609.
[35] PALAMIDIS N, MARKAKIS P. Stability of grape anthocyanin in a carbonated beverage.Journal of Food Science, 1975, 40(5): 1047-1049.
[36] ÖZKAN M, YEMENICIOĞLU A, CEMEROĞLU B. Degradation of various fruit juice anthocyanins by hydrogen peroxide.Food Research International, 2005, 38(8): 1015-1021.
(责任编辑 赵伶俐)
Effects of Phenolic Acids on Copigmentation and Stability of Anthocyanins in Red-Fleshed Apple
SU Fan, XUE Jia, YANG Xi, DENG Hong, MENG YongHong, GUO YuRong
(College of Food Engineering and Nutritional Science, Shaanxi Normal University, Xi’an 710119)
【Objective】‘Zihong NO.1’ red-fleshed apple is cultivated widely in Xinjiang Autonomous Region of China. Through investigating copigmentation of phenolic acids on anthocyanins in red-fleshed apple and their stability, this paper aims at providing a theoretical basis and reference for industrial utilization of red-fleshed apple anthocyanins. 【Method】 Ultrasonic-assistedmethod was used to extract anthocyanins, and pH differential method was adopted to determine the total content of red-fleshed apple anthocyanins. Besides, the constituents of red-fleshed apple anthocyanins and content of monomeric anthocyanins were also analyzed by HPLC. In phosphate buffer (pH 3.0) of red-fleshed apple anthocyanins, the copigmentation effect of these four acids was evaluated. The absorption spectra and absorbance at λmaxof all treatment groups as well as the contrast groups were measured before and after the treatments of heating, light exposure, oxidation and adding metal ions (Fe3+).【Result】The content of total anthocyanins in red-fleshed apple is 268.6 mg·kg-1and mainly consist of cyanidin-3-galactoside, cyanidin-3-arabinoside and cyanidin-3-glucoside, and cyanidin-3-galactoside accounts for the largest proportion of 75.34%. The wavelength of maximum absorption of red-fleshed apple anthocyanins in water system is at 515 nm, and the color and A515mnof red-fleshed apple anthocyanins change due to different pH values. At the concentration of 0.01 mol·L-1, caffeic acid, ferulic acid, chlorogenic acid and gallic acid all showed evident copigmentation, which led to the phenomena of hyperchromic effect and the bathochromic shift in varying degrees. Especially, ferulic acid caused the greatest extent of redshift (11nm) in anthocyanins solution. After anthocyanins was heated in water-bath at 60℃, 80℃, and 100℃ for one hour, respectively, chlorogenic acid and gallic acid showed the best protection effect, which is better than caffeic acid and ferulic acid. Under the natural lighting, the half-life of anthocyanins solution without copigments was less than 7 days, while the stabilities of anthocyanins with phenolic acids as copigments increased evidently (P<0.05). The half-life of anthocyanins with chlorogenic acid, caffeic acid, gallic acid, and ferulic acid increased by 170.87%, 142.68%, 39.56% and 23.05%, respectively. When the concentration of H2O2in anthocyanins solution was at a range of 0.1%-0.6%, anthocyanins was oxidized rapidly, but phenolic acids can protect anthocyanins from oxidation apparently. After being oxidized by 0.1% H2O2for one hour, the content of anthocyanins in contrast group decreased to 38.39%, however, the retention rate of treatment groups with caffeic acid, ferulic acid, chlorogenic acid and gallic acid were 57.95%, 63.10%, 59.95% and 48.81%, respectively. The solution of Fe3+with concentration of 2.5×10-4-1×10-3mol·L-1had an adverse effect on anthocyanins color. In the solution containing Fe3+, the stability of anthocyanins with gallic acid as copigment was the highest. Additionally, the A515nmof treatment groups were higher than contrast group (P<0.05). 【Conclusion】The color of red-fleshed apple anthocyanins depends on pH value of solutions obviously. The property of anthocyanins remained stable and the color kept bright red when pH<3.0. Caffeic acid, ferulic acid, chlorogenic acid and gallic acid showed varying degrees of hyperchromic effect and the bathochromic shift on red-fleshed apple anthocyanins and evidently improved the stability of anthocyanins (P<0.05) under various conditions of heating, light exposure, oxidation and adding metal ion of Fe3+.
red-fleshed apple; anthocyanins; phenolic acids; caffeic acid; ferulic acid; chlorogenic acid; gallic acid; copigmentation; stability
10.3864/j.issn.0578-1752.2017.04.013
2016-07-19;接受日期:2016-10-25
国家现代农业产业技术体系建设专项(CARS-28)
联系方式:苏帆,E-mail:sufan.stella@hotmail.com。通信作者郭玉蓉,Tel:029-85310471;E-mail:guoyurong730@163.com

