三氯乙酸法脱除黄精多糖中蛋白的工艺优化
施伽+杨浩+杨思文+李丽
摘 要:该文采用正交设计试验优化黄精多糖脱除蛋白的最佳条件。在单因素实验的基础上,以蛋白脱除时间、三氯乙酸浓度、蛋白脱除温度、蛋白质浓度为自变量,以黄精多糖中蛋白脱除率为考察指标,通过L9(34)正交试验得出黄精多糖蛋白脱除率的最佳工艺条件为:蛋白脱除时间40min、三氯乙酸浓度6%、蛋白脱除温度80℃、蛋白质浓度0.11mg/mL,在该条件下黄精多糖蛋白的脱除率为93.51%。
关键词:黄精多糖;三氯乙酸法;蛋白脱除
中图分类号 TS252.5 文献标识码 A 文章编号 1007-7731(2017)06-0029-03
Deproteinization of Polygonatum Polysaccharide by Trichloroacetic Acid
Shi Jia et al.
(Tongren University,Tongren554300,China)
Abstract:Optimization of the optimum conditions for deproteinization of polygonatum polysaccharide by orthogonal design.Orthogonal design was employed to evaluate the significance of four crucial variables including reaction time,concentration of trichloroacetic acid,deproteinization temperature,protein concentration,and to determine the effect of prime factors on the rate of deproteinization.The optimum conditions were reaction time 40min,concentration of trichloroacetic acid 6%,deproteinization temperature 80℃,and protein concentration 0.11mg/mL.Under these conditions,the rate of deproteinization was 93.51%.
Key words:Polygonatum polysaccharide;Trichloroacetic acid;Deproteinization
黄精又名老虎姜、鸡头参、玉竹[1],为百合科黄精属多年生草本植物,在我国主要产于云南、贵州、四川、广西等地,已有2 000多年的药用历史[2-4]。黄精多糖是黄精重要的活性成分之一,含量达到17.79%,具有降血糖、降血压、调脂等生理功能[5]。传统方法提取的黄精多糖,残留有一定的蛋白,分离蛋白的方法主要有:乙醇醇沉法、大孔树脂吸附法、三氯乙酸法、Sevag法及酶法脱蛋白等[6],其中三氯乙酸法脱蛋白效果好,但容易引起多糖损失[7-8]。
1 材料与方法
1.1 材料与试剂 新鲜黄精,二年生,采于铜仁市印江县梵净山下,在55℃烘箱烘中干燥至恒重后,用钢磨打粉机粉碎为粉末后备用。无水乙醇,三氯乙酸,磷酸,乙醚(均为分析纯)。牛血清蛋白(购于源叶生物),考马斯亮兰(购于Solarbio)。
1.2 仪器与设备 分光光度计,旋转蒸发仪,高速离心机,钢磨打粉机,索式提取器。
1.3 方法
1.3.1 黄精多糖的提取 改进徐渭沉[9-11]等多糖提流程:准确称量10g黄精粉末用乙醚回流2h脱脂后取渣,于50℃干燥黄精渣,用于多糖的提取,热水提取多糖条件:温度80℃,固液比1∶15,提取时间4h,提取次数1次,提取结束后。用高速离心机8 000r/min离心10min后取其上清液,在80℃浓缩至20mL,加入5倍95%的乙醇,醇沉过夜,通过离心机离心取其沉淀,制得黄精多糖溶液备用。
1.3.2 黄精多糖的蛋白质测定
1.3.2.1 标准曲线的制备 采用考马斯亮蓝法[12-13]。(1)考马斯亮兰G-250染料试剂(0.1mg/mL):称0.01g考马斯亮兰G-250,溶于5mL、95%的乙醇,再在乙醇溶液中加入10mL、85%的磷酸,用蒸馏水溶解定容于100mL棕色容量瓶后过滤备用。(2)标准蛋白质溶液(0.1mg/mL):称0.01g牛血清蛋白,加水稀释至100mL。精确吸取上述标准品溶液0.0、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9mL于10mL试管中,加入5mL考马斯亮兰G-250染料試剂然后定溶至6mL静至3min备用。(3)标准曲线的制作:分别在595nm处测出吸光度[14-15],以吸光度值为纵坐标(Y),以牛血清蛋白质量(mg)为横坐标(X),生成标准曲线,得到的标准曲线回归方程为y=6.4962x+0.0028,相关系数为0.9959,标准曲线的拟合度良好,表明测定吸光度与牛血清蛋白浓度呈良好的线性关系,如图1所示。
1.3.2.2 黄精多糖中的蛋白质的测定 取1mL多糖溶液于试管中,加入5mL考马斯亮兰G-250染料试剂,静置3min后,用分光光度计在595nm处测定其吸光度值。将吸光度值带入回归方程y=6.492x+0.0028中计算出多糖溶液中蛋白质质量,并计算蛋白脱除率。
1.3.3 黄精多糖脱除蛋白条件单因素试验
1.3.3.1 蛋白脱除时间选择试验 准确量取蛋白质浓度为0.06mg/mL的多糖溶液10mL,脱蛋白温度为70℃,加入浓度为6%三氯乙酸3mL,考察脱蛋白时间为10min、20min、30min、40min、50min条件下多糖蛋白脱除率。
1.3.3.2 三氯乙酸浓度选择试验 蛋白脱除温度为70℃,脱蛋白时间为30min,加入三氯乙酸3mL,考察三氯乙酸浓度分别为2%、4%、6%、8%、10%条件下多糖的蛋白脱除率。
1.3.3.3 蛋白质浓度选择试验 准确量取不同浓度的蛋白质多糖溶液10mL,温度为70℃,时间为30min,加入浓度为6%三氯乙酸3mL,考察蛋白质浓度分别为0.05mg/mL、0.06mg/mL、0.07mg/mL、0.08mg/mL、0.09mg/mL条件下多糖蛋白脱除率。
1.3.3.4 脱除蛋白温度选择试验 准确量取蛋白质浓度为0.06mg/mL的多糖溶液10mL,脱蛋白时间为30min,加入浓度为6%三氯乙酸3mL,考察脱蛋白温度为50℃、60℃、70℃、80℃、90℃条件下多糖蛋白脱除率。
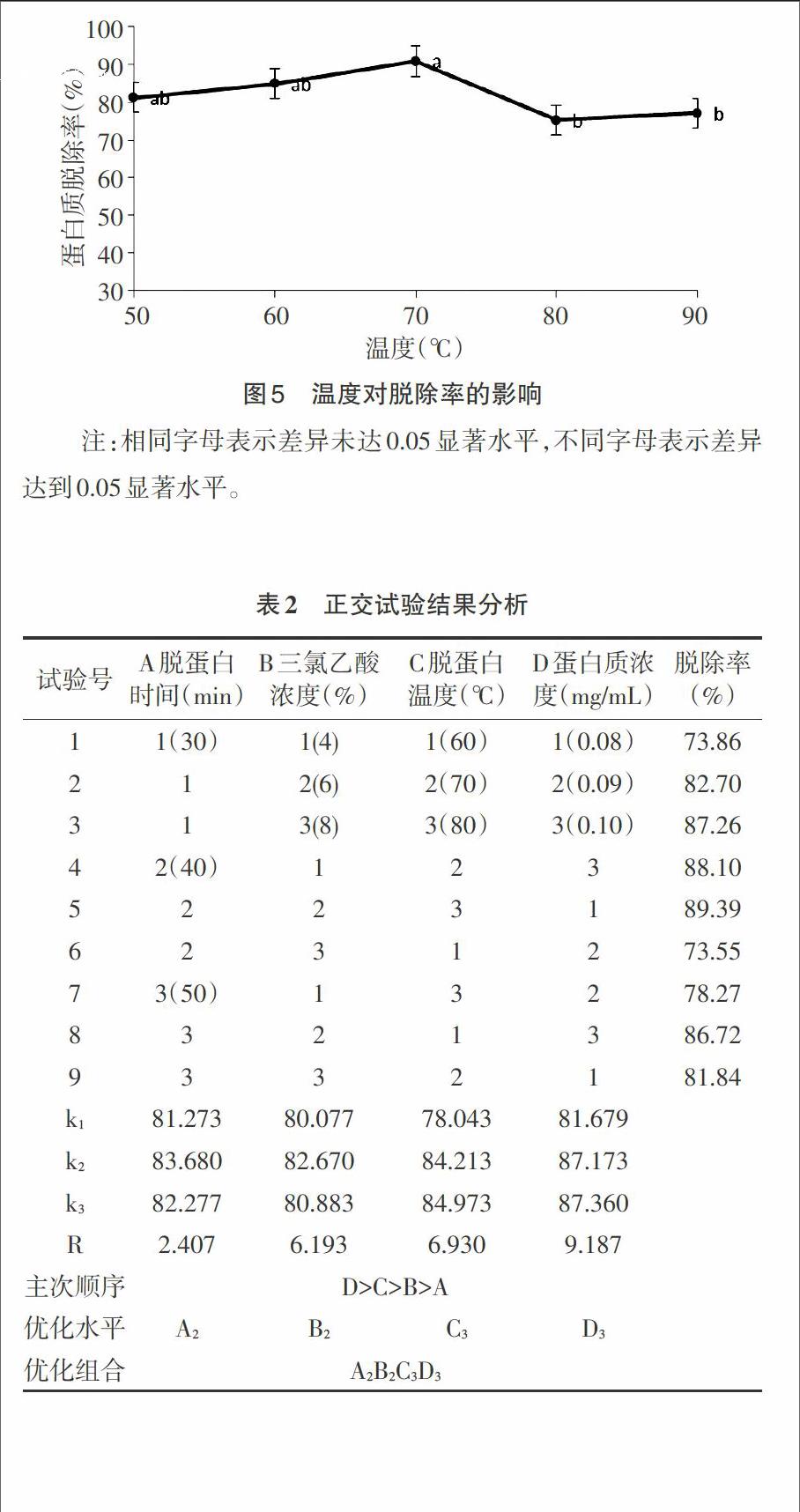
1.3.3.5 正交试验法优化黄精多糖脱蛋白条件 在单因素试验的基础上,以脱蛋白时间、脱蛋白温度、蛋白质浓度、三氯乙酸浓度作为研究的4因素,每因素取3个水平,以黄精多糖脱蛋白作为考察指标,进行L9(34)正交试验设计,见表1。
2 结果与分析
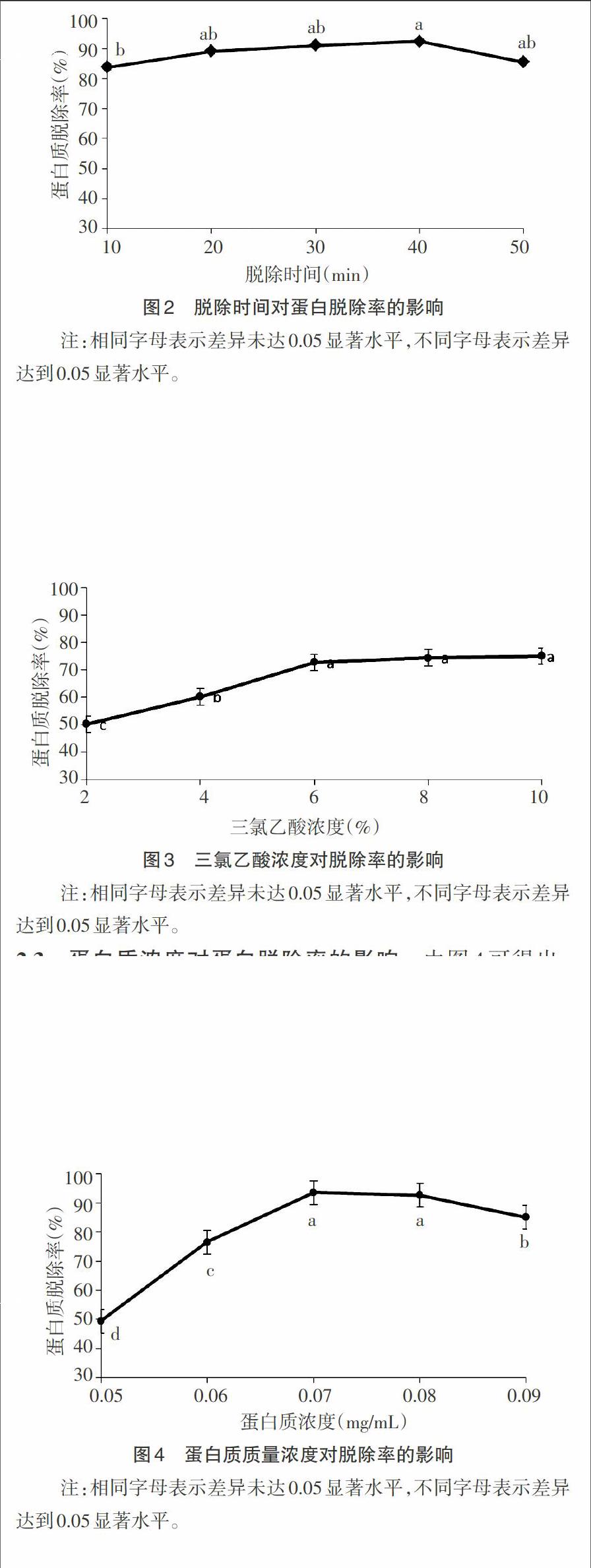
2.1 脱蛋白时间对蛋白脱除率的影响 由图2得出,随着脱蛋白时间的增加,蛋白质脱除率呈先升高后降低的趋势,当脱蛋白时间在10~40min范围时随着时间的的延长蛋白质脱除率逐渐增加,在40min时,蛋白质脱除率有了显著的提高(P<0.05),达到最大值82.49%。之后随着时间的增长,蛋白脱除率逐渐降低,所以蛋白脱除时间不宜过长。因此,在后续实验中采用30、40、50min进行正交实验。
2.2 三氯乙酸浓度对蛋白脱除率的影响 由图3得出,随着三氯乙酸浓度的增加,蛋白脱除率逐渐增大,在6%时,有显著提升(P<0.05),随着三氯乙酸浓度继续升高,蛋白脱除率不再有显著的变化。因此,在后续实验中采用4%、6%、8%进行正交实验。
2.3 蛋白质浓度对蛋白脱除率的影响 由图4可得出,随着蛋白质浓度的增加,蛋白质脱除率呈先上升后下降的趋势,当蛋白质浓度上升至0.07mg/mL时,脱除率有了显著的提高,但随着蛋白质浓度的增加,脱除率逐渐降低,脱除率显著下降(p<0.05)。因此,在后续实验中采用0.06、0.07、0.08mg/mL进行正交实验。
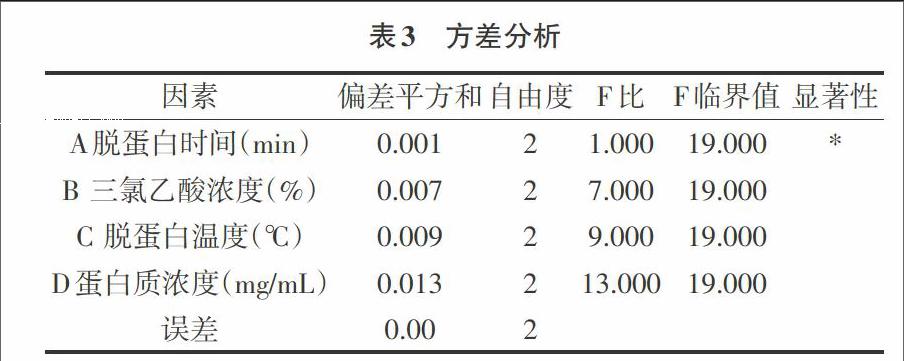
2.4 温度对蛋白脱除率的影响 由图5可得出,随着温度的增加,蛋白质脱除率呈先升后降的趋势,当脱蛋白温度为70℃时,蛋白质脱除率达到最大值为80.95%,当温度高于70℃后蛋白质脱除率逐渐降低。因此,在后续实验中采用60、70、80℃进行正交实验。
2.5 最佳工艺条件的确定 由表2正交试验结果的直观分析可以看出,蛋白脱除条件为A2B2C3D3时,即脱蛋白时间为40min、三氯乙酸浓度为6%、脱蛋白温度为80℃、蛋白质浓度为0.11mg/mL,黄精多糖蛋白的蛋白质脱除率效果最佳。且由极差分析可知,各因素对黄精多糖蛋白的蛋白质脱除率效果影响的主次顺序为:D>C>B>A,即蛋白质浓度>脱蛋白温度>三氯乙酸浓度>脱蛋白时间。其中由方差分析结果可知,脱蛋白时间这一因素对多糖提取率有显著的影响(p<0.05)。正交试验使黄精多糖中蛋白质的脱除工艺得到了优化,最优组合为A2B2C3D3。由于最优组在正交实验中没有出现,所以进行验证试验。根据正交实验分析所得出的提取条件,进行了3次重复试验,平均蛋白脱除率为 93.51%,高于单因素实验的提取得率,表明此优化工艺可行。
3 结论
通过单因素及L9(34)正交实验,确定了三氯乙酸法脱除黄精多糖中蛋白质的最佳条件为三氯乙酸浓度6%,脱除时间40min,脱除温度80℃,蛋白质浓度0.08mg/mL,此条件下黄精多糖中蛋白的脱除率达93.51%,是一种效率高、试剂用量少的脱除黄精多糖蛋白质的有效方法。
参考文献
[1]梁引库,吴三桥,徐仲阳,等.黄精多糖肽的单糖组成和抗氧化活性[J].食品与发酵工业,2012,09.
[2]朱伍凤.药用植物黄精繁育技术研究[D].杨凌:西北农业科技大学,2013.
[3]车勇,王宪冉,夏作理.黄精的现代研究进展[J].社区医学杂质,2004,2(6):34-35.
[4]高英.降血糖中药筛选及黄精降血糖活性成分的研究[D].重庆:西南大学,2010:5.
[5]候双菊.黄精多糖的提取工艺及提取液树脂法脱色的研究[D].合肥:合肥工业大学,2006:1.
[6]刘小攀,田启建,田春莲.黄精多糖酶法脱蛋白的工艺研究[J].西北林学院学报,2016,31(1):239.
[7]赵师师,高旭红,常君,等.石榴皮多糖的三氯乙酸法脱蛋白工艺研究[J].广州化工,2015,34(17):64-65.
[8]池玥兰,王雪,王仁雷,等.蛹虫草基质多糖的脱蛋白方法研究[J].食品科技,2014,39(12):205.
[9]徐渭沉.黄精多糖的提取工艺及其纯化、分离[D].贵阳:贵州大学,2006:25-26.
[10]王坤.多花黄精多糖的分离制备及其结构研究[D].北京:中国林业科学研究院,2013:13.
[11]徐鑫.黄精多糖提取工艺及黄精酸豆奶研制[D].南京:南京农业大学,2011:7.
[12]曹稳根,焦庆才,刘茜,等.考马斯亮藍显色剂变色反应机理的研究[J].化学学报,2002,60(9):1656-1661.
[13]骆文灿.长梗黄精多巧提取、分离纯及其抗氧化性研究[D].福州:福建农林大学,2015:22-23.
[14]李婉停.款冬花多糖提取及分离纯化工艺研究[D].西安:西北大学,2010:25.
[15]王聪.多花黄精多糖提取分离、分子量测定及其粗多糖的初步药效研究[D].四川:成都中医药大学,2012:23.
[16]梁引库,吴三桥.黄精多糖脱色和脱蛋白工艺研究陕[J].食品科技,2012,37(12):166-169.
[17]时晓娟,李朋收,魏颖,等.黄精多糖提取工艺及药理作用研究进展[J].中医药导报,2015,21(23):103-105.
[18]杨发建.黄精属6种药用植物生药学的初步研究[D].昆明:云南中医学院,2016.
[19]李丽,田丽娜,任振兴,等.黄精多糖的结构分析及功能活性研究进展[J].中国实验方剂学杂志,2015,21(15).
[20]贺立虎,周济铭,高鹏.黄精多糖脱蛋白工艺研究[J].陕西农业科学,2008(3). (责编:张宏民)

