绒毡层发育和激素对拟南芥育性的影响
张艳++何勇++李建雄++田志宏
摘 要:自然界中植物雄性不育是普遍存在的现象,拟南芥植株中雄性不育更是尤为常见。花药作为雄蕊的重要组成部分,其发育对植物的育性至关重要,绒毡层发育的异常会影响到花粉发育,而植物激素合成异常也会降低其育性。除此之外,环境因素对植物的生育力也有一定的影响。
关键词:雄性不育;花粉发育;绒毡层;植物激素
中图分类号 Q943.2 文献标识码 A 文章编号 1007-7731(2017)06-0034-05
Effects of Tapetal Development and Hormones on Fertility of Arabidopsis thaliana
Zhang Yan1,2 et al.
(1College of Life Science,Yangtze University,Jingzhou 434025,China;2 South China Botanical Garden,Chinese Academy of Sciences,Guangzhou 510650,China)
Abstract:Plant male sterility is a common phenomenon in nature,male sterility is especially common in Arabidopsis thaliana plants.As an important constituent part of stamen,anther plays an important role in the development of plant,abnormal development of tapetum will affect pollen development,phytohormones synthesis abnormalities will also reduce fertility.In addition,the environmental factors on plant fertility also have a certain impact.
Key words:Male sterility;Pollen development;Tapetum;Phytohormones
開花植物的雄性生殖过程发生在雄蕊中,雄蕊由2个形态不同的部分组成——花药和花丝。花丝是一种维管组织的管道,它具有支持功能,将雄蕊锚定在花上,并作为输导水和营养物质的管道。相比之下,花药负责产生和释放花粉粒,使得授粉和受精过程在花中得以发生,花药可能产生具有生殖能力和没有生殖能力的花粉[1]。雄性不育现象是指产生的花粉不具有正常的生活力,雄蕊的畸形,缺失,小孢子异常,花药不能正常开裂,不形成花粉或是花粉没有生活力等都会出现不育现象。从花药原基分化到形成成熟的花粉粒,花药绒毡层发育,花粉母细胞减数分裂等都是形成可育花粉的关键[2]。影响植物花药发育的因素有很多,例如,茉莉酸甲酯(MeJA)能诱导水稻颖花开放[3]。玉米mscal突变体孢原细胞没有分裂成初生造孢细胞和初生周缘细胞,出现雄性不育[4]。MAC1(MAIZE MULTIPLE ARCHESPORIAL CELLS 1)基因在花药发育的早期能够调控细胞分化,该基因突变会产生过多的孢原细胞,使得花药发育出现异常现象[5]。拟南芥ems1227突变体营养生长正常,但是生殖生长发育则出现异常,大多数的花药中没有花粉,只有极少数的花药中有少量的正常花粉[6]。花药能够正常发育是雄蕊正常授粉的关键因素,因而研究花药正常发育过程和调控该过程的信号传导途径,对提高植物的育性有重大作用。
1 拟南芥的花药发育过程
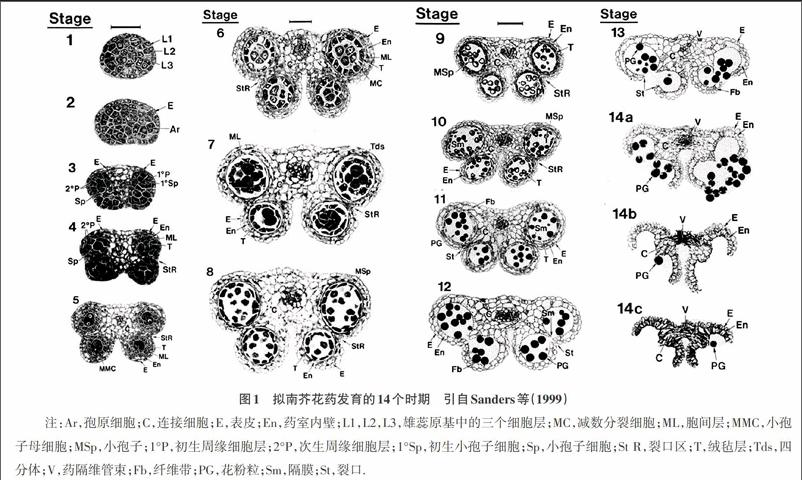
目前已经有很多关于花药和花粉发育过程的研究[7-11]。通过制作野生型拟南芥花药切片来详述发生在细胞水平的从雄蕊原基发生到花药开裂和衰老的变化过程。Sanders等(1999)将拟南芥花药发育分为14个时期[12](图1)。第1期到第8期代表了花药发育的第一阶段,而第9期到第14期则代表了花药发育的第二阶段。在第1期到第4期,发育中的花药原基发生细胞分裂以建立具有成熟花药特征的双侧结构小室、花药壁、连接细胞和维管组织。4个角隔花药原基内的孢原细胞平周分裂形成不同的初级壁细胞和造孢细胞,最终会分化成内壁细胞、中间层、绒毡层和小孢子母细胞。在第5期到第7期,小孢子母细胞经过减数分裂形成四分体单倍体小孢子。在第8期小孢子被从四分体中释放并在第9期到第12期分化成三细胞花粉粒。与花粉发育相协调的是花药的增大、几个细胞层的退化和花药开裂时花粉粒释放前花药细胞特化的可视变化。包括内层细胞膨大,药室内壁增厚和连接层细胞中纤维带沉积,绒毡层和中间层消失。最后,在第11期到第12期隔膜退化形成2药室,紧接着的13期,裂口区细胞破裂,花药衰老花粉从小室中被释放出来脱落到植物的柱头上。除了要产生具有生活力的花粉外,花药也必须在适当的时间开裂以在雌性器官雌蕊接受花粉时释放出成熟花粉粒,并且花丝必须达到适合的高度以将释放的花粉粒传送到雌蕊柱头上。
图1 拟南芥花药发育的14个时期 引自Sanders等(1999)
注:Ar,孢原细胞;C,连接细胞;E,表皮;En,药室内壁;L1,L2,L3,雄蕊原基中的三个细胞层;MC,减数分裂细胞;ML,胞间层;MMC,小孢子母细胞;MSp,小孢子;1°P,初生周缘细胞层;2°P,次生周缘细胞层;1°Sp,初生小孢子细胞;Sp,小孢子细胞;St R,裂口区;T,绒毡层;Tds,四分体;V,药隔维管束;Fb,纤维带;PG,花粉粒;Sm,隔膜;St,裂口.
总的来说,花药发育一般可分為2个阶段,在阶段1期间,花药形态形成,细胞和组织分化发生,小孢子母细胞进行减数分裂。在阶段1结束时,花药包含大部分其特化的细胞和组织,四分体小孢子存在于花粉囊中。在阶段2期间,花粉粒分化,花药增大,并且在花中由花丝向上推动延伸,组织退化、花药开裂和花粉粒释放。然而,调控花药细胞分化,建立花药组织模式和导致花药从组织特异性(阶段1)转换到细胞退化和花药开裂(阶段2)的细胞学过程目前还不清楚[13]。
2 绒毡层发育对花药的影响
绒毡层(tapetum)在种子植物中存在于幼花药的内侧,为富于原生质的组织,在减数分裂后退化、解体。形成绒毡层的绒毡细胞(tapetum cell)来源于侧壁细胞,在其内侧有孢原细胞群,当减数分裂开始时绒毡细胞也开始分裂,所以很容易被误认为与孢原细胞相同。虽然绒毡细胞的分裂是有丝分裂,但也有很多异常分裂。在花粉囊中绒毡层是直接与花粉母细胞相邻的一层细胞,主要为花粉发育提供营养,也分泌形成花粉壁所需的物质及各种酶[14-16]。在小孢子母细胞开始减数分裂后,绒毡层细胞就开始进行有丝分裂,形成双核或多核极性分泌细胞[17]。小孢子母细胞减数分裂完成后包裹四分体的胼胝质层被绒毡层合成分泌的胼胝质酶复合体降解,释放出小孢子[18-19]。然而,胼胝质层能使花药中的四分体与孢子体细胞层分隔开,也使得四分体之间分开,避免细胞间因为接触而融合在一起,防止小孢子发育提前[20-21]。
在目前已报道的研究中,很多的拟南芥突变体植株出现结实异常的情况。拟南芥甘油-3-磷酸乙酰转移酶6(GPAT6)基因敲除突变体的育性相较于野生型有严重下降,同时突变体的花药绒毡层内的内质网含量有明显地减少并且绒毡层的发育异常。绒毡层的异常也进一步造成了花药衰亡和花粉壁发育的缺陷。除此之外,GPAT6也同样影响花粉内物质的积累并可能影响到花粉的萌发以及花粉管的伸长[22]。ems1227突变体植株的绒毡层细胞出现肥大且空泡化,绒毡层平周分裂出现2层细胞,降解延迟的异常现象,而且绒毡层和中间层不分离。胼胝质层不能正常降解,小孢子不能从四分体中正常释放出来[6]。
MYB家族是一种参与基因转录水平调控的重要转录因子,在许多植物生长发育、逆境反应、信号转导、抗病性等一系列基因表达中起到重要的调控作用。在myb33和myb65双突变体花药中,绒毡层在花粉母细胞阶段过度增大,导致在减数分裂前花粉发育败育,而且单个基因的突变体并不表现出表型,表明MYB33和MYB65具有功能冗余,相比较于野生型,myb33和myb65双突变体的雄蕊通常比较短,未能完全延伸到雌蕊柱头,除此之外,myb33和myb65双突变体的花药比野生型的更小,不能产生花粉,表明这种突变体是雄性不育的。myb33和myb65双突变体和野生型之间的正反交证明myb33和myb65双突变体植株的雌蕊部分是完全可育的,这进一步确认了myb33和myb65双突变体的雄性不育表型,myb33和myb65双突变体中花粉发育减数分裂前异常是因绒毡层过度增长所造成的[23]。AtMYB103突变后会使得绒毡层过早的解体和小孢子畸形、退化等异常现象,从而导致雄性不育[24-25]。TDF1(TAPETAL DEVELOPMENT AND FUNCTION 1)编码的R2R3 MYB转录因子参与绒毡层细胞和花粉母细胞中的转录调控。在tdf1突变体中,由于绒毡层发育畸形,胼胝质未降解释放小孢子,引起雄配子败育[26]。该基因还与其上游的AtMYB103、MYC型转录因子AMS[27]、下游的DYT1协同参与调控绒毡层的发育。绒毡层是介导配子体和孢子体之间一种很重要的组织。
UDT1(UNDEVELOPED TAPETUM 1)突变体的绒毡层细胞在减数分裂时期高度液泡化,花粉母细胞不分裂成小孢子造成雄性不育[28]。TDR1(TAPETUM DEGENERATION RETARDATION 1)与绒毡层的降解有关,该基因发生突变会造成绒毡层和中间层解体延迟,出现小孢子败育,引起雄性不育[29]。
bHLH(碱性/螺旋-环-螺旋)转录因子家族在生物体内起着重要的调控作用,调控植物各个组织的生长发育过程。bHLH142参与调控花药绒毡层程序性细胞死亡,其突变体出现绒毡层解体延迟现象,花粉母细胞不进行减数分裂,表现出完全的雄性不育[30]。EXS编码一种富含亮氨酸重复序列的受体激酶,参与调控花药原基L2层细胞平周分裂的数量和位置,并在花序分生组织,花序顶端,花药和发育中的种子里表达[31]。在花药中,增加的L2层细胞形成孢原细胞并分裂形成更多的孢子细胞。Exs(extra sporogenous cell)雄性不育突变体孢原细胞产生异常的造孢细胞,次生周缘细胞受到造孢细胞团和药室内壁的挤压或是解体无法形成绒毡层细胞,使得其形成缺少绒毡层和胞间层的性母细胞。
胞外多肽激素基因CHAL/CLL1/CLL2对拟南芥雄蕊发育有着非常重要的作用[32]。chal/cll1/cll2三突变体有明显的植株育性异常的表型,表现出雄蕊异常表型:相较于野生型,其花丝短小,花药绒毡层发育出现异常和部分花粉出现败育,而且花粉的萌发率也显著降低。CHAL和CLL2在花发育的整个过程中(包括花药发育和花丝伸长)都发挥作用;而CLL1可能只在花早期发育中发挥作用。这3个基因CHAL/CLL1/CLL2在花药绒毡层和花粉母细胞中特异表达。chal/cll1/cll2植株第5期花药出现绒毡层细胞数目多,排列松散,形状不规则,局部形成2层,而且这种异常一直到绒毡层降解完全。野生型花药发育的第12期时绒毡层细胞已全部完全降解了,而同一时期的chal/cll1/cll2却存在完整的绒毡层。这些都说明CHAL/CLL1/CLL2不仅在调控绒毡层数目及排列规则上有重要功能,而且在绒毡层的降解过程中也发挥作用。除此之外,CHAL/CLL1/CLL2在花粉萌发过程中也发挥重要功能,且功能冗余。在花药发育过程中,花药不同细胞层之间的信号交流和相互协调对于花药结构的正确形成和功能至关重要。而细胞-细胞间的信号交流需要借助胞外多肽和受体激酶所介导的信号传导途径。CHAL/CLL1/CLL2可能在雄蕊发育的过程中作为配基-受体复合物来发挥重要功能的。Hord等(2008)报道了ER/ERL1/ERL2基因在花药发育过程中,通过影响花药药室的数目和组成药室的五层细胞的发育来影响植株的育性[33],ER/ERL1/ERL2在正常的花药形成和花药细胞分裂和分化中发挥重要作用。
3 植物激素对育性的影響
植物激素普遍存在于植物组织中,参与调控植物生长发育。例如,生长素可以促进植物维管束发育,花药中IAA含量不足会引起花药代谢和小孢子生长发育异常,导致花粉败育,表现出雄性不育表型[34]。水稻[35]、小麦[36]的可育系花药中IAA的含量远高于不育系。赤霉素合成途径中的关键酶内根贝壳杉烯合成酶A发生基因突变后,赤霉素不能正常合成,也会表现出雄性不育[37]。在小麦花粉败育的转折时期,不育系花药中的赤霉素含量降低与后面出现的花粉败育有关[36]。在玉米雄性不育系小孢子败育前花药组织乙烯释放量显著高于可育系的,而施加乙烯生物合成抑制剂对T型雄性不育系育性恢复几乎无效应,但可以使部分小孢子继续发育1~3个阶段。S型雄性不育系可以产生少量可育花粉,说明施加乙烯生物合成抑制剂可以抑制不育系花药组织过量合成乙烯,使不育性发生逆转[38]。
由13-LOX途径产生的茉莉酸类物质和脂肪酸衍生物质参与调控生育和花发育过程。在拟南芥中,与野生型相比较,LOX3和LOX4缺乏导致发育功能障碍,lox3和lox4双突变体比野生型植株更高,而且会生长出更多的花序芽和花。进一步的分析显示,在lox3和lox4双突变体中花序发育停滞的发生与异常的心皮化的花产生有关,与野生型的花相比较,lox3和lox4双突变体的花出现花丝变短,柱头乳头状突起更长,花药不开裂等异常现象。而施加外源的茉莉酸(JA)可以恢复突变体的育性,因此,在lox3和lox4双突变体花中JA的合成受阻,导致了其雄性不育[39]。茉莉酸合成异常或是茉莉酸信号转导途径发生异常的拟南芥都会出现雄性不育现象。myb26突变体也表现出花药不开裂导致其雄性不育,然而施加外源的茉莉酸或是茉莉酸类物质并不能恢复其育性,说明myb26突变体不育的原因并不是由于茉莉酸合成途径受阻[40]。aos突变体由于花药和花粉发育受阻表现出严重的雄性不育现象,而施加外源的茉莉酸甲酯能够完全恢复雄性不育表型,表明AOS基因对茉莉酸酯的生物合成是关键的[41]。
茉莉酸已经被证实可以诱导与防御相关的基因,这些基因有可能在花粉发育或雄性育性的其它方面发挥作用,如茉莉酸被发现可以调节由另一种植物信号分子水杨酸诱导的程序性细胞死亡[42],茉莉酸促进由伏马菌毒素B1(mycotoxin fumonisin B1)诱导的细胞死亡[43]。因为花药开裂需要在2个花药组织,隔膜和裂口处的程序性细胞死亡[23,44],茉莉酸可能还调节花药中的程序性细胞死亡。Sanders等观察到在dde1突变体中隔膜和裂口处细胞正常分化,程序性细胞死亡过程看起来也似乎正常,但是却延迟了。当花已经开始衰老而且雌蕊的柱头对花粉粒不具亲和力的时候花药才开裂。所以,除了需要正常发育的花粉外,花丝伸长到适合的位置花药开裂将花粉释放到有亲和力的雌蕊柱头对植物的育性也至关重要[45]。opr3突变体植株就表现出花药开裂延迟现象,然而在开裂的花药内检测不到OPR3基因的表达[9],这表明在花药开裂前茉莉酸已经发挥作用,所以茉莉酸对花药中的细胞死亡不是必需的,但似乎可以调节细胞死亡的时间[44],而表达OPR3基因可以恢复opr3突变体的育性。
4 环境因素对育性的影响
事实上双突变体可以零星地结实,而且其结实的程度有很大的变化范围,这一事实表明环境因素也可能影响植物的生育能力。光照强度,光照时间和温度都可以影响植物的生育力[28]。番茄sl2温度敏感型的雄性不育突变体在低温下雄蕊和花粉能正常发育,而高温下sl2雄蕊中的IAA和ABA含量远高于正常植株水平,高温会完全抑制小孢子的发生[46-47]。光敏核不育水稻农垦58S在适宜温度下长日照不育、短日照诱导可育[48]。myb33和myb65双突变体及myb26突变体植株的不育现象,在更强的光照或是更低的温度条件下其育性会有所恢复[23,40]。这表明除了遗传的原因,环境因素(光照强度、温度等)对拟南芥的育性也有很大的影响。
5 结语
在拟南芥中已经鉴定出很多与花药发育相关的基因,它们对花药的形成和花粉育性具有重要的作用。有些功能互为冗余的基因,其单个基因发生突变可能对植株的生育力并没有太大影响,但它们的双突变一般都会影响到其它基因的表达,最终影响到花药的发育和花粉育性。而激素也对植物的生长发育有调控作用,影响植物的育性,除了要在分子水平深入研究影响育性相关的基因及其调控机理,也要给植株提供适宜的生长环境,合适的光照、温度更利于植物传种和提高产量。
参考文献
[1]Zhao D Z,Ma H.Male fertility:A case of enzyme identity[J].Current Biology,2000,10:904-907.
[2]刘伟华,邱博,罗红兵.花药绒毡层发育和花粉母细胞减数分裂相关基因研究进展[J].作物研究,2015,29(3):311-317.
[3]曾晓春,周燮.茉莉酸甲酯(MeJA)诱导水稻颖花开放[J].植物学报,1999, 41(5):560-562.
[4]Chaubal R,Anderson J R,Trimnell M R,et al.The transformation of anthers in the msca1 mutant of maize[J].Planta,2003,216:778-788.
[5]Wang C R,Nan G L,Kelliher T,et al.Maize multiple archesporial cells 1 (macl),an ortholog of rice TDL1A,modulates cell proliferation and identity in early anther development[J].Development,2012,139:2594-2603.
[6] 成志鵬.拟南芥心皮发育基因MS1522的功能分析及雄性不育突变体ems1227的基因定位[D].上海:上海师范大学,2012.
[7]McConn M,Browse J.The critical requirement for linolenic acid is pollen development,not photosynthesis,in an Arabidopsis mutant[J].The Plant Cell,1996,8:403-416.
[8]Ishiguro S,Kawai-Oda A,Ueda J,et al.The defective in anther dehiscence1 gene encodes a novel phospholipase A1 catalyzing the initial step of jasmonic acid bio- synthesis,which synchronizes pollen maturation,anther dehiscence,and flower opening in Arabidopsis[J].The Plant Cell,2001,13:2191-2209.
[9]Stintzi A,Browse J.The Arabidopsis male-sterile mutant,opr3,lacks the 12- oxophytodienoic acid reductase required for jasmonate synthesis[J].Proc.Natl.Acad.Sci.USA,2000,97(19):10625-10630.
[10]Yang M,Hu Y,Lodhi M,et al.The Arabidopsis SKP1-LIKE1 gene is essential for male meiosis and may control homologue separation[J].Proc.Natl.Acad.Sci.USA,1999,96:11416-11421.
[11]Schiefthaler U,Balasubramanian S,Sieber P,et al.Molecular analysis of NOZZLE,a gene involved in pattern formation and early sporogenesis during sex organ development in Arabidopsis thaliana[J].Proc.Natl.Acad.Sci.USA,1999,96:11664-11669.
[12]Sanders P M,Bui A Q,Weterings K,et al.Anther developmental defects in Arabidopsis thaliana male-sterile mutants[J].Sexual Plant Reproduction,1999,11:297-322.
[13]Goldberg R B,Beals T P,Sanders P M.Anther development:Basic principles and practical applications[J].The Plant Cell,1993,5:1217-1229.
[14]Pacini E,Franchi G G,Hesse M.The tapetum:Its form,function and possible phylogeny in embryophyta[J].Plant Systematics and Evolution,1985,149:155-185.
[15]Hsieh K,Huang A H C.Tapetosomes in Brassica tapetum accumulate endoplasmic reticulum-derived flavonoids and alkanes for delivery to the pollen surface[J].The Plant Cell,2007,19:582-596.
[16]Mascarenhas J P.Molecular mechanisms of pollen tube growth and differen-tiation[J].The Plant Cell,1993,5:1303-1314.
[17]Bedinger P.The remarkable biology of pollen[J].The Plant Cell,1992,4:879-887.
[18]Stieglitz H.Role of β-1,3-glucanase in postmeiotic microspore release[J].Deve- lopmental Biology,1977,57(1):87-97.
[19]Piffanelli P,Ross J H E,Murphy D J.Biogenesis and function of the lipidic structures of pollen grains[J].Sexual Plant Reproduction,1998,11:65-80.
[20]Waterkeyn L,Bienfait A.On a possible function of the callosic special wall in Ipomoea purpuea (L) roth[J].Grana,1970,10:13-20.
[21] Harrison J H,Machenzie A.Autoradiography of soluble (2-14C) thymidine deriveatives during meiosis and microsporogenesis in Lilium anthers[J].Journal of Cell Science,1967,2:387-400.
[22]Li X C,Zhu J,Yang J,et al.Glycerol-3-phosphate acyltransferase 6 (GPAT6) is important for tapetum development in Arabidopsis and plays multiple roles in plant fertility[J].Molecular Plant,2012,5(1):131-142.
[23]Millar A A,Gubler F.The Arabidopsis GAMYB-like genes,MYB33 and MYB65,are microRNA-regulated genes that redundantly facilitate anther develop- pment[J].The Plant Cell,2005,17:705-721.
[24]Zhang Z B,Zhu J,Gao J F,et al.Transcription factor AtMYB103 is required for anther development by regulating tapetum development,callose dissolution and exine formation in Arabidopsis[J].The Plant Journal,2007,52:528-538.
[25]Higginson T,Li S F,Parish R W.AtMYB103 regulates tapetum and trichome development in Arabidopsis thaliana[J].The Plant Journal,2003,35:177-192.
[26]Zhu J,Chen H,Li H,et al.Defective in tapetal development and function 1 is essential for anther development and tapetal function for microspore maturation in Arabidopsis[J].The Plant Journal,2008,55:266-277.
[27]Sorensen A M,Kr?ber S,Unte U S,et al.The Arabidopsis ABORTED MICROSPORES (AMS) gene encodes a MYC class transcription factor[J].The Plant Journal,2003,33:413-423.
[28]Jung K H,Han M J,Lee Y S,et al.Rice undeveloped tapetum1 is a major regulator of early tapetum development[J].The Plant Cell,2005,17:2705-2722.
[29] Li N,Zhang D S,Liu H S,et al.The rice tapetum degeneration retardation gene is required for tapetum degradation and anther development[J].The Plant Cell,2006,18:2999-3014.
[30] Ko S S,Li M J,Sun B K M,et al.The bHLH142 transcription factor coordinates with TDR1 to modulate the expression of EAT1 and regulate pollen development in rice[J].The Plant Cell,2014,26:2486-2504.
[31]Canales C,Bhatt A M,Scott R,et al.EXS,a putative LRR receptor kinase,regulates male germline cell number and tapetal identity and peomotes seed development in Arabidopsis[J].Current Biology,2002,12:1718-1727.
[32]何卓娜,王雙双,马红,等.胞外多肽激素基因CHAL/CLL1/CLL2在拟南芥雄蕊发育过程中发挥重要作用[J].植物生理学报,2016,52(2):167-176.
[33]Hord C L H,Sun Y J,Pillitteri L J,et al.Regulation of Arabidopsis early anther development by the mitogen- activated protein kinases,MPK3 and MPK6,and the ERECTA and related receptor- like kinases[J].Molecular Plant,2008,1(4):645-658.
[34]黄厚哲,楼仕林,王侯聪,等.植物生长素亏缺与雄性不育的发生[J].厦门大学学报自然科学版,1984,23(1):82-97.
[35]黄少白,周燮.水稻细胞质雄性不育与内源GA1+4和IAA的关系[J].华北农学报,1994,9(3):16-20.
[36]李英贤,张爱民,黄铁城.小麦细胞质雄性不育与花药组织内源激素的关系[J].农业生物技术学报,1996,4(4):307-313.
[37]Sun T P,Kaimaya Y.The Arabidopsis GA1 locus encodes the cyclase ent-kaurene synthetase A of gibberellin biosynthesis[J].The Plant Cell,1994,6:1509-1518.
[38]夏涛,刘纪麟.玉米细胞质雄性不育性与乙烯的关系[J].华北农学报,1996,11(3):68-72.
[39]Caldelari D,Wang G,Farmer E E,et al.Arabidopsis lox3 lox4 double mutants are male sterile and defective in global proliferative arrest[J].Plant Molecular Biology,2011,75:25-33.
[40]Steiner-Lange S,Unte U S,Eckstein L,et al.Disruption of Arabidopsis thaliana MYB26 results in male sterility due to non-dehiscent anthers[J].The Plant Journal,2003,34:519-528.
[41]Park J H,Halitschke R,Kim H B,et al.A knock-out mutation in allene oxide synthase results in male sterility and defective wound signal transduction in Arabidopsis due to a block in jasmonic acid biosynthesis[J].The Plant Journal,2002,31(1):1-12.
[42]Rao M V,Lee H,Creelman R A,et al.Jasmonic acid signaling modulates ozone-induced hypersensitive cell death[J].The Plant Cell,2000,12:1633-1646.
[43]Asai T,Stone J M,Heard J E,et al.Fumonisin B1-induced cell death in Arabidopsis protoplasts requires jasmonate-,ethylene-,and salicylate-dependent signaling pathways[J].The Plant Cell,2000,12:1823-1835.
[44]Sanders P M,Lee P Y,Biesgen C,et al.The Arabidopsis DELAYED DEHISCENC1 gene encodes an enzyme in the jasmonic acid synthesis pathway[J].The Plant Cell,2000,12:1041-1061.
[45]甘立軍,夏凯,周燮.茉莉酸对拟南芥花粉育性的调控[J].植物生理学通讯,2004,40(3):269-274.
[46]Singh S,Sawhney V K,Pearce D W.Temperature effects on endogenous indole-3-acetic acid levels in leaves and stamens of the normal and male sterile ‘stamenless-2 mutant of tomato (Lycopersicon esculentum mill.)[J].Plant,Cell & Environment,1992,15:373-377.
[47]Singh S,Sawhney V K.Abscisic acid in male sterile tomato mutant and its regultion by low temperature[J].Journal of Experimental Botany,1998,49(19):199-203.
[48]赵玉锦,童哲,陈华君,等.内源植物激素与光敏核不育水稻农垦58S育性的关系[J].植物学报,1996,38(12):936-941.
(责编:张长青)

