小鼠PD-1胞外段重组蛋白表达及其包涵体复性
江 慧, 康巧珍, 黄夏冰, 张成龙, 刘 鑫
(郑州大学 生命科学学院 河南 郑州 450001)
小鼠PD-1胞外段重组蛋白表达及其包涵体复性
江 慧, 康巧珍, 黄夏冰, 张成龙, 刘 鑫
(郑州大学 生命科学学院 河南 郑州 450001)
旨在利用原核表达系统制备可溶性的PD-1胞外段(以下简称exPD-1)蛋白.以C57BL/6小鼠脾细胞cDNA为模板,扩增小鼠exPD-1基因,成功构建重组质粒pET-28a-exPD-1,并在E.coliBL21(DE3)中诱导表达.结果显示,小鼠exPD-1重组蛋白大小约为17 kD,以包涵体形式存在.exPD-1包涵体蛋白经8 mol/L尿素变性、Ni-NTA亲和层析后,采用尿素梯度透析法对蛋白进行复性,复性效果不佳,添加氧化/还原型谷胱甘肽复性后,复性率达到50%以上,提高了复性效率.小鼠exPD-1蛋白的成功制备,为进一步研究PD-1的免疫学功能奠定了材料基础.
PD-1; 原核表达载体; 包涵体; 复性
0 引言
PD-1(programmed cell death-1)是一种免疫抑制受体,主要表达于活化的T细胞、B细胞、自然杀伤性T细胞,单核细胞和巨噬细胞.PD-1与其配体PD-L1(B7-H1,CD274)和PD-L2(B7-DC,CD273)结合后,能够削弱和抑制CD4+T、CD8+T细胞、B细胞、单核细胞的增殖和活化,在肿瘤、 病毒感染、 自身免疫性疾病等方面均发挥重要的免疫调节作用[1-3].PD-1为50~55 kD的Ⅰ型跨膜糖蛋白,胞外区的IgV结构域是其与配体主要结合区域,其胞质尾部的两个酪氨酸残基在调控下游信号分子产生免疫负性调节作用中扮演重要角色[4].外源表达的PD-1胞外段(extracellular domain of PD-1,exPD-1)蛋白能够识别并结合配体,干扰PD-1与配体的结合,阻碍负性信号传递.
利用原核表达系统,实现外源基因在基因工程菌中稳定高效表达,可以快速易行地获得大量目的蛋白,且生产周期短、成本低[5].但是,重组蛋白在大肠杆菌内的高表达易导致形成不溶的、无活性的包涵体.目标基因高拷贝、强效的启动系统、诱导产物浓度过高都易诱导包涵体的形成,往往需要通过变性溶解,并在适宜条件下复性,使其形成正确折叠,才能得到可溶的、有生物活性的蛋白[6].由于目的蛋白组成及结构的差异,选择和优化复性方式对获得有生物活性的蛋白具有重要意义.
本实验使用基因工程技术获取小鼠PD-1胞外段基因,将其克隆至原核表达载体pET-28a中,并在宿主菌E.coliBL21(DE3)中表达,得到的包涵体蛋白用含8 mol/L尿素的变性液变性,经Ni-NTA亲和层析柱纯化后,采取尿素梯度透析复性及添加氧化/还原型谷胱甘肽等小分子物质对蛋白进行复性,成功制备PD-1胞外段蛋白,为进一步研究PD-1的免疫学功能奠定了材料基础.
1 材料与方法
1.1 材料
pET-28a质粒为本实验室保存;E.coliDH5α和E.coliBL21(DE3)感受态细胞购于北京鼎国昌盛生物技术有限公司.Taq DNA聚合酶、T4 DNA连接酶、NdeⅠ、XhoⅠ、DNA marker购自Takara公司;氧化型谷胱甘肽(GSSG)、还原型谷胱甘肽(GSH)购自上海生工生物工程公司;ProteinIsoTMNi-NTA Resin、低相对分子质量蛋白marker购自北京全式金有限公司;其余试剂及试剂盒购自北京鼎国昌盛生物技术有限公司.PCR引物合成及DNA测序由北京金唯智公司完成.
1.2 小鼠exPD-1的克隆与鉴定
取C57BL/6小鼠脾脏,TRIzol法提取脾细胞总RNA,并反转录为cDNA,具体步骤按试剂盒说明书进行.用小鼠exPD-1引物,F:5’-CGGCATATGTCAGGGTGGCTTCTAGA-3’(NdeⅠ);R:5’-CCCCTCGAGTTATTGAAACCGGCCTTCTG-3’(XhoⅠ),扩增exPD-1基因.PCR扩增条件为:94 ℃预变性5 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸1 min,30个循环;72 ℃再延伸10 min.取5 μL PCR产物上样于1%琼脂糖凝胶中电泳,凝胶成像分析.PCR产物用DNA片段纯化试剂盒纯化,用于后续实验.
1.3 小鼠exPD-1原核表达载体构建
质粒pET-28a和纯化后PCR产物分别用限制性内切酶NdeⅠ和XhoⅠ双酶切,酶切产物上样于1%琼脂糖凝胶中电泳,使用DNA琼脂糖凝胶回收试剂盒回收酶切产物,并用T4 DNA连接酶于16 ℃过夜连接,构建重组质粒pET-28a-exPD-1,转化至E.coliDH5α感受态细胞,挑取单克隆,提取质粒,进行双酶切鉴定,鉴定正确的送至北京金唯智公司测序.
1.4 小鼠exPD-1蛋白的表达与鉴定
将构建正确的重组质粒pET-28a-exPD-1转化至宿主菌E.coliBL21(DE3)中,挑取单克隆接种于LB培养基(kan抗性)中,37 ℃振荡培养过夜.次日按1∶100接种比例接种于LB培养基(kan抗性)中,培养4 h后加入0.2 mmol/L IPTG诱导表达4 h.以E.coliBL21(DE3)和转化pET-28a的菌株为阴性对照.取菌液,用15% SDS-PAGE电泳分析.
1.5 小鼠exPD-1蛋白表达形式分析、纯化及鉴定
9 000 rpm离心5 min收集IPTG诱导后的菌体,用可溶性平衡缓冲液(300 mmol/L NaCl,50 mmol/L NaH2PO4,10 mmol/L imidazole,10 mmol/L Tris,pH 8.0)重悬,冰浴条件下使用300 W短脉冲超声处理(超声处理10 s,间隔15 s)20 min,9 000 rpm离心20 min,收集上清及沉淀,15% SDS-PAGE分析蛋白表达形式.可溶性平衡缓冲液洗涤沉淀3次后,用变性液(8 mol/L urea,0.1 mol/L NaH2PO4,0.01 mol/L Tris,pH 8.0)溶解沉淀,离心收集上清,并用0.45 μm滤膜过滤.使用Ni-NTA亲和层析柱对蛋白进行纯化,使用不同浓度的咪唑洗脱液(变性缓冲液中分别加入50 mmol/L、100 mmol/L、200 mmol/L、300 mmol/L、400 mmol/L imidazole)梯度洗脱,收集洗脱液,15% SDS-PAGE电泳检测纯化结果,并用Image J图像分析软件分析蛋白纯度.
1.6 小鼠exPD-1的复性

M:marker; 1:小鼠exPD-1 PCR产物.图1 PCR产物的琼脂糖凝胶电泳分析Fig.1 Analysis of PCR products by agarose gel electrophoresis
纯化后的蛋白用不同的复性缓冲液进行梯度透析复性.复性缓冲液体系1:配制PBS缓冲液(137 mmol/L NaCl,2.7 mmol/L KCl,10 mmol/L Na2HPO4,2 mmol/L KH2PO4),分别加入尿素至终浓度为6 mol/L、4 mol/L、3 mol/L、2 mol/L、1 mol/L、0.5 mol/L;复性缓冲液体系2:在复性缓冲液1的基础上,在含0.5 mol/L尿素的复性缓冲液中添加1 mmol/L GSH,0.2 mmol/L GSSG.在同一蛋白质量浓度和温度条件下分别使用体系1和2进行稀释复性,收集上清进行 SDS-PAGE,并用Image J软件分析复性效率.
2 结果
2.1 小鼠exPD-1的克隆
以C57BL/6小鼠脾细胞cDNA为模板,PCR扩增小鼠PD-1胞外段基因,扩增产物经1%琼脂糖凝胶电泳检测,可见大小约为450 bp的特异性条带,与目的基因大小一致(小鼠exPD-1基因为441 bp)(图1).
2.2 重组质粒pET-28a-exPD-1的鉴定
重组质粒pET-28a-exPD-1经XhoⅠ、NdeⅠ双酶切鉴定,分别在5 300 bp、450 bp处出现特异性条带(图2),测序结果经Blast比对,与GenBank(X67914.1)同源性达到100%,表明重组质粒pET-28a-exPD-1构建成功.
2.3 小鼠exPD-1蛋白的表达及鉴定
将构建成功的重组质粒pET-28a-exPD-1转化至E.coliBL21(DE3)中,进行菌落PCR鉴定,正确的阳性克隆菌经IPTG于37 ℃诱导表达4 h,SDS-PAGE结果显示在17 kD处可见明显的蛋白诱导条带(图3).

1:pET-28a空质粒的XhoⅠ、NdeⅠ双酶切结果; 2: pET-28a-exPD-1的XhoⅠ、NdeⅠ双酶切结果; 3:exPD-1 PCR产物;M: marker.图2 重组质粒pET-28a-exPD-1双酶切鉴定Fig.2 Restriction enzyme analysis of recombinant plasmid pET-28a-exPD-1

M:marker (12~120 kD);1:宿主菌E.coli BL21(DE3);2:诱导的E.coli BL21(DE3)/pET-28a; 3:未诱导的E.coli BL21(DE3)/pET-28a-exPD-1;4:诱导的E.coli BL21(DE3)/pET-28a-exPD-1.图3 小鼠exPD-1蛋白的诱导表达Fig.3 Expression of exPD-1 protein induced by IPTG
2.4 小鼠exPD-1蛋白表达形式分析
收集菌体,超声破碎后9 000 rpm离心20 min,收集上清及沉淀,SDS-PAGE结果显示exPD-1蛋白主要以包涵体的形式表达(图4).
2.5 小鼠exPD-1蛋白的变性与纯化
菌体破碎离心后沉淀经可溶性平衡缓冲液洗涤3次后,加入含8 mol/L尿素的变性液对包涵体蛋白变性.使用Ni-NTA亲和层析柱对蛋白进行纯化,用不同浓度的咪唑洗脱液对蛋白梯度洗脱.SDS-PAGE显示100~400 mmol/L咪唑洗脱液洗脱率较高(图5),图像经Image J软件分析,蛋白纯度达到80%以上.

M:marker(12~120 kD); 1:超声破碎后离心上清;2:超声破碎后离心沉淀.图4 小鼠exPD-1蛋白表达形式分析Fig.4 Expression form analysis of exPD-1 protein
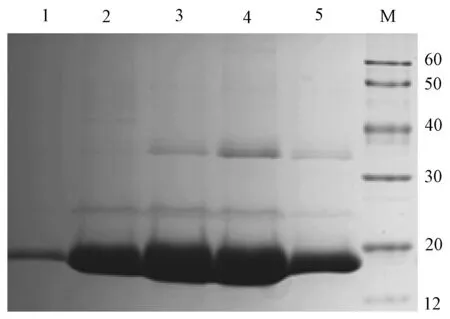
1~5:依次为50 mmol/L、100 mmol/L、200 mmol/L、300 mmol/L、400 mmol/L咪唑洗脱液洗脱产物;M:marker (12~120 kD).图5 小鼠exPD-1蛋白纯化Fig.5 Purity of mouse exPD-1 protein
2.6 小鼠exPD-1蛋白的复性
亲和层析纯化后的蛋白分别用只含尿素的复性缓冲液和添加氧化/还原型谷胱甘肽的复性缓冲液进行梯度透析复性,实验发现用只含尿素的复性体系对蛋白进行复性时,当尿素浓度降至0.5 mol/L时,会析出大量白色不溶沉淀,可溶性蛋白急剧减少;而添加氧化/还原型谷胱甘肽后,这一现象会得到很高程度的缓解(图6).SDS-PAGE图像经Image J软件分析,结果显示,只含尿素的复性体系复性率不足10%,使用添加氧化/还原型谷胱甘肽的复性体系后蛋白复性率达到50%以上,提升了约40%的复性效率.

A: 1:复性前蛋白;2~7:依次为含6 mol/L、4 mol/L、3 mol/L、2 mol/L、1 mol/L、0.5 mol/L尿素的复性缓冲液复性蛋白;8:PBS缓冲液复性蛋白.B:1~5:依次为含6 mol/L、4 mol/L、3 mol/L、2 mol/L、1 mol/L尿素的复性缓冲液复性蛋白;6:含0.5 mol/L尿素及GSH/GSSG复性缓冲液复性蛋白;7:含GSH/GSSG的PBS复性蛋白;M:marker (13~90 kD).图6 小鼠exPD-1蛋白复性Fig.6 Refolding of mouse exPD-1 protein
3 讨论
PD-1是一种重要的免疫检验点分子,其通过胞外部分与配体结合传递负性信号,抑制T细胞活化和细胞因子产生.在正常组织中,PD-1信号在维持体内免疫平衡、防止自身免疫反应中发挥重要作用;但在肿瘤微环境中,这一信号已被证实能够通过抑制细胞毒性T细胞功能,帮助肿瘤细胞逃避免疫监视[7].利用基因工程技术制备可溶性PD-1胞外段蛋白,或许可以竞争性阻断PD-1/PD-Ls通路,从而削弱其对T细胞、B细胞功能的抑制作用,增强CTL肿瘤杀伤能力,恢复免疫细胞的特异性的抗病毒功能.已在胰腺癌、黑色素瘤、结肠癌等小鼠肿瘤模型上证实PD-1的阻断能够有效增强抗肿瘤T细胞应答,延长小鼠生存期[8-10].此外,研究表明PD-1的阻断能够恢复T细胞功能,促进病毒清除[11].
已有研究者利用真核表达系统[12]和pGEX原核表达载体[13]表达PD-1胞外段蛋白.与真核表达系统相比,原核表达载体生产周期短,成本低,蛋白产量高.本实验成功构建pET-28a-exPD-1重组质粒并转化至宿主菌E.coliBL21(DE3)中,IPTG诱导表达后,SDS-PAGE检测到目的蛋白表达,蛋白以包涵体的形式存在.在实验过程中,为实现其可溶性表达,我们尝试进行低温诱导并降低IPTG浓度,希望减缓重组蛋白的表达速率,从而形成正确折叠,但未能阻碍包涵体的形成.进一步我们使用含8 mol/L尿素的变性缓冲液溶解包涵体,采用尿素梯度透析的方式,逐步降低变性剂的浓度来消除变性剂对蛋白的影响,使蛋白重新折叠,以获得可溶性蛋白.但在实验的过程中发现,单纯降低尿素浓度的复性方式并不能很好地实现exPD-1蛋白的复性,在复性后期,即低浓度的尿素复性缓冲液中,蛋白大量析出,从而严重影响复性效果.最终,我们尝试在含低浓度尿素的复性缓冲液中添加小分子物质氧化型和还原型谷胱甘肽,这种含巯基的化合物能够提供合适的氧化还原电位,帮助形成正确的二硫键[14].实验结果显示,此种复性方式蛋白复性率达到50%以上,与单纯的尿素梯度透析法相比,复性率明显提升.
重组质粒pET-28a-exPD-1的成功构建及小鼠exPD-1蛋白的诱导表达和纯化,为进一步研究PD-1的免疫学功能奠定了实验基础,但蛋白活性验证及复性方法的进一步优化,仍需要更多实验研究.
[1] KEIR M E, BUTTE M J, FREEMAN G J, et al. PD-1 and its ligands in tolerance and immunity [J]. Annu Rev Immunol, 2008, 26(1):677-704.
[2] SIMONE M, CLARA B, PIERLUIGI P. Coinhibitory molecules in cancer biology and therapy [J].Cytokine Growth Factor Rev, 2013, 24(2):147-161.
[3] CHEN L. Co-inhibitory molecules of the B7-CD28 family in the control of T-cell immunity [J]. Nat Rev Immunol,2004, 4(5):336-347.
[4] CHEMNITZ J M, PARRY R V, NICHOLS K E, et al. SHP-1 and SHP-2 associate with immunoreceptor tyrosine-based switch motif of programmed death 1 upon primary human T cell stimulation, but only receptor ligation prevents T cell activation [J]. J Immunol, 2004, 173(2):945-954.
[5] 黄夏冰, 康巧珍, 傅国, 等. GST-NAP融合蛋白可溶性表达及柱上切割GST标签 [J]. 郑州大学学报(理学版),2015, 47(4):94-98.
[6] SINGH A, UPADHYAY V, UPADHYAY A K, et al. Protein recovery from inclusion bodies ofEscherichiacoliusing mild solubilization process [J]. Microb Cell Fact, 2015,14(1):41.
[7] KIM J W, EDER J P. Prospects for targeting PD-1 and PD-L1 in various tumor types [J]. Oncology (Williston Park), 2014, 28(S3):15-28.
[8] NOMI T, SHO M, AKAHORI T, et al. Clinical significance and therapeutic potential of the programmed death-1 ligand/programmed death-1 pathway in human pancreatic cancer [J]. Clin Cancer Res, 2007, 13(7):2151-2157.
[9] PENG W, LIU C, XU C, et al. PD-1 blockade enhances T-cell migration to tumors by elevating IFN-gamma inducible chemokines [J]. Cancer Res, 2012, 72(20):5209-5218.
[10]IWAI Y, TERAWAKI S, HONJO T. PD-1 blockade inhibits hematogenous spread of poorly immunogenic tumor cells by enhanced recruitment of effector T cells [J]. Int Immunol, 2005, 17(2):133-144.
[11]CHINAI J M, JANAKIRAM M, CHEN F, et al. New immunotherapies targeting the PD-1 pathway [J]. Trends Pharmacol Sci, 2015, 36(9):587-595.
[12]覃晓琳, 刘朝奇, 唐国慧, 等. 小鼠可溶性PD1的克隆、真核表达及生物学活性检测[J]. 生物技术通报, 2011(2):121-125.
[13]覃晓琳, 刘朝奇, 唐国慧, 等. 小鼠PD-1胞外区基因片段表达、纯化及其多克隆抗体的制备[J]. 中国免疫学杂志, 2010,26(10):919-922.
[14]SONG H N, JANG J H, KIM Y W, et al. Refolded scFv antibody fragment against myoglobin shows rapid reaction kinetics [J]. Int J Mol Sci, 2014, 15(12):23658-23671.
(责任编辑:王浩毅)
Expression and Refolding of Mouse PD-1 Extracellular Protein inEscherichiacoli
JIANG Hui, KANG Qiaozhen, HUANG Xiabing, ZHANG Chenglong, LIU Xin
(SchoolofLifeSciences,ZhengzhouUniversity,Zhengzhou450001,China)
To obtain soluble mouse PD-1 extracellular (exPD-1) protein by using prokaryotic expression system, mouse exPD-1 gene was amplified from C57BL/6 mice spleen cells cDNA by PCR.The recombinant plasmid pET-28a-exPD-1 was constructed and expressed inE.coliBL21(DE3)after IPTG induction. The SDS-PAGE showed that exPD-1 recombined protein was about 17 kD and in the form of inclusion body. After solubilized in 8 mol/L urea and purified by Ni-NTA affinity column, the protein was refolded. A 40% of the renaturation rate was improved by adding GSH/GSSG compared with urea gradient dialysis, in which the former rate of refolding was more than 50%. The mouse PD-1 extracellular protein was successfully prepared, which lay the foundation for further study of the function of PD-1 in immunotherapy.
PD-1; prokaryotic expression vector; inclusion body; renaturation
2016-08-17
重大新药创制科技重大专项(2012ZX09103301-022);国家自然科学基金项目(U1204817,81373119).
江慧(1991—),女,河南平顶山人,硕士研究生,主要从事肿瘤免疫研究,E-mail:huijiang1991@126.com;通讯作者:刘鑫(1981—),女,甘肃白银人,讲师,主要从事免疫性疾病的发病机制及治疗研究,E-mail:liux@zzu.edu.cn.
Q786
A
1671-6841(2017)02-0111-05
10.13705/j.issn.1671-6841.2016204
——一道江苏高考题的奥秘解读和拓展

