CD14基因在不同发育阶段梅山猪各组织中的表达趋势和差异分析
钦伟云,甘丽娜,魏宗友,叶 兰,包文斌,吴圣龙*
(1.扬州大学江苏省动物遗传繁育与分子设计重点实验室,江苏扬州 225009;2.江苏省太仓市畜牧兽医站,江苏太仓 215400)
CD14基因在不同发育阶段梅山猪各组织中的表达趋势和差异分析
钦伟云1,甘丽娜1,魏宗友2,叶 兰2,包文斌1,吴圣龙1*
(1.扬州大学江苏省动物遗传繁育与分子设计重点实验室,江苏扬州 225009;2.江苏省太仓市畜牧兽医站,江苏太仓 215400)
为分析CD14基因在猪各组织中的发育表达差异情况,进一步探讨该基因的免疫调控机制,实验利用实时荧光定量PCR比较分析CD14基因在7个不同发育阶段梅山猪的12个组织中的表达水平。结果表明:CD14基因在不同发育阶段梅山猪的12个组织中均有表达,且在不同阶段呈现相对一致的表达规律,在肝中呈现极高的表达水平,在脾、肺、肠系膜淋巴结等组织中呈现中等的表达水平,在其他组织中呈现较低的表达水平。发育性表达分析显示,CD14基因在肝脏中从初生到成年一直保持较高的表达水平;在免疫组织(脾、肺、肾和胸腺)、肠道组织(十二指肠、空肠和回肠)和胃组织中,CD14基因的表达水平从初生起呈上升趋势,14或21日龄表达水平最高,之后呈下降趋势并一直保持较低的表达水平,在肠系膜淋巴结中,初生仔猪CD14基因的表达水平最高,之后显著下降并维持较低的表达水平。由此推测,CD14基因的表达水平变化趋势与仔猪自身免疫发育具有相对的一致性,且与仔猪抵抗开食期和断奶期的应激有着密切的联系。
CD14基因;猪;组织表达谱;发育性表达
白细胞分化抗原14(Cluster of Differentiation Antigen 14,CD14)是存在于单核细胞、巨噬细胞等细胞表面的白细胞分化抗原之一,同时作为脂多糖(Lipopolysaccharide,LPS)的细胞受体参与对革兰氏阴性菌的吞噬和消化。当革兰氏阴性菌进入动物机体内后,LPS从活菌体上缓慢释放或在菌体破碎后大量释放通过CD14的途径激活单核巨噬细胞、内皮细胞等免疫活性细胞,引起炎症介质以及细胞因子的合成及释放,产生一系列生物学效应从而起到抗感染作用;但炎症介质的过度释放又是发生感染性休克及多脏器功能不全的主要因素[1]。CD14作为一种分化抗原以及细胞受体,其在机体的免疫反应过程中尤其是革兰氏阴性菌引起的疾病中起着重要的调控作用。目前关于CD14基因mRNA水平上的研究多集中于人和鼠上[2-3],本课题组前期研究表明TLR信号通路,特别是CD14基因在中国地方猪种抵抗E. coli F18感染的过程中可能发挥重要的作用[4]。因此,本实验以不同发育阶段(初生、7、14、21、28、35、134日龄)的梅山猪为实验对象,采用荧光定量PCR检测CD14基因在梅山猪12个组织中的相对表达量,进而分析各个组织中该基因在不同发育阶段的表达差异,探讨CD14基因在梅山猪中的时空表达谱,为进一步探讨CD14基因在猪免疫调控中的作用及其分子机制提供参考和依据。
1 材料与方法
1.1 实验材料 本实验猪全部取自江苏省太仓市梅山猪保种场,分别在7个不同的生长发育阶段(初生、7、14、21、28、35、134日龄)在相同环境条件下饲养的5个家系中筛选出体重和体形等性状基本一致的个体各1头,即每个发育时期选取5头。每个样本屠宰取心、肝、脾、肺、肾、胃、肌肉、胸腺、肠系膜淋巴结、十二指肠、空肠和回肠等12个猪组织样,现场液氮保存,然后转移至实验室,液氮罐备用;Trizol裂解液购自Invitrogen(美国);反转录试剂盒和荧光定量试剂盒购自南京诺唯赞生物科技有限公司(中国,南京)。
1.2 引物设计 参照GenBank数据库中CD14基因序列(GenBank登录号:AB267810.1),利用Primer Premier 5.0软件设计Real-time PCR引物,以GAPDH和ACTB基因作为内参基因,引物均由生工生物工程(上海)股份有限公司合成。引物序列和预计扩增片段大小见表1。
1.3 提取各组织总RNA 按照Trizol Reagent说明书的要求提取12个组织中的总RNA,提取步骤严格按照Trizol Reagent说明书操作,并以1%甲醛变性琼脂糖凝胶电泳检测RNA完整程度,使用ND-1000核酸/蛋白浓度测定仪测定浓度及纯度,-70℃保存备用。以RNA为模板进行cDNA合成,cDNA合成反应体系(10 μL):5×qRT SuperMix II 2 μL,组织RNA 500 ng,RNase free ddH2O补足至10 μL。反应条件:25℃ 10 min,50℃ 30 min,85℃ 5 min,最后4℃保存。
1.4 实时荧光定量PCR 实时荧光定量PCR反应体系:模板 cDNA 2.0 μL,上、下游引物各0.4 μL(10 μmol/L),2× SYBR Premix ExTapTMII 10 μL,50× ROX Reference Dye II 0.4 μL,RNase free ddH2O补足至总体积20 μL,PCR 扩增程序:95℃30 s;95℃ 5 s,60℃ 34 s,共40个循环;为了分析扩增产物的特异性,在PCR扩增结束后采集多个信息点,进行熔解曲线的分析,每个样本设置3个重复,取平均值。
1.5 统计分析 相对定量的结果采用2-ΔΔCt法进行处理[5],并利用SPSS17.0软件一般线性模型(GLM)的Multivariate统计方法分析梅山猪不同生长发育阶段各组织的表达差异。
2 结果与分析
2.1 总RNA的纯度与完整性 提取后的各个组织总RNA经1.5%甲醛变性琼脂糖凝胶电泳,显现28S、18S、5S共3条带,无DNA污染条带及明显降解,且样本的A260/A280在1.8~1.9,表明提取的RNA完整性和纯度较高,可用于后续实验。
2.2 荧光定量PCR的扩增曲线与熔解曲线 CD14基因PCR扩增和熔解曲线表明,CD14基因的荧光定量PCR产物只有1个特异峰,无引物二聚体及非特异性产物形成,可用于进一步的荧光定量检测分析。
2.3 不同发育阶段梅山猪12个组织中CD14基因的相对表达量 通过荧光定量PCR检测了不同发育阶段梅山猪12个组织中CD14基因的表达水平,以GAPDH和ACTB基因为内参基因对表达结果进行均一化处理,并以35日龄梅山猪肌肉中CD14基因的平均表达量为1,计算得到该基因在不同发育阶段梅山猪各组织中的相对表达量。由图1可以发现,CD14基因在不同发育阶段梅山猪的12个组织中均有表达,并且在各个不同发育阶段都呈现相对一致的组织表达规律,其中在心脏和肌肉组织中表达水平极低,在肝、脾、肺、肠系膜淋巴结等组织中呈现很高的表达水平,在肾、胃、胸腺、十二指肠、空肠、回肠等组织中呈现中度或较低的表达水平。
2.4 CD14基因在梅山猪12个组织中的发育性表达趋势及差异分析 通过比较分析CD14基因在梅山猪10个组织(除心和肌肉组织)中的发育性表达趋势及差异可以发现(图2),该基因在各组织中的表达水平随生长发育的进程呈现不同的变化规律。CD14基因在肝脏中从初生到成年一直保持较高的表达水平;在脾、肺、肾、胃和胸腺组织中,CD14基因的表达水平从初生到14日龄呈上升趋势,14~21日龄表达水平最高,之后呈下降趋势;在肠道(十二指肠、空肠和回肠组织)中,CD14基因的表达水平从初生到21日龄呈上升趋势,21日龄表达水平最高,之后呈下降趋势并一直保持较低的表达水平;在肠系膜淋巴结中,初生仔猪CD14基因的表达水平最高,之后显著下降并维持较低的表达水平。

表1 基因荧光定量引物
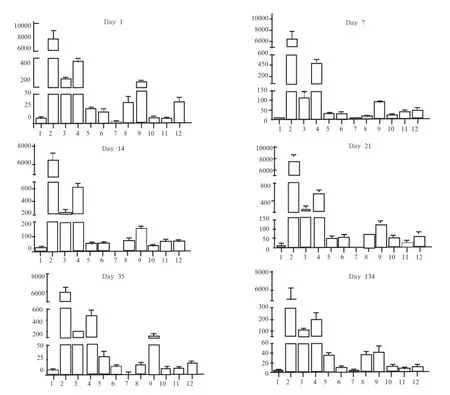
图1 梅山猪不同发育时期不同组织CD14基因表达谱
3 讨 论
CD14根据其在体内的存在形式和分布可分成两类:一类是位于单核细胞、巨噬细胞和中性白细胞等细胞细胞膜上的膜结合型CD14(Membrane-Bound Form CD14, mCD14);另一类是主要存在于血浆(清)中的可溶性CD14(Soluble CD14,sCD14)。mCD14和sCD14的生物学活性相似,都可以和LPS/LBP复合物结合并产生相应的病理生理反应。当革兰氏阴性菌进入血液后,LPS会和脂多糖结合蛋白(Lps Binding Protein,LBP)结合形成LPS/LBP复合物,随即被单核/巨噬细胞上的mCD14识别并结合,刺激单核细胞等分泌TNF、IL-1等细胞因子从而介导免疫和炎症反应,同时mCD14还介导单核细胞等对LPS /LBP复合物的吞噬作用,清除被LBP调理后的革兰阴性细菌和LPS[6]。内皮细胞、上皮细胞等细胞表面不存在mCD14,此时由sCD14起到对LPS以及LPS /LBP复合物的介导反应[7],sCD14可与LPS /LBP复合物结合或者直接与LPS 结合,形成复合物再将信息传递给内皮细胞、上皮细胞[8]。由此可见,CD14基因在调控革兰氏阴性菌引起的疾病中可能存在重要的作用。
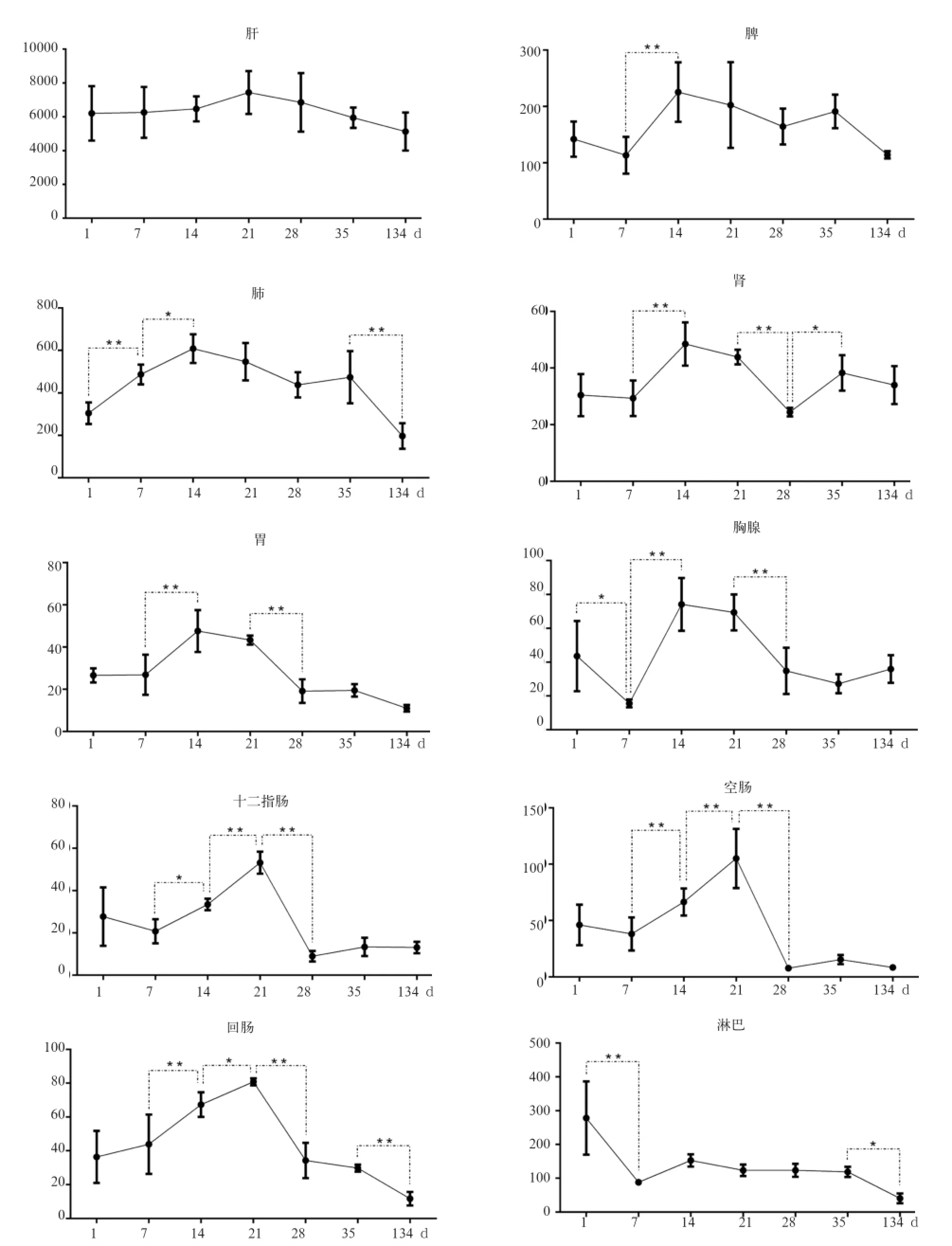
图2 梅山猪同一组织不同发育阶段CD14基因的表达变化规律
3.1 梅山猪CD14基因的组织表达分析 本实验对不同发育阶段梅山猪12个组织中的CD14基因表达谱进行分析后发现,CD14基因的表达具有广泛性,不存在明显组织特异性,并且该基因在梅山猪的不同发育阶段呈现相对一致的表达规律,其中在肝中呈现极高的表达水平,在脾、肺、肠系膜淋巴结等组织中呈现中等的表达水平,在心、肾、胃、肌肉、胸腺、十二指肠、空肠、回肠等组织中呈现较低的表达水平,这与夏日炜[9]和Qiu等[10]在其他品种中的研究结果一致。肝脏是机体中最大的清除外来有毒物质的器官,在机体的代谢过程中产生的废物、内毒素等随门静脉进入肝脏后被解毒,但当动物发生内毒素血症时,肝脏会受到严重的损伤[11]。由此可见,肝脏是最易受LPS伤害的主要靶器官之一,这可能也是CD14基因在肝脏中高表达的原因。单核/巨噬细胞均起源于骨髓干细胞,在骨髓中经前单核细胞分化发育为单核细胞,进入血液后随血液流到全身各种组织,一部分进入组织的巨噬细胞随即发生形态变化,如肝脏中的库普弗细胞、肺脏中的肺泡巨噬细胞、结缔组织中的组织细胞以及脾和淋巴结中的固定和游走巨噬细胞等[12]。脾是机体最大的免疫器官,占全身淋巴组织总量的25%,含有大量的淋巴细胞和巨噬细胞,是机体细胞免疫和体液免疫的中心,淋巴同样是机体产生免疫应答的重要器官之一。肺是机体重要的呼吸器官,能和外界直接进行物质交流和接触。因此,肺更易受到外界有害物质和病原菌的侵害,肺巨噬细胞作为呼吸系统防御体系中重要的组成部分,在外界有害物质侵入时发挥着重要作用。脾、肺和肠系膜淋巴结中都存在大量的巨噬细胞,而mCD14主要存在于巨噬细胞上,这可能是CD14基因在脾、肺和肠系膜淋巴结中呈现中等水平表达的原因。
3.2 CD14基因在梅山猪不同发育阶段的表达差异分析 7、21日龄时CD14基因在各组织中的表达变化较为明显。5~7日龄是仔猪的开食期,开食喂料过多或过少都会影响仔猪正常的生长发育,产生应激;21日龄是梅山猪的断奶期,断奶对仔猪来说是一个很大的应激,饲料、生活环境的改变可能继发由大肠杆菌等引起的病原性腹泻,而大肠杆菌是革兰氏阴性菌的一种,大肠杆菌在肠道中的黏附会导致肠道LPS的浓度升高,CD14介导细胞反应的作用受到LPS浓度的影响[13]。因此,7日龄和21日龄时CD14基因在各组织中的表达变化可能与仔猪在开食、断奶2个阶段的应激相关,是仔猪适应肠道内环境及LPS浓度产生的应激机制。此外,CD14基因在肝中持续高表达可能与肝作为机体的解毒器官一直在发挥清除代谢废物和内毒素的作用有关,同时也表明肝脏的解毒功能与CD14基因具有密切的相关性。初生仔猪的免疫保护主要来自于从母乳中获得的被动免疫,以及仔猪自身免疫系统的发生、发育而形成的主动免疫,仔猪的被动免疫在7日龄达到高峰之后下降,自身免疫系统在4~5周开始发挥作用[14],Toll样受体在先天性免疫中发挥着重要的调控作用,CD14作为TLR4的共受体在仔猪自身免疫系统的发生、发育的过程中可能具有重要的作用,这可能是梅山猪免疫组织(脾、肺、肾和胸腺组织)和肠道组织(十二指肠、空肠和回肠组织)中CD14基因的相对表达量从初生一直呈上升趋势,直到21日龄左右达到最高值的原因,第4周后仔猪自身免疫系统开始发挥作用,因此CD14基因的表达量显著下降并维持在较低的水平。基于本实验的结果,结合夏日炜等[9]在大白猪F18大肠杆菌病耐受型和敏感型个体间CD14基因的差异表达分析,以及前期运用Agilent双标记表达谱芯片,对苏太猪资源群体内F18大肠杆菌抗性型和敏感型全同胞个体十二指肠组织内差异表达基因及调控通路进行了分析,筛选出对苏太猪断奶仔猪抗F18大肠杆菌可能具有重要调控作用的鞘糖脂生物合成—球系列通路以及包含CD14基因在内的Toll-like信号炎症免疫通路[15],可以说明CD14基因的表达水平变化可能与断奶仔猪抗F18大肠杆菌等革兰氏阴性菌的侵害存在一定的相关性,今后有必要通过在细胞水平上的干扰和过表达来进一步验证分析CD14基因和仔猪抗F18大肠杆菌的具体相关性及其可能的分子调控机制。
4 结 论
CD14基因的表达不存在明显组织特异性,且在肝中呈现极高的表达水平,脾、肺、肠系膜淋巴结等组织呈现中等表达水平,在其他组织中呈现较低的表达水平;CD14基因在肝脏中从初生到成年一直保持较高的表达水平,在免疫组织(脾、肺、肾和胸腺)、肠道组织(十二指肠、空肠和回肠)和胃组织中,CD14基因的表达水平从初生起呈上升趋势,14或21日龄表达水平最高,之后呈下降趋势。CD14基因的表达水平变化趋势与断奶仔猪抗F18大肠杆菌具有密切的联系。
[1] 陈理华. CD14分子的受体作用及其信号传递[J]. 国外医学: 免疫学分册, 2000, 23(3): 137-140.
[2] 王灵芝. 急性脑梗塞伴急性肺损害时肺内毒素受体CD14基因的表达[J]. 中国误诊学杂志, 2004, 4(8): 1198-1200.
[3] 杨爱东, 李文雯, 王利霞, 等. 急性肺损伤大鼠肺组织Toll样受体4及CD14mRNA的表达[J]. 中国实验动物学报, 2011, 19(3): 216-219.
[4] Wu Z, Liu Y, Dong W, et al. CD14 in the TLRs signaling pathway is associated with the resistance to E. coli F18 in Chinese domestic weaned piglets[J]. Sci Rep, 2016, 6:24611.
[5] Oparina N Y, Sadritdinova A F, Snezhkina A V, et al. Increase in NETO2 gene expression is a potential molecular genetic marker in renal and lung cancers[J]. Russ J Gene, 2012, 48(5): 506-512.
[6] Wright S D, Ramos R A, Tobias P S, et al. CD14, a receptor for complexes of lipopolysaccharide (LPS) and LPS binding protein[J]. Science, 1990, 249(4975): 1431-1433.
[7] Frey E A, Miller D S, Jahr T G, et al. Soluble CD14 participates in the response of cells to lipopolysaccharide[J]. J Exp Medi, 1992, 176(6): 1665-1671.
[8] Jin Y, Gupta D, Dziarski R. Endothelial and epithelial cells do not respond to complexes of peptidoglycan with soluble CD14 but are activated indirectly by peptidoglycaninduced tumor necrosis factor-alpha and interleukin-1 from monocytes[J]. J Infect Dis, 1998, 177(6): 1629-1638.
[9] 夏日炜, 宗秋芳, 庄亚润, 等. CD14基因在大白猪F18大肠杆菌病耐受型和敏感型个体间的差异表达分析[J].中国畜牧杂志, 2016, 52(1): 13-16.
[10] Qiu X T, Li Y H, Li H J, et al. Molecular cloning, mapping, and tissue expression of the porcine cluster of dif f erentiation 14 (CD14) gene[J]. Biochem Genet, 2007, 45(5-6): 459-468.
[11] 毕铭华, 张淑文, 王宝恩, 等. 内毒素血症对大鼠肝细胞线粒体的损伤及其机制[J]. 中国应用生理学杂志, 2004, 20(1): 90-91.
[12] Gordon S, Taylor P R. Monocyte and macrophage heterogeneity[J]. Nat Rev Immunol, 2005, 5(12): 953-964.
[13] Perera P Y, Vogel S N, Detore G R, et al. CD14-dependent and CD14-independent signaling pathways in murine macrophages from normal and CD14 knockout mice stimulated with lipopolysaccharide or taxol[J]. J Immunol, 1997, 158(9): 4422-4429.
[14] Miller B G, James P S, Smith M W, et al. Ef f ect of weaning on the capacity of pig intestinal villi to digest and absorb nutrients[J]. J Agri Sci, 1986, 107(3): 579-590.
[15] Bao W B, Ye L, Pan Z Y, et al. Microarray analysis of dif f erential gene expression in sensitive and resistant pig to Escherichia coli F18[J]. Anim genet, 2012, 43(5): 525-534.
Tissue Expression Trend and Dif f erentiation of CD14 Gene in Dif f erent Development Stages of Meishan Pigs
QIN Wei-yun1, GAN Li-na1, WEI Zong-you2, YE Lan2, BAO Wen-bin1, WU Sheng-long1*
(1. Key Laboratory for Animal Genetics, Breeding, Reproduction and Molecular Design of Jiangsu Province, Yangzhou University, Jiangsu Yangzhou 225009, China; 2.Taicang Animal Husbandry and Veterinary Station of Jiangsu Province, Jiangsu Taicang 215400, China)
This study aims to analyze developmental expression dif f erences of CD14 gene in porcine tissues, and further explore it’s immune regulation mechanism. CD14 gene expressions in 12 tissues from 7 development stages of Meishan pigs were determined by real-time quantitative PCR. The results showed that the CD14 gene was broadly expressed in all tissues, and the expression pattern was relatively consistent in dif f erent stages. In the liver, CD14 gene had a higher expression level, the moderate in spleen, lung and mesenteric lymph nodes, and other tissues were lower. Meanwhile, expression level of CD14 gene remained high from newborn to adult in the liver; In immune tissues (spleen, lung, kidney and thymus), intestinal tissues (duodenum, jejunum and ileum) and stomach, the expression levels of CD14 gene was increased since newborn, and reached the highest level at 14 or 21 days of age, then declined and maintained a low level; In mesenteric lymph nodes, CD14 gene expression level was the highest when the newborn, then declined signif i cantly and maintained a low level. Thus we speculate that the expression trend and dif f erentiation of CD14 gene is consistent with autoimmune development of piglet, and has a close correlation with stress of resistance to starting feed period and weaning period.
CD14 gene; Pig; Tissue expression prof i le; Developmental expression
S828.2
A
10.19556/j.0258-7033.2017-04-038
2016-11-27;
2016-12-04
江苏省科技支撑计划重点项目(BE2014357);苏州市科技局攻关项目(SNG201628)
钦伟云(1992-),男,浙江湖州人,硕士,研究方向为猪抗病育种,E-mail:qinwy24@163.com
* 通讯作者:吴圣龙(1963-),男,江苏泰州人,博士,研究员,研究方向为猪抗病育种,E-mail: pigbreeding@163.com

