大豆中主要抗原蛋白表位的研究进展
娜仁高娃,赵 元,强嘉楠,孙赵洋,潘 丽,袁志杰
(动物生产及产品质量安全教育部重点实验室,动物营养与饲料科学吉林省重点实验室,吉林农业大学动物科学技术学院,吉林长春130118)
大豆中主要抗原蛋白表位的研究进展
娜仁高娃,赵 元*,强嘉楠,孙赵洋,潘 丽,袁志杰
(动物生产及产品质量安全教育部重点实验室,动物营养与饲料科学吉林省重点实验室,吉林农业大学动物科学技术学院,吉林长春130118)
本文简要介绍了大豆中主要的抗原蛋白如大豆球蛋白、β-伴大豆球蛋白、Gly m Bd 30K、Gly m Bd 28K等具有强烈的致敏原性的抗原蛋白其抗原表位的研究进展,将从大豆抗原蛋白抗原表位的鉴定方法和研究进展两方面做一综述。
大豆;抗原蛋白;表位;致敏
大豆作为一种营养价值很高的植物性蛋白来源被广泛应用在食品及饲料工业中,而大豆中含有的多种抗营养因子可以引发幼龄动物过敏反应,导致其肠道损伤进而影响动物的生长发育,使幼龄动物对饲料的消化利用率降低,对畜牧业造成很大危害。大豆中的抗原蛋白可以分为2S、7S、11S和15S 4个组成成分[1-4]。大豆球蛋白含糖蛋白较少,属于11S球蛋白,是大豆蛋白中最大的单体蛋白,其中酸性亚基可引起人体和动物的过敏[5]。凝集素、β-淀粉酶、Gly m Bd 28K、Gly m Bd 30K、脂肪氧化酶和β-伴大豆球蛋白共同构成7S组分,β-伴大豆球蛋白是由α、α'和β 3个亚基组合而成的三聚体,并以α和α'亚基的抗原性最强[6]。2S组分有胰蛋白酶抑制剂、细胞色素c尿酶素、2S球蛋白等,15S组分占大豆蛋白的4.6%,它不是单纯的某种蛋白质,而是由多种蛋白质分子构成[7]。近些年来,国内外学者对大豆抗原蛋白进行了深入研究,而作为蛋白质致敏的重要“元凶”——抗原表位,包括大豆球蛋白、β-伴大豆球蛋白、Gly m Bd 30K、Gly m Bd 28K的抗原表位也得到了进一步揭示。大豆抗原蛋白抗原表位的研究可以对单克隆抗体的制备、饲料原料中抗原蛋白含量的降低、动物致敏机理的研究等工作起指导性作用,因而大豆抗原蛋白的研究十分重要。
1 抗原表位的定义、功能意义
抗原表位又被称为抗原决定簇,通常指抗原分子中可以决定抗原特异性的特殊化学基团,是抗原分子中最主要的功能单位,可以有效地刺激机体发生细胞免疫和体液免疫[8-10]。根据抗原表位能够发生特异性免疫应答的程度,可以用免疫优势表位、亚优势表位和隐性表位来区分抗原表位。根据其结合受体的差异,抗原表位可以分为T细胞表位和B细胞表位;按照结构的不同可以分为线性表位和构象表位,通常由5~17个氨基酸残基或5~7个多糖残基或核苷酸组成[11-12]。线型表位为T细胞表位和一部分B细胞表位,构象型表位均为B细胞表位[13],线性表位是由在抗原分子上的一段连续不间断的氨基酸序列组成,构象表位则是由于蛋白质特有的三级结构所产生的空间折叠,从而发生本不连续的氨基酸在结构上的相互接近,进而形成次级结构而组成的。大豆抗原蛋白的晶体结构目前已经被解析,而抗原表位存在的某些特征也体现在了晶体结构上,如大豆球蛋白和β-伴大豆球蛋白的晶体结构(图1和图2)[13-14],常用于抗原表位预测的依据主要有亲水性、可及性和可塑性。抗原表位是抗原抗体能够发生特异性反应的基础,一旦抗原表位遭到破坏,抗原蛋白就无法引发动物的过敏反应。研究表明,某些种类的免疫调节剂,如维生素C和硫辛酸,可以特异性阻断由IgE介导的过敏反应[15],在经由食物所产生的过敏反应中,过敏原并不是通过其完整的大分子结构来发挥致敏作用,而是通过胃肠道的消化所产生的含有过敏原抗原表位的蛋白片段与抗体发生特异性反应,从而使机体产生过敏反应。因此,要对大豆抗原蛋白进行研究,首要工作就是要研究清楚大豆抗原蛋白的抗原表位。
2 大豆抗原表位的研究方法
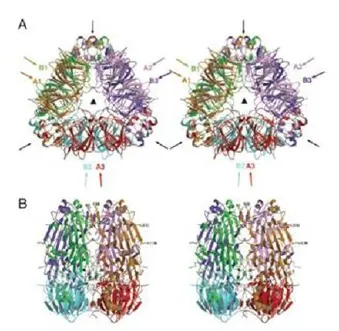
图1 大豆球蛋白的空间结构
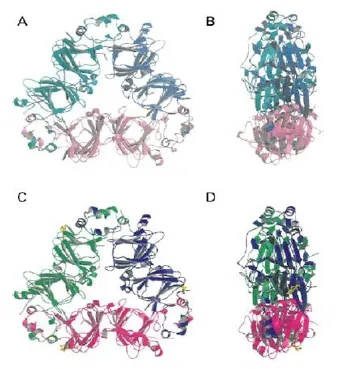
图2 β-伴大豆球蛋白的空间结构
2.1 生物信息学法预测 由于大豆抗原蛋白抗原表位由氨基酸构成,因而在试验中会使用生物信息学软件来对抗原表位的氨基酸序列做出预测。关于大豆抗原蛋白线性表位的预测均基于蛋白质的一级结构,常用指标包括氨基酸的理化特性、结构特点、统计显著性等指标,由此获得一系列具体的计算方式,如亲水性越高的氨基酸残基越容易形成抗原表位、可及性高说明该部分氨基酸残基有较大的几率与相应抗体结合,而活动性较强的氨基酸残基具有较大的可塑性,更容易构成抗原表位[16-20]。但以上计算指标在单独运用时,具有一定的局限性,因此常被联合使用,用以提高线性表位预测的准确率。对于构象表位的预测通常基于蛋白质三级结构所具有的特点,但由于蛋白质的空间结构相对复杂,预测难度相较线性表位来讲更难,准确性也越低。
2.2 蛋白质酶解法 酶解法是一个能够直接定位线性及构象性抗原表位的方法,又被称做蛋白质足迹分析(Protein Footprinting),指利用多种或单一酶将过敏原分解为多个短肽段,再逐一检测这些短肽是否具有过敏原性,进而确定哪部分肽段与过敏反应有关,从而获得构成抗原表位的氨基酸序列[17]。或是将抗原蛋白先与抗体进行反应,而后利用相应的酶来进行水解,抗原表位与抗体结合的部位会受到保护而不与酶发生反应,从而检测出相应的抗原表位[9,13,16]。酶解法研究抗原表位的过程比较复杂,酶解的条件、抗原-抗体结合的条件、解离的完全程度、解离后的片段是否能有效分离、酶解片段的大小等都会对结果产生一定的影响。
2.3 肽扫描技术 对于一些氨基酸序列已知的抗原蛋白来说,应用肽扫描这种方法进行线性抗原表位的鉴定是一种便捷的准确性高的检测方法。肽扫描技术是在合成固相多肽后,使合成的固相多肽与该种抗原的特异性抗体反应,根据其结果判断该多肽是否为抗原表位。应用这种方法必须同时满足2个条件:一是该种抗原蛋白的一级结构已知;二是获得该种抗原的抗血清或单克隆抗体。合成多肽经过与载体蛋白偶联,可以在硝酸纤维素上点膜,进行Dot-blot试验,筛选抗原表位。目前,常用的载体蛋白有3种:牛血清白蛋白(BSA)、血蓝蛋白(KLH)和鸡卵白蛋白(OVA)[10,13]。但是,大部分可视抗原表位是氨基酸序列上并不接近但在空间结构上存在相互作用的构象表位,因而,肽扫描技术只能够检测线性表位,并不能提供构象表位信息。
2.4 质谱技术 利用免疫亲和技术分离抗体结合肽,然后用质谱技术鉴定含有抗原表位的肽段,也是一种常用的鉴定抗原表位的方法。质谱技术主要针对分子间的非共价键反应如抗原-抗体间的特异性结合进行分析,在灵敏度、样品用量、分析速度上都优于X-射线衍射和核磁共振技术,并且能同时进行分离和鉴定[12,21-26]。近些年来,随着电雾离子源(ESI)技术的出现,分子能够无损的从液相过渡到气相,也因此质谱技术在研究抗原表位的构象方面有着越来越难以取代的作用。
2.5 氨基酸定点突变技术 氨基酸定点突变是人工将氨基酸序列上的某个氨基酸突变,然后比较突变型抗原和野生型抗原与抗体的识别情况,以此为依据鉴定抗原表位[10]。尽管氨基酸定点突变是该氨基酸作为抗原表位最有力的证明,但一个特定的氨基酸突变可能从以下几个方面影响抗原与抗体结合的能力:①抗原抗体的结合与否,可能取决于抗原表位的8个或更关键的几个氨基酸残基,因而,只是单一残基的突变对标准抗体检测的衡量可能并不准确,对此,可以采用多点突变。②用来代替的氨基酸的性质也可能影响抗原表位与抗体的结合。尽管氨基酸的亲疏水性、带电荷数和侧链均很重要,但这些特性在线性表位或构象表位中的作用却因抗体差异而产生区别,所以,大片段氨基酸残基取代小片段氨基酸残基可能会限制在构象表位上与抗体结合,相反小片段氨基酸残基取代大片段氨基酸残基可能会降低原氨基酸残基和抗体的结合能力。③抗原表位之外的氨基酸突变也可能引起抗原自身结构的明显变化,进一步影响抗原和抗体的结合,显而易见,这种情况下抗原结构并不受到突变影响[10]。
3 大豆抗原表位的鉴定
3.1 大豆球蛋白抗原表位的鉴定 大豆球蛋白作为一种大豆中常见的致敏蛋白,由6个亚基组成,且酸性肽链比碱性肽链容易水解,大豆球蛋白能引起幼龄动物强烈的致敏反应,但目前国内鲜有相关的研究报道。Hu等[27]研发了新型大豆球蛋白的纯化方法,该方法是基于单克隆抗体4B2的亲和免疫层析法,在提高了纯度产率和生物活性的同时节约了时间和成本,而高纯度的大豆球蛋白无疑有利于在未来进一步揭示其致敏机理。Xiang等[28]通过表位作图法和氨基酸定点突变等方法鉴定出了S219-N233(S219GFAPEFLKEAFGVN233)是G2a亚基的人IgE结合表位,该肽IgE中心结合区在E224和V232之间,IgE结合的最关键氨基酸为F225、L226和F230。尽管免疫印迹结果表明大豆球蛋白的碱性和酸性亚基几乎同样具有抗原性,但Earl Taliercio 通过Elisa法验证了大豆球蛋白Gy1(A1aBx)亚基基本没有被猪致敏血清识别[25]。Gy1(A1aBx)亚基对仔猪IgG结合能力比Gy4(A1aBx)及其他亚基更低。虽然致敏血清能够识别Gy1(A1aBx)和Gy4(A1aBx)亚基的重叠区域,但没有致敏血清能共同识别A5A4B3和A1aBx[29]。由此可知,大豆球蛋白不同种亚基上的抗原表位的氨基酸序列互有重叠但并不完全相同,且同种亚基上的抗原表位的氨基酸序列对不同实验材料也有所不同。Chen[30]建立了用于鉴定微量大豆球蛋白的夹心ELISA法,该方法的测定范围为3~200 ng / mL,检测限为1.63 ng/mL,该方法具有高灵敏度和强特异性的特点,对于日后筛选并去除大豆球蛋白的抗原表位具有重要意义。
3.2 7S组分大豆抗原蛋白抗原表位的鉴定 Gly m Bd 28K、Gly m Bd 30K和β-伴大豆球蛋白均属于大豆球蛋白7S组分,且致敏性均很强。目前国内外学者对于大豆抗原蛋白7S组分的研究相对较多,其中大部分采用了信息学法预测抗原表位后再进行验证,也有使用酶解法将抗原蛋白进行酶解后再分析抗原蛋白抗原表位,但是胃蛋白酶和胰蛋白酶有着十分明显的专一性,胃蛋白酶很难有效地水解 β-Conlycinin 的β亚基。虽然生物信息学软件对抗原表位进行预测可以避免一部分抗原表位被酶解而消失,但仍需要进行后续的验证。闫慧丽等[31]利用生物信息学软件 DNAStar、Disco Tope 2.0 和SOPMA和肽扫描法成功预测并鉴定出了 Gly m Bd 28K 蛋白的4个线性表位5~13、75~77、175~177、200~203和 6个 构 象 表 位 11~14、40~41、43、114~115、185~192、194~207, 其 中 11~13和200~203两段氨基酸序列为线性表位和构象表位的公共序列。单晓红等[32]利用 DNAStar、SOPMA 预测了 Gly m Bd 30K 的二级结构并结合其模拟的三级结构,预测出了 Gly m Bd 30K 的4个抗原表位,并使用点杂交法进行定性分析验证了11段短肽是β-伴大豆球蛋白α亚基主要的线性表位。Sun等[33]综合DNAStar、SOPMA和BepiPred的预测结果,预测出了β-伴球蛋白α 亚基上的 15 个线性表位,利用大豆过敏患者血清 IgE 鉴定 15 条合成多肽,其中11个表位被鉴定为主要的IgE结合表位。Ricki等[8]通过肽扫描方法筛选得到了Gly m Bd 30K 5个抗原表位区域,分别是3~12、100~109、207~225、229~238、340~359。虽然大豆抗原蛋白7S组分含有的抗原蛋白种类较多,但其抗原表位仍然表现出了明显的差异性,其中线性表位和构象表位的氨基酸序列互有重叠,预测后的抗原表位经各种方法验证也多为抗原表位,由此也可以证明生物信息学法预测的准确性。Taliercio等[34]证实了β-伴大豆球蛋白的β亚基上的抗原表位对于猪、狗、兔和鱼存在着差异,虽然有很大一部分的重叠肽段,但并不完全一致,由此也可以证明同一种致敏原对于不同动物在抗原表位上存在着差异。
4 小 结
抗原表位是抗原分子能够被T细胞和B细胞特异性识别的关键。大豆作为一种重要的饲料原料和食物来源,从源头分析并遏制其免疫原性是使大豆制品能够更广泛应用的关键。近年来大豆抗原蛋白得到了足够的重视和研究,关于大豆抗原蛋白的单抗和纯化及检测的方法时有创新,许多新的成果也进一步应用到了生产上,不过在分子层面的研究上仍有所不足,虽然其构象和线性表位也不断被海内外学者所发现,但在抗原构象表位的研究领域仍有不足,大部分实验仍然停留在抗原蛋白线性表位的研究上,许多研究方法或因其难度或因其造价而没有得以应用,且不同种属动物对大豆抗原蛋白表位区的敏感程度不同。关于大豆抗原蛋白抗原表位相关信息需要被进一步揭示,以期为揭示其致敏机理、优化其检测方法、寻找其致敏阻断剂等服务。
[1] 朱翠, 蒋宗勇, 郑春田, 等. 大豆抗原蛋白的组成及其致敏作用机理[J]. 动物营养学报, 2011, 23(12): 2053-2063.
[2] 刘宾. 大豆主要致敏原的免疫检测研究[D]. 北京: 中国农业科学院, 2011.
[3] 韩鹏飞, 姜学, 马曦. 大豆抗原蛋白研究进展[J]. 中国畜牧杂志, 2009, 45(19): 69-72.
[4] 秦贵信, 孙泽威, 赵元,等. 大豆中主要抗原蛋白的研究进展[J]. 吉林农业大学学报, 2008, (4): 553-558.
[5] Adachi M, Kanamori J, Masuda T, et al. Crystal structure of soybean 11S globulin: glycinin A3B4 homohexamer[J]. Proc Natl Acad Sci, 2003, 100(12): 7395-7400.
[6] Amigo-Benavent M, Clemente A, Ferranti P, et al. Digestibility and immunoreactivity of soybean β-conglycinin and its deglycosylated form[J]. Food Chem, 2011, 129(4):1598-1605.
[7] Tay S L, Kasapis S, Perera C O, et al. Functional and structural properties of 2S soy protein in relation to other molecular protein fractions[J]. J Agric Food Chem, 2006, 54(16): 6046-6053.
[8] Helm R M, Cockrell G, Connaughton C, et al. Mutational analysis of the IgE-binding epitopes of P34/Gly m Bd 30K [J]. J Allergy Clin Immun, 2000, 105(2):378-384.
[9] 张伟, 余传信. 抗原表位的研究进展及其应用[J]. 中国血吸虫病防治杂志, 2012, 24(1): 99-103.
[10] 文雪霞, 陈化兰, 熊永忠,等. 抗原表位鉴定方法的研究进展[J]. 中国畜牧兽医, 2012, (7): 66-70.
[11] Sugahara T, Yamada Y, Yano S, et al. Heat denaturation enhanced immunoglobulin production stimulating activity of lysozyme from hen egg white[J]. Biochim Biophys Acta (BBA)-General Subjects, 2002, 1572(1): 19-24.
[12] 武涌. 牛乳β-乳球蛋白构象性表位定位及结构特征研究[D]. 南昌: 南昌大学, 2012.
[13] Adachi M, Kanamori J, Masuda T, et al. Crystal structure of soybean 11S glycinin A3B4 homohexamer[J]. P Natl Acad Sci USA, 2003, 100(12):7395-7400.
[14] Maruyama N, Adachi M, Takahashi K, et al. Crystal structures of recombinant and native soybean β-conglycinin β homotrimers[J]. Eur J Biochem, 2001, 268, 3595-3604.
[15] He L, Han M, Qiao S, et al. Soybean antigen proteins and their intestinal sensitization activities[J]. Curr Protein Pept Sci, 2015, 16(7):613-621.
[16] 马凡舒, 张蕾, 王洋,等. B细胞抗原表位预测方法的研究进展[J]. 中国畜牧兽医, 2016, (1): 63-67.
[17] 宋帅, 李春玲, 贾爱卿,等. 抗原表位研究方法进展[J].动物医学进展, 2010, (12): 87-91.
[18] 闫慧丽. 大豆主要过敏原Gly m Bd 28K IgG结合表位的定位研究[D]. 郑州: 河南工业大学, 2016.
[19] 侯英, 白雪娟, 梁艳,等. 结核分枝杆菌Rv1242蛋白抗原表位的预测[J]. 郑州大学学报(医学版), 2016, (3): 345-348.
[20] 李江英, 白雪娟, 梁艳,等. 应用DNAStar软件预测结核分枝杆菌Rv3812的抗原表位[J]. 郑州大学学报(医学版), 2016, (2): 474-477.
[21] 李欣, 陈红兵. 牛奶过敏原表位研究进展[J]. 食品科学, 2006, (11): 592-598.
[22] 李海侠, 毛旭虎. 蛋白质抗原表位研究进展[J]. 微生物学免疫学进展, 2007, (1): 54-58.
[23] 万翠红, 黎根, 刘志强, 等. 免疫亲和质谱法研究β2-微球蛋白抗原表位[J]. 化学学报, 2008, (13): 1572-1576.
[24] 刘新生, 王永录. 质谱技术在抗原表位研究中的应用[J].江西农业学报, 2010, (5): 152-154.
[25] 李雪美, 王富强, 沈飞,等. 免疫亲和质谱技术鉴定抗血管性血友病因子单克隆抗体SZ-125的抗原表位[J]. 细胞与分子免疫学杂志, 2013, (3): 284-291.
[26] 黎根, 刘宁, 刘志强,等. β2-微球蛋白连续表位的免疫亲和质谱研究[J]. 高等学校化学学报, 2007, (1): 92-96.
[27] Hu S, Liu H, Qiao S, et al. Development of immunoaffinity chromatographic method for isolating glycinin (11S) from soybean proteins[J]. Agric Food Chem, 2013, 61(18):4406-4410.
[28] Xiang P, Beardslee T A, Zeece M G, et al. Identification and analysis of a conserved immunoglobulin E-binding epitope in soybean G1a and G2a and peanut Ara h 3 glycinins[J]. Arch Biochem Biophys, 2002, 408(1): 51-57.
[29] Taliercio E, Kim S W. Epitopes from two soybean glycinin subunits are antigenic in pigs[J]. Sci Food Agric, 2013, 93(12):2927-2932.
[30] Chen J, Wang J, Song P, et al. Determination of glycinin in soybean and soybean products using a sandwich enzymelinked immunosorbent assay[J]. Food Chem, 2014, 162:27-33.
[31] 闫慧丽, 席俊, 贺梦雪, 等. 大豆主要过敏原Gly m Bd 28K的同源建模和B细胞表位的预测[J]. 河南工业大学学报(自然科学版), 2016, (4):41-45.
[32] 单晓红, 孙秀兰, 管露, 等. 大豆主要过敏原Gly m Bd 30K抗原决定簇表征预测研究[J]. 分析科学学报, 2012, (6):771-774.
[33] Sun X, Shan X, Yan Z, et al. Prediction and characterization of the linear IgE epitopes for the major soybean allergen β-conglycinin using immunoinformatics tools[J]. Food Chem Toxicol, 2013, 56:254-260.
[34] Taliercio E, Loveless T M, Turano M J, et al. Identif i cation of epitopes of the β subunit of soybean β-conglycinin that are antigenic in pigs, dogs, rabbits and fish[J]. Sci Food Agric, 2014, 94(11):2289-2294.
Advances in the Major Allergic Protein Epitopes of Soybean
NARENGAOWA, ZHAO Yuan*, QIANG Jia-nan, SUN Zhao-yang, PAN Li, YUAN Zhi-jie
(1. Biologic and geographic science institute of Yili Normal University, Xinjiang Yili 835000, China; 2. College of animal science, Xinjiang Agricultural University, Xinjiang Urumqi 830052, China)
This paper reviews the progrocess on the major allergic protein epitopes of soybean, such as glycinin, β-conglycinin, Gly m Bd 30K and Gly m Bd 28K, mainly including the identified methods and the identification of soybean antigen epitopes.
Soybean; Allergic protein; Epitope; Sensitization
S816
A
10.19556/j.0258-7033.2017-04-008
2016-11-18;
2016-12-11
国家自然科学基金(31572439、31572415);吉林省自然科学基金(20160101348JC);吉林省教育厅“十二五”科学技术研究项目(2015198)
娜仁高娃(1991),女,内蒙古呼伦贝尔人,硕士研究生,主要从事饲料抗营养因子方向的研究,E-mail: devil1868@sina.com
* 通讯作者:赵元,博士,副教授,E-mail: zhaoyuan4CL52@ 126.com

