冠醚-金属离子配合物的构象转化、选择性和同位素效应的理论计算研究
曹明汉,彭 静,胡少文
(北京分子科学国家研究中心,放射化学与辐射化学重点学科实验室,北京大学 化学与分子工程学院,北京 100871)
冠醚是一类具有一定空腔尺寸的环状分子,其空腔尺寸可与金属离子半径相互匹配,通过改变环上的修饰基团以改善其电子授受作用,从而有可能实现其对特定金属离子的高度选择性配位[1]。但是冠醚结构及其修饰基团种类繁多,对金属离子及其同位素有效分离的冠醚结构是关键。通过理论计算的方式可以系统地研究冠醚对金属离子的选择性、结合能、同位素效应等,并可深入探讨冠醚与金属离子配位前后的构象变化,为后续理论计算和实验筛选冠醚配体结构提供重要的依据。
目前关于不同修饰基团及空腔大小的冠醚与金属离子相互作用的实验[2-6]与理论计算研究已经有很多文献报道[7-22],理论计算结果表明,在没有溶剂分子存在的情况下,碱金属及碱土金属离子与冠醚的结合能主要由金属离子的电荷/半径比及冠醚中能与金属离子配位的原子数目决定。对于同一种冠醚,其与碱金属和碱土金属离子的结合能随电荷/半径比减小而增大[7-8];而对于同一种金属离子,其与冠醚的结合能随冠醚所包含的配位原子数目增加而增大[17]。在气相条件下,虽然金属离子-冠醚配合物结合能理论计算的顺序基本符合实验测定的顺序,但是实验测定的结合能普遍低于计算值,而且这一偏差随着金属离子半径增加而增大[23-25]。由于构象间势垒的存在,实验中存在非能量最低的构象[24]。另外,由于理论计算在气相中进行,而实验中多使用其他溶剂[7, 9],溶剂也对配位存在影响。因此,有必要深入研究金属离子-冠醚体系的具体构象问题,使得计算与实验的偏差得到合理的解释。虽然关于冠醚与金属离子配位作用的理论计算研究较多,但是对金属离子同位素效应的理论计算研究很少[26]。而同位素效应的研究有利于筛选合适的配体结构,指导同位素的有效分离。对金属离子与冠醚结合能的准确理论计算取决于是否找到了金属离子-冠醚配合物和冠醚配体的最低能量构象。本文旨在为解决该问题提供一种简单且可行的计算方法。
密度泛函理论(DFT)适用于研究分子和凝聚态的性质,计算量小于其他计算方法。为此本文采用密度泛函理论,对构成冠醚的结构单元化合物乙二醇二甲醚(DME)及其和不同空腔大小冠醚的构象之间的关系进行研究,在逐一命名冠醚各种构象的基础上,对金属离子-冠醚配合物的配位能力进行系统研究,包括冠醚所含氧原子个数与构象的关系,金属离子种类对构象稳定性的影响等,最终计算与构象密切相关的结合能和同位素效应。
1 计算方法
本文中所有计算均使用Guassion09[27]程序完成,计算中采用密度泛函理论(DFT)中的B3LYP方法及6-311+G*基组对本文所研究的分子体系进行几何优化,并使用相同方法和基组的频率进行计算,以确定所得结构是势能面上的极小值,这种方法及基组在进行不涉及氢键的轻元素计算时具有较高的计算精度和较快的计算速度。体系的自由能通过频率计算所包含的统计处理得到,并定义同位素效应为包含不同金属同位素构象的自由能之差。
2 结果与讨论
2.1 冠醚构象的命名与分类
已知冠醚及其金属离子配合物各有许多不同构象[8],除了个别简单冠醚的构象可通过几何对称性加以辨识外,绝大多数构象并无恰当的方法命名和分类,导致很难研究构象带来的性质问题。乙二醇二甲醚(DME)可看作是构成冠醚的结构单元。由Tsuzuki等的工作[28]可知DME具有9种构象,因此将这9种构象按照能量由低到高的顺序命名为构象1至构象9(另外还存在3*构象,由于不是势能面的极小值,因此不是稳定构象)。将所计算的DME构象的对称性点群及其相对能量ΔErel列于表1。
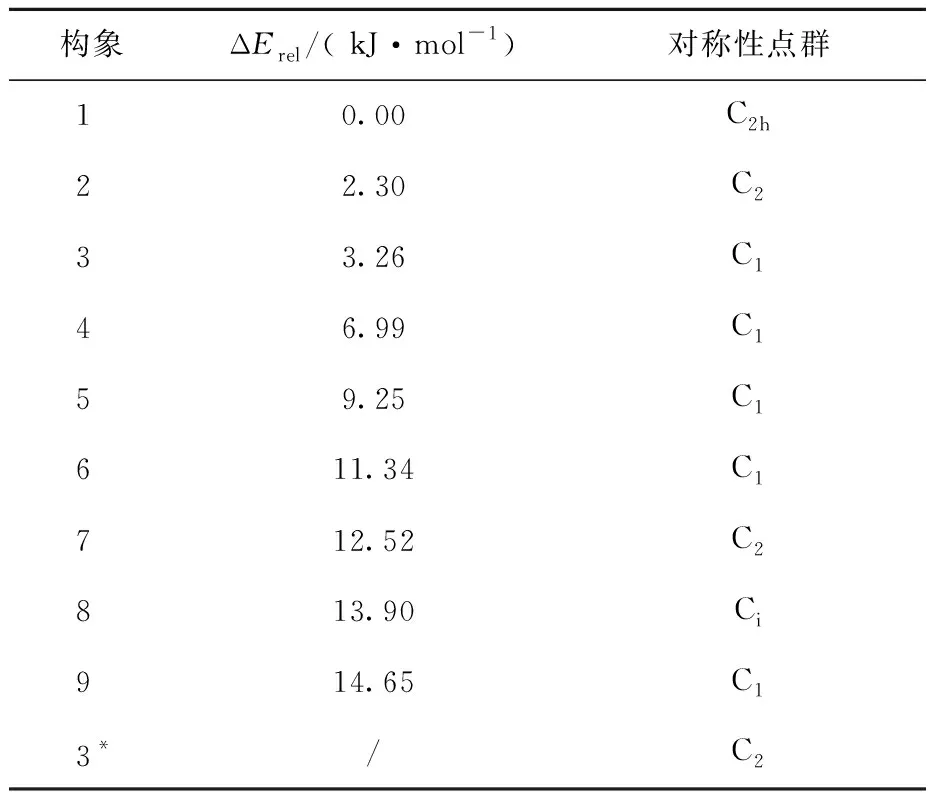
表1 DME的可能构象及其相对能量ΔErelTable 1 The possible conformationsof DME and their relative energy ΔErel
如果将冠醚的构象视作由若干DME的构象相连而成,便可以用DME构象来命名冠醚的构象,例如,图1中12-冠-4醚(12C4)的一个构象是由4个分别为2,3,5,5的DME构象相连而成,称之为2355构象。DME中有C1-O1-C2-C3、O1-C2-C3-O2、C2-C3-O2-C4三个二面角,可以使用二面角标识来描述DME的构象并规定以下符号意义:‘0’:-180°≤α<-120° 或120°<α<180°;‘-’:-120°<α<0°;‘+’:0°<α<120°。
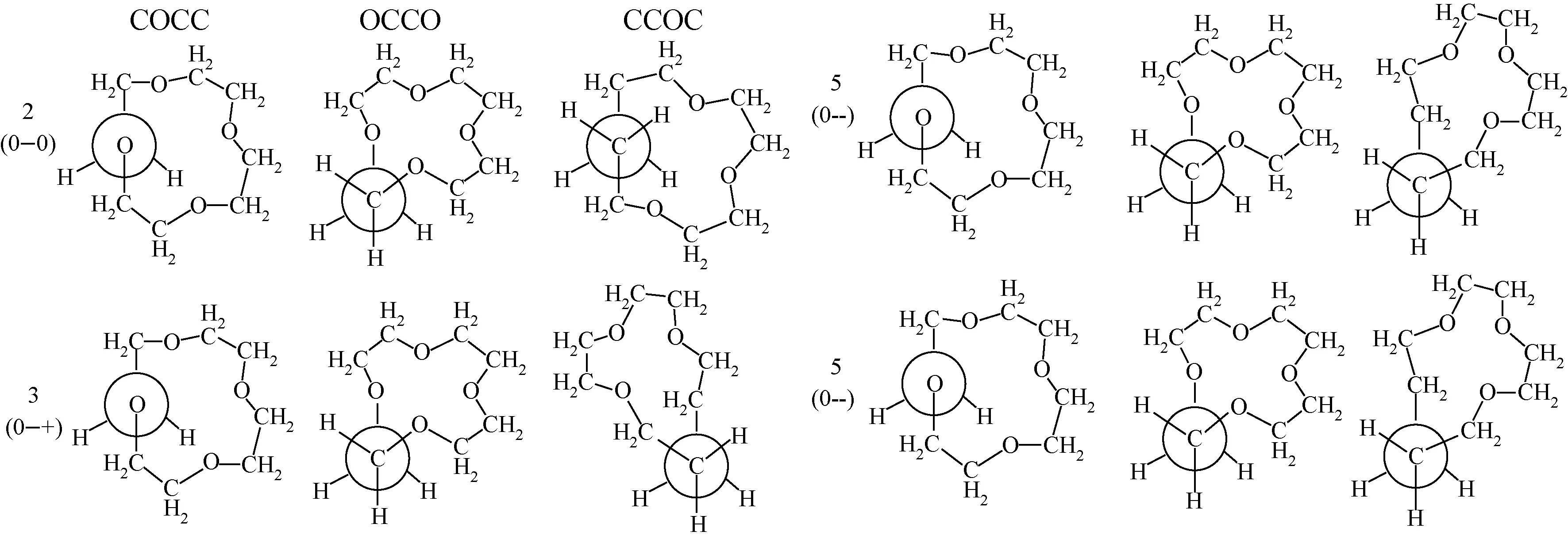
图1 12C4的2355构象图(图中括号内为二面角符号)Fig.1 The 2355 conformer of 12-crown-4 ether
2.2 不同冠醚构象的计算
参考文献[12-13,19]中对自由冠醚构象的研究,逐一计算确定并按照以上方法命名了12C4的38个构象,15-冠-5-醚(15C5)的69个构象和18-冠-6-醚(18C6)的72个构象。可以看出,在这些构象中,构象8出现的概率最低,因为(-0+)的结构不利于成环,相应的,高比例的构象9通常形成高能量的构象,例如12C4中的9999。表2列出了四种冠醚最稳定的三个构象及其相对能量ΔErel,可以看出,低能量的DME构象出现概率更大,且构象3出现概率最高。这是因为成环之后,构象1倾向于形成直链,环张力较大;构象2重复出现时氧原子均指向环中心,排斥力较强;构象3则易于形成相对有序的结构,而在18C6中,由于环足够大,构象1引起的环张力和构象2引起的静电斥力作用都较弱,因此123123成为18C6的最稳定构象。

表2 四种冠醚的最稳定构象Table 2 The most stable conformations of four crown ethers
2.3 金属离子-冠醚配合物的稳定性与构象的关系
2.3.1DME的不同构象与金属离子的配位计算 由所计算的几何结构和能量差(图2)可知,DME和自由冠醚的最稳定构象均不适合与金属离子配位。由于空间位置及位阻的因素,只有构象2、5和7的两个氧原子能同时与金属离子配位,构象7配位后进一步优化就会得到构象2和构象5。由此可见,冠醚内最适合与金属离子配位的构象应主要由构象2、5、7构成。
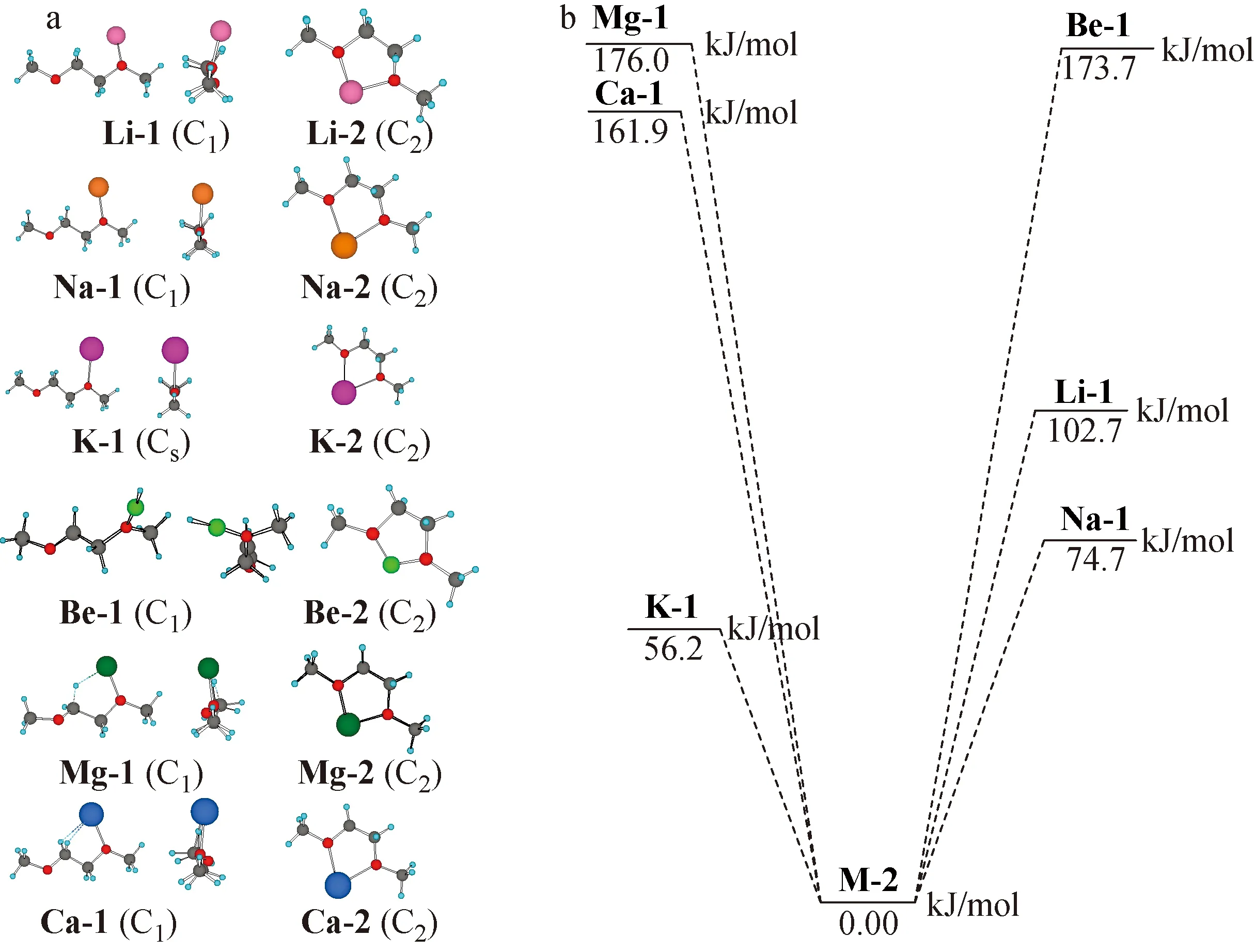
图2 金属离子-DME 配合物构象中单氧配位M-1和双氧配位M-2的几何结构(a)和能量差(b)Fig.2 The structure (a) and energy difference (b) between M-1(Monooxygen complex) and M-2(Dioxygen complex) in conformations of metal ion-DME complexes
2.3.2锂离子-冠醚配合物稳定性与构象关系
然而,能逃得掉么?他看到棘球撞上了岩石,可岩石并未被搅碎,这说明对方对这种力量收放自如。那钢笼一般的骨架,在与岩石接触的瞬间,向内凹了进去,以这种形变,将棘球的动能转化为了关节间的弹性势能,随后,它以更快的速度,重新朝着自己飞射而来。
加入金属离子配位后,之前增加构象2能量的静电斥力被降低能量的配位作用所取代,导致构象2能量最低,由于O原子均指向中心,这种构象适合与半径稍小于空腔的金属离子配位。以构象5为主的冠醚相对能量较高,但由于O原子指向垂直冠醚环平面的同一方向,其可以和半径大于空腔的金属离子配位,也可以形成金属夹心配合物。以构象7为主的冠醚构象能量更高,结构弯曲度大,O原子在不同平面指向中心,可以与半径比空腔小的金属离子配位。参考文献[14-16,20],对找到的所有Li-9C3,Li-12C4,Li-15C5,Li-18C6构象的骨架二面角进行计算,证实了推测。四种锂离子-冠醚配合物的几种构象示于图3。不难看出,构象相对能量的顺序为:以构象2为主<以构象5为主<以构象7为主。由于自由冠醚中能量较低的构象存在概率高,因此形成(a)不需要进行构象转化,动力学上有利;而形成(b)或(c)的结合能较大或者生成物较稳定,热力学上有利,但动力学上需要克服构象变化的能垒。
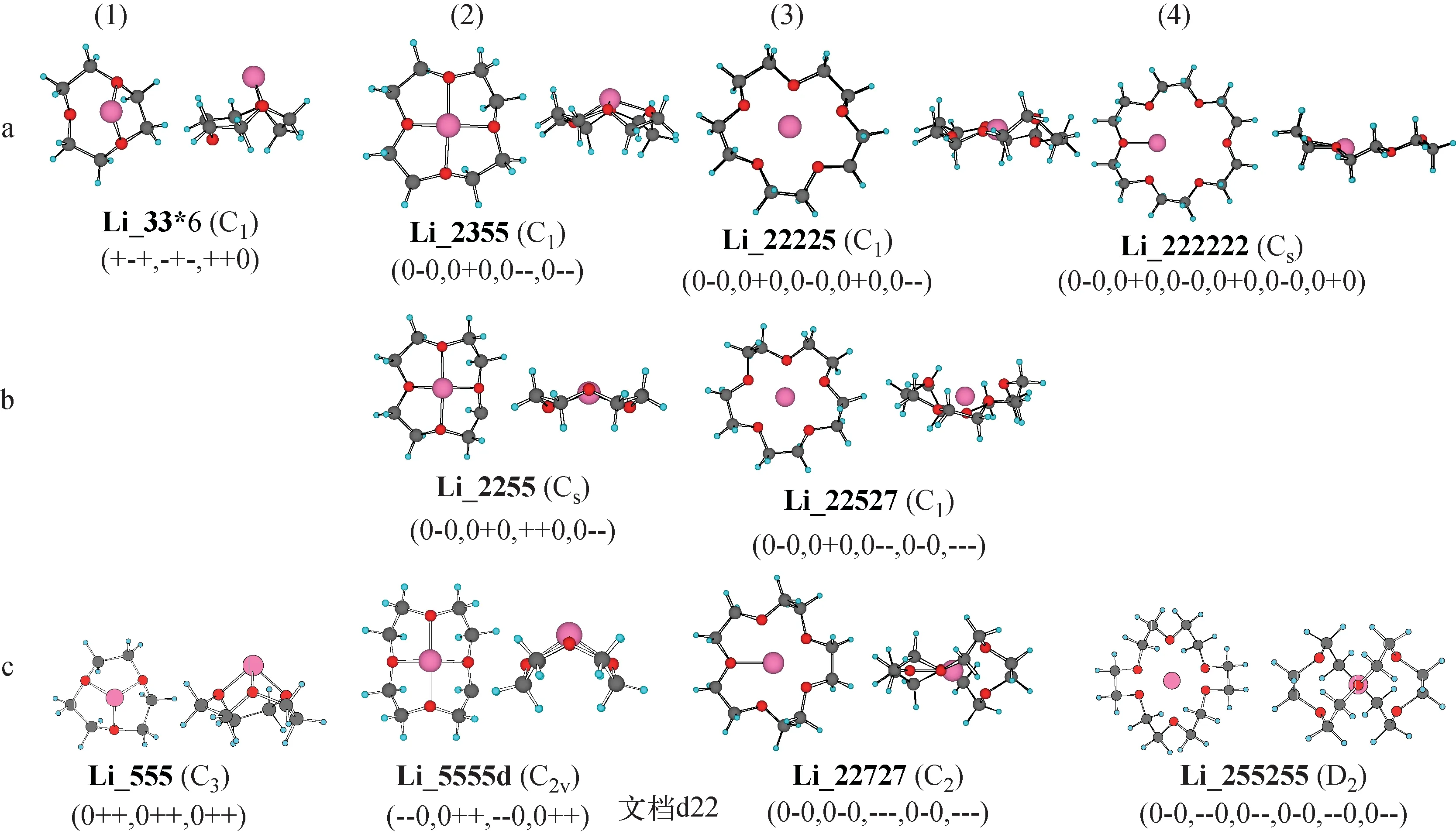
a——能量最低构象与金属离子配位;b——配合物最稳定构象;c——配合物结合能最大构象图3 几种锂离子-冠醚配合物的构象(9C3-Li(1),12C4-Li(2),15C5-Li(3),18C6-Li(4))Fig.3 Conformations of Li ion-crown ether complexes (9C3-Li(1),12C4-Li(2),15C5-Li(3),18C6-Li(4))
2.3.3冠醚构象对金属离子配位的影响过程分析 若L1和L2为冠醚的不同构象,则存在以下关系:

(1)

(2)

(3)
若ΔE12<0, 则ML2比ML1稳定;若ΔEb1>ΔEb2,则ML1比ML2结合能大,即结合能大的配合物不一定最稳定。在文献中[7,18],通常定义结合能为:

(4)
其中,L0和(ML)0分别为自由配体和配合物最稳定的构象,从而只能得出唯一的结合能。显然,这种定义假设配合物和自由配体的构象相同,忽略构象转变的能量差和能垒,因此导致结合能理论计算值与实验值存在偏差。
由此可见,冠醚-金属离子配合物能够形成多种构象,以哪种构象为主,取决于以下因素:(1) 较低能量、适合配位的自由冠醚构象与金属离子配位后的稳定性;(2) 自由冠醚不同构象之间的能量差和相互转化能垒;(3) 金属离子-冠醚配合物不同构象之间的能量差和相互转化能垒。因为较低能量、适合配位的自由冠醚构象通常以构象2为主,当半径合适的金属离子与其配位时,形成最稳定且结合能最大的配合物构象,例如Na-22225和K-222222,从动力学角度较容易形成,在热力学上比较稳定。
2.3.4金属离子对DME构象转化能垒的影响 如上所述,金属离子-冠醚配合物的构象取决于构象之间的能量差和相互转换的能垒,因此需要找到构象所在势能面上的最低点和极小点,以及鞍点,即构象转换的过渡态,这对于复杂的冠醚体系难以做到,因此,通过对构成冠醚结构单元DME进行构象转换的研究。对于直链DME而言,九个构象之间的极差为14.65 kJ/mol(表1),这些构象之间可以通过O—C、C—C、C—O键的旋转来互相转换,而过渡态能量则决定了转换的能垒。在DME中构象转化经过的基元步骤数取决于转换时旋转单键所需经过的能垒数(图4),构象2通过旋转C—C键即可转化为构象1,但是不能一步转化为构象2的光学异构体2。
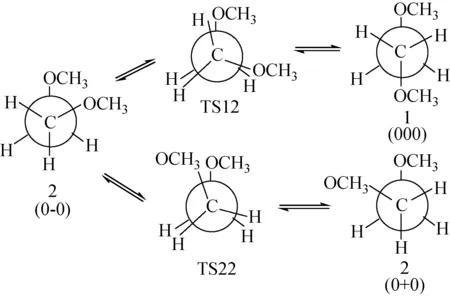
图4 DME构象间的转变过程Fig.4 The transformation process of DME conformations
当金属离子与DME结合时,由于配位氧原子数目不同,构象之间的能量差显著增加,同时金属离子配位之后构象转化的能垒显著变小,能垒减小的程度随金属离子电荷/半径比的增加而变强(图5),即具有较低电荷,较大半径的金属离子配合物具有更高的转化位垒。由此可以推测,当若干DME构成冠醚并且和金属离子配位后,构象之间转换的位垒顺序也是如此,解释了实验得到的金属离子-冠醚配合物的结合能与Ray等理论计算值的偏差随着金属离子半径增加而变大的现象[23-25],因为金属离子半径越大,金属离子-冠醚配合物转化为结合能更大或构象更稳定的能垒就越高,越容易以动力学上较低结合能构象存在,导致实验测得的结合能偏低。

图5 不同金属离子对金属离子-DME配合物构象能量差和转换能垒的影响Fig.5 The effects of different metal ions on the energy difference of conformations and transformation energy barrier of metal-ion and DME complex
2.4 冠醚对金属离子的选择性配位
2.4.112C4与金属离子的配位结构与热力学参数 金属离子-冠醚配合物的结合能随冠醚大小、金属离子电荷及半径等性质变化。结合能大小主要取决于金属离子的电荷/半径比以及与金属离子配位的氧原子数目,而相同电荷的金属离子与冠醚形成配合物时,配位键键长RM-O与结合能ΔEb呈线性关系,且冠醚空腔内径可以用相隔最远的O原子距离的一半(1/2RO-O)表示。计算几种金属离子与冠醚配合物的结合能与键长(表3),从表3中可以看出,当RM-O适当小于1/2RO-O时,形成的配合物比较稳定或具有较大的结合能。例如,Be的RM-O为1.497 Å,12C4的构象2727的1/2RO-O为1.665 Å,与Be-2727是Be-12C4最大结合能构象的结果符合;Li的RM-O为1.865 Å,只是略小于12C4构象2222的1/2RO-O1.945 Å,而与构象5555d的2.086 Å比较匹配,因此Li-5555d是Li-12C4最大结合能的构象,这与前面计算得出的构象2、5、7与金属离子半径的匹配关系吻合。
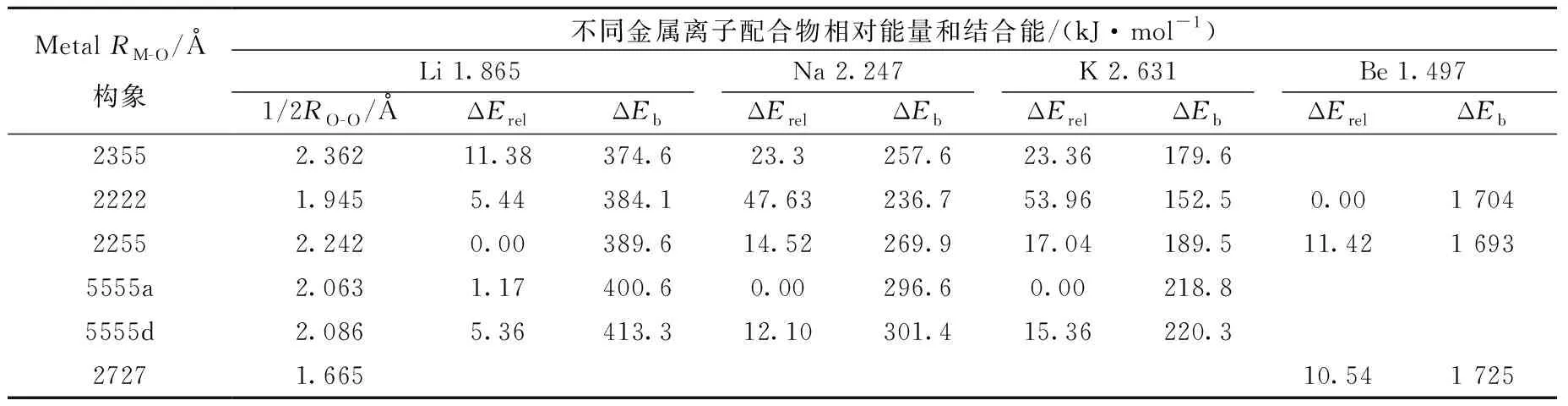
表3 几种金属离子与12-冠醚-4的配合物构象的结构与热力学参数Table 3 The structure and thermodynamical parameters of some metal ion-crown ether complex conformations
2.4.2不同冠醚对金属离子的配位选择性 在实验过程中,冠醚一般在水中与金属离子配合[29-30],考虑到多个水分子与金属离子的配位作用十分复杂,可能的构象也难以计算,而冠醚可以通过单个分子来配位,计算相对简单,因此为了研究配体选择性,本文使用其他冠醚计算以下配体交换反应的能量变化。例如:

(5)
根据计算得到的能量变化就可以判断冠醚对金属离子配位的热力学倾向。而根据所结合的冠醚本身构象的稳定性,可以判断该构象出现的概率,从而推测出动力学倾向。
分别计算以下两种情况的能量变化。
(1) 冠醚以较低能量构象与金属离子配位后的配位反应,例如:

(6)
该反应能量降低,因此平衡向Na-22225和Li-2355方向移动,由于构象2355和22225是较低能量的自由冠醚构象,因此在Na和Li同时存在的情况下,热力学和动力学上12C4都倾向于和Li配位,而15C5倾向于和Na配位。该计算结果也与实验相符[6]。
(2) 最稳定的冠醚-金属离子配合物构象之间的反应,例如:

(7)
从热力学考虑,可以得到和(1)中相同的结论,只是由于冠醚从较稳定构象转化成易于配位的构象需要经过能量位垒,导致反应程度减弱。
(3) 最大的结合能配合物构象之间的反应,例如:

(8)
该反应的能量变化接近于0,这与金属离子半径和冠醚空腔半径的匹配程度相符合。表4是通过计算(1)和(2)两种情况时得出的不同冠醚对金属离子在动力学和热力学上的选择性。由表4可知,不同金属离子和不同冠醚生成动力学较稳定配合物构象的倾向性和热力学最稳定配合物构象的倾向性。当所要配位的冠醚是12C4和15C5时,电荷/半径比大的Be+和Li+明显倾向于和配位O原子数较少的12C4配位,说明金属离子半径和冠醚空腔的匹配对选择性的影响。同理,当所要配位的冠醚是15C5和18C6时,电荷/半径比最小的K+对于18C6的配位倾向性增加。半径较大的Ca2+也比Mg2+更倾向于和18C6配位。

表4 几种金属离子与锂离子的冠醚交换反应能量变化Table 4 The reaction energy(kcal/mol) of crown ether-metal cations complex in exchange reaction of some metal ions with lithium ion
2.5 锂离子-冠醚配合物的同位素效应
对于同一金属离子的不同同位素构成的配合物而言,计算得到的电子能量值没有差别,只有振动能和转动能的差别,与结合能定义类似的,定义以下结合自由能为如下反应的自由能变化:
(10)
(11)
同位素效应即:
ΔGiso=ΔG1-ΔG2
(12)
由于金属离子-冠醚配合物限制了M—O键的自由转动,因此同位素效应实际基本来自M—O键的振动自由能之差。由于振动能与约化质量的平方根呈反比,与力常数平方根呈正比,因此同位素效应的大小主要取决于同位素的相对质量差2Δm/(m1+m2)以及M—O键的强度。
由于Li是重要的能源战略金属,6Li和7Li是其稳定同位素,在核聚变反应和核能领域具有重要应用[31]。因此,本文主要研究Li同位素与冠醚的配位作用。表5中列出了Li在不同Li-12C4配合物构象中的同位素效应,可以看出,同位素效应与平均配位键键长RM-O呈线性相关。表中最小RM-O出现在Li-2222,相比于配合物最稳定的构象Li-2255与结合能最大的构象Li-5555d,由于其空腔半径小,导致其配位能力稍弱,但具有最大的同位素效应。Li-2222虽然不是最稳定或结合能最大的构象,但2222构象适合配位,其具有一定的动力学优势。自由的2222构象具有D2d点群对称性,由于Li半径与12C4的2222构象孔径差距过小,配位之后对称性下降为C2v(图6),环张力的增加增大了振动能的影响,也增大了同位素效应。通过计算可知,金属离子与冠醚配位的同位素效应和冠醚的构象有关。对于Li-冠醚体系,同位素效应大的构象与结合能大的构象不一致,如需要提高同位素的分离因子,就需要促进同位素效应大的构象生成,本文计算出Li-12C4的锂同位素效应大的构象具有动力学优势,因此实际分离实验中可以采用低温或脉冲反应器等促进动力学形成配合物的方法来提高体系的同位素分离因子。
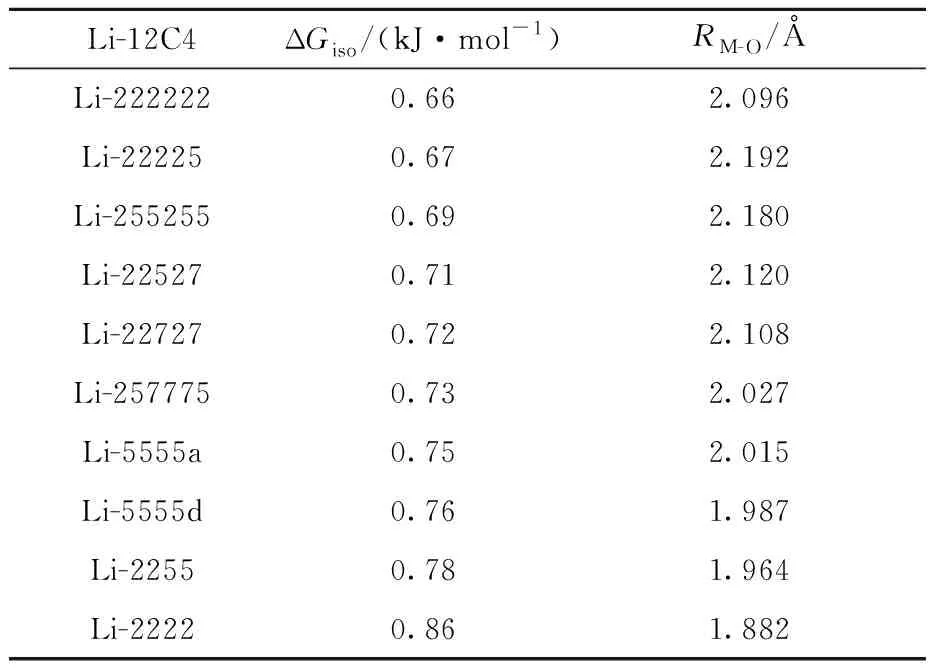
表5 Li-12C4配合物离子的同位素效应ΔGiso和配位键的平均键长RM-OTable 5 The isotope effect of Li-12C4 ions and the average coordination bond length

图6 具有最大同位素效应的Li-12C4构象Li-2222的几何结构Fig.6 The structure of Li-12C4 complex( Li-2222 ) with the highest isotope effect
3 结论
冠醚的构象可由多个DME的构象组成。通过这样的构象关联,用统一的方法为冠醚及其金属离子配合物的构象做了分类和命名。通过DFT计算解释了前人工作中关于金属离子-冠醚配合物结合能计算值与实验值的偏差,并通过DME的构象转化计算,分析了金属离子-冠醚配合物构象之间可能存在的转化机理。当金属离子的半径适合与能量较低的冠醚构象结合时,金属离子-冠醚配合物的形成具有动力学和热力学上的优势。当金属离子与冠醚配位时,冠醚的构象转化位垒减小,而且金属离子的电荷/半径比越大,对冠醚构象转化的影响也越大。当冠醚可配位的O原子数目增加时,金属离子-冠醚配合物的结合能增大,对于电荷/半径比大的金属离子构成的配合物,结合能增大的趋势更为明显,但是这一趋势也受金属离子半径和冠醚空腔的匹配程度影响,所以在不同冠醚之间,金属离子配位显示出一定的选择性。而选择结合能大的配体有利于提高其对金属离子的分离选择性,为萃取或吸附分离应用提供理论依据。金属离子-冠醚配合物的同位素效应由其自由能之差来确定,质量较大的同位素具有较小的振动转动能量,自由能较小。金属离子-冠醚配合物的同位素效应取决于两者的相对平均质量差和金属配位键的强度。由于金属配位键的平均键长随金属离子-冠醚配合物的构象而变化,所以不同构象具有不同的同位素效应,对于6Li和7Li而言,Li-12C4配合物的Li-2222构象具有最大的同位素效应,虽然其热力学配位能力较弱,但在动力学上具有一定优势,因此为了提高同位素分离因子可以考虑采用低温及脉冲反应器等能发挥动力学优势的装置。由于空穴较大的冠醚可以形成很多构象来适应不同大小的金属离子,对金属离子与冠醚结合能的准确理论计算取决于是否找到了金属离子-冠醚配合物和冠醚配体的最低能量构象。本文提供了一种简单而可行的计算方法,有利于未来更准确地分析不同基团修饰冠醚与金属离子及其同位素的配位作用,为实际分离应用提供理论依据。

