二甲双胍抑制慢性哮喘小鼠气道炎症、重塑及新生血管形成*
马文娴, 郭海琴, 韩新鹏, 徐灵彬, 刘 亮, 李志超, 吴昌归△
(1第四军医大学西京医院呼吸内科, 陕西 西安 710032; 2陕西省人民医院呼吸内科,陕西 西安 710068; 3第四军医大学病理生理学教研室,陕西 西安 710032)
二甲双胍抑制慢性哮喘小鼠气道炎症、重塑及新生血管形成*
马文娴1, 郭海琴1, 韩新鹏1, 徐灵彬2, 刘 亮1, 李志超3△, 吴昌归1△
(1第四军医大学西京医院呼吸内科, 陕西 西安 710032;2陕西省人民医院呼吸内科,陕西 西安 710068;3第四军医大学病理生理学教研室,陕西 西安 710032)
目的: 探讨二甲双胍对慢性哮喘气道炎症、重塑及新生血管形成的影响及可能机制。方法: 采用卵白蛋白(OVA)致敏并激发制备慢性哮喘小鼠模型,给予二甲双胍干预,与生理盐水对照组和慢性哮喘模型组相比,观察支气管肺泡灌洗液(BALF)细胞计数、外周血免疫球蛋白、气道重塑及磷酸化腺苷酸活化蛋白激酶(p-AMPK)蛋白水平的变化。结果: 慢性哮喘小鼠BALF细胞总数及嗜酸性粒细胞百分比较对照组升高(P<0.01),血清OVA特异性IgE明显升高(P<0.01),给药组可降低上述指标(P<0.05)。肺组织HE染色可见气道壁炎症细胞浸润、杯状细胞增生、上皮下胶原沉积等病理改变,免疫组化CD31染色观察到气道上皮下新生血管数目和面积增加;二甲双胍部分抑制了上述病理过程。肺组织免疫组化p-AMPK染色观察到其在模型组气道壁的表达较对照组下降(P< 0.05),给药组升高明显(P<0.01)。结论: 慢性哮喘中AMPK磷酸化表达水平受抑制。二甲双胍可能通过激活AMPK来抑制慢性哮喘气道炎症、重塑及新生血管的形成。
二甲双胍; 气道新生血管形成; 腺苷酸活化蛋白激酶; 慢性哮喘
支气管哮喘(简称哮喘)是一种慢性气道疾病,以气道慢性炎症、气道高反应性、气道重塑为主要特征,伴有可变气流受限,反复发作可导致气道重塑,其主要病理改变包括杯状细胞增生过分泌、气道平滑肌(airway smooth muscle,ASM)增殖肥大、上皮下纤维化、气道壁新生血管增多等[1]。其中,气道黏膜下和固有层新生血管增多作为气道重塑的重要组分,可在慢性哮喘的早期就已出现,且与患者的病情严重程度有着明显的正相关关系[2]。因而抑制哮喘气道新生血管形成对防治哮喘有重要意义。腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)是细胞代谢和氧化还原的感受调节器,参与糖尿病、肥胖、心血管疾病、哮喘、肿瘤等多种疾病的发生[3]。近年研究表明AMPK活性对血管内皮细胞的生物特性发挥调节作用,可能通过抗氧化、抗炎途径影响内皮细胞功能,或发挥抗增殖效应[4]。二甲双胍(metformin,MET)作为AMPK的一种激动剂,通过抑制线粒体呼吸,使得AMP/ATP比值增加,从而激活AMPK。近来有报道,二甲双胍可减轻肥胖型哮喘的嗜酸性炎症[5],但其对慢性哮喘气道新生血管的形成及气道重塑的影响目前尚不清楚。本研究通过建立慢性哮喘小鼠模型,对二甲双胍的这一作用进行了观察。
材 料 和 方 法
1 动物
SPF级6~8周雌性BALB/c小鼠(20±2) g,由第四军医大学实验动物中心提供。饲养于第四军医大学病理生理学实验室动物房,该实验室饲养室达到SPF级标准,实验动物在安静、无抗原、通风良好的环境中饲养,实验室按昼夜节律采光12 h,室温保持在20~25 ℃,室内湿度保持在40%~70%,小鼠可自由摄食、饮水。所有实验遵从第四军医大学动物伦理委员会制定的“实验室动物管理原则”。
2 主要试剂
卵白蛋白(ovalbumin,OVA)和二甲双胍(Sigma);OVA特异性IgE(上海西唐生物科技);抗CD31抗体及HRP标记的兔抗山羊 II 抗(武汉谷歌生物科技有限公司);抗AMPKα 兔单克隆抗体(CST)。空压雾化器 (“欧姆龙”NE-C29型);光学显微镜(CIC);成像系统(Nikon)。
3 主要方法
3.1 动物造模及分组 将小鼠随机分为3组,每组8只,即生理盐水对照组(control组)、慢性哮喘模型组(OVA组)和二甲双胍干预组(OVA+MET组)。造模前适应性饲养1周,采用OVA致敏和激发制备哮喘小鼠气道重塑模型[6]。模型组和干预组分别于第0、7天给予OVA 100 μg和Al(OH)31.5 mg混悬液腹腔注射;第21天开始超声雾化吸入5% OVA 30 min;以后每周雾化3次,连续8周。对照组致敏和激发均给予生理盐水,给药方法相同。干预组于雾化前30 min给予二甲双胍250 mg/kg腹腔注射。
3.2 血清和支气管肺泡灌洗液(bronchoalveolar la-vage fluid,BALF)收集及细胞分类计数 末次雾化24 h后眼球采血、行支气管肺泡灌洗后取肺组织。通过气管插管行支气管肺泡灌洗,分3次缓慢注入PBS液,分别为0.6 mL、0.6 mL和0.5 mL,缓慢收集,回收率约为80%。BALF 1 500 r/min 离心8 min,收集上清液-20 ℃保存待测。细胞沉渣用0.2 mL PBS重悬,并用血细胞计数板进行细胞分类计数。取100 μL细胞悬液进行离心甩片,室温晾干后进行Diff-Quik染色,光学显微镜下进行细胞分类,数200个细胞,求出各类白细胞百分比。取血后3 000 r/min 离心15 min,血清移至另一干净Eppendorf管,-20 ℃保存待测。
3.3 小鼠血清OVA特异性IgE的测定 操作步骤严格按照小鼠血清OVA特异性IgE ELISA试剂盒说明书进行,在450 nm处测吸光度(A),根据标准曲线计算标本中待测指标浓度。
3.4 气管肺组织病理学检查 取肺左上叶组织用多聚甲醛固定,常规石蜡包埋,切片厚度4 μm。HE染色观察气道炎症细胞浸润,PAS染色观察气道壁杯状细胞增生,Masson’s染色观察气道壁胶原沉着,免疫组化CD31染色观察气道新生血管形成情况,免疫组化p-AMPK染色观察气道p-AMPK蛋白水平变化。由1位研究者在未知本研究实验设计的情况下,采用半定量评分(0~4)评价支气管周围炎症细胞浸润情况:0分为正常;1分是少量细胞浸润;2分为一层细胞环状浸润;3分则是2~4层细胞形成环状浸润;4分是多于4层的细胞浸润环。采用5分(0~4)评分系统评价气道上皮细胞中PAS染色阳性细胞百分比:0分表示无杯状细胞;1分表示<25%杯状细胞;2分表示25%~50%杯状细胞;3分表示50%~75%杯状细胞;4分表示>75%杯状细胞。再评价气道每毫米基底膜上胶原沉着区的面积比。计数支气管上皮下至基底膜区域新生血管数目并计算血管区域面积占基底膜区百分比。Image-Pro Plus软件半定量分析上皮至基底膜区域内平均吸光度=积分吸光度(IA)/目标区域面积(area)。
4 统计学处理
应用SPSS 13.0软件进行统计分析。实验结果采用均数标准误(mean±SEM)表示,多组间比较采用单因素方差分析(one-way ANOVA),均数间的多重比较采用Tukey法。以P<0.05为差异有统计学意义。
结 果
1 动物一般情况
慢性哮喘组小鼠激发过程中出现烦躁不安、呼吸急促、前肢抬缩、腹肌抽搐、大小便失禁等哮喘急性发作症状。对照组无上述反应,干预组与模型组表现相似,但程度较轻。
2 各组小鼠BALF中细胞总数和分类计数及外周血OVA特异性IgE的比较
对照组小鼠BALF中主要以巨噬细胞为主,偶见个别单核细胞和淋巴细胞;慢性哮喘组BALF的细胞总数较对照组明显增多(P<0.01),其中以嗜酸性粒细胞百分比增多为主(P<0.01),中性粒细胞和淋巴细胞百分比也增多(P<0.05),巨噬细胞百分比相对减少(P<0.01);二甲双胍干预组细胞总数及嗜酸性粒细胞百分比较慢性哮喘组下降(P<0.05),中性粒细胞百分比略有减少,巨噬细胞及淋巴细胞比例略有增加,但均无统计学显著性,见图1。
慢性哮喘组OVA特异性IgE较对照组明显升高(P<0.01);二甲双胍干预组OVA特异性IgE与模型组比较有降低(P<0.05),见图1。

Figure 1.Comparison of total cell counts and diffenential cell counts in BALF and OVA specific IgE levels in the serum in the 3 groups. MeanSEM.n=8.*P<0.05,**P<0.01vscontrol group;#P<0.05,##P<0.01vsOVA group.
图1 各组小鼠BALF中细胞总数、白细胞分类计数及血清抗OVA特异性IgE水平的比较
3 肺组织普通病理学染色观察
对照组小鼠上皮结构完整,未见明显气道壁炎症细胞浸润、管壁增厚、胶原沉积、平滑肌层增厚等改变。慢性哮喘组小鼠支气管黏膜皱襞增多、断裂,支气管和血管周围可见大量炎症细胞浸润,上皮下胶原沉积,气道壁及气道平滑肌明显增厚,气道壁还可见上皮细胞脱落,杯状细胞增多;干预组上述改变轻微。HE染色采用炎症细胞浸润情况评分,发现慢性哮喘组小鼠肺部炎症的病理改变程度明显高于对照组(P<0.01),干预组炎症明显减轻(P<0.01)。采用PAS染色阳性细胞占气道上皮细胞百分比评分,发现模型组小鼠肺部杯状细胞增生变化明显高于对照组(P<0.01),干预组可抑制其升高(P<0.01)。Masson’s染色发现哮喘组胶原沉着区在气道每毫米基底膜上面积比较对照组增多明显(P<0.01),而干预组较模型组有减轻(P<0.01),见图2。
4 肺组织免疫组化CD31染色结果的比较
可见慢性哮喘组气道上皮下至基底膜区域的CD31阳性细胞(胞浆示棕色为阳性细胞,黑色箭头所示)形成管腔样结构,模型组气道壁黏膜下新生血管数目和血管面积占黏膜下区域面积百分比较对照组明显增多(P<0.01),而干预组较模型组有减少(P<0.01),见图3。
5 肺组织免疫组化p-AMPK染色结果的比较
对照组小鼠p-AMPK蛋白阳性细胞(胞浆示棕色为阳性细胞,黑色箭头所示)主要分布在支气管上皮细胞,并在血管内皮细胞(红色箭头所示)、平滑肌细胞也有分布(蓝色箭头所示);慢性哮喘组气道壁p-AMPK相比对照组阳性细胞分布减少(P<0.05),二甲双胍干预后明显升高(P<0.01),见图4。
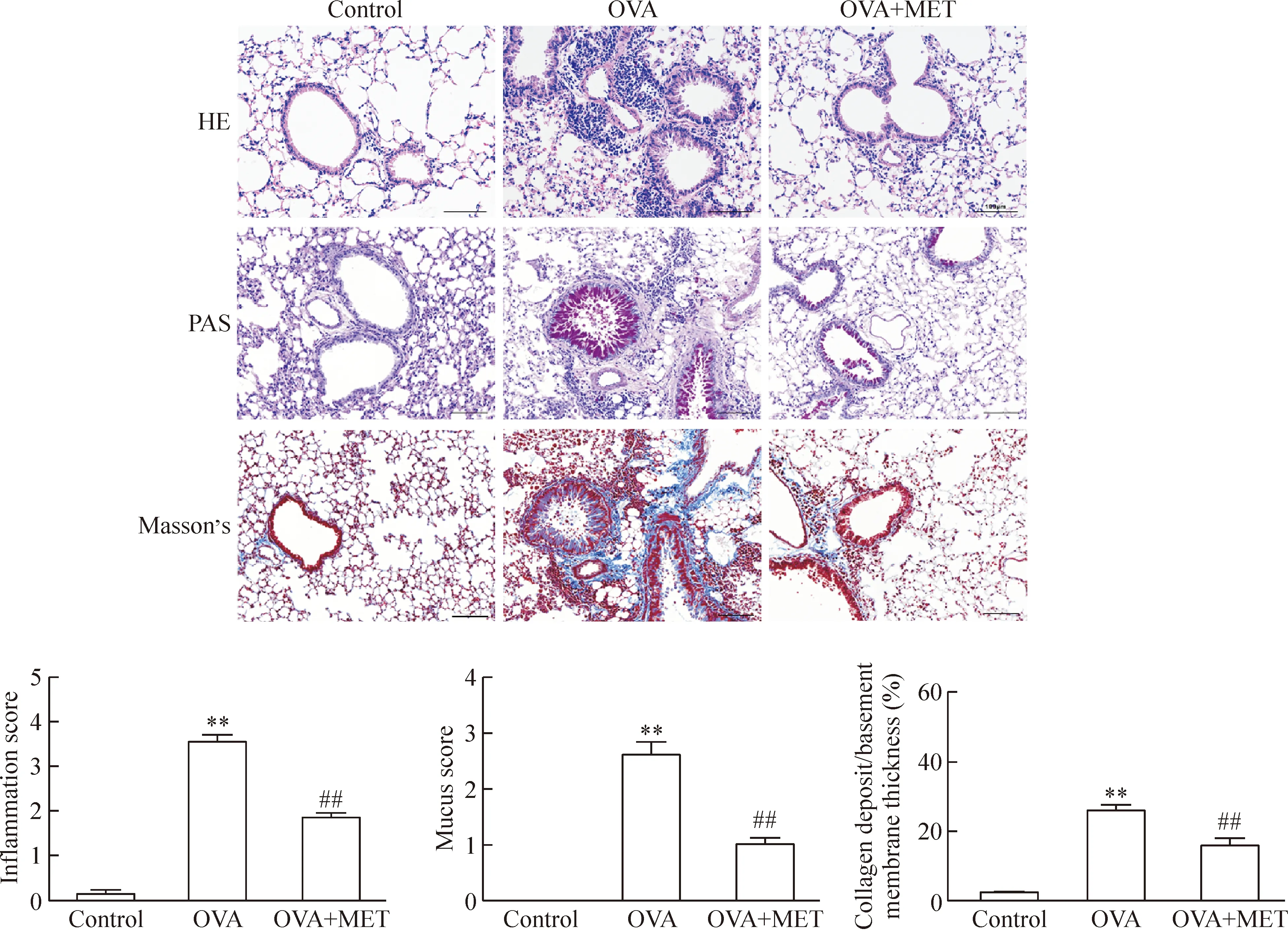
Figure 2.Pathological changes of lung tissues from each group (HE staining, PAS staining and Masson’s staining) and comparison of peribronchial inflammation score, goblet hyperplasia and collagen deposit in the airway. The scale bar=100 μm. MeanSEM.n=8.**P<0.01vscontrol group;##P<0.01vsOVA group.
图2 各组小鼠肺组织病理染色及气道炎症评分、杯状细胞增生评分、胶原沉着的比较
Figure 3.Immunostaining for CD31 to identify vessels and comparison of number of vessels per square millimeter of submucosa and percentage vascular area in the submocosa of the airway. Black arrows show blood vessels stained with CD31. The scale bar=50 μm. MeanSEM.n=8.**P<0.01vscontrol group;##P<0.01vsOVA group.
图3 各组小鼠肺组织免疫组化CD31染色及支气管上皮下至基底膜区CD31标记新生血管数目和面积的比较

Figure 4.Immunostaining for p-AMPK to compare the activation of AMPK in the 3 groups. p-AMPK positive cells were epithelial cells, endothelial cells and airway smooth muscle cells, which were indicted by black arrows, red arrows and blue arrows, respectively. The scale bar= 100 μm. Mean±SEM.n=8.*P<0.05vscontrol group;##P<0.01vsOVA group.
图4 各组小鼠肺组织免疫组化p-AMPK染色其表达水平比较
讨 论
气道炎症和重塑在哮喘的发病中均有重要意义,目前临床上治疗哮喘的药物并不能有效地改善气道重塑,故寻求能同时减轻气道炎症及重塑的新途径一直是该领域的研究热点。慢性哮喘气道粘膜下新生血管的形成增多是气道重塑中的一个重要特征[2]。哮喘气道上皮下微血管网络发生结构和功能异常(血管密度、血管面积百分比及血管通透性增加),是气道持续性炎症、气道结构细胞异常增殖分化及肺功能降低的潜在原因,也是联系气道炎症和重塑的关键[7]。血管形成增多受多个因素的调控,除了促血管因子和抑血管因子的失衡外,研究表明局部代谢状态的变化(如低氧、营养不足)也将促进血管新生[8]。AMPK是一种广泛表达且高度保守的丝/苏氨酸蛋白激酶,主要是通过肝脏激酶B1(liver kinase B1,LKB1)、转化生长因子β激活性激酶1(transforming growth factor beta-activated kinase 1,TAK1)、钙调素依赖蛋白激酶激酶β(calmodulin-de-pendent protein kinase kinase β,CaMKKβ) 磷酸化AMPK Thr172位点,或经AMP/ATP变构调节被激活[9]。AMPK作为细胞能量代谢调节器,不仅调节氧化应激、抗炎,还可以抑制多种非恶性细胞和肿瘤细胞的增殖[10-11]。二甲双胍除了用于II型糖尿病的降血糖治疗外,还被证实能通过激活AMPK发挥抗炎、抗增殖效应来抑制组织炎症和组织重塑[11]。
多篇文献报道二甲双胍可以通过降低黏附分子和炎症因子的表达,从而减少炎症细胞迁移,发挥抗炎作用[12-13]。Calixto等[5]发现二甲双胍能抑制高脂诱导的肥胖型哮喘小鼠BALF中炎性细胞的渗出;Park等[14]在OVA和真菌相关变应原蛋白诱导哮喘小鼠中也观察到此现象。本研究也在成功复制的慢性哮喘模型小鼠中有类似发现,二甲双胍能够降低BALF中细胞总数、嗜酸性粒细胞比例及血清OVA-IgE水平;并且HE染色显示二甲双胍也减轻了支气管周围炎症。另外,多个研究表明二甲双胍在组织重塑发生发展中具有重要调节的作用,它能抑制心肌重塑、血管重塑、肾脏纤维化等[15-16]。我们建立的慢性哮喘模型小鼠肺组织染色也提示二甲双胍减轻了杯状细胞增生及胶原沉积等气道重塑病理改变。
近年来,关于二甲双胍对血管结构和功能的研究日益增多。多项研究表明二甲双胍可以抑制肿瘤血管的生成从而影响肿瘤的生长和转移[17];体外实验也证实二甲双胍可抑制内皮细胞的增殖、迁移及成管[4]。此外,Jian等[18]还观察到二甲双胍激活AMPKα1改善了急性肺损伤模型中的微血管损伤。哮喘气道黏膜下新生血管发生增多,将使血浆渗出增多,加速炎症细胞的迁移和募集,加重气道炎症;新生血管的增多将引起营养物质和生长因子供应增多,导致组织生长异常、细胞行为异常和高活性状态,如气道平滑肌细胞增生肥大、成纤维细胞增生、细胞外基质沉积和黏液腺增生过分泌等,这些结构性变化致使持续性气道高反应性发生和发展[7]。故而研究二甲双胍对慢性哮喘新生血管生成方面的作用将为哮喘的临床治疗提供新的线索。本实验采用血管内皮标志物CD31来显示新生的血管内皮,观察二甲双胍对慢性哮喘新生血管生成方面的作用,发现二甲双胍干预后气道上皮下区域新生血管数目和面积较哮喘组明显减少,提示二甲双胍能抑制哮喘气道新生血管的形成。此外,我们的研究证实了慢性哮喘组p-AMPK表达水平较正常组降低,二甲双胍能使其明显升高。这些结果提示:二甲双胍可能通过激活AMPK抑制炎症因子和血管生成因子的合成与释放或对内皮细胞增殖的直接抑制影响气道重塑的发生和发展,有关这一机制还有待进一步深入研究。
综上所述,二甲双胍既可减轻气道炎症及重塑,又抑制了气道新生血管的形成,对慢性哮喘的治疗有一定的潜在临床应用前景。AMPK及其信号通路有望成为治疗哮喘的药理学靶点。
[1] Saglani S, Lloyd CM. Novel concepts in airway inflammation and remodelling in asthma[J]. Eur Respir J, 2015, 46(6):1796-1804.
[3] Mihaylova MM, Shaw RJ. The AMPK signalling pathway coordinates cell growth, autophagy and metabolism[J]. Nat Cell Biol, 2011, 13(9):1016-1023.
[4] Peyton KJ, Liu XM, Yu Y, et al. Activation of AMP-activated protein kinase inhibits the proliferation of human endothelial cells[J]. J Pharmacol Exp Ther, 2012, 342(3): 827-834.
[5] Calixto MC, Lintomen L, André DM, et al. Metformin attenuates the exacerbation of the allergic eosinophilic inflammation in high fat-diet-induced obesity in mice[J]. PLoS One, 2013, 8(10): e76786.
[6] Kumar RK, Herbert C, Foster PS. The “classical” ovalbumin challenge model of asthma in mice[J]. Curr Drug Targets, 2008,9(6): 485-494.
[7] Harkness LM, Ashton AW, Burgess JK. Asthma is not only an airway disease, but also a vascular disease[J]. Pharmacol Ther, 2015, 148: 17-33.
[8] Potente M, Gerhardt H, Carmeliet P. Basic and therapeutic aspects of angiogenesis[J]. Cell, 2011, 146(6):873-887.
[9] Hardie DG. Molecular pathways: is AMPK a friend or a foe in cancer?[J]. Clin Cancer Res, 2015, 21(17):3836-3840.
[10]Wang G, Song Y, Feng W, et al. Activation of AMPK attenuates LPS-induced acute lung injury by upregulation of PGC1α and SOD1[J]. Exp Ther Med, 2016,12(3): 1551-1555.
[11]Vincent EE, Coelho PP, Blagih J, et al. Differential effects of AMPK agonists on cell growth and metabolism[J]. Oncogene, 2014, 34(28):3627-3639.
[12]Hattori Y, Suzuki K, Hattori S, et al. Metformin inhibits cytokine-induced nuclear factor κB activation via AMP-activated protein kinase activation in vascular endothelial cells[J]. Hypertension, 2006, 47(6):1183-1188.
[13]Victor VM, Rovira-Llopis S, Banuls C, et al. Metformin modulates human leukocyte/endothelial cell interactions and proinflammatory cytokines in polycystic ovary syndrome patients[J]. Atherosclerosis, 2015, 242(1):167-173.
[14]Park CS, Bang B, Kwon H, et al. Metformin reduces airway inflammation and remodeling via activation of AMP-activated protein kinase[J]. Biochem Pharmacol, 2012, 84(12):1660-1670.
[15]Burla AK, Lobato NS, Fortes ZB, et al. Cardiac fibrosis and vascular remodeling are attenuated by metformin in obese rats[J]. Int J Cardiol, 2013, 165(3):483-487.
[16]Shen Y, Miao N, Xu J, et al. Metformin prevents renal fibrosis in mice with unilateral ureteral obstruction and inhibits Ang II-induced ECM production in renal fibroblasts[J]. Int J Mol Sci, 2016, 17(2):146.
[17]Kannarkatt J, Alkharabsheh O, Tokala H, et al. Metformin and angiogenesis in cancer revisited[J]. Oncology, 2016, 91(4):179-184.
[18]Jian MY, Alexeyev MF, Wolkowicz PE, et al. Metformin-stimulated AMPK-1 promotes microvascular repair in acute lung injury[J]. Am J Physiol Lung Cell Mol Physiol, 2013, 305(11):L844-L855.
(责任编辑: 林白霜, 罗 森)
Metformin inhibits airway inflammation, remodeling and neovascularization in asthma mice
MA Wen-xian1, GUO Hai-qin1, HAN Xin-peng1, XU Ling-bin2, LIU Liang1, LI Zhi-chao3, WU Chang-gui1
(1DepartmentofRespiratoryMedicine,XijingHospital,FourthMilitaryMedicalUniversity,Xi’an710032,China;2DepartmentofRespiratoryMedicine,ShaanxiProvincialPeople’sHospital,Xi’an710068,China;3DepartmentofPathophysiology,FourthMilitaryMedicalUniversity,Xi’an710032,China.E-mail:changgui@fmmu.edu.cn;lizhic@fmmu.edu.cn)
AIM: To investigate the effects of metformin on airway inflammation, remodeling and neovascularization in a mouse model of chronic asthma and its possible mechanisms. METHODS: BALB/c mice were randomly divided into saline group, ovalbumin (OVA) group and OVA+metformin group, with 8 in each. At the end of OVA exposure, blood and bronchoalveolar lavage fluid (BALF) were collected for the measurement of OVA specific IgE and leukocyte counts. Lung tissue sections were stained with hematoxylin-eosin, periodic acid-Schiff and Masson’s trichrome to detect inflammatory cell infiltration, goblet cell hyperplasia, and collagen deposition around the airway, respectively. Immunohistochemistry was used to evaluate the number and percentage area of new blood vessels (CD31+), and the protein level of phosphorylated AMP-activated protein kinase (p-AMPK) in the airway. RESULTS: Compared with saline group, the eosinophil percentage and OVA specific IgE in serum in OVA group were all increased obviously (P<0.01). Metformin inhibited the above increases (P<0.05). Compared with control group, a marked increase in inflammation infiltration, PAS+cells and collage deposition in the airway mucosa in OVA group were observed. Metformin partially relieved the above changes. CD31+vessels in the wall of bronchi showed the abundance of blood vessels observed in OVA group compared with control group, which was suppressed by the treatment with metformin (P<0.05). The protein level of p-AMPK was reduced in the lung tissue challenged with OVA as compared with control group (P<0.05), while metformin increased the protein level of p-AMPK (P<0.01). CONCLUSION: The protein level of p-AMPK in the airway in OVA group is attenuated. Metformin effectively inhibits airway inflammation, remodeling and neovascularization possibly via activating AMPK signaling pathway.
Metformin; Airway neovascularization; AMP-activated protein kinase; Chronic asthma
1000- 4718(2017)04- 0590- 06
2016- 12- 06
2017- 03- 01
国家自然科学基金资助项目(No. 81470223)
R562.2+5; R965; R363
A
10.3969/j.issn.1000- 4718.2017.04.003
△通讯作者 吴昌归 Tel: 029-84774194; E-mail: changgui@fmmu.edu.cn; 李志超 Tel: 029-84772705; E-mail: lizhic@fmmu.edu.cn

