根皮素与两种β-环糊精衍生物的包合作用及性质
李姝静,周自若,周 威,王心蕊,袁 丽
(北京工商大学理学院化学系,北京 100048)
根皮素与两种β-环糊精衍生物的包合作用及性质
李姝静,周自若,周 威,王心蕊,袁 丽
(北京工商大学理学院化学系,北京 100048)
采用相溶解度法定量研究甲基-β-环糊精(methyl-β-cyclodextrin,Me-β-CD)及羟丙基-β-环糊精((2-hydroxy) propyl-β-cyclodextrin,HP-β-CD)与根皮素的包合作用,通过冷冻-干燥法成功制备了水溶性良好的包合物。并利用红外光谱、粉末X射线衍射、扫描电子显微镜研究分析根皮素及其包合物的结构。此外,通过测定还原能力及1,1-二苯基-2-三硝基苯肼自由基清除能力,检测根皮素及其包合物的抗氧化能力,并探究其对酪氨酸酶单酚酶和二酚酶活力的影响。结果表明:成功制备了根皮素与Me-β-CD、HP-β-CD物质的量比1∶1的包合物,包合作用显著提升了根皮素在水中的溶解度及抗氧化能力,有助于其加工成为水基化保健食品剂型。此外,根皮素及其包合物对酪氨酸酶均有良好的抑制效果,可作为天然、高效、环保的食品保鲜剂。
根皮素;β-环糊精衍生物;包合物;溶解性;抑制酪氨酸酶能力;抗氧化能力
根皮素属于二氢查耳酮类化合物,作为一种天然的活性物质广泛分布于苹果、梨等多汁水果的根皮中,故名“根皮素”[1]。已有大量研究报道表明,根皮素具有降低血糖、改善记忆力、抗癌[2-3]及抗炎[4]等功效。同时,它还具有抗氧化[5]及抑制酪氨酸酶活性的能力[6]。一些食品如蔬菜、肉类等长时间处在空气中,易氧化分解成为低级脂肪酸等物质,造成食品酸败。而一些海洋产品及水果饮料等由于酪氨酸酶的酶促作用,易导致结构中的酚类被氧化成黑色素,从而导致食品褐变、变质。根皮素可以有效地防止食品的酸败变黑,因此可作为良好的抗氧化剂及水果保鲜剂应用到食品工业中[7]。但是,由于根皮素较低的水溶性,限制了其在食品领域中的发展。
环糊精(cyclodextrins,CDs)是由α-1,4-糖苷键连接多个D(+)-葡萄糖单元形成的环状化合物,形状类似截去尖部的中空圆筒立体锥。环糊精外侧通过C2、C3形成的仲羟基及C6构成的伯羟基使之具有亲水性,而内层空腔则因受到C—H键的屏蔽作用而具有疏水性[8]。利用这种特性,环糊精可以包合许多具有疏水性质的化合物,提高难溶性物质的水溶性及对抗光、热时的稳定性[9-10]。β-CD由于其廉价、具有适中的空腔尺寸、容易形成包合物等特点,应用最为广泛。但由于其较低的水溶性限制了应用。甲基-β-环糊精(methyl-β-cyclodextrin,Me-β-CD)、羟丙基-β-环糊精((2-hydroxy) propyl-βcyclodextrin,HP-β-CD)等衍生物因具有水溶性好、无毒性等优点[11-12],常用来替代β-CD进行包合。
本实验采用冷冻-干燥法制备了根皮素与Me-β-CD及HP-β-CD的包合物,通过相溶解度法、红外光谱分析、粉末X射线衍射(X-ray diffraction,XRD)谱图及扫描电子显微镜(scanning electron microscopy,SEM)研究了CDs与根皮素的主客体作用,并考察了包合作用对抗氧化性和抑制酪氨酸酶活性的影响,有助于根皮素加工成为水基化保健食品剂型,扩大应用领域。
1 材料与方法
1.1 材料与试剂
根皮素(纯度>98%)、氢醌、酪氨酸酶(25 kU)、L-多巴(纯度>9 9%)、三氯乙酸、铁氰化钾(K3Fe(CN)6)、三氯化铁 阿拉丁公司;L-酪氨酸国药集团化学试剂有限公司;熊果苷、Me-β-CD(M= 1 310 g/mol,取代度为12.5) 北京百灵威科技有限公司;HP-β-CD(M=1 380 g/mol,取代度为4.2) 上海西宝生物科技有限公司。
1.2 仪器与设备
CARY-60分光光度计 美国瓦里安公司;D/MAX 2500V/PC X射线衍射仪 德国布鲁克公司;VEGA Ⅱ扫描电子显微镜 捷克Tescan公司。
1.3 方法
1.3.1 根皮素/Me-β-CD、根皮素/HP-β-CD包合物的制备
根皮素分别与Me-β-CD、HP-β-CD按物质的量比3∶1配制。根皮素溶于乙醇,环糊精溶于去离子水中,然后将根皮素溶液缓慢加入到环糊精溶液中,磁力搅拌3 d,经旋转-蒸发除去大部分溶剂,剩余样品用0.45 µm的滤膜过滤,滤液经冷冻干燥后即得包合物。
1.3.2 根皮素/Me-β-CD、根皮素/HP-β-CD的物理混合物
将根皮素分别与两种环糊精按照物质的量比1∶1混合,在玛瑙研钵中充分研磨使其混合均匀。
1.3.3 相溶解度的测定
称取过量的根皮素依次加入不同浓度的Me-β-CD与HP-β-CD的水溶液中,然后将样品放入水浴恒温振荡器中,保持水温为25 ℃、振动频率为120 r/min的条件进行充分振荡,反应48 h。最后用0.45 µm的滤膜除去不溶的根皮素。通过紫外-可见分光光度计测定滤液中根皮素的含量,然后分别以Me-β-CD及HP-β-CD的浓度为横坐标,根皮素的溶解度为纵坐标,绘制根皮素的相溶解度曲线并根据式(1)计算包合平衡常数(KS)[13]。

式中:S0表示在25 ℃的条件下不添加环糊精的根皮素的溶解度;Slope为相溶解度曲线的斜率。
1.3.4 红外光谱分析
采用KBr压片法研究分析根皮素、Me-β-CD、HP-β-CD、根皮素与Me-β-CD及HP-β-CD的混合物、根皮素与Me-β-CD及HP-β-CD包合物的红外吸收光谱。
1.3.5 XRD分析
在Cu Kα射线,波长为1.540 56 Å,电流40 mA,电压40 kV,扫描速率4°/min,扫描范围25~50°的条件下,分别对根皮素、Me-β-CD、HP-β-CD、根皮素/Me-β-CD、根皮素/H P-β-C D的物理混合物及其包合物进行XRD分析。
1.3.6 SEM观察
将样品粉末研磨均匀后,在导电胶带上涂布一层样品,之后放入喷金仪中喷金使之具有导电性,最后放入SEM中观察样品形貌。
1.3.7 抗氧化性检测
1.3.7.1 还原能力的测定
配制不同质量浓度的样品溶液注入含有2 mL磷酸盐缓冲溶液(0.2 mmol/L,pH 6.6)和2.0 mL的1 g/100 mL K3Fe(CN)6的混合溶液中。在50 ℃的条件下保温20 min。经迅速冷却后,再量取2.0 mL的10 g/100 mL三氯乙酸溶液加入到样品溶液中。取上清液加入到含有2.0 mL去离子水和0.4 mL 0.1 g/100 mL FeCl3的混合液中。经充分反应后,在700 nm波长处检测样品吸光度[14]。
1.3.7.2 DPPH自由基清除能力的测定
1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除能力的实验方法为:以乙醇为溶剂配制DPPH溶液,在避光的条件下,将2 mL的DPPH溶液分别注入到不同浓度的样品溶液,然后在(30±1)℃的温度中保温60 min,检测517 nm波长处样品的吸光度[15]。DPPH自由基清除能力(KD)的计算公式如式(2)所示:
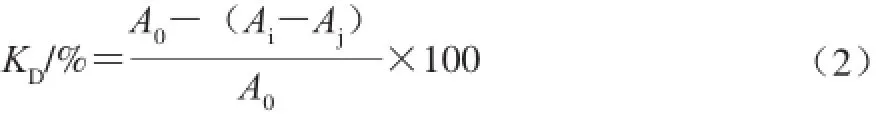
式中:A0表示DPPH溶液和样品溶剂的吸光度;Ai表示DPPH溶液和样品溶液的吸光度;Aj表示样品溶液和乙醇溶液的吸光度。
1.3.8 抑制酪氨酸酶活性能力
1.3.8.1 根皮素及其包合物对酪氨酸酶单酚酶活力影响以L-酪氨酸为底物,向其中加入磷酸盐缓冲溶液(pH 6.5)及样品溶液(熊果苷为对照组)混匀保温
10 min,再加入酪氨酸酶溶液,混匀后放入37 ℃的水浴锅中反应,在475 nm波长处测定吸光度。根据公式(3)计算根皮素及其包合物对酪氨酸酶的抑制率。

式中:A1表示加入L-酪氨酸、酪氨酸酶时的吸光度;A2表示加入L-酪氨酸、样品、酪氨酸酶时的吸光度;A3表示加入L-酪氨酸时的吸光度;A4表示加入L-酪氨酸、样品时的吸光度。
1.3.8.2 根皮素及其包合物对酪氨酸酶二酚酶活力影响
以L-多巴为底物,按照下列步骤操作:空白对照:向L-多巴中加入磷酸盐缓冲溶液(pH 6.5),水浴15 min后,再加酪氨酸酶溶液,37 ℃水浴加热,在475 nm波长处测量吸光度(A3);受试组:向不同样品溶液中加入L-多巴和磷酸盐缓冲溶液(pH 6.5),水浴15 min后,加酪氨酸酶溶液,37 ℃水浴加热,测量475 nm波长处的吸光度(A1);受试对照:将受试组的样品换成氢醌,测量吸光度(A2)。根皮素及其包合物的抑制率计算见公式(4)。
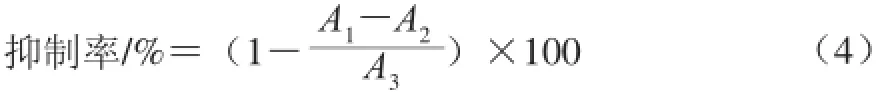
2 结果与分析
2.1 相溶解法
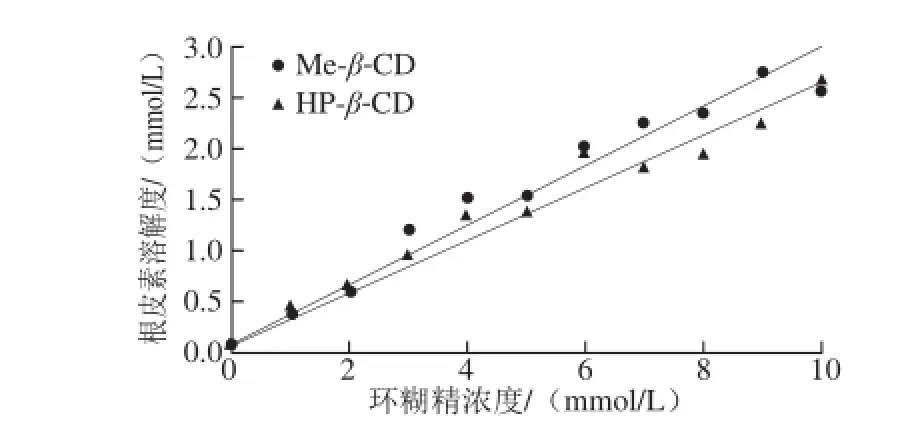
β-CD存在下根皮素的相溶解度曲线Fig. 1 Phase-solubility diagrams of phloretin with Me-β-CD and HP-β-CD图1 Me-β-CD和HP-
相溶解度是一种用来计算主客体间形成包合物稳定性强弱的重要方法。环糊精包合物的稳定性与相溶解法计算出的包合平衡常数相对应。其中,包合平衡常数数值越大,表明生成的包合物越稳定。由根皮素与Me-β-CD及HP-β-CD的相溶解图可知(图1):根皮素在水溶液中的溶解度随环糊精浓度的增加呈线性增长。基于Higuchi等[13]理论,表明Me-β-CD及HP-β-CD与根皮素均以物质的量比1∶1的形式生成了包合物。计算得出根皮素与Me-β-CD及HP-β-CD的包合平衡常数分别为6 606、5 577 mol-1,根据包合平衡常数与形成包合物的键能关系可知[16],根皮素与环糊精之间化学键结合强度大,形成的包合物稳定性好。此外,当Me-β-CD及HP-β-CD的浓度增加到10 mmol/L时,根皮素的溶解度分别增大了47.7、42.3 倍。表明经包合作用后,根皮素的水溶性得到了显著地提升。
2.2 包合物的表征
2.2.1 红外光谱分析
测定根皮素、Me-β-CD、HP-β-CD、根皮素与Me-β-CD、HP-β-CD物质的量比为1∶1的物理混合物及其包合物波数在4 000~400 cm-1处的红外吸收光谱,其结果如图2所示。以Me-β-CD为例,根皮素在1 600~1 400 cm-1处出现了苯环骨架振动峰,其中1 605 cm-1处为C=O键伸缩振动的特征峰;Me-β-CD在3 400 cm-1处出现了宽且强的环糊精羟基吸收峰;根皮素与Me-β-CD物质的量比为1∶1物理混合物的红外光谱图中既包含Me-β-CD在3 400 cm-1处的特征峰,也含有根皮素在1 605 cm-1处的特征峰,仅仅是峰的强度有所减弱。该结果表明两者只是简单的混合,并未发生包合作用。而根皮素与Me-β-CD包合物的红外光谱图中,1 600 cm-1处C=O键伸缩振动峰蓝移至1 633 cm-1,表明根皮素成功进入了Me-β-CD的空腔内,根皮素和Me-β-CD形成了包合物。HP-β-CD与根皮素的红外谱图与上述结果类似,表明根皮素也可以与HP-β-CD形成包合物。
2.2.2 XRD分析
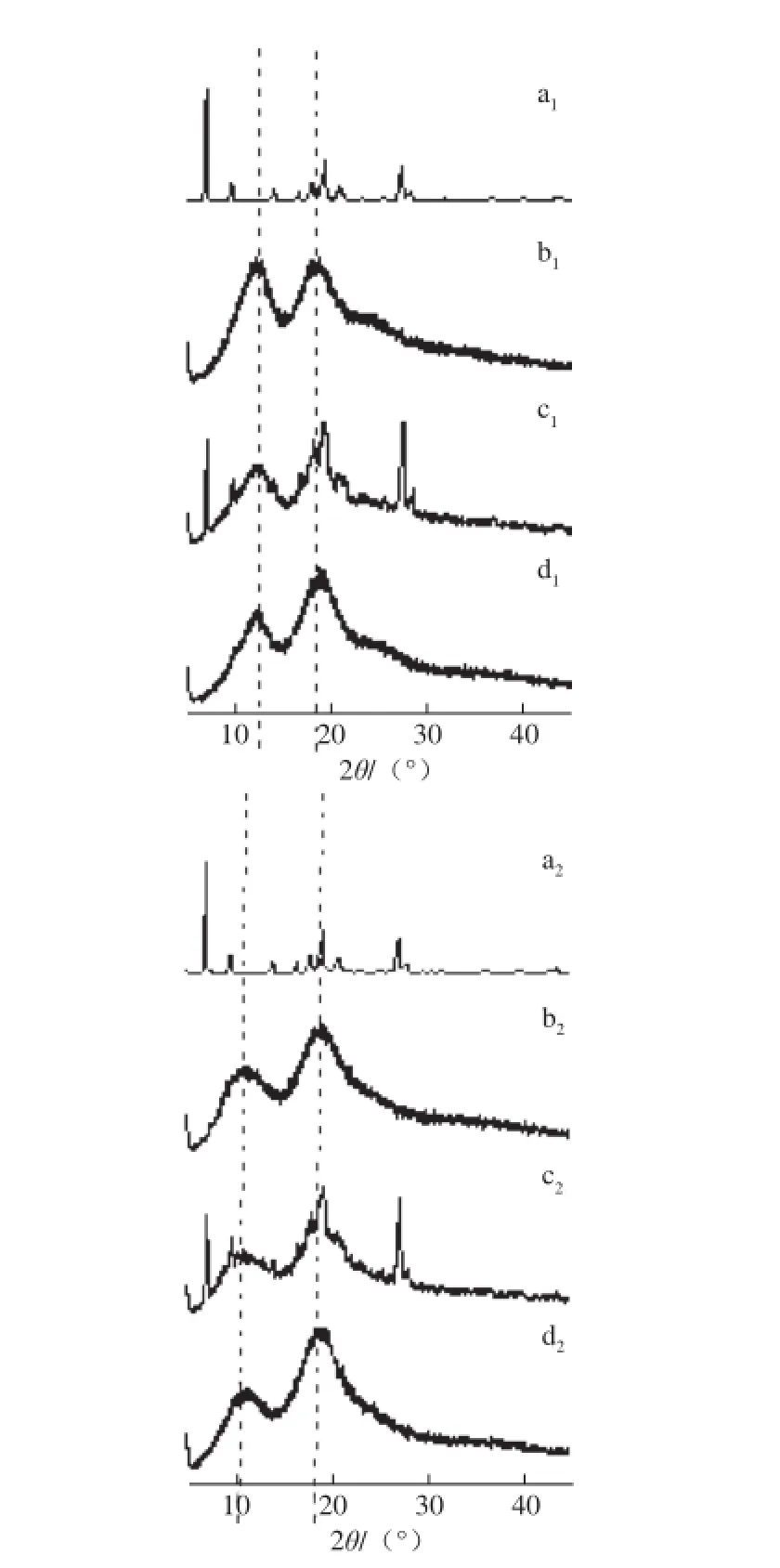
图3 XRD图Fig. 3 XRD patterns
XRD是表征主客体包合物常用的研究方法。根据根皮素、Me-β-CD及HP-β-CD、根皮素与环糊精的物理混合物及其包合物的XRD图可知(图3):根皮素衍射图中出现了许多晶型结构的特征峰,表示根皮素为晶体结构,而Me-β-CD及HP-β-CD的衍射峰仅为两条宽峰,表明环糊精为无定型结构。根皮素与环糊精物理混合物的峰形为两者峰形的叠加,因此可以证明根皮素和环糊精之间未发生化学反应,仍保留两者原始的物理化学性质[17]。而包合后根皮素,其峰形由结晶态的尖峰变成了两条无定型态的宽峰,表明根皮素成功进入了Me-β-CD及HP-β-CD的空腔内部,并发生了化学反应,且包合过程中未破坏环糊精的结构,由此证明了包合物的形成[18-20]。
2.2.3 SEM观察

图4 SEM图Fig. 4 Scanning electron microphotographs
图4 是根皮素、Me-β-CD、根皮素/Me-β-CD的物理混合物、根皮素/Me-β-CD包合物的SEM图。观察可知,根皮素的形貌为细长的条状结构,Me-β-CD的形貌为球体。根皮素/Me-β-CD物理混合物的图像中,既有根皮素特有的形貌结构,也含有Me-β-CD的形貌特点,由此可以证明两者并未形成新的物质,而根皮素/Me-β-CD包合物的形貌则变成表面光滑的块状,由此证明了根皮素与Me-β-CD之间发生了包合作用。
2.2.4 还原能力

图5 抗氧化能力Fig. 5 Antioxidant activities
检测物质的还原能力是确定样品抗氧化能力强弱的一种常用方法。其原理是利用抗氧化剂将铁氰化物中的Fe3+还原成Fe2+,然后检测溶液在700 nm波长处的吸光度,判断物质的还原能力。其中,吸光度越高,表明物质的还原能力越强[21]。以环糊精作对照,在700 nm波长处并未产生吸光度,由此排除环糊精自身对根皮素还原能力结果的影响。根皮素及其包合物的还原能力如图5A所示,随着根皮素质量浓度的增加,其吸光度也随之增加,并且经环糊精包合后的根皮素吸光度远大于未经包合的根皮素,表明了包合作用提升了物质的还原能力。产生该结果的原因可能是由于包合作用提升了根皮素的水溶性,减小了其在水中的团聚,有利于根皮素充分接触Fe3+,从而增强物质的还原能力[22-23]。
2.2.5 清除DPPH自由基能力
抗氧化剂捕获DPPH单电子,使其在517 nm波长处的吸光度下降。所以,测定的吸光度越低,表明物质的抗氧化能力越强,以此判定抗氧化能力的强弱。酚醛类化合物抗氧化的能力主要取决于羟基的位置及羟基化程度[24]。同样以环糊精作对照,在517 nm波长处并未产生吸光度,由此排除环糊精的影响。根皮素及其包合物的清除DPPH自由基能力如图5B所示,随着样品浓度的增加,根皮素及其包合物的清除DPPH自由基能力也随之增加,并且包合后的根皮素明显高于未包合的,该结果证明了根皮素包合物的抗氧化性能更强。其原因可能为:抗氧化性物质进入环糊精空腔内,使客体分子稳定性增加,更易与DPPH自由基反应[25]。抗氧化性物质中的酚羟基与环糊精中的羟基形成了分子内氢键,增加了羟基化程度,使之更有利于清除DPPH自由基[26-27]。
2.2.6 根皮素及其包合物对酪氨酸酶的抑制率
2.2.6.1 根皮素及其包合物对酪氨酸酶单酚酶活力影响
以L-酪氨酸为底物,根皮素、根皮素/Me-β-CD包合物及根皮素/HP-β-CD包合物为效应物,对酪氨酸酶单酚酶活力的抑制能力如表1所示。表中显示Me-β-CD、HP-β-CD、根皮素及其包合物对酪氨酸酶的单酚酶活性均没有抑制作用,而阳性对照组熊果苷的抑制率为43%。由此推测环糊精及根皮素不具有通过清除过氧自由基,终止自由基链的引发,从而抑制对酪氨酸酶单酚酶激活的能力[28]。

表1 根皮素及其包合物对酪氨酸酶单酚酶活力的抑制率Table 1 Inhibition types and inhibition constants of phloretin and its inclusion complexes on monophenolase activity
2.2.6.2 根皮素及其包合物对酪氨酸酶二酚酶活力影响
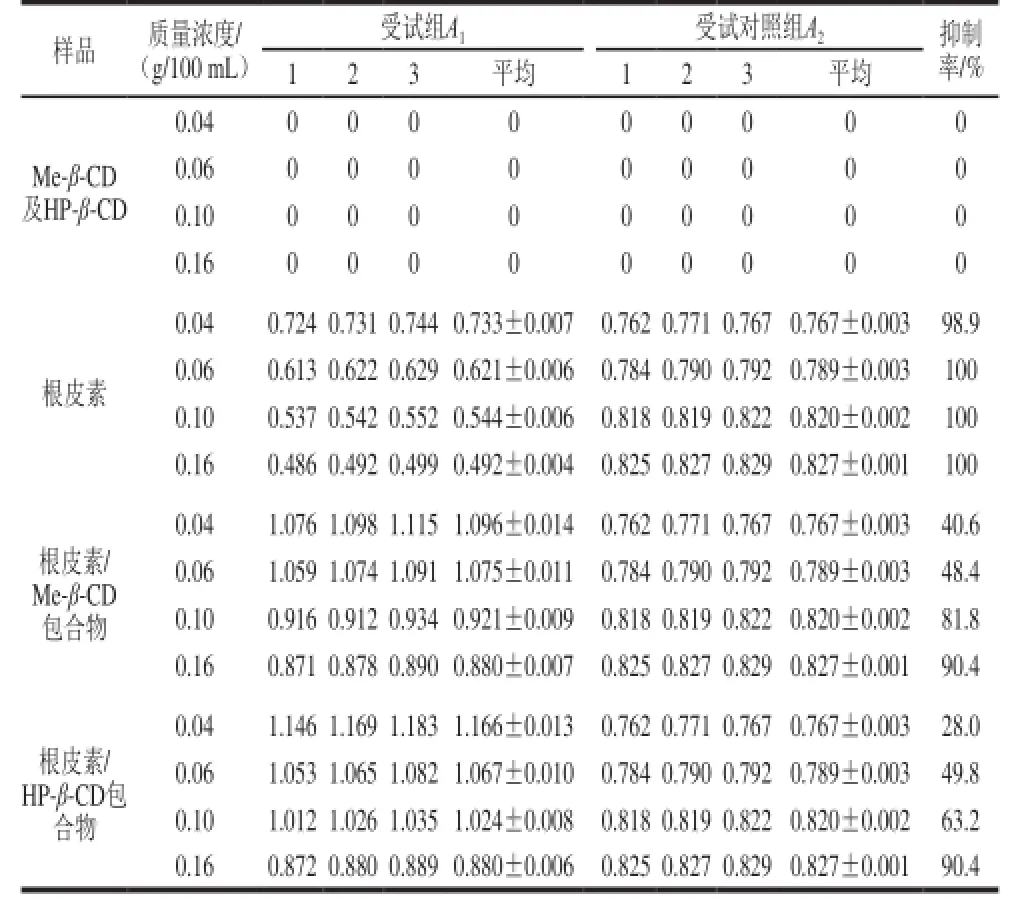
表2 根皮素及其包合物对酪氨酸酶二酚酶活力的抑制作用Table 2 Inhibition types and inhibition constants of phloretin and its inclusion complexes on diphenolase activity
以L-多巴为底物,测定根皮素及其包合物对酪氨酸酶二酚酶活力的抑制作用,结果见表2。Me-β-CD及HP-β-CD对酪氨酸酶二酚酶活力无抑制作用,而根皮素及其包合物对酪氨酸酶二酚酶活力均有抑制作用,且随着质量浓度的增加,对二酚酶活性的抑制能力也逐渐加强,当质量浓度达到0.16 g/100 mL时,根皮素及其包合物的抑制率分别达到100%、90.4%和90.4%。此外,根皮素/Me-β-CD及根皮素/HP-β-CD包合物对酪氨酸酶的抑制率由于受包合作用的影响,对二酚酶活性的抑制率有所减弱。
根据根皮素结构推测,其对酪氨酸酶的抑制作用主要是由于分子中存在大量的还原性羟基与酪氨酸酶分子中的Cu2+发生螯合作用有关[29],并且其结构可能与L-多巴相似,从而与底物形成竞争关系,削弱了酪氨酸酶对底物的氧化作用。由于影响抑制活性的关键位点是根皮素的3 个酚羟基,推测包合作用减弱对酪氨酸酶抑制能力的原因为环糊精将根皮素部分酚羟基包裹在空腔内部,减弱了其与酪氨酸酶分子中Cu2+的螯合作用。
3 结 论
本实验以Me-β-CD和HP-β-CD为主体成功制备了水溶性良好的根皮素/Me-β-CD及根皮素/HP-β-CD包合物。相溶解法的结果表明根皮素与环糊精之间形成了包合比1∶1的包合物,通过包合平衡常数可知生成的包合物稳定性高。利用XRD、SEM等表征手段证明了包合物的形成,并且发现包合作用有助于促进根皮素水溶性的提升。此外,通过检测物质的还原能力及清除DPPH自由基能力表明包合后根皮素的抗氧化能力增加,而抑制酪氨酸酶的实验则证明了根皮素及其包合物均可以有效地抑制黑色素的生成,且抑制效果优越。目前,抗氧化剂、酪氨酸酶抑制剂的开发已成为食品保健、防腐及保鲜等领域的研究重点,根皮素包合物优良的水溶性、抗氧化能力及抑制酪氨酸酶活性在食品领域有着广阔的发展前景。
[1] 李静, 余燕影, 曹树稳. 根皮素异烟酰基腙的合成、表征及抗氧化活性研究[J]. 天然产物研究与开发, 2011(23): 824-827. DOI:10.3969/j.issn.1001-6880.2011.05.007.
[2] WU C H, HO Y S, TSAI C Y, et al. In vitro and in vivo study of phloretin-induced apoptosis in human liver cancer cells involving inhibition of type II glucose transporter[J]. International Journal of Cancer, 2009, 124(9): 2210-2219. DOI:10.1002/ijc.24189.
[3] 谭飔, 周志钦. 根皮苷研究进展[J]. 食品与发酵工业, 2013, 39(8): 182-185. DOI:10.1016/j.plaphy.2013.02.017.
[4] SUN Yinshi, LI Wei, LIU Zhengbo. Preparative isolation, quantif i cation and antioxidant activity of dihydrochalcones from Sweet Tea (Lithocarpus polystachyus Rehd)[J]. Journal of Chromatography B, Analytical Technologies in the Biomedical and Life Sciences, 2015, 1002: 372-378. DOI:10.1016/j.jchromb.2015.08.045.
[5] REZK B M, HAENEN G R, van der VIJGH W J, et al. The antioxidant activity of phloretin: the disclosure of a new antioxidant pharmacophore in flavonoids[J]. Biochemical and Biophysical Research Communications, 2002, 295(1): 9-13. DOI:10.1016/S0006-291X(02)00618-6.
[6] 王建新, 周忠, 王建国. 根皮素抑酪氨酸酶活性研究[J]. 香料香精化妆品, 2002(2): 4-5.
[7] 董华强, 宁正祥. 根皮苷与糖尿病防治[J]. 食品科技, 2006, 31(12): 192-195. DOI:10.3969/j.issn.1005-9989.2006.12.056.
[8] 徐春明, 焦志亮, 李丹, 等. 栀子黄色素β环糊精包合物制备及其稳定性研究[J]. 中国食品学报, 2015, 15(3): 106-113. DOI:10.3969/ j.issn.1671-8895.2013.11.018.
[9] XIAO Chuanfan, LI Ke, HUANG Rong, et al. Investigation of inclusion complex of Epothilone A with cyclodextrins[J]. Carbohydrate Polymer, 2014, 102: 297-305. DOI:10.1016/j.carbpol.2013.11.049.
[10] YANG Lijuan, MA Shuixian, ZHOU Shuya, et al. Preparation and characterization of inclusion complexes of naringenin with β-cyclodextrin or its derivative[J]. Carbohydrate Polymer, 2013, 98(1): 861-869. DOI:10.1016/j.carbpol.2013.07.010.
[11] ZOPPETTI G, PUPPINI N, PIZZUTTI M, et al. Water soluble progesterone-hydroxypropyl-β-cyclodextrin complex for injectable formulations[J]. Journal of Inclusion Phenomena and Macrocyclic Chemistry, 2007, 57(1/2/3/4): 283-288. DOI:10.1007/s10847-006-9174-2.
[12] YUAN Chao, JIN Zhengyu, XU Xueming, et al. Preparation and stability of the inclusion complex of astaxanthin with hydroxypropylβ-cyclodextrin[J]. Food Chemistry, 2008, 109(2): 264-268. DOI:10.1016/j.foodchem.2007.07.051.
[13] HIGUCHI T A, CONNORS K A. Phase-solubility techniques[J]. Advances in Analytical Chemistry and Instrumentation, 1965, 4: 117-212.
[14] GHARIBZAHEDI S M T, RAZAVI S H, MOUSAVI M. Characterizing the natural canthaxanthin/2-hydroxypropyl-βcyclodextrin inclusion complex[J]. Carbohydrate Polymer, 2014, 101: 1147-1153. DOI:10.1016/j.carbpol.2013.10.074.
[15] WANG Biaoshi, LI Biansheng, ZENG Qingxiao, et al. Antioxidant and free radical scavenging activities of pigments extracted from molasses alcohol wastewater[J]. Food Chemistry, 2008, 107(3): 1198-1204. DOI:10.1016/j.foodchem.2007.09.049.
[16] MARQUES H M, HADGRAFT J, KELLAWAY I W. Studies of cyclodextrin inclusion complexs, I. the salbutamol-cyclodextrin complex as studied by phase solubility and DSC[J]. International Journal of Pharmaceutics, 1990, 63(3): 259-266. DOI:10.1016/0378-5173(90)90132-N.
[17] LIU Benguo, LI Wei, ZHAO Jian, et al. Physicochemical characterisation of the supramolecular structure of luteolin/ cyclodextrin inclusion complex[J]. Food Chemistry, 2013, 141(2): 900-906. DOI:10.1016/j.foodchem.2013.03.097.
[18] HO B T, BHANDARI B R. Novel solid encapsulation of ethylene gas using amorphous α-cyclodextrin and the release characteristics[J]. Journal of Agricultural and Food Chemistry, 2016, 64(17): 3318-3323. DOI:10.1021/acs.jafc.5b06037.
[19] SRIVALLI K M R, MISHRA B. Improved aqueous solubility and antihypercholesterolemic activity of ezetimibe on formulating with hydroxypropyl-β-cyclodextrin and hydrophilic auxiliary substances[J]. AAPS Pharmscitech, 2016, 17(2): 272-283. DOI:10.1208/s12249-015-0344-7.
[20] ZHANG Da, ZHANG Jianqiang, JIANG Kunming, et al. Preparation, characterisation and antitumour activity of β-, γ- and HP-βcyclodextrin inclusion complexes of oxaliplatin[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2016, 152: 501-508. DOI:10.1016/j.saa.2015.07.088.
[21] GHARIBZAHEDI S M T, RAZAVI S H, MOUSAVI S M. Comparison of antioxidant and free radical scavenging activities of biocolourant synthesized by Dietzianatronolimnaea HS-1 cells grown in batch, fed-batch and continuous cultures[J]. Industrial Crops and Products, 2013, 49: 10-16. DOI:10.1016/j.indcrop.2013.03.019.
[22] YUAN Chao, DU Lei, JIN Zhengyu, et al. Storage stability and antioxidant activity of complex of astaxanthin with hydroxypropylβ-cyclodextrin[J]. Carbohydrate Polymers, 2013, 91(1): 385-389. DOI:10.1016/j.carbpol.2012.08.059.
[23] GHARIBZAHEDI S M T, RAZAVI S H, MOUSAVI M. Characterizing the natural canthaxanthin/2-hydroxypropyl-βcyclodextrin inclusion complex[J]. Carbohydrate Polymers, 2014, 101: 1147-1153. DOI:10.1016/j.carbpol.2013.10.074.
[24] LI Jinxia, HAN Lili, CHAO Jianbin. Preparation and characterization of the inclusion complex of baicalein with γ-cyclodextrin: an antioxidant ability study[J]. Journal of Inclusion Phenomena and Macrocyclic Chemistry, 2012, 73(1/2/3/4): 247-254. DOI:10.1007/ s10847-011-0048-x.
[25] JULLIAN C, OROSTEGUIS T, PÉREZ-CRUZ F, et al. Complexation of morin with three kinds of cyclodextrin A thermodynamic and reactivity study[J]. Spectrochimica Acta Part A Molecular & Biomolecular Spectroscopy, 2008, 71(1): 269-275. DOI:10.1016/ j.saa.2007.12.020.
[26] YUAN Chao, DU Lei, JIN Zhengyu, et al. Storage stability and antioxidant activity of complex of astaxanthin with hydroxypropylβ-cyclodextrin[J]. Carbohydrate Polymers, 2013, 91: 385-389. DOI:10.1016/j.carbpol.2012.08.059.
[27] STRAZISAR M, ANDRENSEK S, SMIDOVNIK A. Effect of β-cyclodextrin on antioxidant activity of coumaric acids[J]. Food Chemistry, 2008, 110(3): 636-642. DOI:10.1016/ j.foodchem.2008.02.051.
[28] 陈桂霞, 邱凌, 宋康康, 等. 桑黄素对蘑菇酪氨酸酶的抑制作用[J].厦门大学学报(自然科学版), 2006, 45(3): 424-427. DOI:10.3321/ j.issn:0438-0479.2006.03.029.
[29] ISAO K, IKUYO K H, SWAPAN K, et al. Flavonols from Heterotheca inuloides: tyrosinase inhibitory activity and structural criteria[J]. Bioorganic & Medicinal Chemistry, 2000, 8(7): 1749-1755. DOI:10.1016/S0968-0896(00)00102-4.
Preparation and Properties of Inclusion Complexes of β-Cyclodextrin Derivatives with Phloretin
LI Shujing, ZHOU Ziruo, ZHOU Wei, WANG Xinrui, YUAN Li
(Department of Chemistry, School of Science, Beijing Technology and Business University, Beijing 100048, China)
The inclusion complexation behavior of phloretin with methyl-β-cyclodextrin (Me-β-CD) and (2-hydroxy) propylβ-cyclodextrin (HP-β-CD) was investigated quantitatively by the phase solubility method. Water-soluble inclusion complexes of phloretin and two β-CD derivatives were prepared by the freeze-drying method and structurally characterized by infrared spectroscopy (IR), X-ray diffraction (XRD) and scanning electron microscopy (SEM). Furthermore, the antioxidant activities of phloretin and the inclusion complexes were determined by reducing power (RP) and 1,1-diphenyl-2-picryl-hydrazyl (DPPH) radical scavenging methods. The tyrosinase inhibitory activities of phloretin and the inclusion complexes were also investigated. The results proved that phloretin formed 1:1 stoichiometric inclusion complex with Me-β-CD and HP-β-CD, respectively. The water solubility and antioxidant activity of phloretin were greatly enhanced in the presence of CDs, providing a good way to develop water-based health food formulations. Additionally, phloretin and its inclusion complexes were observed to eff i ciently inhibit tyrosinase activity. The inclusion complexes could be developed as a natural, eff i cient and environmental friendly food preservative.
phloretin; β-cyclodextrin derivatives; inclusion complex; solubility; tyrosinase inhibitory activity; antioxidant activities
10.7506/spkx1002-6630-201707003
TS201.1
A
李姝静, 周自若, 周威, 等. 根皮素与两种β-环糊精衍生物的包合作用及性质[J]. 食品科学, 2017, 38(7): 11-16.
10.7506/spkx1002-6630-201707003. http://www.spkx.net.cn
LI Shujing, ZHOU Ziruo, ZHOU Wei, et al. Preparation and properties of inclusion complexes of β-cyclodextrin derivatives with phloretin[J]. Food Science, 2017, 38(7): 11-16. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201707003. http://www.spkx.net.cn
2016-04-26
国家自然科学基金青年科学基金项目(31501445)
李姝静(1980—),女,副教授,博士,研究方向为新型主客体识别功能体系的设计与制备。E-mail:lishujing@mail.ipc.ac.cn

