超高压辅助中华管鞭虾脱壳及对其肌肉品质的影响
王芝妍,杨文鸽,*,周 果,徐大伦,楼乔明,张进杰,崔 燕
(1.宁波大学海洋学院,浙江省动物蛋白食品精深加工重点实验室,浙江 宁波 315211;2.宁波市农业科学研究院,浙江 宁波 315040)
超高压辅助中华管鞭虾脱壳及对其肌肉品质的影响
王芝妍1,杨文鸽1,*,周 果1,徐大伦1,楼乔明1,张进杰1,崔 燕2
(1.宁波大学海洋学院,浙江省动物蛋白食品精深加工重点实验室,浙江 宁波 315211;2.宁波市农业科学研究院,浙江 宁波 315040)
为研究超高压处理对虾仁品质的影响,采取不同的压力(100~500 MPa)处理中华管鞭虾,通过测定虾仁肌原纤维蛋白盐溶性、巯基含量、表面疏水性、Ca2+-ATPase活性及虾仁色泽、质构、肌肉超微结构,研究超高压处理在辅助脱去虾壳的同时对虾仁肌肉及其蛋白生化特性的影响。结果表明,与对照组相比,200、300 MPa处理中华管鞭虾,在保持虾仁结构完整性及其良好品质的同时能显著提高脱壳效果,400、500 MPa处理后虾肉发生熟化;200 MPa处理组虾肉硬度、弹性和咀嚼性比对照组分别提高35.37%、7.46%和24.93%,肌原纤维蛋白除表面疏水性上升外,其盐溶性、总巯基含量和Ca2+-ATPase活性无明显变化;而300、400、500 MPa处理后肌原纤维蛋白盐溶性、巯基含量及Ca2+-ATPase活性下降明显。结合脱壳效果和对虾仁肌肉及其肌原纤维蛋白生化特性的影响,选择200 MPa处理中华管鞭虾,可有效提高脱壳效果,还能保持虾仁良好品质。实验结果可为冻虾仁生产中利用超高压辅助中华管鞭虾脱壳技术的应用提供支持。
中华管鞭虾;超高压;脱壳;肌原纤维蛋白
中华管鞭虾(Solenocera melantho)又称红虾,是我国主要的海捕虾品种[1],营养丰富、味甜鲜美。但因中华管鞭虾捕捞后即死,且其肉质细嫩、头胸易脱落,运销期间容易腐败变质,因此除少量鲜销外,主要被加工为冻虾仁出口。在虾仁加工中,目前普遍使用人工剥壳,存在效率差、完整率低、氯霉素超标等问题。随着劳动力持续紧缺、对高品质虾仁需求日益增长,急需实现对虾快速脱壳、品质保证的加工方式。
超高压(ultra high pressure,UHP)技术是当前备受各国重视的食品非热加工新技术之一,用100~1 000 MPa处理食品物料,达到杀菌、灭酶、提高脱壳效率或消减致敏性等目的,以改善食品品质及其贮藏特性[2]。陈少华等[3]对南美白虾进行200 MPa保压3 min处理,发现能有效缩短脱壳时间,同时使虾仁得肉率提高6.21%。孟辉辉等[4]发现400 MPa保压2 min能使毛蚶脱壳率达到90%以上。除了能够辅助脱壳外,超高压技术在水产品加工保鲜等方面的研究也多有报道,如Shang Xiaolan等[5]用600 MPa处理海鲈鱼,发现其肌肉持水性显著提高;常耀光等[6]发现超高压处理可有效杀灭南美白对虾中的绝大多数微生物,抑制贮藏期间挥发性盐基氮的积累。但在某些高压条件下,水产品的肌肉品质也会发生一些不良变化,如贾莹等[7]利用250~500 MPa处理虾姑,发现随压力升高,虾姑肉颜色变白、透明度降低;Jantakoson等[8]用200~800 MPa处理斑节对虾20 min,肌球蛋白巯基氧化形成二硫键,虾肉品质受到影响;于勇等[9]发现400~500 MPa的处理压力会使虾仁中水分与蛋白凝胶之间的结合力降低。但目前利用超高压技术预处理中华管鞭虾,对脱壳效果及其肌肉品质影响的研究鲜见报道。本实验以中华管鞭虾为原料,在评价超高压处理后的脱壳效果基础上,以虾仁色泽、质构、肌原纤维蛋白盐溶性、巯基含量、表面疏水性、Ca2+-ATPase活性及肌肉超微结构等为指标,分析超高压处理对中华管鞭虾肌肉及其肌原纤维蛋白生化特性的影响,旨在为超高压处理脱壳技术在中华管鞭虾中的应用提供指导。
1 材料与方法
1.1 材料与试剂
中华管鞭虾(Solenocera melantho),刚捕获的新鲜红虾,每只质量(13±2) g,购于宁波路林水产交易市场,加冰快速运至实验室;其他试剂均为分析纯。
1.2 仪器与设备
CQC2L-600超高压设备 北京速原中天股份有限公司;CR-400色差仪 日本柯尼卡美能达公司;TA.XT Plus质构仪 英国Stable Micro Systems公司;SpectraMax i3酶标仪 美国Molecular Devices公司;Biofuge Stratos型台式高速冷冻离心机 德国Thermo Scientific Sorvall公司;XF-D型内切式匀浆机 宁波新芝生物科技有限公司;JEM-1230型透射电子显微镜 日本JEOL公司。
1.3 方法
1.3.1 样品准备
取颜色相近、大小均一的红虾,聚乙烯袋包装(每包含5 只虾、100 mL水),密封,在预实验基础上,分别于100、200、300、400、500 MPa条件下常温保压5 min,不同条件下各处理60 只虾,解压后开袋,手工去除虾头及虾壳。未处理直接去壳的为对照组。
1.3.2 脱壳效果评分
按表1由6 名经过培训的人员对超高压处理后的红虾进行手工剥壳[1],对壳肉剥离度、虾仁完整性及虾仁熟化度进行评分,各分项相加为脱壳效果评分。

表1 脱壳效果评分标准Table 1 Standards for the evaluation of shelling eff i ciency
1.3.3 虾仁色泽的测定
采用Lab模型分别测定虾仁表面及内部的L*、a*和b*值,每只虾仁重复测定3 次。测定表面色泽时,以虾仁第二腹节背面为准;测定内部色泽时,从虾仁背部沿肌肉条纹横切后测定。
1.3.4 虾仁质构指标的测定
取虾仁第二腹节,采用TPA模式,测定虾仁硬度、弹性及咀嚼性。测试参数:P50探头,测前速率2 mm/s,测试速率1 mm/s,测后速率1 mm/s,应变50% 。
1.3.5 虾仁肌原纤维蛋白溶液的制备
参考林娴萍等[10]方法。取2 g虾肉,加入20 mL预冷Tris-maleate缓冲溶液(50 mmol/L KCl-20 mmol/L Trismaleate,pH 7),匀浆后10 000 r/min离心10 min,沉淀加入10 倍量Tris-maleate缓冲液(0.6 mol/L KCl-20 mmol/L Tris-maleate,pH 7),匀浆后提取1 h,10 000 r/min离心10 min,上清液即为肌原纤维蛋白溶液。上述过程均在4 ℃条件下进行,双缩脲法测定蛋白含量。
1.3.6 肌原纤维蛋白表面疏水性的测定
依据Chelh等[11]方法。取1 mL 肌原纤维蛋白溶液,加200 μL溴酚蓝(质量浓度1 mg/mL),室温条件下搅拌10 min,10 000 r/min离心15 min,取上清液稀释10 倍,测定595 nm波长处吸光度。以20 mmol/L磷酸盐缓冲液(pH.6.0) 作空白。表面疏水性以其所结合的溴酚蓝量表示,见公式(1)。
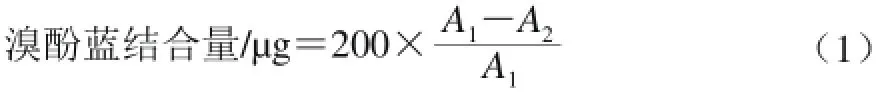
式中:200为溴酚蓝加入量/μg;A1为空白样595 nm波长处吸光度;A2为样品液595 nm波长处吸光度。
1.3.7 肌原纤维蛋白总巯基含量的测定
[12]方法。取1 mL肌原纤维蛋白溶液,加入9 mL 0.2 mol/L Tris-HCl (pH 6.8,含8 mol/L尿素,2%十二烷基硫酸钠和10 mol/L乙二胺四乙酸),充分混匀后取4 mL该液体,加0.4 mL 0.1% 5,5’-二硫代双(2-硝基苯甲酸)溶液(溶于0.2 mol/L Tris-HCl中,pH 8.0),40 ℃水浴中反应25 min,测412 nm波长处吸光度。空白组以0.6 mol/L KCl溶液替代,总巯基含量的计算见公式(2)。
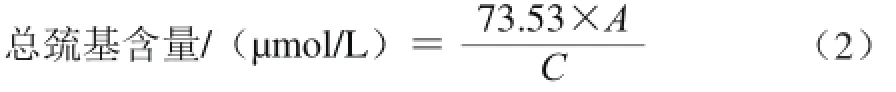
式中:A为样品液与空白组412 nm波长处吸光度之差;C为稀释倍数。
1.3.8 肌原纤维蛋白Ca2+-ATPase活性的测定
按文献[13]方法进行。以每分钟每毫克肌原纤维蛋白分解ATP所释放的磷酸根中磷的微克数计算,钼酸铵法测定无机磷含量。
1.3.9 虾仁肌肉显微结构分析
取虾仁背部肌肉,切成3 mm3左右小块,3%戊二醛溶液固定2 h,取出用0.1 mol/L磷酸盐缓冲液漂洗3~4 次,每次15 min,再用1%饿酸于黑暗中固定1~2 h。0.1 mol/L磷酸盐缓冲液漂洗3 次,分别用30%、50%、70%及90%乙醇依次脱水15 min,90%丙酮脱水(每次20 min,重复4 次),之后包埋、切片、染色,透射电子显微镜观察拍照。
1.4 数据统计
实验平行次数3~5 次,数据采用Duncan模型进行方差分析,由SAS 8.0软件进行计算。显著性水平取0.05,即P<0.05时,差异显著。
2 结果与分析
2.1 超高压处理对脱壳效果的影响
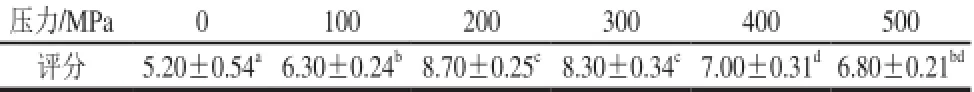
表2 超高压处理对中华管鞭虾脱壳效果的影响Table 2 Effect of UHP on the shelling of S. melantho
不同压力作用下红虾的脱壳效果评分如表2所示。可以看出,超高压处理有助于红虾脱壳,其中200 MPa与300 MPa处理红虾的改善效果最明显,且两组效果差异不显著;400 MPa与500 MPa处理后,虽然去壳速度较快,虾仁完整性好,但处理后肌肉熟化较为明显,影响最终分值。杨徽[2]进行南美白对虾脱壳时,也发现200~300 MPa处理3~5 min时有利于虾脱壳效率的提高,本实验结果与其基本一致。
2.2 超高压处理对虾仁色泽的影响
表3为超高压处理后红虾虾仁表面和内部色泽的变化情况。与对照组相比,在较高的压力下虾仁表面与内部L*值均出现上升趋势,虾仁表面L*值的显著变化出现在400 MPa处理之后,且500 MPa组比400 MPa组显著升高(P<0.05)。虾仁内部L*值的变化起始于200 MPa,压力继续升高后的300 MPa组与200 MPa组无显著差异,400 MPa后继续呈明显上升趋势。300 MPa处理后虾仁表面及内部L*值与200 MPa处理组相比均无显著差异。L*值从0~100表示黑暗色到明亮色,说明高压处理能提高虾仁的白度,但同时也降低了肌肉的透明度,过高的压力下虾仁出现熟化现象。这与甘晓玲[13]在超高压处理南美白对虾中的发现一致。
a*值由大到小代表红色到绿色,在0~400 MPa间,虾仁表面和内部肌肉的a*值随着压力的增加而减少,这种变化趋势与杨徽[2]研究超高压对南美白对虾色泽的影响结果一致。200 MPa和300 MPa组与对照组相比a*值均显著降低(P<0.05),同时300 MPa处理组表面与内部的a*值显著低于200 MPa组(P<0.05),红度变化程度加深。但500 MPa组a*值显著大于400 MPa组(P<0.05),这可能是由于过高的压力导致蛋白质变性,与虾青素的结合减弱,游离的虾青素发生氧化而成为红色的虾红素[14],易俊洁等[15]在超高压优化鲍鱼脱壳工艺时也发现a*值的升高现象。
b*值由大到小表示黄色到蓝色,虾仁表面b*值为正数,而内部为负数,说明红虾体表颜色偏黄而体内颜色偏蓝。超高压处理后,表面和内部b*值均呈现下降趋势,与对照组相比,100 MPa和200 MPa组b*值的变化不明显,但300、400、500 MPa组与对照组相比均显著下降(P<0.05)。虾仁表面和内部的黄度均从300 MPa开始出现显著变化。这一结果与贾莹[7]、Yi Junjie[16]等研究超高压对虾蛄和扇贝肌肉b*值的影响结果一致。但Cruzromero等[17]发现260 MPa处理会使牡蛎肉b*值显著升高,雒莎莎[18]认为当压力大于300 MPa时,鳙鱼肉b*值随压力的增加而上升。可见,超高压对不同水产品b*值的影响不一,原因在于肌肉色泽的改变是超高压作用下蛋白变性和色素失活共同作用的结果[15],不同水产品所含的色素不同,造成其b*值变化趋势的不一致。
2.3 超高压处理对虾仁肌肉质构的影响
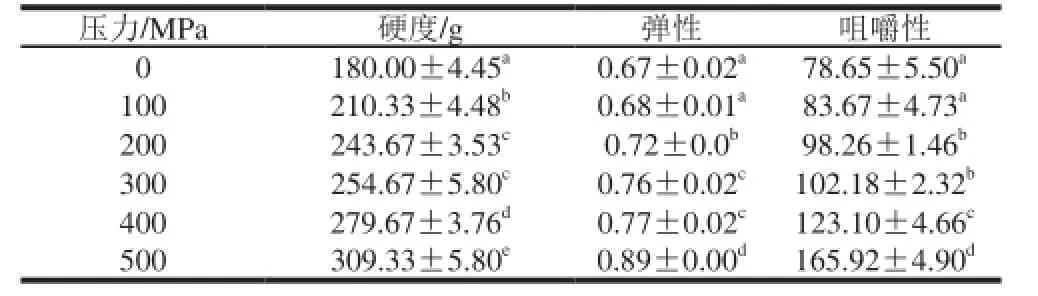
表4 超高压处理对中华管鞭虾虾仁质构的影响Table 4 Effect of UHP on the texture of S. melanthomeat
超高压对虾仁质构指标的影响如表4所示,超高压处理后硬度、弹性和咀嚼性均发生了不同程度的变化,三者均随压力的增加而升高。其中硬度的改变最为明显,100 MPa处理后虾仁硬度由对照组的180 g显著上升至210 g,而弹性和咀嚼性的显著变化始于200 MPa。200 MPa处理组虾仁硬度、弹性和咀嚼性分别提高35.37%、7.46%和24.93%,虾仁质构得到改善。300 MPa组虾仁的硬度和咀嚼性与200 MPa组相比均无显著变化,弹性显著大于200 MPa组。Kaur[20]、Bindut[21]等发现超高压能使对虾硬度随着压力的升高而显著增大,Angsupanich等[22]推测硬度及咀嚼性的增大缘于压力的升高所导致的肌原纤维蛋白变性凝聚,此推论也将在后续红虾肌原纤维蛋白特性的变化中得到验证。
水产品死后的品质变化大致分为僵硬、自溶和腐败变质3 个阶段[23],在僵硬阶段,硬度不断升高,鲜度良好,僵硬期后水产品硬度下降并进入自溶状态,鲜度不断下降。虾肉组织较松软,组织蛋白酶活性较强,死后僵硬期短,肌肉容易变软且腐败速度加快。本实验结果表明,适当的超高压处理能在一定程度内提高虾肉硬度、弹性和咀嚼性,减缓虾肉质构品质的下降速度,有利于保持虾仁鲜度。
2.4 超高压处理对虾仁肌肉肌原纤维蛋白含量的影响
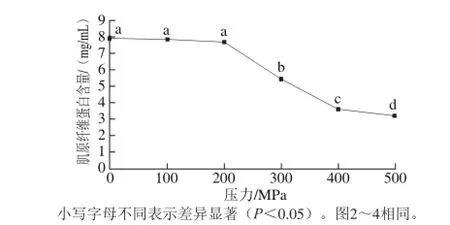
图1 超高压处理对虾仁肌原纤维蛋白含量的影响Fig. 1 Effect of UHP on salt-soluble protein content of shrimp meat
肌原纤维蛋白是虾肉的重要蛋白组分,与虾仁的持水性、嫩度等密切相关,超高压处理对虾仁肌原纤维蛋白含量的影响如图1所示。在100~200 MPa处理下,虾仁肌原纤维蛋白含量与对照组相比无显著差异(P>0.05),但在300~500 MPa压力下,肌原纤维蛋白含量的下降显著(P<0.05),500 MPa组降至3.22 mg/mL,仅为对照组的40.50%。朱松明等[24]认为在较高压力下蛋白质分子变性聚集,影响了肌原纤维蛋白的盐溶性;Alberto等[25]也证实猪肉经超高压处理,氢键的结合导致肌原纤维蛋白聚合而降低其溶解性。从肌原纤维蛋白含量的变化,可以推测当压力达到300 MPa时,会影响到虾仁肌肉品质。
2.5 超高压处理对虾仁肌原纤维蛋白表面疏水性的影响
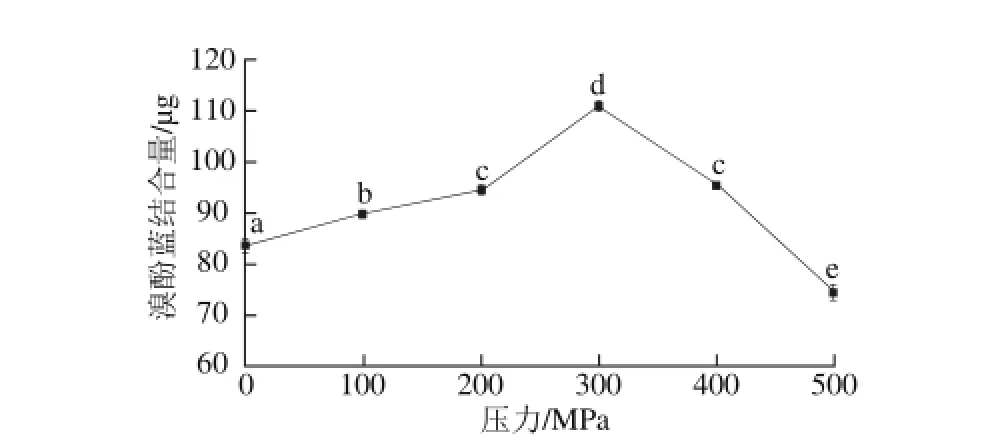
图2 超高压对肌原纤维蛋白表面疏水性的影响Fig. 2 Effect of UHP on surface hydrophobicity of myof i brillar protein
溴酚蓝可以与蛋白质表面的疏水性氨基酸残基相结合,因此肌原纤维蛋白的表面疏水性可以用其所结合的溴酚蓝量表示。由图2可知,随处理压力的增大,表面疏水性呈现先增大后减小的趋势,当压力达到300 MPa时表面疏水性值达到最大。
红虾在超高压作用下,肌肉蛋白的多肽链去折叠而暴露出内部的一些疏水性氨基酸残基,导致表面疏水性升高,但过高的压力又容易导致去折叠蛋白的进一步聚集,暴露出的疏水性氨基酸残基又重新被掩埋而使表面疏水性下降。郭宝颜等[26]在研究超高压对罗非鱼肌原纤维蛋白表面疏水性的影响时,也发现当压力达到300 MPa,表面疏水性随压力的增加而显著下降。
2.6 超高压处理对虾仁肌原纤维蛋白总巯基含量的影响
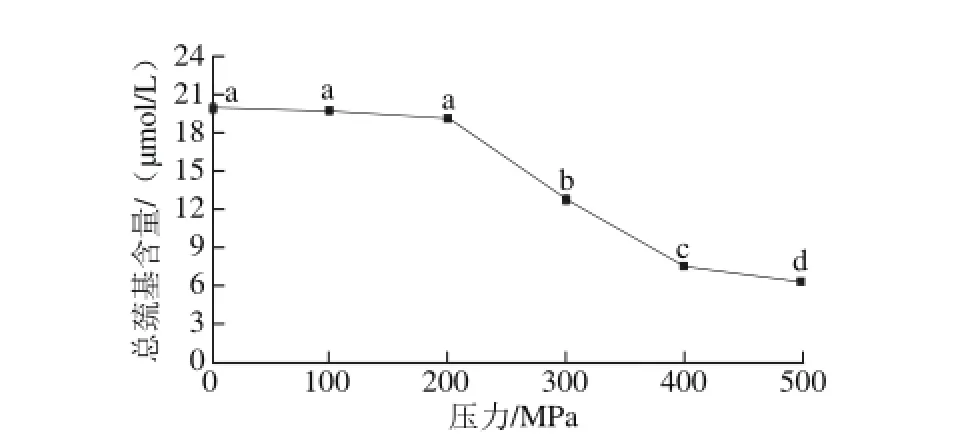
图3 超高压处理对肌原纤维蛋白总巯基含量的影响Fig. 3 Effect of UHP on total sulfhydryl content of myof i brillar protein
图3为超高压处理后虾仁肌原纤维蛋白总巯基含量的变化。可以看出,超高压导致总巯基含量下降,100 MPa和200 MPa组与对照组相比无显著差异(P>0.05),但在300 MPa及之后下降明显(P<0.05),这与前面肌原纤维蛋白含量的变化临界点一致。巯基含量的下降可能是由于高压作用下蛋白质分子之间的相互作用力增强,促使巯基氧化形成了二硫键。这与阎微[27]研究100~500 MPa处理蛋黄蛋白质,其巯基含量随着压力增加而减小的结果相符合。
2.7 超高压处理对虾仁肌原纤维蛋白Ca2+-ATPase活性的影响
肌原纤维蛋白中的肌球蛋白头部具有ATP酶活性,其活性需要Ca2+维持,Ca2+-ATPase活性是肌球蛋白分子结构完整性的重要指标,能较好地反映肌原纤维蛋白的变性程度。超高压处理对红虾肌原纤维蛋白Ca2+-ATPase活性的影响如图4所示。
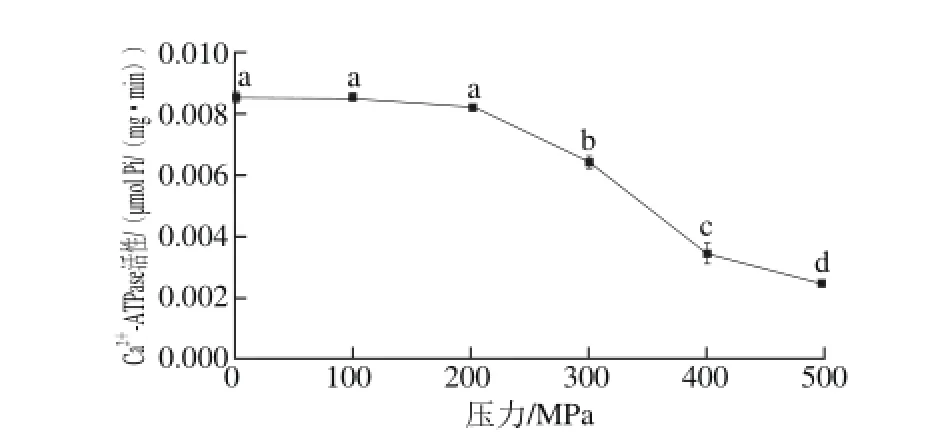
-ATPase活性的影响Fig. 4 Effect of UHP on Ca2+-ATPase activity of myof i brillar protein图4 超高压处理对肌原纤维蛋白Ca2+
同肌原纤维蛋白含量及其巯基活性的变化趋势类似,100 MPa或200 MPa处理后Ca2+-ATPase活性无显著变化,而在300~500 MPa组Ca2+-ATPase活性急剧降低(P<0.05)。可见,中华管鞭虾肌原纤维蛋白中Ca2+-ATPase活性对300 MPa及以上高压极其敏感。但在Ko等[28]报道中,100 MPa处理即能使罗非鱼肌球蛋白的Ca2+-ATPase活性急剧降低,这可能是由于不同水产品中的Ca2+-ATPase对压力的敏感程度不同。
酶活性的下降缘于较高压力对蛋白质产生构象的改变和破坏,蛋白质的构象是形成酶活性中心的基础,当压力低于临界值,酶的活性中心结构可逆恢复,活性不受影响;但当超过临界值导致构象崩溃,酶活发生不可逆永久性失活。推测中华管鞭虾Ca2+-ATPase活性的压力临界值位于200~300 MPa之间。
2.8 超高压处理对中华管鞭虾肌肉超微结构的影响
肌原纤维的明暗条纹由粗丝和细丝有规则地平行排列而成,暗条纹即图中的A带,长度由粗丝决定;明条纹即I带,长度由细丝决定。A带中央有一条稍暗的线,为M线,附近较浅区域为H区[29]。I带中央的暗线,则称为Z线,两条Z线之间的距离,即为一个肌节长度。

图5 超高压处理对中华管鞭虾肌肉超微结构的影响(×30 000)Fig. 5 Effect of UHP on ultrastructure of S. melantho muscle (× 30 000)
由图5可以看出,对照组中华管鞭虾肌肉肌原纤维排列整齐,肌节完整;100~300 MPa超高压处理后,明暗带仍旧可见,但Z线与M线消失,H区不可明显区分。300 MPa组中肌节变短,肌节完整性被破坏,同时肌原纤维间隙变模糊,开始出现凝胶化,这与其他指标在300 MPa时出现明显变化的情况相符。雒莎莎[18]在研究超高压对鳙鱼肉品质影响中发现,鳙鱼肌原纤维中A带和Z线从150 MPa开始出现断裂,在450 MPa处理后肌节被彻底破坏。赵伟等[30]在研究超高压处理对牡蛎肌肉的影响时,发现随着压力的上升,牡蛎闭壳肌结构的界限变得不再明显,整体呈现出片状。可见,随着压力的增加,肌肉纤维结构会遭到破坏而影响虾仁品质。
3 结 论
超高压处理有助于中华管鞭虾的脱壳,但肌肉色泽、质构、超微结构和肌原纤维蛋白含量、表面疏水性、总巯基含量及其Ca2+-ATPase活性会随着压力的不同而发生不同程度的变化。400 MPa与500 MPa处理后,虽然脱壳效果和虾仁完整率均有所提高,但虾仁易出现熟化现象;200 MPa处理组虾仁硬度、弹性和咀嚼性分别提高35.37%、7.46%和24.93%,虾仁质构得到改善;当压力处于100 MPa和200 MPa时,红虾肌原纤维蛋白含量、总巯基含量和Ca2+-ATPase活性、体表L*值未发生明显变化;而300、400 MPa或500 MPa处理后虾仁肌原纤维蛋白盐溶性、巯基含量及Ca2+-ATPase活性下降明显。在较高压力作用下,肌原纤维蛋白构象被改变,盐溶性下降,疏水基团暴露后又进一步被掩埋,巯基被氧化,Ca2+-ATPase逐渐失活。结合本实验结果,可以看出肌原纤维蛋白特性显著改变的转折点在200 MPa和300 MPa之间。为避免肌原纤维蛋白生化特性的改变导致肌肉品质的劣化,结合超高压处理后中华管鞭虾的脱壳效果、虾仁色泽以及质构等指标,建议200 MPa压力处理5 min辅助红虾脱壳比较适宜。
虾仁是海浦虾加工的主要产品之一,往往直接通过人工剥壳获得虾仁,但这种脱壳方式效率较低,获得的虾仁完整率低,又存在氯霉素超标等安全问题。因此在确保虾仁品质的同时提高生产效率,利用超高压进行预处理的辅助对虾脱壳技术的应用前景广阔。
参考文献:
[1] 薛利建, 贺舟挺, 徐开达, 等. 东海中华管鞭虾种群动态及持续渔获量分析[J]. 福建水产, 2009(4): 48-54.
[2] 杨徽. 基于超高压技术的虾脱壳工艺与品质检测研究[D]. 杭州: 浙江大学, 2011: 4.
[3] 陈少华, 胡志和, 吴子健, 等. 超高压技术对南美白对虾脱壳及加工性能的影响[J]. 食品科学, 2014, 35(22): 11-16. DOI:10.7506/ spkx1002-6630-201422003.
[4] 孟辉辉, 曹荣, 刘淇, 等. 超高压处理在毛蚶脱壳和减菌化中的作用研究[J]. 食品安全质量检测学报, 2016, 7(1): 291-296.
[5] SHANG Xiaolan, LIU Anjun, ZHENG Jie, et al. High pressure processing and water holding capacity of sea bass skeletal muscle[J]. Journal of Aquatic Food Product Technology, 2015, 24(8): 740-751. DOI:10.1080/10498850.2013.809831.
[6] 常耀光, 李兆杰, 薛长湖, 等. 超高压处理对南美白对虾在冷藏过程中贮藏特性的影响[J]. 农业工程学报, 2008, 24(12): 230-237. DOI:10.3321/j.issn:1002-6819.2008.12.048.
[7] 贾莹, 胡志和, 王秀玲, 等. 超高压对虾蛄脱壳及加工性能的影响[J].食品科学, 2015, 36(23): 47-52. DOI:10.7506/spkx1002-6630-201523010.
[8] JANTAKOSON T, KIJROONGROJANA K, BENJAKUL S. Effect of high pressure and heat treatments on black tiger shrimp (Penaeus monodon Fabricius) muscle protein[J]. International Aquatic Research, 2012, 4(1): 1790-1796. DOI:10.1186/2008-6970-4-19.
[9] 于勇, 葛凌燕, 苏光明, 等. 基于LF-NMR的压力和温度对鲜虾水分状态的影响[J]. 农业机械学报, 2014, 45(12): 255-261. DOI:10.6041/ j.issn.1000-1298.2014.12.038.
[10] 林娴萍, 揭珍, 束玉珍, 等. 鲐鱼肉酶解物添加量对带鱼鱼糜蛋白抗冻效果的影响[J]. 核农学报, 2015, 29(5): 940-945. DOI:10.11869/ j.issn.100-8551.2015.05.0940.
[11] CHELH I, GATELLIER P, SANTÉ-LHOUTELLIER V. Technical note: a simplified procedure for myofibril hydrophobicity determination[J]. Meat Science, 2006, 74(4): 681-683. DOI:10.1016/ j.meatsci.2006.05.019.
[12] 万建荣, 洪玉菁. 水产食品化学分析手册[M]. 上海: 上海科学技术出版社, 1993: 166-202.
[13] 甘晓玲. 超高压处理对南美白对虾虾仁的品质影响[D]. 杭州: 浙江大学, 2012: 9-14.
[14] ZHANG T, LÜ S Y, SUN S J, et al. Effect of high hydrostatic pressure on structure and activity of phytoferritin[J]. Food Chemistry, 2012, 130(2): 273-278. DOI:10.1016/j.foodchem.2011.07.034.
[15] 易俊洁, 董鹏, 丁国微, 等. 鲍鱼超高压脱壳工艺的优化及品质研究[J]. 高压物理学报, 2014, 28(2): 239-246. DOI:10.11858/g ywlxb.2014.02.017.
[16] YI Junjie, XU Qian, HU Xiaosong, et al. Shucking of bay scallop (Argopecten irradians) using high hydrostatic pressure and its effect on microbiological and physical quality of adductor muscle[J]. Innovative Food Science and Emerging Technologies, 2013, 18(2): 57-64. DOI:10.1016/j.ifset.2013.02.010.
[17] CRUZROMERO M, KELLY A L, KERRY J P. Effects of high-pressure and heat treatments on physical and biochemical characteristics of oysters (Crassostrea gigas)[J]. Innovative Food Science and Emerging Technologies, 2007, 8(1): 30-38. DOI:10.1016/ j.ifset.2006.05.002.
[18] 雒莎莎. 超高压处理对鳙鱼品质的影响[D]. 杭州: 浙江大学, 2012: 14-23.
[19] KRUKA Z, YUNA H, RUTLEYB D L, et al. The effect of high pressure on microbial population, meat quality and sensory characteristics of chicken breast fi llet[J]. Food Control, 2011, 22(1): 6-12. DOI:10.1016/j.foodcont.2010.06.003.
[20] KAUR B P, KAUSHIK N, RAO P S, et al. Effect of High-pressure processing on physical, biochemical and microbiological characteristics of black tiger shrimp (Penaeus monodon)[J]. Food and Bioprocess Technology, 2013, 6(6): 1390-1400. DOI:10.1007/s11947-012-0870-1.
[21] BINDU J, GINSON J, KAMALAKANTH C K, et al. Physicochemical changes in high pressure treated Indian white prawn (Fenneropenaeus indicus) during chill storage[J]. Innovative Food Science & Emerging Technologies, 2013, 17(1): 37-42. DOI:10.1016/ j.ifset.2012.10.003.
[22] ANGSUPANICHH K, EDDE M, LEDWARD D A. Effects of high pressure on the myofibrillar proteins of cod and turkey muscle[J]. Journal of Agricultural and Food Chemistry, 1999, 47(1): 92-99. DOI:10.1021/jf980587p.
[23] 李姣. 中国对虾贮藏过程中肌肉蛋白质生化特性变化规律研究[D].杭州: 浙江工商大学, 2011: 12.
[24] 朱松明, 苏光明, 王春芳, 等. 水产品超高压加工技术研究与应用[J]. 农业机械学报, 2014, 45(1): 168-177. DOI:10.6941/ j.issn.1000-1298.2014.01.027.
[25] ALBERTOl G, KARSTEN O, TOMAS B, et al. The effect of high pressure on the functional properties of pork myofibrillar proteins[J]. Food Chemistry, 2016, 196(1): 1005-1015. DOI:10.1016/ j.foodchem.2015.10.062.
[26] 郭宝颜, 梁燕, 周爱梅, 等. 超高压对罗非鱼肌动球蛋白物化特性的影响[J]. 现代食品科技, 2015, 31(6): 259-263. DOI:10.13982/ j.mfst.1673-9078.2015.6.041.
[27] 阎微. 高压和热处理对蛋黄体系中蛋白质的影响[D]. 无锡: 江南大学, 2009: 12-14.
[28] KO W C, JAO C, HSU K C. Effect of hydrostatic pressure on molecular conformation of tilapia (Orechromis niloticus) myosin[J]. Journal of Food Science, 2003, 68(4): 1192-1195. DOI:10.1111/ j.1365-2621.2003.tb09623.x.
[29] 白艳红, 德力格尔桑, 赵电波, 等. 超高压处理对绵羊肉嫩化机理的研究[J]. 农业工程学报, 2004, 20(6): 6-10. DOI:10.3321/ j.issn:1002-6819.2004.06.002.
[30] 赵伟, 杨瑞金, 张文斌, 等. 超高压处理对牡蛎超微结构、组分及蛋白质变性的影响[J]. 食品与发酵工业, 2011, 37(5): 7-11.
Shelling of Solenocera melantho Using Ultra High Pressure and Its Effect on the Quality of Muscle
WANG Zhiyan1, YANG Wenge1,*, ZHOU Guo1, XU Dalun1, LOU Qiaoming1, ZHANG Jinjie1, CUI Yan2
(1. Key Laboratory of Animal Protein Food Deep Processing Technology of Zhejiang Province, School of Marine Science, Ningbo University, Ningbo 315211, China; 2. Ningbo Academy of Agricultural Sciences, Ningbo 315040, China)
With the aim to study the effect of ultra high pressure (UHP) on the shelling and quality of shrimp meat, Solenocera melantho was subjected to UHP treatment (100-500 MPa), and evaluated for salt-soluble protein content, total sulfhydryl content and Ca2+-ATPase activity of myof i brillar protein, as well as the color, texture and ultrastructure of shrimp muscle. The results indicated that UHP at 200 and 300 MPa could improve the shelling eff i ciency while maintaining the integrity and quality of shrimp meat, but shrimp meat showed some degree of curing at 400 and 500 MPa. Compared with the control group, the hardness, springiness and chewiness of shrimp meat increased by 35.37%, 7.46% and 24.93% respectively, the surface hydrophobicity rose, but the salt-soluble proteins content, total sulfhydryl content and Ca2+-ATPase activity of myof i brillar protein had no signif i cant differences at 200 MPa. After treated with 300, 400 and 500 MPa, the saltsoluble protein content, total sulfhydryl content and Ca2+-ATPase activity of myof i brillar protein decreased. Taking into account both shelling eff i ciency and the inf l uence of UHP on the biochemical characteristics of shrimp protein, a pressure of 200 MPa was suitable to treat S. melantho. These results can provide a full support for the industrial application of UHP in the shucking of S. melantho in the production of frozen shrimp.
Solenocera melantho; ultra high pressure; shelling; myof i brillar protein
10.7506/spkx1002-6630-201707008
TS254.1
A
1002-6630(2017)07-0043-06
王芝妍, 杨文鸽, 周果, 等. 超高压辅助中华管鞭虾脱壳及对其肌肉品质的影响[J]. 食品科学, 2017, 38(7): 43-48. DOI:10.7506/spkx1002-6630-201707008. http://www.spkx.net.cn
WANG Zhiyan, YANG Wenge, ZHOU Guo, et al. Shelling of Solenocera melantho using ultra high pressure and its effect on the quality of muscle[J]. Food Science, 2017, 38(7): 43-48. (in Chinese with English abstract)
10.7506/spkx1002-6630-201707008. http://www.spkx.net.cn
2016-04-21
宁波市重大科技专项(2015C110002);宁波大学研究生科研创新基金重点项目(G16025);国家自然科学基金面上项目(31371793)
王芝妍(1991—),女,硕士研究生,研究方向为水产品加工与质量控制。E-mail:say168173@163.com
*通信作者:杨文鸽(1966—),女,教授,博士,研究方向为水产品保鲜加工与高值化利用。E-mail:yangwenge@nbu.edu.cn

