槌果藤乙醇提纯物保护酿酒酵母免受氧化损伤机制研究
张 鹏,王向星,杨雅萍,李士明,赵 辉,骆焱平,*
槌果藤乙醇提纯物保护酿酒酵母免受氧化损伤机制研究
张 鹏1,王向星2,杨雅萍2,李士明3,赵 辉2,骆焱平1,*
在生物体内,由于抗氧化物缺少而无法及时有效地清除过多的活性氧(reactive oxygen species,ROS)时,会对机体造成严重的氧化损伤。在氧化应激过程中,不断增长的ROS水平会损伤特定的分子靶标,导致细胞或组织受损。越来越多的研究表明,氧化应激与很多疾病的致病机理相关,如糖尿病、心脑血管疾病、肿瘤和认知障碍等[1-4]。清除体内过多的自由基对于维持机体结构和功能的稳定具有重要的意义。酿酒酵母(Saccharomyces cerevisiae)作为常用的真核模式生物,由于其生命周期短,基因组小而且基因信息明确,在一些人类遗传性疾病相关基因和疾病机理的研究中发挥了重要作用,如糖尿病和神经退化性疾病等[5-6]。近年来,许多植物来源的食物或者药物被认为有较强的抗氧化功能,原因可能跟这些植物所含的天然抗氧化产物相关。而基于酿酒酵母筛选天然抗氧化物的模型已经被建立起来,并且展现出较高的实用价值。
槌果藤(Capparis zeylanica Linn,CZ),在海南又被称为“牛眼睛”,属于白菜花科槌果藤属,主要生长于南亚的斯里兰卡、印度和中国海南省等地[7]。在印度,槌果藤不仅被当地人民当作传统的调味品沿用至今[8],而且被广泛应用于抗衰老,治疗哮喘、炎症、痛风和风湿等疾病[8-10]。药理学研究表明,槌果藤含有重要的天然活性成分,在传统中医中广泛应用于抗炎、治疗感冒和记忆减退等相关疾病[8,11],然而大量食用槌果藤果实会对机体造成一定伤害,甚至中毒。槌果藤植株不同部位的有效成分呈现出较大的差异。研究人员从整株植物提取物中分离出皂苷、丁香、香豆酸、阿魏酸和羟基酸等;而叶和果实中分离包含香豆脂醇、胡萝卜素、硫苷和糖苷等[9-10]。白菜花科的多个种植物已经应用在多种疾病的治疗上[12],但是直接指明槌果藤作用机制的报道相对匮乏。在啮齿类动物模型上的研究表明槌果藤具有免疫调节活性[13],能够提高空间学习和记忆力[10],并且能够抑制乙醇诱导的胃溃疡[14]。综合以上研究,推断这些保护作用与槌果藤提取物中所含的抗氧化活性物质有关。但是,到目前为止还鲜有研究表明CZ对氧化应激细胞的保护作用。目前关于槌果藤提取物抗氧化活性的检验,主要集中在体外自由基((1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基、羟自由基、超氧阴离子自由基等)清除,这虽然一定程度上能说明提取物具有体外自由基清除活性,但是无法解释CZ在细胞内的作用机制。
本实验通过研究S.cerevisiae野生型及其同源性基因缺陷型菌株Sod1、Ctt1、Gsh1、Gtt1和Gtt2在氧化应激状态下存活率、脂质过氧化和细胞内氧化水平,初步探索CZ的抗氧化作用机制,为进一步研究这些活性物质和后续的功能食品、保健品开发提供参考。
1 材料与方法
1.1 材料与试剂
野生型(WT)Saccharomyces cerevisiae BY4741(MATa、his3、leu2、met15和ura3)购自德国Euroscarf公司,其同源性基因缺陷型菌株Sod1、Ctt1、Gsh1、Gtt1和Gtt2由巴西南卡希亚斯大学的教授D. Pereira赠送。(Sod1编码细胞质超氧化物歧化酶;Ctt1编码过氧化氢酶T;Gsh1编码谷胱甘肽;Gtt1和Gtt2是编码谷胱甘肽硫转移酶的同工酶)。
琼脂粉 北京奥博星生物技术有限责任公司;LP0021酵母提取物 英国Oxoid公司;蛋白胨、D-葡萄糖 美国Amresco公司;酸洗玻璃微珠 北京索莱宝科技有限公司;三氯乙酸(分析纯) 成都市科龙化工试剂厂;芦丁、NaNO2、Al(NO3)3、NaOH、抗坏血酸(VC)、2,6-二叔丁基对甲苯酚(2,6-ditertbutyl-p-cresol,BHT)、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、H2O2、CCl4、CdSO4等其他试剂均为分析纯。
1.2 仪器与设备
P300超微量分光光度计 德国Implen公司;Legend micro 17R离心机 美国Thermo公司;SW-CJ-1F型单人双面净化工作台、BLB-1000洁净工作台 苏净集团·苏州安泰空气技术有限公司;HK-180不锈钢万能粉碎机 广州旭朗机械设备有限公司;TissuePrep细胞破碎仪 拜普诺国际有限公司;SpectraMax M5多功能酶标仪 美国Molecular Devices公司。
1.3 方法
1.3.1 槌果藤样品的制备
整株槌果藤采自海南五指山热带雨林,由海南大学龙文兴教授鉴定。整株粉碎后,收集500 g,室温条件下用4 L无水乙醇分别浸泡3、5、8 d。收集浸提液,离心去沉淀,再抽滤离心后的滤液。将所得到的滤液收集,50 ℃真空旋转蒸发浓缩样品。收集浓缩液,加蒸馏水稀释浓缩液,然后过AB-8大孔树脂,使用无水乙醇洗脱,得到洗脱液,冷冻干燥,得到槌果藤乙醇提纯物(alcoholic extract of CZ,AECZ)10.7 g。取0.5 g样品,溶于5 mL无水乙醇,得到100 mg/mL的母液。
1.3.2 总黄酮含量的测定
提纯样品的总黄酮含量测定采用NaNO2-Al(NO3)3-NaOH比色法[15],以芦丁作为标准品。将AECZ稀释至1 mg/mL,测定稀释液总黄酮含量,结果以每毫克样品所含芦丁等价物来表示。
1.3.3 DPPH自由基清除能力的测定
参考杨云舒等[16]的方法进行测定,使用VC溶液作为对照样品溶液。
1.3.4 羟自由基清除能力的测定
参考刘骏[17]的结晶紫分光光度法检测AECZ的羟自由基清除能力,VC作为对照样品。
1.3.5 AECZ对氧化应激胁迫条件下酵母细胞存活率的影响
通过平板涂布法测定S. cerevisiae的存活率来检测AECZ对氧化应激状态下细胞耐受性的影响[18]。选取扩增培养3 d的单酵母菌落接种于液体YPD培养基中,28 ℃、200 r/min摇床过夜培养。用无菌水调细胞悬浮液OD600nm=1。取1 mL细胞悬液转移至9 mL含有不同质量浓度样品(40、80 µg/mL)的新鲜液体YPD培养基中,涡旋振荡15 s后,28 ℃、200 r/min摇床培养2 h。然后,在培养液中分别加入H2O2、CCl4和CdSO4,使其终浓度分别达到2.0、10.0、2.5 mmol/L。涡旋振荡15 s后,摇床培养1 h。取各处理的酵母细胞悬液,分别稀释1 000 倍,取100 µL稀释后的细胞悬液均匀涂布在固体YPD培养基中。放置于生化培养箱中,28 ℃倒置培养72 h。计数菌落个数,每个处理方法做3 个平行。
1.3.6 AECZ对酵母细胞脂质过氧化水平的影响
采用硫代巴比妥酸(thiobarbituri acid,TBA)法[18]测定脂质过氧化水平。
1.3.7 AECZ对酵母细胞细胞内氧化水平的影响
参考de Sá等[19]的方法,通过2’7’-二氯二乙酸酯荧光探针法测定酵母细胞内过氧化水平。
1.4 数据统计分析
2 结果与分析
2.1 AECZ样品中总黄酮含量
采用NaNO2-Al(NO3)3-NaOH分光光度法测定AECZ样品的总黄酮含量,芦丁含量标准曲线为:y=0.009 8x+ 0.060 5,R2=0.998。AECZ样品的吸光度为0.55,相当于每毫克样品含有44.95 µg芦丁,既每克槌果藤材料中总黄酮含量为0.962 mg。
2.2 DPPH自由基和羟自由基清除能力

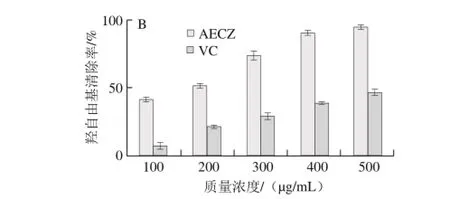
图1 AECZ清除DPPH自由基(A)和羟自由基(B)的能力Fig. 1 DPPH (A) and hydroxyl (B) radical scavenging capacity of AECZ
DPPH自由基清除法是目前广泛使用的一种测定生物样品体外抗氧化能力的方法[20-21]。AECZ和VC两种样品清除DPPH自由基活性如图1A所示。AECZ对DPPH自由基清除活性随着AECZ质量浓度的增加而增加,当质量浓度都为1 000 µg/mL时,AECZ对DPPH自由基的清除能力大约相当于VC质量浓度为50 µg/mL时的清除效果,由此可见AECZ的对DPPH自由基的清除能力低于VC。与之相反,AECZ在羟自由基的清除实验中展现出强劲的清除能力,如图1B所示,在质量浓度为100 µg/mL时,清除率达到46%,而VC对羟自由基的清除能力(8%)远远低于AECZ;在AECZ质量浓度达到400 µg/mL时,清除率几乎接近100%,而VC则仅40%左右。AECZ对于羟自由基的高清除率可能与羟自由基对AECZ所含的成分的敏感度有关。有研究对比了不同黄酮类化合物清除羟自由基的活性,结果表明不同的黄酮类化合物对羟自由基的清除率差异很大[20,22]。如儿茶素、芦丁和桑黄素对羟自由基的清敏感性很高,而羟基黄酮、橙皮素、黄岑苷和柚皮苷等对羟自由基的敏感性则较低,进而清除率也较低[23-24]。AECZ展现出较高的清除率,说明AECZ中含有对羟自由基较敏感的黄酮、多酚或者皂苷类化合物,这需要分离和提纯后,做进一步的研究。
2.3 AECZ提高酵母菌对氧化应激的耐受性
实验采用模式生物酿酒酵母检验AECZ体内抗氧化活性。酿酒酵母已经成为一种成熟的评价天然产物体内抗氧化的模式生物[25]。为了更全面地评价AECZ的细胞保护作用,实验采用肝毒素CCl4、CdSO4(环境致癌物重金属镉)和H2O2。


图2 AECZ对氧化应激条件下酵母菌存活率的影响Fig. 2 Effect of AECZ on survival rates of yeast cells under oxidative stress conditions
本实验结果与之前研究者报道结果类似,H2O2对酿酒酵母产生的毒性是最强的,接着是CCl4和CdSO4[20]。此外,所有测试菌株对AECZ均表现出不同程度的“剂量依赖性”,随着AECZ质量浓度的增高,各菌株存活率表现出不同程度的增加。H2O2在细胞内产生高活性、强破坏力的羟自由基,而羟自由基是内源性细胞有毒物质,所以即使AECZ前处理不同程度地提高了酵母细胞对H2O2的耐受性,但是其存活率还是低于CCl4和CdSO4处理组。如图2A所示,在H2O2处理组中,AECZ质量浓度为40 µg/mL时,对Gtt1突变株(Gtt1)的存活率与直接应激组相比提高不明显;当AECZ质量浓度达到80 µg/mL时才较明显提高Gtt1突变株(Gtt1)的存活率,但仍低于其他菌株类型,这说明Gtt1(谷胱甘肽转移酶)在AECZ抵抗细胞内H2O2应激时发挥一定作用。而Gtt1在谷胱甘肽循环中扮演重要的角色[26],AECZ有可能通过刺激Gtt1的表达,进而提高谷胱甘肽作用效率。
与H2O2应激不同,CCl4应激对各株酵母的氧化损失较轻。相比其他菌株,只有Sod1和Gsh1菌株对CCl4应激耐受性高一些,当AECZ质量浓度达到80 µg/mL时,该两菌株存活率高于其他变异菌株(图2B)。同时,AECZ预处理能明显提高各株酵母对CdSO4应激的耐受性(图2C)。数据表明Gtt1基因缺失型对CdSO4应激相对敏感,虽然AECZ能改善其对与Cd2+的耐受性,但是提高的存活率远远低于其他菌株类型。可见Gtt1基因在AECZ提高酵母细胞对重金属Cd2+的耐受性机制中同样发挥重要作用。有研究表明,Gtt1基因突变株酵母相比于WT型酵母会摄入更多的Cd2+[27],换言之,Cd2+对于Gtt1型酵母毒性相比WT要高,这与CdSO4直接应激后,Gtt1型酵母的存活率最低相一致。对于Gtt1基因,它参与形成GSH-Cd2+复合物,这是减弱重金属镉毒性最重要的一步;有研究同样表明Gtt2基因在Cd2+解毒中同样发挥作用,其机制更为复杂,它不能直接降低细胞对于Cd2+的吸收,有可能与γ-谷氨酰转肽酶(γ-glutamyl transferase)协同作用清除Cd2+[28],然而本实验中的数据还不能说明这一点,具体原因还需进一步研究。
2.4 AECZ对酵母脂质过氧化水平和细胞内氧化水平的影响
机体内过多的自由基会攻击细胞内的大分子,如蛋白、脂质和核酸等。自由基氧化膜脂发生脂质过氧化反应,产生丙二醛(malondialdehyde,MDA)。MDA含有一个活性很高的醛基(高活性的亲电基团),容易导致细胞内蛋白交联,进一步产生严重的细胞毒性,通常MDA作为评价机体内氧化应激(脂质过氧化)的标志物[29]。CCl4、H2O2和CdSO4在细胞内会诱导产生自由基,增加了WT、Sod1和Ctt1型酵母细胞的脂质过氧化水平,而且AECZ展现出对生物膜脂质氧化应激不同程度的保护作用。数据表明,H2O2对各株酵母细胞造成的脂质过氧化损伤是最高的,这与H2O2应激条件下酵母细胞存活率最低相一致。
与直接应激组相比,AECZ前处理会明显地减轻酵母细胞内的脂质过氧化水平。 在H2O2处理组中,AECZ处理能显著地降低H2O2应激WT酵母的脂质过氧化水平(从300%降至190%)。 CCl4和CdSO4直接应激提高了WT酵母细胞的脂质过氧化水平(分别为160%和130%),这明显低于H2O2应激产生的脂质过氧化水平,这与CCl4和CdSO4应激组的高存活率相对应。Ctt1或Sod1突变株似乎对于CCl4或H2O2应激更敏感。相比于CCl4和H2O2应激产生的MDA,Cd2+应激产生的MDA水平低很多(表1)。
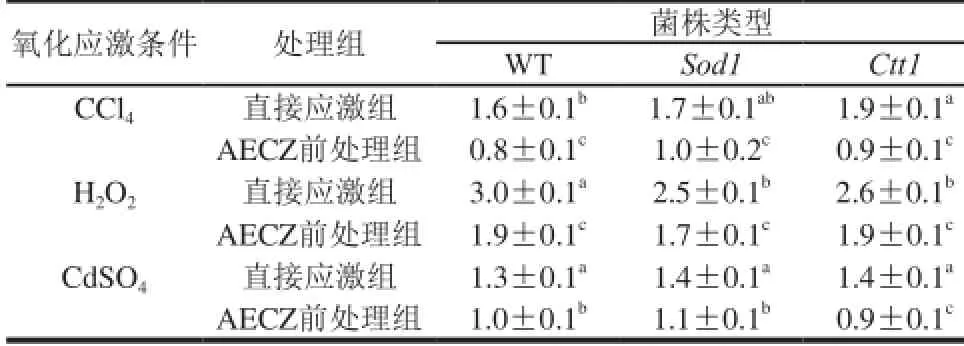
表1 AECZ对菌株过氧化水平(MDA含量)的影响Table 1 Effect of AECZ on lipid peroxidation levels (in terms of MDA contents)
AECZ展现出一定的体外自由基清除活性,并且能显著地提高氧化应激状态下酵母的存活率。为了进一步揭示AECZ对细胞内总ROS水平的影响,实验采用2’7’-二氯二乙酸酯荧光探针(2’,7’-dichlorofluorescein diacetate,DCFH-DA)检测细胞内总氧化水平。DCFH-DA进入细胞后,与ROS反应产生高荧光强度化合物,这种探针已经广泛应用于评估细胞内ROS的水平[30]。

表2 AECZ对菌株细胞内总氧化水平的影响Table 2 Effect of AECZ on intracellular ROS levels
由表2可知,直接应激H2O2和CCl4的酵母细胞与空白对照组相比,细胞内氧化水平会明显的增高,而且增量远远高于Cd2+应激的水平,这与Cd2+应激的高存活率是相一致的。AECZ可以明显地改善WT酵母细胞对于H2O2应激的耐受性(8.1倍)。AECZ处理引起的细胞内总ROS水平的降低可能与AECZ的直接羟自由基清除活性及其对抗氧化酶系统激活作用有关,这与上文所述的脂质过氧化水平的降低与存活率的提高是相关的。
3 结 论
本实验结果表明每克槌果藤材料中总黄酮含量为0.962 mg,经过AB-8大孔树脂处理,能较高程度地提纯槌果藤植株中黄酮、多酚和皂苷等化合物。DPPH自由基和羟自由基清除能力实验数据表明,AECZ对羟自由基具有较高的灵敏度,能较有效地清除体外模拟环境中的羟自由基。为了更好地探究槌果藤乙醇提纯物在生物体内的抗氧化活性,接下来的实验采用氧化因素胁迫下酿酒酵母的模型。AECZ能显著地提高CCl4、H2O2和CdSO4应激下WT酵母的存活率,而且随着AECZ质量浓度增高,增益效果越明显。尤其是Gtt1和Gtt2基因在AECZ提高酵母细胞对H2O2和Cd2+耐受性的机制中发挥重要作用。进一步的脂质过氧化水平和细胞内总ROS水平检测结果表明,AECZ有可能是通过直接清除细胞内ROS和激活抗氧化酶系统发挥细胞保护作用。体外和体内的实验数据均表明槌果藤乙醇提纯物有较强的抗氧化活性,这为进一步研究开发槌果藤各部位在食品、药品及人类健康方面的应用提供了较重要的依据。
[1] LIU J, WANG Y, GONG L, et al. Oxidation of glyceraldehyde-3-phosphate dehydrogenase decreases sperm motility in diabetes mellitus[J]. Biochemical and Biophysical Research Communications, 2015, 465(2): 245-248. DOI:10.1016/j.bbrc.2015.08.006.
[2] DONADELLI M, DANDO I, FIORINI C, et al. Regulation of miR-23b expression and its dual role on ROS production and tumour development[J]. Cancer Letters, 2014, 349(2): 107-113. DOI:10.1016/ j.canlet.2014.04.012.
[3] ELATRECHl I, MARZAIOLI V, BOUKEMARA H, et al. Escherichia coli LF82 differentially regulates ROS production and mucin expression in intestinal epithelial T84 cells: implication of NOX1[J]. Inf l ammatory Bowel Diseases, 2015, 21(5): 1018-1026. DOI:10.1097/ MIB.0000000000000365.
[4] YAN J, HUANG Y, LU Y, et al. Repeated administration of ketamine can induce hippocampal neurodegeneration and long-term cognitive impairment via the ROS/HIF-1α pathway in developing rats[J]. Cellular Physiology and Biochemistry, 2014, 33(6): 1715-1732. DOI:10.1159/000362953.
[5] YOSHIDA A, WEI D, NOMURA W, et al. Reduction of glucose uptake through inhibition of hexose transporters and enhancement of their endocytosis by methylglyoxal in Saccharomyces cerevisiae[J]. Journal of Biological Chemistry, 2012, 287(1): 701-711. DOI:10.1074/ jbc.M111.322222.
[6] KANG J W, LEE N Y, CHO K C, et al. Analysis of nitrated proteins in Saccharomyces cerevisiae involved in mating signal transduction[J]. Proteomics, 2015, 15(2/3): 580-590. DOI:10.1002/pmic.201400172.
[7] SINI K R, SINHA B N, RAJASEKARAN A. Antidiarrheal activity of Capparis zeylanica leaf extracts[J]. Journal of Advanced Pharmaceutical Technology & Research, 2011, 2(1): 39. DOI:10.4103/2231-4040.79803.
[8] BANOTH R K, THAAKUR S. Phytochemical screening and neuropharma cological studies of Capparis zeylanica root bark[J]. World Journal of Pharmaceutical Reaearch, 2014, 3(6): 1936-1944.
[9] PADHAN A R, AGRAHARI A K, MEHER A. A study on antipyretic activity of Capparis zeylanica Linn. plant methanolic extract[J]. International Journal of Pharma Sciences and Research, 2010, 1(3): 169-171.
[10] SOLANKI R, CHAUDHARY A K, SINGH R. Effect of leaf extract of Capparis zeylanica Linn. on spatial learning and memory in rats[J]. Journal of Natural Medicines, 2012, 66(4): 600-607. DOI:10.1007/ s11418-012-0626-2.
[11] MISHRA S K, SINGH P N, DUBEY S D. Sedative & anxiolytic studies of Capparis zeylanica Linn. root extract[J]. Oriental Pharmacy and Experimental Medicine, 2013, 13(4): 307-317. DOI:10.1007/ s13596-013-0120-8.
[12] TLILI N, ELFALLEH W, SAADAOUI E, et al. The caper (Capparis L.): ethnopharmacology, phytochemical and pharmacological properties[J]. Fitoterapia, 2011, 82(2): 93-101. DOI:10.1016/j.f i tote.2010.09.006.
[13] GHULE B V, MURUGANANTHAN G, NAKHAT P D, et al. Immunostimulant effects of Capparis zeylanica Linn. leaves[J]. Journal of Ethnopharmacology, 2006, 108(2): 311-315. DOI:10.1016/ j.jep.2006.03.041.
[14] SINI K R, SINHA B N, RAJASEKARAN A. Protective effects of Capparis zeylanica Linn. leaf extract on gastric lesions in experimental animals[J]. Avicenna Journal of Medical Biotechnology, 2011, 3(1): 31-35.
[15] 杨静毅, 喻玲玲, 吴梅, 等. 银合欢果皮总黄酮含量测定及抗氧化活性[J]. 食品科学, 2015, 36(8): 187-190. DOI:10.7506/spkx1002-6630-201508034.
[16] 杨云舒, 姜子涛, 李荣. 广枣黄酮清除自由基能力及抗氧化性能的细胞模型法评价[J]. 食品科学, 2016, 37(9): 92-97. DOI:10.7506/ spkx1002-6630-201609018.
[17] 刘骏. 结晶紫分光光度法测定Fenton反应产生的羟自由基[J]. 武汉工业学院学报, 2005(2): 53-55. DOI:10.3969/ j.issn.1009-4881.2005.02.016.
[18] DANI C, BONATTO D, SALAVADOR M, et al. Antioxidant protection of resveratrol and catechin in Saccharomyces cerevisiae[J]. Journal of Agricultural and Food Chemistry, 2008, 56(11): 4268-4272. DOI:10.1021/jf800752s.
[19] de SÁ R A, de CASTRO F A V, ELERTHERIO E C A, et al. Brazilian propolis protects Saccharomyces cerevisiae cells against oxidative stress[J]. Brazilian Journal of Microbiology, 2013, 44(3): 993-1000. DOI:10.1590/S1517-83822013005000062.
[20] 汪艳群, 孟宪军. 超声波处理对北五味子多糖抗氧化活性的影响[J].食品科学, 2016, 37(3): 66-70. DOI:10.7506/spkx1002-6630-201603013.
[21] 王晓宇, 杜国荣, 李华. 抗氧化能力的体外测定方法研究进展[J]. 食品与生物技术学报, 2012(3): 247-252.
[22] 王俏, 邹阳, 钟耕, 等. 多酚类单体物质抗氧化活性的研究[J]. 食品工业科技, 2011(1): 137-140.
[23] MONTANA M P, MASSAD W A, CRIADO S, et al. Stability of flavonoids in the presence of riboflavin-photogenerated reactive oxygen species: a kinetic and mechanistic study on quercetin, morin and rutin[J]. Photochemistry and Photobiology, 2010, 86(4): 827-834. DOI:10.1111/j.1751-1097.2010.00754.x.
[24] YIN D D, YUAN R Y, WU Q, et al. Assessment of flavonoids and volatile compounds in tea infusions of water lily flowers and their antioxidant activities[J]. Food Chemistry, 2015, 187: 20-28. DOI:10.1016/j.foodchem.2015.04.032.
[25] ZYRACKA E, ZADRAG R, KOZIOL S, et al. Yeast as a biosensor for antioxidants: simple growth tests employing a Saccharomyces cerevisiae mutant defective in superoxide dismutase[J]. Acta Biochimica Polonica (English ed), 2005, 52(3): 679.
[26] KALININA E V, CHERNOV N N, NOVICHKOVA M D. Role of glutathione, glutathione transferase, and glutaredoxin in regulation of redox-dependent processes[J]. Biochemistry (Moscow), 2014, 79(13): 1562-1583. DOI:10.1134/S0006297914130082.
[27] VLAHOVIC M, ILIJIN L, MRDAKOVIC M, et al. Glutathione S-transferase in the midgut tissue of gypsy moth (Lymantria dispar) caterpillars exposed to dietary cadmium[J]. Environmental Toxicology and Pharmacology, 2016, 44: 13-17. DOI:10.1016/j.etap.2016.04.002.
[28] ADAMIS P D B, MANNARINO S C, ELEUTHERIO E C A. Glutathione and gamma-glutamyl transferases are involved in the formation of cadmium-glutathione complex[J]. FEBS Letters, 2009, 583(9): 1489-1492. DOI:10.1016/j.febslet.2009.03.066.
[29] YANG T C, CHEN Y J, CHANG S F, et al. Malondialdehyde mediates oxidized LDL-induced coronary toxicity through the Akt-FGF2 pathway via DNA methylation[J]. Journal of Biomedical Science, 2014, 21(1): 1-11. DOI:10.1186/1423-0127-21-11.
[30] WANG H, JOSEPH J A. Quantifying cellular oxidative stress by dichlorofluorescein assay using microplate reader[J]. Free Radical Biology and Medicine, 1999, 27(5): 612-616. DOI:10.1016/S0891-5849(99)00107-0.
(1.海南大学热带农林学院,海南 海口 570228;2.天津商业大学 天津市食品生物技术重点实验室,天津 300134;3.黄冈师范学院 湖北省经济林种质资源改良与资源重点实验室,湖北 黄冈 438000)
采用AB-8大孔树脂纯化槌果藤乙醇浸提物,得到槌果藤乙醇提纯物(alcoholic extract of Capparis zeylanica Linn,AECZ)。体外1,1-二苯基-2-三硝基苯肼自由基和羟自由基清除实验表明AECZ具有较强的自由基清除能力。之后采用酿酒酵母BY4741及其基因缺失型(Ctt1、Sod1、Gsh1、Gtt1和Gtt2)探索AECZ对氧化应激条件下对酵母细胞的保护作用。结果表明AECZ能明显地提高酵母细胞对于H2O2、CCl4和CdSO4氧化应激的耐受性,同时能明显地降低应激状态下酵母的脂质过氧化和细胞内氧化水平。GTT1基因在AECZ减轻氧化应激下酵母损伤中发挥重要的作用。本实验验证了AECZ在细胞内具有显著的抗氧化活性,可为进一步开发利用槌果藤提供理论依据。
槌果藤;抗氧化;酿酒酵母;细胞内氧化;脂质过氧化
The Alcoholic Extract of Capparis zeylanica Linn Protects against Oxidative Damage in Saccharomyces cerevisiae: An Investigation into the Mechanism
ZHANG Peng1, WANG Xiangxing2, YANG Yaping2, LI Shiming3, ZHAO Hui2, LUO Yanping1,*
(1. Institute of Tropical Agriculture and Forestry, Hainan University, Haikou 570228, China; 2. Tianjin Key Laboratory of Food Biotechnology, Tianjin University of Commerce, Tianjin 300134, China; 3. Hubei Provincial Key Laboratory of Economic Forest Germplasm Improvement and Resources Comprehensive Utilization, Huanggang Normal University, Huanggang 438000, China)
The crude alcoholic extract of Capparis zeylanica Linn (AECZ) was purif i ed through AB-8 macroporous resin. The in vitro tests indicated that AECZ had potent hydroxyl radical and (1,1-diphenyl-2-picrylhydrazyl) radical scavenging activities. The cytoprotection of AECZ in Saccharomyces cerevisiae BY4741 and its homogenous strains deficient in antioxidant enzyme genes under oxidative stress induced by H2O2, CCl4and CdSO4was explored. Interestingly, AECZ could dramatically protect yeasts against oxidative stresses induced by H2O2, CCl4and CdSO4. Adaptive treatment with AECZ could reduce the level of intracellular lipid peroxidation and reactive oxygen species in yeasts under stress conditions. Moreover, the GTT1 gene played an important role in alleviating oxidative damage in yeast cells. This study for the fi rst time demonstrated the intracellular antioxidant activity of AECZ, which will provide theoretical evidence for further exploitation and utilization of Capparis zeylanica Linn.
Capparis zeylanica Linn; antioxidant; Saccharomyces cerevisiae; cellular oxidation; lipid peroxidation
10.7506/spkx1002-6630-201707009
TS201.2
A
1002-6630(2017)07-0049-06
张鹏, 王向星, 杨雅萍, 等. 槌果藤乙醇提纯物保护酿酒酵母免受氧化损伤机制研究[J]. 食品科学, 2017, 38(7): 49-54. DOI:10.7506/spkx1002-6630-201707009. http://www.spkx.net.cn
ZHANG Peng, WANG Xiangxing, YANG Yaping, et al. The alcoholic extract of Capparis zeylanica Linn protects against oxidative damage in Saccharomyces cerevisiae: an investigation into the mechanism[J]. Food Science, 2017, 38(7): 49-54. (in Chinese with English abstract)
10.7506/spkx1002-6630-201707009. http://www.spkx.net.cn
2016-09-12
国家自然科学基金面上项目(21162007);国家大学生创新项目(201510069043 );天津市农产品加工新工艺及相关机理研究创新团队项目(TD12-5049)
张鹏(1991—),男,硕士研究生,研究方向为天然产物筛选与应用。E-mail:Tjcu408@gmail.com
*通信作者:骆焱平(1973—),男,教授,博士,研究方向为天然产物化学。E-mail:yanpluo@yahoo.com.cn

