柑橘果胶碱法脱酯动力学特征
李 梦,黄雪松,王 超,段翰英*
(暨南大学食品科学与工程系,广东 广州 510632)
柑橘果胶碱法脱酯动力学特征
李 梦,黄雪松,王 超,段翰英*
(暨南大学食品科学与工程系,广东 广州 510632)
为研究碱法脱酯机理以及温度和pH值对果胶酯化度(degree of esterification,DE)与脱酯速率的影响,以高酯柑橘果胶(DE为77.8%)为原料,研究不同温度(10、20、25 ℃和30 ℃)和不同pH值(10.0~11.3)条件下的脱酯动力学和热力学特征。为更精确控制pH值,在NaHCO3/Na2CO3缓冲体系中以NaOH调节果胶溶液pH值,以酯化度和甲氧基浓度为指标研究碱法脱酯规律。结果表明:温度和pH值都对碱法脱酯有显著影响,但pH值的影响大于温度,且它们的交互作用明显。果胶碱法脱酯符合一级动力学反应模型。脱酯速率常数(k)与pH值呈幂指数关系。当pH值从11.0轻微增加到11.3时脱酯速率显著增大。pH值为10.7、11.0和11.3时,脱酯活化能分别为136.97、122.37 kJ/mol和104.20 kJ/mol,脱酯活化焓分别为134.52、119.92 kJ/mol和101.75 kJ/mol,脱酯活化熵分别为141.86、100.28 J/(mol·K)和44.81 J/(mol·K),脱酯活化自由能分别为92.76、90.40 kJ/mol和88.56 kJ/mol。
柑橘果胶;碱法脱酯;脱酯速率;动力学;热力学
果胶是存在于植物根、茎、叶和果实细胞壁间的一种高分子多糖聚合物,相对分子质量介于5万~30万之间,是一类主要以D-半乳糖醛酸(D-galacturonic acids, D-Gal-A)或其甲酯,通过α-1,4糖苷键连接而成的酸性杂多糖。除D-Gal-A外,还含有D-半乳糖、L-阿拉伯糖、D-山梨糖和L-鼠李糖等在内的多种中性单糖[1],以及少量的芹菜糖、槭汁酸和2-脱氧酮-3-D-甘露-辛酮糖酸等稀有单糖类似物[2]。按半乳糖醛酸甲酯化程度的高低,可分为高酯果胶(酯化度(degree of esterif i cation,DE)大于50%)和低酯果胶(DE远小于50%)。自然界许多水果中富含果胶,然而直接从原料中提取低酯果胶的研究却很少,迄今为止报道最多的天然低酯果胶大多从向日葵中提取[3-4],来源有限,因此目前大部分商业低酯果胶是由高酯果胶脱酯而来。
高酯果胶脱酯主要有酸法[5]、酰胺化法[6-7]、酶法[8-9]和碱法[10-11]]。碱法脱酯具有工艺简单、容易操作等优点[12]。有关碱法脱酯的文献主要集中在脱酯工艺的研究上,得到不同来源果胶脱酯时最佳pH值和温度等参数[13-14]。因此这些研究只得到单一酯化度低酯果胶制备的工艺条件,而没有揭示脱酯过程中pH值和温度对果胶脱酯的综合影响,也没有深入探讨碱法脱酯反应机理和反应过程中果胶分子的微观变化。
通过碱法脱酯动力学和热力学研究,可探讨影响脱酯速率的因素和反应机理。Kirtchev等[15]对酸法脱酯研究表明,脱酯反应符合一级动力学反应模型。Renard等[16]对碱法脱酯研究表明,pH值对脱酯动力学级数起决定性作用,但没有更深入探讨脱酯动力学反应机理及其与热力学特征关系。而国内鲜见关于碱法脱酯动力学的报道。因此本实验以柑橘果胶为原料,综合碱法脱酯常采用的温度和pH值[17-19],选取温度为10、20、25 ℃和30 ℃,pH值为10.0~11.3,研究果胶脱酯速率以及酯化度变化规律,得到相应的动力学和热力学特征参数,同时探讨pH值对脱酯速率常数(k)的影响,为揭示碱法脱酯机理和制备低酯柑橘果胶提供更多参考信息。
1 材料与方法
1.1 材料与试剂
柑橘果胶(APC182,DE=77.8%) 山东烟台安德利果胶有限公司;邻苯二甲酸氢钾 国药集团化学试剂有限公司;碳酸钠、氢氧化钠 天津大茂化学试剂厂、碳酸氢钠 广州化学试剂厂;酚酞 上海化学试剂公司分装厂;盐酸 永飞化工厂;95%乙醇 天津市津东天正精细化学试剂厂;所有试剂均为分析纯。
1.2 仪器与设备
JB-2型恒温磁力搅拌器、pHS-3C酸度计 上海雷磁新经仪器有限公司;FA1104N型电子分析天平 上海精密科学仪器有限公司;DHG-9070型鼓风干燥箱 上海恒科学仪器有限公司;SHZ-D(III)循环水式真空泵巩义市予华仪器有限公司。
1.3 方法
1.3.1 果胶的脱酯工艺
脱酯方法主要根据文献[13]并略作修改。称取2 g柑橘果胶,加10 mL 95%的乙醇润湿,加入90 mL浓度为0.1 mol/L的Na2CO3/NaHCO3缓冲溶液。将果胶液置于10、20、25 ℃和30 ℃水浴中,用1 mol/L的NaOH调节pH值(10.0~11.3),并保持pH值恒定,进行脱酯反应。加入2.7 mol/L的HCl调节pH值到3终止脱酯反应,再加100 mL 95%的乙醇沉淀果胶。抽滤分离沉淀,并用95%乙醇洗涤2~3 次。将所得沉淀65 ℃烘干,得到不同温度和pH值条件下的脱酯果胶,放入干燥器中待测。
1.3.2 果胶酯化度的测定
采用滴定法测定果胶酯化度,参照美国食品化学药典[20]并稍作改动:称取1 g脱酯果胶样品与100 mL酸性乙醇混合连续搅拌10 min,砂芯漏斗过滤,用60%乙醇冲洗至无氯离子。加入20 mL无水乙醇洗涤,将滤饼在65 ℃烘箱中烘干。称取200 mg处理后的果胶样品于锥形瓶中,加2 mL乙醇润湿,再加入100 mL煮沸后冷却无CO2的水,加5 滴酚酞,用标定好的0.1 mol/L NaOH溶液滴定,记录消耗NaOH溶液的体积为V1。加入15 mL 0.5 mol/L NaOH溶液振摇15 min,再用15 mL 0.5 mol/L HCl溶液中和,振荡至红色消失,滴入3 滴酚酞,用0.1 mol/L NaOH溶液滴定至粉红色,且0.5 min内不褪色,记录此时消耗NaOH溶液的体积为V2。按式(1)计算DE。

1.3.3 甲氧基浓度的计算
为便于计算果胶碱法脱酯动力学参数,将果胶中的甲氧基含量按式(2)计算甲氧基浓度c。

式中:m为取样量/g;W为甲氧基分数(W=16.3%×DE);M为甲氧基摩尔质量/(g/mol);V为脱酯果胶液体积/mL。
2 结果与分析
2.1 温度和pH值对果胶脱酯的影响
3 个典型pH值(10.7、11.0和11.3)在10、20、25 ℃和30 ℃条件下酯化度随时间变化结果如图1所示。
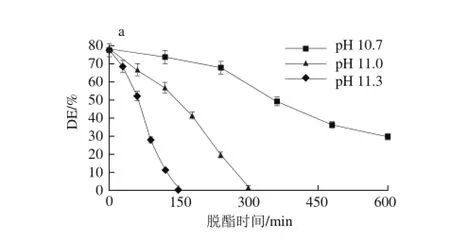

图1 温度和pH值对酯化度的影响Fig. 1 Effect of temperature and pH on DE
2.1.1 pH值对酯化度的影响
相同温度下,pH值轻微变化可显著影响酯化度。在10 ℃的低温条件下(图1a),当pH 11.3时,60 min可使酯化度降低到50%左右,而pH 10.7、11.0时,酯化度变化明显减缓,降低到同等酯化度,分别需360、180 min。因此pH值降低0.6 个单位,脱酯时间延长到原来的6 倍,这与Renard等[16]的研究结果一致,在较高pH值下,酯化度变化非常迅速。在20(图1b)、25 ℃(图1c)和30 ℃(图1d)条件下,pH值对脱酯时酯化度的影响也呈现出相同趋势。
2.1.2 温度对酯化度的影响
相同pH值下,获得相同酯化度的果胶,脱酯时间随温度的升高而缩短。在pH 11.3、10 ℃(图1a)条件下使酯化度降低到15%以下需要128 min,当温度为20 ℃(图1b)时需要40 min,而25 ℃(图1c)和30 ℃(图1d)时,分别只需要15 min和6 min,研究表明温度升高,果胶分子热运动加快,分子间有效碰撞几率增加,更有利于甲酯键的断裂[21],因此反应加快。但果胶脱酯的同时会发生β-消去副反应,它们是典型的竞争性反应,而该副反应会造成果胶分子解聚,从而使分子质量、黏度和胶凝性下降,降低果胶品质[22]。有关研究表明温度为25~35 ℃时,脱酯反应占主导,35~45 ℃时则主要发生β-消去反应[23],因此碱法脱酯温度一般小于30 ℃。
2.1.3 pH值和温度对酯化度的综合影响
将时间固定在0水平,经Design-Expert 8.05软件统计分析,观察pH值和温度的交互作用,进行试验因素对酯化度影响的两交互作用评价,作等高线图,如图2所示。
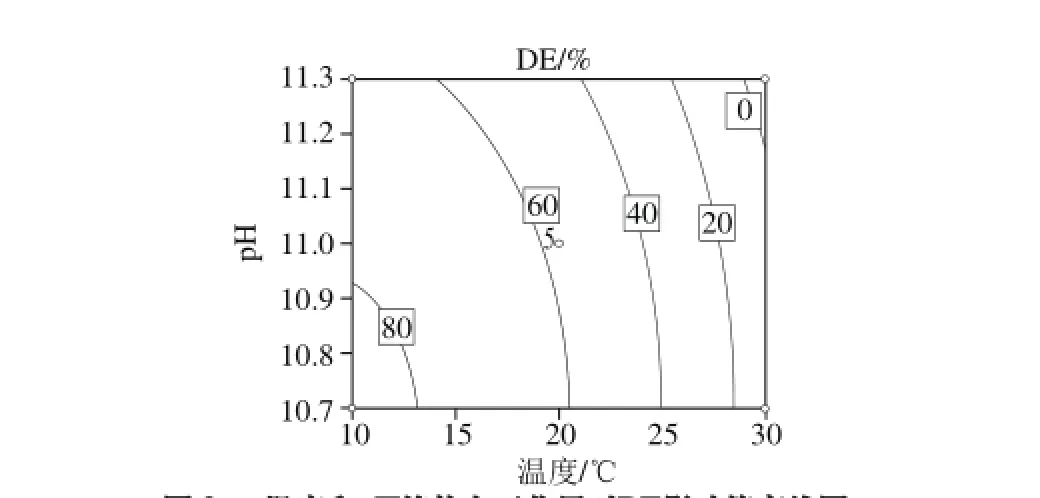
图2 温度和pH值的交互作用对DE影响等高线图Fig. 2 Contour plot for the effects of temperature and pH on DE
图2 直观地反映了温度和pH值对碱法脱酯的综合影响。从等高线的分布规律可看出,pH值轴方向酯化度变化等高线的跨越幅度更大,而温度所代表的横轴方向跨度小,说明pH值对酯化度的影响大于温度。图中等高线呈不规则分布,说明温度和pH值交互作用明显,但未呈现出规律性。
2.2 脱酯动力学方程拟合
果胶经脱酯后分子中甲酯键断裂,甲氧基含量发生变化。因此根据脱酯过程中酯化度的变化,经式(2)得到相应不同条件下脱酯果胶甲氧基浓度,据此计算k,同时对其进行动力学方程拟合,结果见表1。
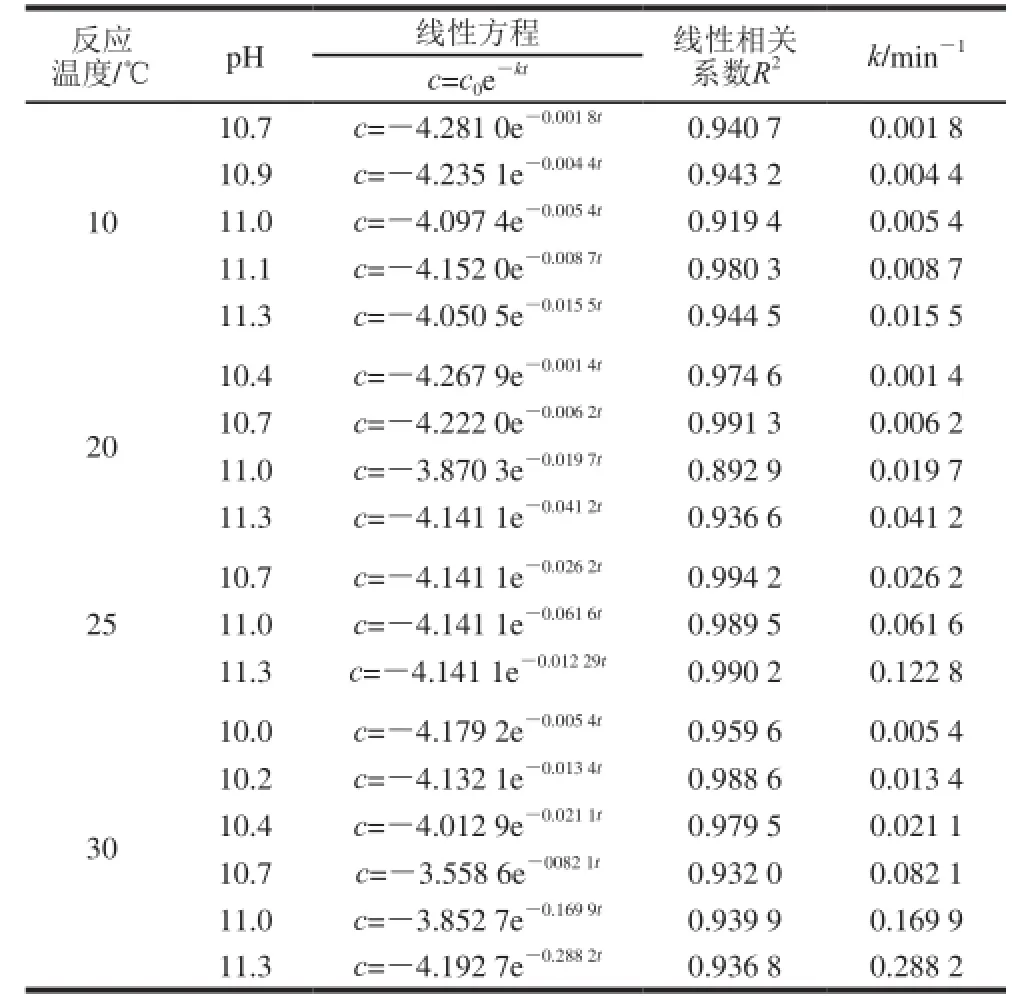
表1 脱酯动力学参数Table 1 Kinetic parameters of pectin demethylation
表1结果表明,甲氧基浓度与脱酯时间线性相关性显著(P<0.05),因此果胶碱法脱酯符合一级动力学反应模型,这与El-Nawawi等[24]的结论一致。
当pH 10.7时,10 ℃和20 ℃条件下k分别为0.001 8 min-1和0.006 2 min-1,这表明温度升高10 ℃,脱酯速率增加3.4 倍,与范特荷夫规则及温度每升高10℃,反应速率增加2~4 倍一致,说明碱性环境下脱酯符合一般的反应速率规律。当温度为10 ℃、pH 11.0时,k为0.005 4 min-1,表明pH值增加0.3 个单位,脱酯速率增加3 倍。因此,pH值对碱法脱酯速率的影响大于温度。而25 ℃和30 ℃时不同pH值条件下的脱酯速率均较大,脱酯反应迅速。
2.3 pH值对脱酯速率的影响
由于pH值对碱法脱酯的影响十分显著,为更好地探讨pH值对脱酯速率的影响,对表1中的k与pH值进行幂指数拟合,结果如图3所示。

k与pH值的关系Fig. 3 Relationship between rate constant and pH图3
由图3可知,10、20、25℃和30℃条件下脱酯速率与pH值呈幂指数关系,分别是:y10=2×10-44pH39.729(R2=0.988 6,n=5)、y20=8×10-45pH40.642(R2=0.983 3,n=4)、y25=2×10-31pH28.321(R2=0.997 2,n=3)、y30=4×10-36pH33.211(R2=0.982 0,n=6)。可见随pH值的增加k也增加,理论上在pH 14.0时,脱酯速率最大。Wehr等[25]研究表明,当pH值由10.5~12.4时,果胶凝胶透光率在30 s内由96%降到67%,而透光率的降低是由于果胶在较强碱性条件下脱酯时会形成较多不稳定正四面体中间物,因此pH值较大时k会显著增加。值得一提的是,当脱酯温度为10 ℃,pH值由10.9变化到11.0时,k增加了0.001 0 min-1,pH值继续增加0.1时,k增加了0.003 3 min-1,最后当pH值由11.1变化到11.3时,k增加了0.006 8 min-1。由此可看出pH值从11.0到11.3轻微变化过程中,脱酯速率会显剧增加,因此精确控制此段pH值对脱酯过程非常关键。温度为30℃时,反应速率很快,实验过程很难控制。当温度为10 ℃时,脱酯速率非常低,曲线相对20、25 ℃和30 ℃变化小,这可能是因为温度过低时脱酯速率主要由温度控制。通过拟合pH值与脱酯速率关系可为低酯果胶制备工艺提供参考。
2.4 脱酯反应活化能
根据阿仑尼乌斯方程,lnk=lnA-Ea/RT,选取3 个典型pH值(10.7、11.0、11.3),以表1中的lnk对1/T作图,结果如图4所示。
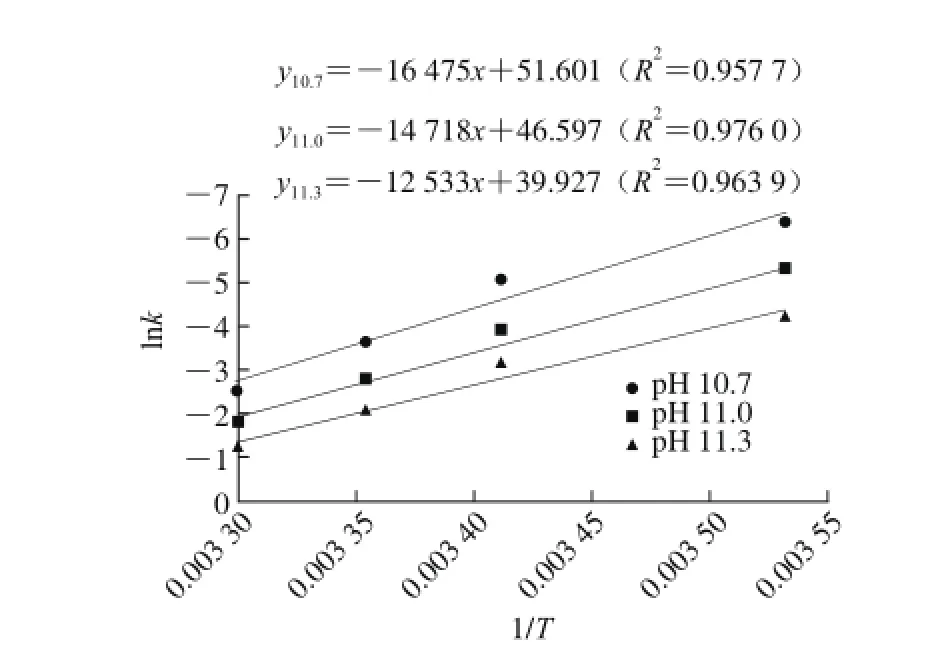
)关系Fig. 4 Relationship between temperature (1/T) and (lnk) at different pH values图4 不同pH值条件下温度(1/T)与(lnk
图4 表明lnk与1/T线性关系良好,所得图形的斜率为-Ea/R,截距即lnA,因此pH值10.7、11.0和11.3条件下的活化能和频率因子分别为136.97 kJ/mol、2.57×1022min-1;122.37 kJ/mol、1.73×1020min-1和104.20 kJ/mol、2.19×1017min-1。通常认为活化能Ea小于40 kJ/mol时,反应较快,而一般反应活化能介于40~400 kJ/mol 之间,由图4中各pH值下的活化能可知脱酯反应在pH 10.7~11.3条件下容易发生。
活化能是指化学反应物分子由基态跃迁到过渡态需要克服的能量,因此活化能越高反应越不容易发生。pH值越大,即OH-浓度越大,微观上表现为果胶分子与OH-之间的有效碰撞百分比越大,甲酯键越容易断裂,脱酯速率越大,宏观上则表现为酯化度降低越快。因此活化能在一定程度上揭示了碱法脱酯速率快慢的动力学机理。
2.5 脱酯反应热力学特征
由化学反应过渡态理论可知,脱酯反应热力学活化特征参数可表征脱酯反应速率,并在一定程度上反映脱酯过程中果胶分子微观结构的变化。热力学特征参数包括活化焓(ΔH)、活化熵(ΔS)和活化自由能(ΔG)等,参照Al-Zubaidy[26]、Sarıkaya[27]等可推算出它们的计算式如下:
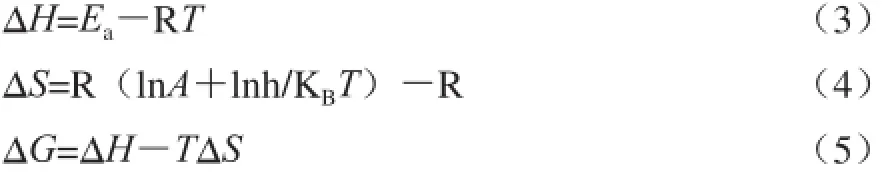
式中:KB为玻耳兹曼常数(1.38×10-23J/K);h为普朗克常数(6.626×10-34J·s=1.104×10-35J·min)。
根据公式(3)~(5),计算不同pH值和温度条件下碱法脱酯反应的活化焓(ΔH)、活化熵(ΔS)和活化自由能(ΔG),结果如表2所示。
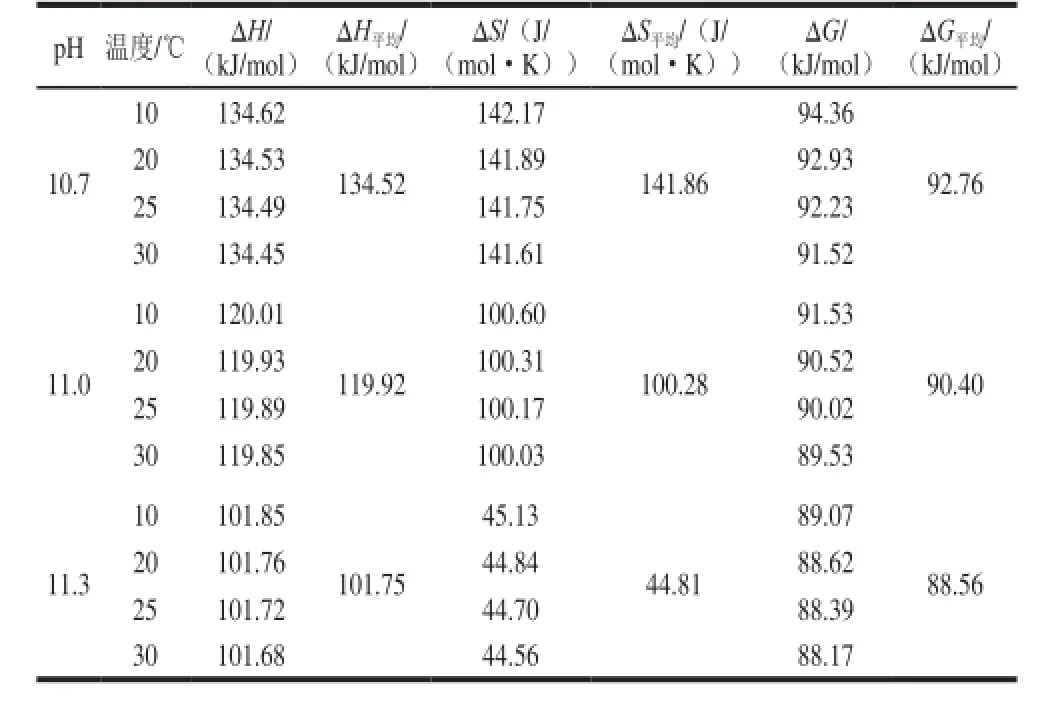
表2 不同脱酯条件下的热力学特征参数Table 2 Thermodynamic characteristic parameters under different demethylation conditions
活化焓(ΔH)可表征脱酯过程中果胶分子由基态跃迁到过渡所需要的总热量,由表2可知,活化焓几乎与活化能相等,pH值为10.7、11.0和11.3时活化焓均大于0 kJ/mol,即果胶甲酯键断裂消耗的总能量大于形成羧基键所释放的能量,因此脱酯反应为吸热反应,升高温度反应速率增加。当pH值一定时,不同温度下活化焓变化不大,这可能是因为在较小的温度范围内,活化能是一个常数。当pH值增加时活化焓明显降低,这可能是由于pH值的增加能减小断裂甲酯键所需热量,即降低活化分子所需要的能量,甲酯键更容易断裂,脱酯速率增加。
果胶碱法脱酯可看成其在碱性催化的条件下发生水解最后生成羧酸盐和醇的过程。果胶在碱性条件下水解反应机理用单分子反应(A)和双分子反应(B)可分别如下表示:
(B)反应机理中决定速率的步骤中有水的参与,会减少体系的平动和转动自由度,则显示负活化熵,而(A)反应机理中没有水的参与,因此反应的活化熵是正值[28]。而表2中活化熵均为正值,因此推测果胶碱法脱酯属于单分子反应机理。
脱酯反应中的活化熵(ΔS)代表反应前后果胶分子有序性和混乱度变化程度,若活化络合物比反应物有更大自由度或对分子内转动和振动约束力更弱,会导致熵值增大,则活化熵大于0[29]。由表2活化熵数据分析可看出,当pH值为10.7、11.0和11.3时,脱酯反应活化熵均大于0 mol/K,果胶由刚性结构变为较松弛结构[30],因此可通过活化熵反映脱酯过程中果胶分子的微观结构变化。温度对活化熵的影响不大,而pH值变化对其影响显著,表明果胶脱酯时pH值对反应活性部位的影响大于温度。当pH值增加时,活化熵减小,且为正值,说明果胶分子有序性较小,混乱度较大,分子内转动和振动约束力较弱,反应活性高,在此pH值范围内容易发生脱酯反应。
脱酯反应中活化自由能(ΔG)代表参加反应的果胶分子由基态跃迁到过渡态的自由能变,pH值为10.7、11.0和11.3时,活化自由能分别为92.76、90.40 kJ/mol和88.56 kJ/mol,可见碱法脱酯自由能变随pH值增加而减小,即pH值越大,果胶分子跃迁所需自由能变越少,因此脱酯速率越大。
3 结 论
果胶碱法脱酯符合一级动力学反应模型,温度和pH值都对脱酯速率有显著影响,且pH值影响大于温度。pH值为10.7、11.0和11.3时,活化能等热力学特征参数均随pH值的增加而减小,即果胶分子发生脱酯反应时,随pH值增加,所需能量减小,甲酯键断裂吸收的热量降低,同时果胶分子混乱度增加,分子跃迁的自由能变减少,果胶分子反应活性增加,因此脱酯速率增加。通过脱酯动力学和热力学研究,更好地从果胶分子微观变化角度解释了pH值对脱酯速率的影响,更深入地研究了果胶碱法脱酯机理。
当脱酯温度为10、20、25 ℃和30 ℃,pH 10.0~11.3时,k与pH值呈幂指数关系,方程分别为:y10=2×10-44pH39.729(R2=0.988 6,n=5)、y20=8×10-45pH40.642(R2=0.983 3,n=4)、y25=2×10-31pH28.321(R2=0.997 2,n=3)、y30=4×10-36pH33.211(R2=0.982 0,n=6)。探讨脱酯速率与pH值的关系可为低酯果胶制备提供更多参考信息。因此,通过果胶碱法脱酯动力学和热力学研究,可更深入分析脱酯机理,为精确控制脱酯过程和脱酯程度,为生产低酯果胶提供相应理论信息。
[1] MOHNEN D. Pectin structure and biosynthesis[J]. Current Opinion in Plant Biology, 2008, 11(3): 266-277. DOI:10.1016/j.pbi.2008.03.006.
[2] JEAN-PAUL V, SCHOLS H A, OOMEN R J F J, et al. If homogalacturonan were a side chain of rhamnogalacturonan I. implications for cell wall architecture[J]. Plant Physiology, 2003, 132(4): 1781-1789. DOI:10.1104/pp.103.022350.
[3] KANG Jiaqi, HUA Xiao, YANG Ruijin, et al. Characterization of natural low-methoxyl pectin from sunf l ower head extracted by sodium citrate and purif i ed by ultraf i ltration[J]. Food Chemistry, 2015, 180: 98-105. DOI:10.1016/j.foodchem.2015.02.037.
[4] HUA Xiao, WANG Kun, YANG Ruijin, et al. Rheological properties of natural low-methoxyl pectin extracted from sunflower head[J]. Food Hydrocolloids, 2015, 44: 122-128. DOI:10.1016/ j.foodhyd.2014.09.026.
[5] 黄文烨, 郭秀君, 黄雪松. 山竹壳果胶提取及流变学特性[J].食品工业科技, 2015, 36(10): 237-240. DOI:10.13386/ j.issn1002-0306.2015.10.041.
[6] 李巧巧, 雷激, 税永红, 等. 酰胺化低酯果胶的研究进展及产业现状[J]. 安徽农业科学, 2009, 37(21): 10148-10150. DOI:10.3969/ j.issn.0517-6611.2009.21.125.
[7] 张卫红, 陈波. 酰胺化法制备低酯果胶工艺研究[J]. 咸阳师范学院学报, 2009, 24(2): 47-50. DOI:10.3969/j.issn.1672-2914.2009.02.015.
[8] 雷激, 李中柱, 易彪, 等. 内源果胶酯酶制备低甲氧基果胶的研究[J]. 中国食品添加剂, 2006(5): 46-51. DOI:10.3969/ j.issn.1006-2513.2006.05.014.
[9] 李川, 单杨, 李高阳. 酶法制备低甲氧基果胶的工艺优化研究[J]. 食品与机械, 2010, 26(2): 110-114. DOI:10.13652/ j.issn.1003-5788.2010.02.016.
[10] GERRIT L, ROMAN K, HANS C B, et a1. Analysis of different deesterif i cation mechanisms for pectin by enzymatic fi ngerprinting using endopectin lyase and endelpolygalacturonase Ⅱ from A. Niger[J]. Carbohydrate Research, 2000, 327(3): 293-307. DOI:10.1016/ S0008.6215(00)00067-7.
[11] ZHAO Wenting, GUO Xingfeng, PANG Xueli, et al. Preparation and characterization of low methoxyl pectin by high hydrostatic pressureassisted enzymatic treatment compared with enzymatic method under atmospheric pressure[J]. Food Hydrocolloids, 2015, 50: 44-53. DOI:10.1016/j.foodhyd.2015.04.004.
[12] 王文, 胡晓燕, 房德. 低甲氧基果胶产业化生产脱酯工艺研究[J].农产品加工(学刊), 2013(11): 30-32. DOI:10.3969/j.issn.1671-9646(X).2013.11.010.
[13] 刘刚, 雷激, 张庆坤, 等. 果胶碱法脱酯工艺影响因素的研究[J]. 食品科技, 2008, 33(6): 61-64. DOI:10.3969/ j.issn.1005-9989.2008.06.019.
[14] 朱文, 肖开恩, 黎国勇, 等. 以西番莲果皮为原料制备LM-果胶[J].食品与发酵工业, 2001, 27(5): 47-49. DOI:10.3321/j.issn:0253-990X-2001.05.013.
[15] KIRTCHEV N, PANCHEV I, KRATCHANOV C. Kinetics of acidcatalysed de-esterification of pectin in a heterogeneous medium[J]. International Journal of Food Science and Technology, 1989, 24(5): 479-486. DOI:10.1111/j.1365-2621.1989.tb00670.x.
[16] RENARD C M G C, THIBAULT J F. Degradation of pectins in alkaline conditions: kinetics of demethylation[J]. Carbohydrate Research, 1996, 286: 139-150. DOI:10.1016/0008-6215(96)00056-0.
[17] 曲昊杨, 朱文学, 刘琛, 等. 苹果渣果胶提取工艺优化及碱法降酯效果评价[J]. 食品科学, 2014, 35(14): 87-92. DOI:10.7506/spkx1002-6630-201414017.
[18] KYOMUGASHO C, CHRISTIAENS S, SHPIGELMAN A, et al. FT-IR spectroscopy, a reliable method for routine analysis of the degree of methylesterification of pectin in different fruit- and vegetable-based matrices[J]. Food Chemistry, 2015, 176: 82-90. DOI:10.1016/j.foodchem.2014.12.033.
[19] 赵静, 吴永娴, 高雪, 等. 碱法脱酯制取低甲氧基果胶的研究[J]. 西南大学学报(自然科学版), 1995(5): 428-430. DOI:10.13718 /j.cnki. xdzk.1995.05.013.
[20] The United States Pharmacopieial Convention. Food chemical codex[M]. Washington DC: National Academy of Sciences, 1981: 322.
[21] 雷激, 马力, 赵义梅, 等. 低温碱法脱酯制取低酯果胶的研究[J].食品与发酵工业, 2006, 32(1): 45-48. DOI:103321/j.issn:0253-990X.2006.01.011.
[22] KRAVTCHENKO T P, ARNOULD I, VORAGEN A G J, et al. Improvement of the selective depolymerization of pectic substances by chemical β-elimination in aqueous solution[J]. Carbohydrate Polymers, 1992, 19(4): 237-242. DOI:10.1016/0144-8617(92)90075-2.
[23] 戴诗玙. 柑橘皮低酯果胶工艺的研究[D]. 武汉: 华中农业大学, 2013: 32-33.
[24] El-NAWAWI S A, HEIKAL Y A. Production of a low ester pectin by de-esterif i cation of high ester citrus pectin[J]. Carbohydrate Polymers, 1995, 27(3): 191-195. DOI:10.1016/0144-8617(95)00051-8.
[25] WEHR J B, MENZIES N W, BLAMEY F P C. Alkali hydroxideinduced gelation of pectin[J]. Food Hydrocolloids, 2004, 18(3): 375-378. DOI:10.1016/S0268-005X(03)00124-3.
[26] Al-ZUBAIDY M M I, KHALIL R A. Kinetic and prediction studies of ascorbic acid degradation in normal and concentrate local lemon juice during storage[J]. Food Chemistry, 2007, 101(1): 254-259. DOI:10.1016/j.foodchem.2006.01.024.
[27] SARIKAYA Y, ADA K, ÖNAL M. Applications of the zero-order reaction rate model and transition state theory on the intra-particle sintering of an alumina powder by using surface area measurements[J]. Journal of Alloys and Compounds, 2007, 432(1/2): 194-199. DOI:10.1016/j.jallcom.2006.05.100.
[28] 金家骏. 化学反应的活化熵对反应速率的影响及其在推断反应机理上的应用[J]. 化学通报, 1975(6): 58-62. DOI:10.14159/ j.cnki.0441-3776.1975.06.016.
[29] CHOWDHURY S, MISHRA R, SAHA P, et al. Adsorption thermodynamics, kinetics and isosteric heat of adsorption of malachite green onto chemically modified rice husk[J]. Desalination, 2011, 265(1/2/3): 159-168. DOI:10.1016/j.desal.2010.07.047.
[30] 吕耀萍. 活化熵在化学动力学理论中的作用[J]. 江汉大学学报, 2000(3): 4-7.
Demethylation Kinetics of Citrus Pectin in Alkaline Solution
LI Meng, HUANG Xuesong, WANG Chao, DUAN Hanying*
(Department of Food Science and Engineering, Jinan University, Guangzhou 510632, China)
For a better understanding of the mechanism of alkali demethylation of pectin and the effect of temperature and pH on the degree of esterif i cation (DE) and demethylation rate of pectin, high methoxyl citrus pectin (DE = 77.8%) was investigate for demethylation kinetics and thermodynamic characteristics at different temperatures (10, 20, 25 and 30 ℃) and pH (10.0-11.3). The pH was accurately controlled by sodium hydroxide in sodium bicarbonate/sodium carbonate buffer. DE and methoxyl group concentration were studied during the demethylation process. The results showed that the alkali demethylation followed a fi rst-order kinetic reaction model. Temperature, pH and their interaction had remarkable effects on the demethylation process, while the effect of pH was more notable. The demethylation reaction rate constant (k) and pH showed an exponential relationship and k sharply increased when pH varied lightly from 11.0 to 11.3. At pH 10.7, 11.0 and 11.3, the activation energy (Ea) were 136.97, 122.37 and 104.20 kJ/mol, the activation enthalpy (ΔH) were 134.52, 119.92 and 101.75 kJ/mol, the activation entropy (ΔS) were 141.86, 100.28 and 44.81 J/(mol·K), and the free energy of activation (ΔG) were 92.76, 90.40 and 88.56 kJ/mol, respectively.
pectin; alkali demethylation; demethylation rate; kinetics; thermodynamics
10.7506/spkx1002-6630-201707022
TS255.1
A
1002-6630(2017)07-0136-06
李梦, 黄雪松, 王超, 等. 柑橘果胶碱法脱酯动力学特征[J]. 食品科学, 2017, 38(7): 136-141. DOI:10.7506/spkx1002-6630-201707022. http://www.spkx.net.cn
LI Meng, HUANG Xuesong, WANG Chao, et al. Demethylation kinetics of citrus pectin in alkaline solution[J]. Food Science, 2017, 38(7): 136-141. (in Chinese with English abstract)
10.7506/spkx1002-6630-201707022. http://www.spkx.net.cn
2016-05-09
公益性行业(农业)科研专项(201303077)
李梦(1989—),女,硕士研究生,研究方向为功能性食品。E-mail:13247391011@163.com
*通信作者:段翰英(1978—),女,讲师,博士,研究方向为食品加工与保藏。E-mail:tduhy@jnu.edu.cn

