卡拉胶寡糖对冷冻南美白对虾的抗冻保水作用
吴海潇,张 宾,*,史周荣,房传栋,邹俊杰,李海波
(1.浙江海洋大学食品与医药学院,浙江 舟山 316022;2.浙江国际海运职业技术学院,浙江 舟山 316022)
卡拉胶寡糖对冷冻南美白对虾的抗冻保水作用
吴海潇1,张 宾1,*,史周荣1,房传栋1,邹俊杰1,李海波2
(1.浙江海洋大学食品与医药学院,浙江 舟山 316022;2.浙江国际海运职业技术学院,浙江 舟山 316022)
目的:研发冷冻南美白对虾虾仁的抗冻保水剂并探索其应用效果。方法:以冷冻虾仁解冻损失率、明度、pH值、肌原纤维蛋白含量、Ca2+-ATPase活性、弹性和咀嚼性为评价指标,以焦磷酸钠为阳性对照,研究卡拉胶寡糖对冷冻虾仁的抗冻保水效果及微观组织结构的影响情况。结果:卡拉胶寡糖和焦磷酸钠浸泡处理能有效抑制冷冻虾仁解冻损失率的增加,减少肌原纤维蛋白含量和Ca2+-ATPase活性的下降,对虾仁pH值、明度和质构特性的保护效果显著,且3 g/100 mL处理组的保护效果整体高于1 g/100 mL处理组;同时,3 g/100 mL卡拉胶寡糖处理对虾仁肌原纤维蛋白的保护效果显著高于3 g/100 mL焦磷酸钠处理(P<0.05);微观结构观察发现,冻藏6 周后,3 g/100 mL卡拉胶寡糖处理组虾仁肌纤维排列紧密,完整性较好,与新鲜冷冻虾仁组织结构较为相近。结论:3 g/100 mL卡拉胶寡糖浸泡处理有利于冷冻虾仁品质的保持。研究结果可为开发一种低甜味、低热量的虾仁抗冻剂提供参考。
南美白对虾;抗冻;保水;焦磷酸钠;卡拉胶寡糖
南美白对虾(Litopenaeus vannamei),学名凡纳滨对虾,是世界对虾养殖中产量较高的三大优良虾种之一,同时也是目前养殖对虾中单产量最高的虾种。南美白对虾肉质细嫩、鲜美,营养丰富,但其水分含量较高,在酶和微生物的作用下易发生劣变。冷冻保藏可最大限度地保持南美白对虾的营养价值,但冻藏过程中产生的冰晶,易使肌肉细胞受损、蛋白质变性,增加解冻时的汁液损失,导致其风味和营养价值下降[1]。
抗冻剂的添加可有效抑制冷冻水产品中冰晶的生长、减少蛋白质的冷冻变性、降低冻藏对肌肉品质造成的影响[2]。糖类物质作为抗冻剂被广泛应用于冷冻水产品中,其作用机理是糖类可改变包埋在蛋白质分子中结合水的状态,取代蛋白质分子表面的结合水并与之结合,从而达到抑制蛋白质变性的效果[3]。水产品加工业中,常以山梨醇和蔗糖的混合物为抗冻剂,以抑制水产品蛋白质的冷冻变性,但其甜味和热量相对较高,在一定程度上影响了产品的风味和营养价值[4]。目前,低甜味、低热量的新型抗冻剂开发已成为国内外的研究热点,如海藻糖、乳糖醇及低聚木糖等的应用已见报道[5-7]。
卡拉胶(carrageenan),是从红藻中提取的一种天然硫酸多糖类化合物,由1,3-β-D-吡喃半乳糖和1,4-β-D-吡喃半乳糖作为基本骨架交替连接而成,其具有优良的成膜性、凝胶性及增稠性,已被广泛应用于食品、医药及化工等各个领域[8]。卡拉胶具有有较强的保水性,能与蛋白质聚集形成蛋白质胶束,以减少肉制品蒸煮损失,从而提高产品的稳定性,增加出品率[9]。于建行等[10]研究发现卡拉胶能有效减少PSE(发白、松软、易析水,pale,soft,exudative)兔肉糜的蒸煮损失。汪星星等[11]发现卡拉胶作为抗冻剂,添加到面团中能有效减缓冰晶对面筋蛋白的破坏作用。卡拉胶寡糖是卡拉胶的降解产物,其分子质量较小、溶解性好、稳定性和安全性有所改善,同时具有甜度低、热量小等特点,在生物医药领域已表现出良好的应用前景[12-13]。Yamada等[14]研究发现,降解和硫酸酯化后得到的卡拉胶寡糖抗艾滋病病毒活性显著增强。此外,卡拉胶寡糖在抗氧化、防辐射及抗肿瘤等方面也具有重要的生理活性[15-17]。目前,将卡拉胶寡糖作为抗冻保水剂应用于冷冻水产品的研究鲜见报道。
本实验以冷冻南美白对虾虾仁为研究对象,评价卡拉胶寡糖对冷冻虾仁的抗冻保水效果及影响机制,以期减少冷冻南美白对虾的汁液损失,保障产品品质,从而为冷冻水产品新型抗冻保水剂的开发及应用提供理论参考。
1 材料与方法
1.1 材料与试剂
鲜活南美白对虾(体长9~10 cm),购自浙江舟山老碶菜场,置于保温箱内,30 min内运至实验室。卡拉胶寡糖(分子质量小于3 000 D,食品级)、焦磷酸钠(含量大于99%,食品级) 青岛博智汇力生物科技有限公司;其他试剂均为分析纯。
1.2 仪器与设备
MDF-U53V型超低温冰箱 日本Sanyo公司;CR-10型便携式色差仪 日本柯尼卡美能达公司;TMS-Pro物性测试仪 美国FTC公司;751UVGD型紫外-可见分光光度计 上海第三分析仪器厂。
1.3 方法
1.3.1 实验处理与分组
1.3.1.1 处理过程
在0~4 ℃条件下,将南美白对虾进行清洗,去头、尾及壳,选取大小均一的完整虾仁个体,沥干并用纱布拭干水分,在4 ℃溶液中浸泡2 h,每隔20 min搅拌1 次,再次沥干并用纱布拭干水分,称质量记为m1(精确至0.001 g,下同)。将虾仁于-18 ℃条件下进行冻藏保存,每隔7 d取样1次。取样虾仁在室温条件下解冻2 h,纱布拭干水分,称质量记为m2。按下式计算虾仁解冻损失率。

1.3.1.2 实验分组
1组:蒸馏水浸泡组(空白对照);2组:1.0 g/100 mL和3.0 g/100 mL卡拉胶寡糖溶液浸泡组;3组:1.0 g/100 mL和3.0 g/100 mL焦磷酸钠溶液浸泡组(阳性对照)。前期实验发现,卡拉胶溶液处理对冷冻虾仁未起到显著的抗冻保水作用,因此本实验中未设置卡拉胶对照处理组。
1.3.2 色差值测定
以虾仁第2腹节为测试点,用CR-10型色差仪测定虾仁的L*(明度)值。每个处理组测定5 个样品,取平均值来反应样品的色差值。
1.3.3 质构特性测定
采用TMS-PRO物性分析仪,测定虾体背部第2节肌肉质构特性分析(texture profile analysis,TPA)。测定参数:P/0.5柱形探头,测试速率1.0 mm/s,样品压缩形变量30%。每个处理组测定5 个样品,取平均值来反映样品的质构特性。
1.3.4 pH值测定
[18],称取虾仁样品5.0 g于烧杯中,加入45 mL的蒸馏水,高速均质1 min后,静置30 min,过滤,PHS-25型酸度计测定滤液pH值。
1.3.5 肌原纤维蛋白含量测定
参考文献[19],称取虾仁样品5.0 g,切碎后加入10 倍量的Tris-顺丁烯二酸缓冲液(20 mmol/L,pH 7.0,含0.05 mol/L KCl),20 000 r/min均质1 min,然后10 000 r/min低温(4 ℃)离心15 min。沉淀加入10 倍量Tris-顺丁烯二酸缓冲液(20 mmol/L,pH 7.0,含0.6 mol/L KCl),匀浆1 min后4 ℃条件下提取l h,然后9 000 r/min低温(4 ℃)离心10 min,上清液即为肌原纤维蛋白溶液。双缩脲法测定其蛋白质含量。
1.3.6 肌原纤维蛋白Ca2+-ATPase 活性测定
Ca2+-ATPase 活性采用南京建成生物工程研究所提供的测试盒进行测定。
1.3.7 苏木精-伊红染色分析
参考文献[20],以新鲜虾仁(0 周),冻藏6 周后的蒸馏水组、3.0 g/100 mL卡拉胶寡糖组、3.0 g/100 mL焦磷酸钠组虾仁为实验对象,固定虾仁背部第2节肌肉,苏木精-伊红(hematoxylin-eosin,HE)染色后观察其肌肉组织微观结构。
1.4 数据分析
首先,我国著作权法明确规定了不受著作权法保护的对象包括:思想、操作方法、技术方案和实用功能、事实及对事实无独创性的汇编、官方文件和正式译文等。⑰ 王迁著:《著作权法》,中国人民大学出版社2015年版,第39-74页。因此,只要未经许可演绎成果不属于上述情形即可。
采用Origin 8.1、SPSS 13.0软件进行作图及数据分析,结果表示为s(采用SNK法分析测验显著性水平,P<0.05)。
2 结果与分析
2.1 不同抗冻剂处理对冷冻虾仁解冻损失率的影响

图1 不同浸泡处理对冷冻虾仁解冻损失率的影响Fig. 1 Effects of different soaking treatments on the thawing loss of frozen shrimps
由图1可知,在0~1 周冻藏期内,不同处理组冷冻虾仁解冻损失率变化显著(P<0.05);随冻藏时间的延长(3~6 周),解冻损失率呈上升趋势,但变化幅度不大。冻藏6 周后,蒸馏水处理组虾仁的汁液流失程度最大,解冻损失率达12.8%。而卡拉胶寡糖和焦磷酸钠浸泡处理,显著降低了冷冻虾仁的解冻损失率(P<0.05),且3.0 g/100 mL高质量浓度浸泡处理组效果均优于1 g/100 mL低质量浓度处理组;冻藏6 周后,卡拉胶寡糖和焦磷酸钠处理组虾仁的解冻损失率仅为7.6%~9.1%和4.4%~9.9%。研究表明,糖类提高冷冻虾仁保水性的作用机理,可能为糖类的游离羟基可加强自由水转化为束缚水的能力,降低“共晶点”温度,减少冰晶体的形成量,形成一个不完全冻结区域,减缓蛋白质分子间的互相聚集,进而防止了肌肉蛋白质的凝聚变性[21]。
2.2 不同抗冻剂处理对冷冻虾仁pH值的影响

图2 不同浸泡处理对冷冻虾仁pH值的影响Fig. 2 Effects of different soaking treatments on the pH of frozen shrimps
由图2可知,新鲜虾仁肌肉pH值为6.90。冻藏0~1 周,1 g/100 mL和3 g/100 mL焦磷酸钠处理虾仁肌肉pH值出现一定程度的上升(pH 0.12~0.19),其原因可能是由于焦磷酸钠溶液呈碱性,致使浸泡后虾仁肌肉pH值略有增加[22]。冻藏3~6 周,各处理组虾仁pH值呈明显上升趋势,可能是由于冻藏虾仁蛋白质及脂类发生氧化作用而生成产物所致;此外,部分嗜冷微生物的代谢作用,也致使少部分蛋白质及氨基酸发生降解产生少量碱性物质[23-24]。冻藏6 周后,蒸馏水处理组虾仁肌肉pH值达7.52,显著高于其他各处理组(P<0.05),并接近Shamshad等[23]提出的可接受临界值。
2.3 不同抗冻剂处理对冷冻虾仁L*值的影响

*值的影响Fig. 3 Effects of different soaking treatments on the L* value of frozen shrimps图3 不同浸泡处理对冷冻虾仁L
色泽是评价虾仁物理品质的重要指标,也是影响消费者购买力的重要因素。本实验中,解冻后的南美白对虾虾仁发白、略红,彩色色差较一致,所以选择L*值作为虾仁色泽的评价指标[25]。由图3可知,新鲜虾仁L*值为44.3;冻藏6 周后,各处理组L*值从小到大依次为3 g/100 mL卡拉胶寡糖(45.92)、1 g/100 mL卡拉胶寡糖(46.94)、3 g/100 mL焦磷酸钠(47.51)、1 g/100 mL焦磷酸钠(47.94)和蒸馏水(48.81)。虾仁L*值升高主要是因为冷冻过程中形成的冰晶改变了肌肉的持水性,导致解冻后虾仁表面的游离水增多,从而提高了对光的反射效果[26]。在各浸泡处理组中,3 g/100 mL卡拉胶寡糖处理虾仁的L*值增加幅度最小,说明该处理组虾仁肌肉组织内的冰晶损伤较小,即3 g/100 mL卡拉胶寡糖能有效减少冻藏过程中冰晶对细胞膜的机械损伤作用。
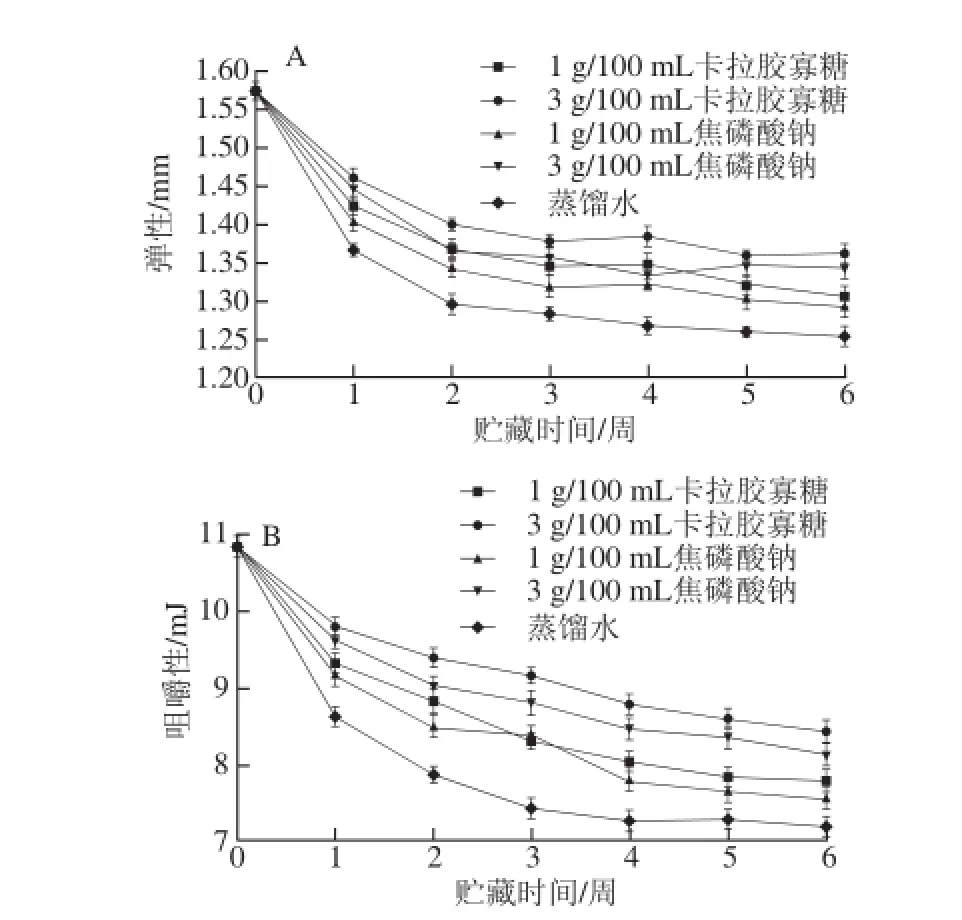
图4 不同浸泡处理对冷冻虾仁弹性(A)、咀嚼性(B)的影响Fig. 4 Effects of different soaking treatments on the springiness (A) and chewiness (B) of frozen shrimps
由图4可知,随冻藏时间的延长,不同处理组虾仁的弹性和咀嚼性均呈显著下降趋势(P<0.05)。冻藏6 周后,卡拉胶寡糖和焦磷酸钠处理组虾仁的弹性均显著优于蒸馏水处理组(P<0.05),其中3 g/100 mL卡拉胶寡糖和3 g/100 mL焦磷酸钠处理组虾仁,弹性值分别为1.36 mm和1.34 mm,二者无显著性差异(P>0.05)。另外,随着冻藏时间的延长,虾仁肌肉的组织结构被破坏,也导致咀嚼性不断下降;冻藏6 周后,卡拉胶寡糖和焦磷酸钠浸泡处理的虾仁咀嚼性均优于蒸馏水处理组(7.21 mJ),其中以3 g/100 mL卡拉胶寡糖(8.43 mJ)和3 g/100 mL焦磷酸钠(8.14 mJ)处理效果最佳。研究发现,虾仁贮藏过程中品质的劣变与蛋白质降解所引起的空间结构破坏有关[27]。本实验中,卡拉胶寡糖及焦磷酸钠的添加在一定程度上延缓了肌肉蛋白质的冷冻变性,进而减小了质构品质的下降程度。
2.5 不同抗冻剂处理对冷冻虾仁肌原纤维蛋白含量的影响
从图5可以看出,新鲜虾仁肌原纤维蛋白含量为129.78 mg/g;随冻藏时间的延长,不同处理组虾仁的肌原纤维蛋白含量均呈显著下降趋势(P<0.05)。冻藏6 周后,蒸馏水处理组肌原纤维蛋白含量为98.21 mg/g,显著低于其他处理组(P<0.05);1 g/100 mL卡拉胶寡糖和1 g/100 mL焦磷酸钠处理组虾仁肌原纤维含量分别为104.03 mg/g和104.86 mg/g,二者无显著性差异(P>0.05)。3 g/100 mL卡拉胶寡糖和3 g/100 mL焦磷酸钠处理对肌原纤维蛋白含量的保持作用显著(P<0.05);冻藏6 周后,虾仁肌原纤维蛋白含量分别为111.32 mg/g和107.97 mg/g。研究表明,冻藏过程中肌原纤维蛋白含量下降主要是因为蛋白质的部分结合水形成冰晶,使肌动球蛋白分子间形成非共价键,进而形成超大分子的不溶解凝集体所致[28]。本实验中,卡拉胶寡糖对肌原纤维蛋白质的保护效果较好,可能是因为卡拉胶寡糖抑制了虾仁肌肉内冰晶的破坏,防止了肌球蛋白重链的冷冻变性,从而达到保护肌肉蛋白质构象稳定性的效果。

图5 不同浸泡处理对虾仁肌原纤维蛋白含量的影响Fig. 5 Effects of different soaking treatments on the content of myof i brillar proteins in frozen shrimps
2.6 不同抗冻剂处理对冷冻虾仁肌原纤维蛋白Ca2+-ATPase活性的影响

图6 不同浸泡处理对虾仁肌原纤维蛋白Ca2+-ATPase活力的影响Fig. 6 Effects of different soaking treatments on the Ca2+-ATPase activity of frozen shrimps
由图6可看出,新鲜南美白对虾虾仁Ca2+-ATPase活力为0.171 U/mg。随冻藏时间的延长,不同抗冻剂处理组虾仁的Ca2+-ATPase活性均呈下降趋势。蒸馏水处理组Ca2+-ATPase活性下降显著(P<0.05),冻藏6 周后,Ca2+-ATPase活力为0.102 U/mg,下降约40%。3 g/100 mL卡拉胶寡糖和3 g/100 mL焦磷酸钠处理,对冷冻虾仁肌肉Ca2+-ATPase活性的保护效果相对较好;冻藏6 周后,Ca2+-ATPase活力分别为0.134 U/mg和0.130 U/mg,显著高于同样抗冻剂低质量浓度处理组(P<0.05)。研究发现,冻藏过程中形成的冰晶及体系离子强度的增强,均会改变肌球蛋白的头部结构,致使其Ca2+-ATPase活性下降[29]。由此可见,卡拉胶寡糖及焦磷酸钠处理能延缓虾肉肌原纤维蛋白的冷冻变性及降低Ca2+-ATPase活性的下降程度。
2.7 不同抗冻剂处理对冷冻虾仁微观结构的影响

图7 虾仁肌肉(纵切)HE染色结果Fig. 7 HE staining of shrimp muscle (longitudinal cross sections)

图8 虾仁肌肉(横切)HE染色结果Fig. 8 HE staining of shrimp muscle (transverse cross sections)
不同抗冻剂浸泡处理对冷冻虾仁肌肉组织微观结构的影响,见图7和8。新鲜虾仁(图7A和8A)内部结缔组织排列均一整齐,彼此间结合较紧密,存在少量空隙。冻藏6 周后,蒸馏水处理组(图7D和8D),冷冻虾仁组织结构发生了明显的变化,其肌肉纤维结构变得松散,肌束间的间隙变大,横切面出现大小不一的孔洞,这可能是由于冻藏过程中冰晶破坏了肌肉组织细胞,加剧了冻结过程中蛋白质的变性,致使肌束间、肌束内部的孔间距增大[30]。3 g/100 mL焦磷酸钠处理组(图7C和8C),冷冻虾仁肌束收缩显著,肌束间产生了较多空隙,但其肌肉纤维排列仍较紧密,孔洞直径较蒸馏水处理组小。3 g/100 mL卡拉胶寡糖处理组(图7B和8B),冷冻虾仁肌纤维排列仍较紧密,完整性较好,无明显扭曲、挤压现象,与新鲜虾仁的组织结构较为相近。这可能是由于卡拉胶寡糖与蛋白质相结合,提高了肌肉蛋白质的稳定性,抑制了蛋白质的降解变性。以上结果表明,卡拉胶寡糖对冷冻虾仁微观组织结构具有显著保护作用,这也与肌原纤维蛋白含量和Ca2+-ATPase活性研究结果相一致。
3 结 论
在冻藏过程中,卡拉胶寡糖浸泡处理能有效降低冷冻虾仁的解冻汁液损失,且在保持虾仁质构及色泽,延缓肌原纤维蛋白含量下降和保护Ca2+-ATPase活性等方面均具有较好的效果。此外,卡拉胶寡糖处理对冷冻虾仁微观结构的保持作用也较好,同时以较高质量浓度的卡拉胶寡糖处理效果最佳。因此,卡拉胶寡糖可作为一种优良的抗冻保水剂应用于冷冻水产品中,为水产品低甜味、低热量抗冻剂的开发与应用提供参考。
参考文献:
[1] BOONSUMREJ S, CHAIWANICHSIRI S, TANTRATIAN S, et al. Effects of freezing and thawing on the quality changes of tiger shrimp (Penaeus monodon) frozen by air-blast and cryogenic freezing[J]. Journal of Food Engineering, 2007, 80(1): 292-299.
[2] 胡晓亮, 王易芬, 郑晓伟, 等. 抗冻剂在水产品冻藏中的应用研究[J].中国农学通报, 2015, 31(35): 38-42.
[3] SAROAT R K, AKKASIT J J, SUTTIRUG P C, et al. Assessment of protein changes in farmed giant catfish (Pangasianodon gigas) muscles during refrigerated storage[J]. International Journal of Food Science and Technology, 2010, 45(5): 985-994. DOI:10.1111/j.1365-2621.2010.02217.x.
[4] 刘欣, 周爱梅, 赵力超, 等. 海藻糖、乳酸钠对冻藏鳙鱼鱼糜蛋白抗冻效果的影响[J]. 食品与发酵工业, 2007, 33(8): 60-64.
[5] 马璐凯, 张宾, 王晓玲, 等. 海藻糖、海藻胶及寡糖对蒸煮南美白对虾的抗冻保水作用[J]. 食品科学, 2015, 36(16): 266-271. DOI:10.7506/spkx1002-6630-201516051.
[6] HERRERA J R, MACKIE I M. Cryoprotection of frozen-stored actomyosin of farmed rainbow trout (Oncorhynchus mykiss) by some sugars and polyols[J]. Food Chemistry, 2004, 84(1): 91-97.
[7] WU Y, LIN K. Inf l uences of xylooligosaccharides on the quality of Chinesestyle meatball (kung-wan)[J]. Meat Science, 2011, 88(3): 575-579.
[8] 胡亚芹, 竺美. 卡拉胶及其结构研究进展[J]. 海洋湖沼通报, 2005, 94(9): 94-100.
[9] 浮吟梅, 王林山, 苏海燕. 卡拉胶在食品工业中的应用[J]. 中国食品添加剂, 2009, 1(5): 159-163.
[10] 于建行, 夏杨毅, 尚永彪, 等. 卡拉胶和黄原胶对转谷氨酰胺酶处理PSE兔肉糜蒸煮损失与成胶能力的影响[J]. 食品科学, 2014, 35(15): 77-81. DOI:10.7506/spkx1002-6630-201415016.
[11] 汪星星, 余小林, 胡卓炎, 等. 冻融冻藏中卡拉胶对面筋蛋白分子量及超微结构的影响[J]. 食品工业科技, 2016, 37(12): 89-93.
[12] 朱楠楠, 姚子昂, 吴海歌, 等. 卡拉胶寡糖的研究进展[J]. 化学与生物工程, 2009, 26(10): 9-12.
[13] GUANGLI Y, HUASHI G, IOANOVICIU A S, et al. Structural studies on κ-carrageenan derived oligosaccharides[J]. Carbohydrate Research, 2002, 337(5): 433-440.
[14] YAMADA T, OGAMO A, SAITO T, et al. Preparation of O-acylated lowmolecular-weight carrageenans with potent anti-HIV activity and low anticoagulant effect[J]. Carbohydrate Polymers, 2000, 41(2): 115-120.
[15] 李翊, 王海青. 卡拉胶寡糖对放射损伤的防护作用[J]. 中华放射医学与防护杂志, 2005, 25(2): 116-117.
[16] YUAN H M, ZHANG W W, LI X G, et al. Preparation and in vitro antioxidant activity of J-carrageenan oligosaccharides and their oversulfated, acetylated and phosphorylated derivatives[J]. Carbohydrate Research, 2005, 340(4): 685-692.
[17] MOU H J, JIANG X L, GUAN H S. A κ-carrageenan derived oligosaccharide prepared by enzymatic degradation containing antitumor activity[J]. Journal of Applied Phycology, 2003, 15(4): 297-303.
[18] 卫生部. 水产品卫生标准的分析方法: GB/T 5009.45—2003[S]. 北京: 中国标准出版社, 2003.
[19] 薛勇, 薛长湖, 李兆杰, 等. 海藻糖对冻藏过程中鳙肌原纤维蛋白冷冻变性的影响[J]. 中国水产科学, 2006, 13(4): 637-641.
[20] 荣建华, 张亮子, 谢淑丽, 等. 冷冻对脆肉鲩和草鱼肉微观结构和质构特性的影响[J]. 食品科学, 2015, 36(12): 243-248. DOI:10.7506/ spkx1002-6630-201512046.
[21] 何芸, 姚开, 贾冬英, 等. 抗鱼肉蛋白冷冻变性机理的研究进展[J].氨基酸和生物资源, 2007, 29(2): 36-39.
[22] 刘金昉, 刘红英, 齐凤生, 等. 复合生物保鲜剂结合冰温贮藏对南美白对虾的保鲜效果[J]. 食品科学, 2014, 35(20): 286-290. DOI:10.7506/spkx1002-6630-201420056.
[23] SHAMSHAD S I, NISA K U, RIAZ M, et al. Shelf life of shrimp (Penaeus merguiensis) stored at different temperatures[J]. Journal of Food Science, 1990, 55(5): 1201-1205.
[24] 林婉玲, 杨贤庆, 侯彩玲, 等. 浸渍冻结对凡纳滨对虾冻藏过程中品质的影响[J]. 食品科学, 2014, 35(10): 223-229. DOI:10.7506/ spkx1002-6630-201410042.
[25] 邹明辉, 李来好, 郝淑贤, 等. 凡纳滨对虾虾仁在冻藏过程中品质变化研究[J]. 南方水产, 2010, 6(4): 37-42.
[26] PEARSON D H, DUTSON T R. Advances in meat research[M]. Westport CT: AVT Publishing Company, 1985: 185-218.
[27] 崔宏博, 薛勇, 宿玮, 等. 即食南美白对虾贮藏过程中水分状态的变化研究[J]. 中国食品学报, 2012, 12(6): 198-203.
[28] ROURA S I, MONTECCIA C, GOLDEMBERG A L, et al. Biochemical and physicochemical properties of actomyosin from preand post-spawned hake (Merluccius hubbsi) stored on ice[J]. Journal of Food Science, 1990, 55(3): 688-692.
[29] BENJAKUL S, BAUER F. Physicochemical and enzymatic changes of cod muscle proteins subjected to different freeze-thaw cycles[J]. Journal of the Science of Food and Agriculture, 2000, 80(8): 1143-1150.
[30] BREMNER H A, HALLETT I C. Muscle fi ber-connective tissue junctions in the fi sh blue grenadier (Macruronus novaezelandiae). A scanning electron microscope study[J]. Journal of Food Science, 1985, 50(4): 975-980.
Cryoprotective Effects of Carrageenan Oligosaccharides on Pacif i c White Shrimp (Litopenaeus vannamei) during Frozen Storage
WU Haixiao1, ZHANG Bin1,*, SHI Zhourong1, FANG Chuandong1, ZOU Junjie1, LI Haibo2
(1. College of Food and Medicine, Zhejiang Ocean University, Zhoushan 316022, China; 2. Zhejiang International Maritime College, Zhoushan 316022, China)
Objective: To evaluate the cryoprotective effects of carrageenan oligosaccharides on peeled shrimp (Litopenaeus vannamei). Methods: The thawing loss, color, texture, myof i brillar protein content, Ca2+-ATPase activity, and microscopic structure of shrimp muscle were investigated during frozen storage with sodium pyrophosphate as a positive control. Results: Both sodium pyrophosphate and carrageenan oligosaccharide treatments signif i cantly decreased the thawing loss, inhibited the degradation of myof i brillar proteins and Ca2+-ATPase activity, and maintained the pH and textural and color properties of shrimp muscle, when compared with the control during frozen storage. In addition, each treatment at a concentration of 3 g/100 mL showed better cryoprotective effect on shrimp muscle than at 1 g/100 mL. Importantly, carrageenan oligosaccharides were significantly more effective than sodium pyrophosphate (P < 0.05) at the same concentration of 3 g/100 mL. The microstructural analysis revealed that the texture of shrimps treated with 3 g/100 mL carrageenan oligosaccharide after six weeks of frozen storage was compact and showed good integrity, which was not significantly different from that of fresh shrimps after frozen storage. Conclusion: Carrageenan oligosaccharide treatment at 3 g/100 mL is more benef i cial for maintaining the quality of white shrimp during frozen storage. This study can lay the foundation for developing a low-sweetness and low-calorie cryoprotective additive for frozen shrimp.
Litopenaeus vannamei; cryoprotective; water retention; sodium pyrophosphate; carrageenan oligosaccharides
10.7506/spkx1002-6630-201707041
TS254.4
A
1002-6630(2017)07-0260-06
吴海潇, 张宾, 史周荣, 等. 卡拉胶寡糖对冷冻南美白对虾的抗冻保水作用[J]. 食品科学, 2017, 38(7): 260-265.
DOI:10.7506/spkx1002-6630-201707041. http://www.spkx.net.cn
WU Haixiao, ZHANG Bin, SHI Zhourong, et al. Cryoprotective effects of carrageenan oligosaccharides on pacif i c white shrimp (Litopenaeus vannamei) during frozen storage[J]. Food Science, 2017, 38(7): 260-265. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201707041. http://www.spkx.net.cn
2016-06-22
中国博士后科学基金项目(2016M590663);浙江省自然科学基金项目(Y15C200052);浙江省公益项目(2016C32080;2016C32081)
吴海潇(1993—),女,硕士研究生,研究方向为水产品加工及贮藏。E-mail:1443813242@qq.com
*通信作者:张宾(1981—),男,副教授,博士,研究方向为水产品加工及贮藏。E-mail:zhangbin_ouc@163.com

