乳腺X线立体定位体表标记在触诊阴性乳腺钙化灶诊治中的应用
徐 静, 江 颖, 刘文帅, 仇奕然
复旦大学附属中山医院普通外科,上海 200032
·论 著·
乳腺X线立体定位体表标记在触诊阴性乳腺钙化灶诊治中的应用
徐 静, 江 颖*, 刘文帅, 仇奕然
复旦大学附属中山医院普通外科,上海 200032
目的: 探讨乳腺X线立体定位体表标记活检在触诊阴性乳腺钙化灶诊治中的应用价值。方法: 收集2015年1月至2016年5月,临床触诊阴性而乳腺X线摄片显示有钙化灶,乳腺影像报告和数据系统(breast imaging reporting and data system, BI-RADS)分级4~5级的病例51例,均行乳腺钙化灶手术切除活检,其中25例患者采用乳腺X线立体定位导丝引导切除病灶,26例患者采用乳腺X线立体定位体表标记切除病灶,切除病灶均送病理检查,比较两者的定位准确率、病灶阴性切缘大小及恶性检出率。结果: 导丝标记法:平均每位患者行乳腺X线摄片6次,定位中无并发症发生,1例患者活检术中切除病灶3次未见钙化,后行象限切除后将钙化灶完整活检,其余患者均术中一次性活检成功;阴性切缘平均值(30.6±8.7) mm;恶性检出率为11%。体表标记法:平均每位患者乳腺X线摄片4次,定位中无并发症发生,术中均一次性活检成功,阴性切缘平均值(29.1±5.6) mm;恶性检出率为20%。结论: 在外科与影像科合作下,乳腺X线立体定位体表标记的手术活检准确率高、创伤小、费用低,较导丝标记更适宜在基层医院推广。
触诊阴性乳腺病灶;钙化;定位切检
近年来,随着生活水平的提高和饮食结构的变化,乳腺癌发病率呈逐年上升趋势[1-2]。得益于乳腺普查及乳腺X线摄影术在筛查中的广泛开展,更多的乳腺癌得到早期发现、早期诊断、早期治疗,乳腺癌患者的生存率较之前明显改善[3]。临床上,有相当一部分早期乳腺癌患者没有任何的临床症状和体征,仅在乳腺X线摄影检查时发现可疑钙化灶。因此,如何准确定位并切除可疑钙化灶是早期诊断的关键。为探讨在乳腺X线立体定位后是使用操作简单、使用经济方便的体表标记还是更精准的导丝穿刺标记,本研究对课题协作单位在2015年1月至2016年5月期间收治的51例临床触诊阴性的乳腺钙化灶患者做一回顾性总结。
1 资料与方法
1.1 一般资料 收集课题协作单位自2015年1月至2016年5月,临床触诊阴性而乳腺X线摄影显示有钙化灶,BI-RADS分级4~5级,并进行乳腺钙化灶手术切除活检的病例51例,均为女性;年龄32~72岁,中位年龄51岁。钙化灶在左侧者28例,右侧者19例,双侧者4例。除1例患者因乳头溢液就诊,其余患者均无阳性体征,体检行乳腺X线摄影时发现钙化灶。其中25例患者采用乳腺X线立体定位导丝引导切除病灶,26例患者采用乳腺X线立体定位体表标记后切除病灶。
1.2 方 法
1.2.1 立体定位导丝标记法 采用乳腺X线立体定位装置,根据乳腺X线摄片显示的病灶位置,取0°和左右15°位进行乳腺X线摄影定位。应用计算机工作站计算病灶的X、Y和Z轴三维立体定位值,确定进针的部位和深度。将预穿刺进针点进行皮肤消毒后,通过活检装置用Bard“Y”型钩针进行定位穿刺至病灶。再次左右15°进行拍摄,确认针尖位于目标病灶内(图1A、1B);再拍摄1张90°位片,确认进针深度(图1C)。完成确认后,拨出针套,定位导丝留在患者乳腺病灶处(图1D);用无菌胶纸黏合皮肤穿刺点,患者入手术室行病灶切除。
1.2.2 立体定位体表标记法 根据患侧乳房拍摄的轴位片和侧位片,以轴位片上与乳腺基底部平行的水平延伸线为X轴,在侧位片上与乳腺基底部平行的水平延伸线为Y轴,据图像上直接测得的钙化灶距皮肤的距离得出空间坐标的Z轴,在体表用金属标记后再次拍摄乳腺X线摄片确认并根据标记与病灶的相对位置调整定位,直至两张乳腺X线摄片金属标记均完全围绕或覆盖病灶(图2),在金属标记范围内对病灶画定位标记,同时告知医生切除病灶的深度与范围,患者入手术室行病灶切除。
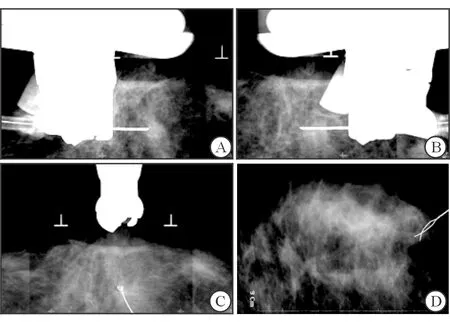
图1 立体定位导丝标记法
A:定位穿刺至病灶,右15°拍摄;B:定位穿刺至病灶,左15°拍摄;C:定位穿刺至病灶,90°拍摄;D:定位导丝在钙化灶内
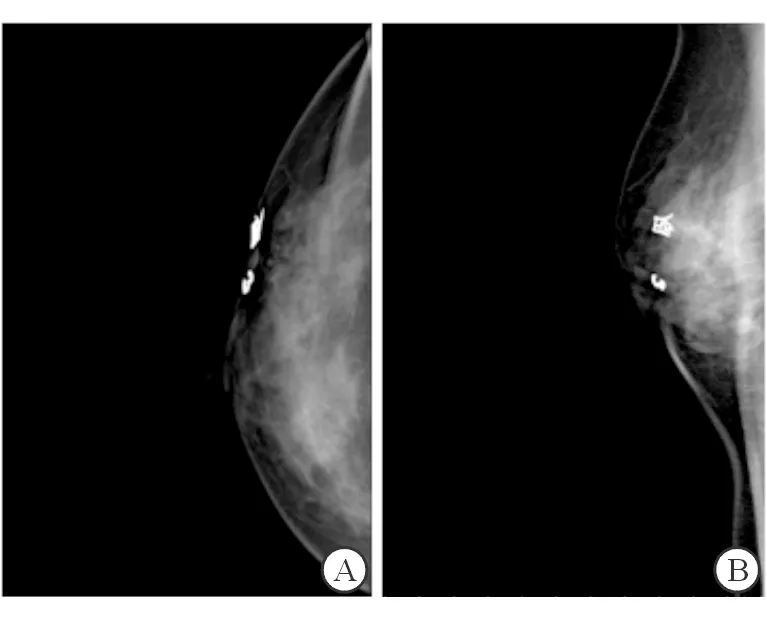
图2 立体定位体表标记法
A:轴位片右乳外上方不均质钙化影位于两金属标记之间(BI-RADS 4B);B:侧位片金属标记完全围绕右乳外上方不均质钙化影(BI-RADS 4B)
1.2.3 导丝标记手术方法 乳腺X线立体定位导丝标记完成后,据定位情况及乳癌保乳手术切口要求选择手术切口。常规消毒,铺巾,逐层切开皮肤、皮下组织及乳腺,寻找导丝尖端,以此为中心,根据病变范围,切除定位处钙化灶,标本送病理检查前先行乳腺X线摄片,如摄片显示钙化灶未完整切除,需继续在原手术切除区域周围行扩大切除,标本切除后再次送检乳腺X线摄片,直至确认所有术前定位的可疑钙化灶均完整切除。确认钙化灶完整切除后逐层缝合伤口,标本行病理检查。病理结果为良性时,不再进一步手术;若为恶性,按乳腺癌治疗规范进一步手术治疗。所有病例均经病理确诊。
1.2.4 体表标记手术方法 定位完成后,在体表定位处选择切口,注意乳癌保乳手术切口要求。常规消毒,铺巾,逐层切开皮肤及皮下组织,以乳腺X线立体定位为依据,根据钙化灶体表定位范围,柱状切除定位范围内乳腺组织。后续操作与导丝标记手术方法相同。
1.3 观察指标 观察两种定位标记方法的定位准确率,病灶阴性切缘大小、恶性检出率,用以比较两种标记方法的临床意义和在临床推广的可行性。
2 结 果
2.1 两种标记方法的定位准确率与阴性切缘大小
2.1.1 导丝标记法 平均每位患者行乳腺X线摄片6次;定位中无气胸、出血、血肿形成、定位导丝折断、迷走神经反应等并发症发生;1例患者活检术中切除病灶3次未见钙化,行象限切除后将钙化灶完整活检,其余患者均术中一次性活检成功;阴性切缘平均值为(30.6±8.7) mm。
2.1.2 体表标记法 平均每位患者乳腺X线摄片4次,定位过程顺利,术中均一次性活检成功,阴性切缘平均值为(29.1±5.6) mm。
2.2 两种标记方法活检手术后病理结果
2.2.1 立体定位导丝标记法 活检25例患者(共27枚病灶,其中2例患者为双侧乳腺钙化),其中恶性3例(均为导管内癌),良性病灶24枚(单纯乳腺病17枚,乳腺病伴纤维腺瘤形成4枚,纤维腺瘤2枚,管状腺瘤1枚),恶性检出率为11%。
2.2.2 立体定位体表标记法 活检26例患者(共29枚病灶,其中3例患者为双侧乳腺钙化),其中恶性6例(导管内癌3例,导管内癌微浸润1例,浸润性导管癌2例),良性病灶23枚(单纯乳腺病13枚,乳腺病伴纤维腺瘤形成7枚,导管内乳头状瘤3枚),恶性检出率为20%(表1)。
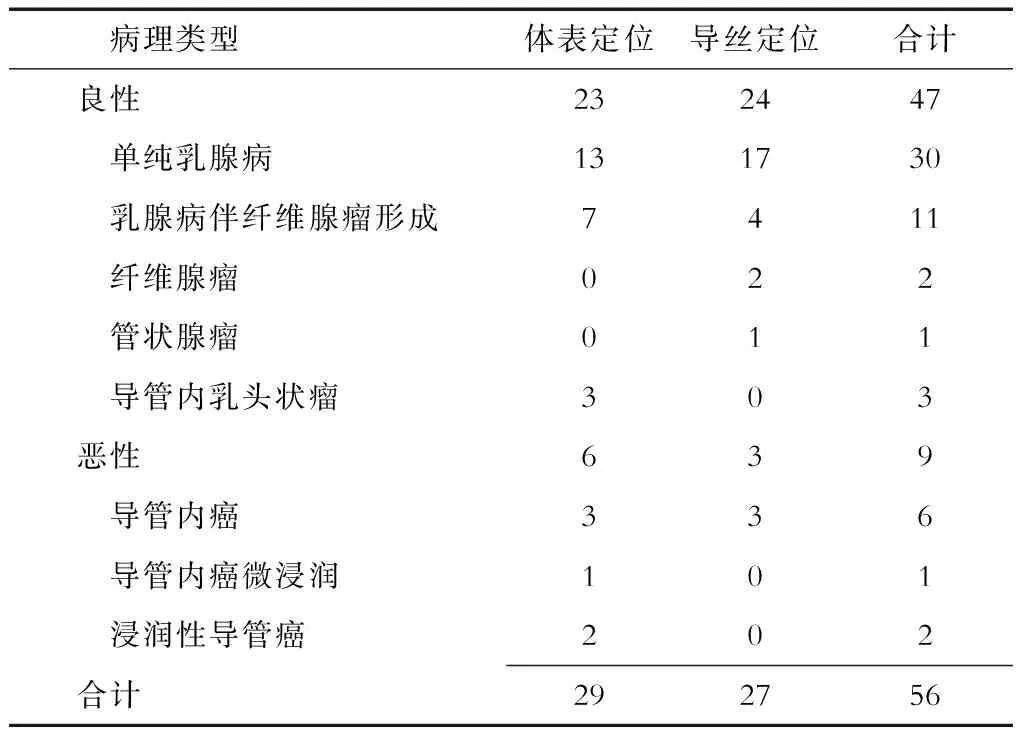
表1 病理分析结果
56枚触诊阴性的钙化灶中共9枚恶性病灶,恶性检出率为16%,恶性病灶中导管内癌占66.7%,导管内癌微浸润占11.1%,浸润性导管癌占22.2%。
3 讨 论
乳腺癌(breast cancer)是女性最常见的恶性肿瘤之一。近10年间,中国城乡人群乳腺癌发病率均呈上升趋势。在京津沪等国内一线城市,乳腺癌的发病率已居女性恶性肿瘤之首,占所有女性恶性肿瘤的15%。据统计,我国目前约有200多万的乳腺癌患者,每年约有20多万新发乳腺癌患者[1-2]。
乳腺X线摄影术是经典的乳腺辅助检查方法,能发现无临床症状体征的早期乳腺癌[3]。文献报道[4],70%的临床未扪及肿块的乳腺导管内癌是由乳腺X线摄影发现的。在欧美,由于乳腺X线摄影的普及,新发的乳腺癌患者中约60%为早期乳腺癌[5],与之相比,目前我国新发的乳腺癌患者中仅约20%为早期乳腺癌[6]。在乳腺癌的自然病程中,疾病全程的前2/3为临床前期,多数早期乳腺癌尚未出现明显肿块或肿块较小,乳腺体检往往不易触及。乳腺X线摄影是目前诊断触诊阴性仅表现为钙化灶的隐匿性乳腺病灶的最重要且最有效的方法,也是许多欧美发达国家公认的乳腺癌筛查首选手段。乳腺X线摄影术对显示钙化的敏感性,是其他影像学检查无法比拟的[7],超声无法探知的微小钙化灶可以由乳腺X线摄片清晰地检测出来[8]。
钙化是乳腺X线影像中常见的一种征像和重要的诊断依据。在早期乳腺癌尤其是那些没有临床症状、查体又不能扪及肿块的乳腺癌的诊断中,钙化起着极为重要的作用,有时异常的钙化灶甚至是早期乳腺癌的唯一征像。Sakka等[9]研究发现,乳腺X线摄片显示乳腺癌伴钙化者高达30%~50%。乳腺导管内癌多表现为细小成簇的钙化及粗细不均、形态不规则的钙化,其首发症状中,仅表现为乳腺摄片钙化者占9.76%[10]。Berg等[11]分析了150例乳腺钙化灶活检的病理结果,其中27例导管内癌,1例小叶原位癌,3例早期导管浸润癌,21例非典型导管增生和8例非典型小叶增生。由此可见,重视乳腺钙化灶的活检可以有效提高乳腺癌的早期诊断率。
为了规范乳腺影像报告,美国放射学会于20世纪90年代提出了乳腺影像报告和数据系统(breast imaging reporting and data system, BI-RADS)。BI-RADS分级越高,病灶阳性预测值越高(positive predictive value, PPV;PPV=病理诊断为恶性的病灶数/活检病灶总数)。文献报道,欧美国家BI-RADS 4级和5级病灶的PPV分别可达25.0%~34.0%和77.4%~100%[12-14]。而亚洲人群BI-RADS 4级和5级的PPV与欧美国家结果相似,分别为27.0%和84.0%[15]。本研究使用BI-RADS分级评估乳腺X线摄片中发现的触诊阴性的乳腺钙化灶。为了提高恶性检出率,对钙化灶评级为BI-RADS 3级的患者进行临床随访,选择BI-RADS分级4~5级的患者进行活检。
在病灶尚不能扪及时行病灶切除活检,对乳腺癌的早期发现、早期诊断,早期治疗有重要意义,可明显改善患者预后。但难点在于如何进行准确的病灶定位及完整的切除,同时又能保留尽量多的正常乳腺组织,达到创伤小、美观以及保乳的要求。目前对于查体不可触及,超声检查又无法显影的乳腺微小钙化灶进行活检的方法主要有X线立体定位导丝引导切除活检(stereotactic needle localized biopsy, SNLB)、X线立体定位空心针穿刺活检(stereotactic core needle biopsy, SCNB)、乳腺X线立体定位真空辅助活检术(stereotactic vacuum-assisted biopsy, SVAB)[16]。另有研究者尝试将核素联合美蓝示踪法应用于查体阴性的乳腺钙化灶的定位活检上取得了满意的结果[17]。SCNB、SVAB均属于微创方法,与外科手术活检相比,具有快捷、侵袭性低、瘢痕小等优点;国外研究者对形态不规则的乳腺钙化灶使用SCNB的方式进行活检可达到97%的准确率,但SCNB取得的组织样本量较少,有可能存在组织学低估,仍有54%的患者在穿刺术后需进一步行外科手术治疗[11,18]。SVAB较SCNB能获得更多的组织样本[19-20],但仍有约9%的患者需要进行二次活检[21]。核素联合美蓝定位活检法是将前哨淋巴结活检时使用的核素和美蓝示踪法应用于查体阴性的乳腺钙化灶的活检中。核素联合美蓝定位活检法较X线立体定位导丝引导切检而言,病灶切缘阳性率较低、切口更小、手术时间较短[22]。但该方法对医院设备有特殊要求,且从事放射性同位素工作的人员要受一定的专门训练,要具备相应的安全防护措施和条件,不适合在基层医院推广。
立体定位导丝引导切检(SLNB)是在乳腺X线摄影引导下,采用乳腺X线摄影立体定位活检装置,将导丝定位于可疑钙化灶中,引导手术活检。它完整切除影像显示的病灶,可以获得满意的病理结果[23],弥补了SCNB和SVAB的取材不足和假阴性率高的缺陷[24]。SLNB对良、恶性肿瘤的定位、切除可以一次性完成,是集诊断和治疗为一体的方法,被认为是诊断触诊阴性乳腺钙化灶的金标准,在临床得到广泛应用[25]。但该技术在定位过程中可引起出血、血肿形成、迷走神经反射等并发症,穿刺后不慎牵拉导致导丝移位定位不准可能,而且多次X线摄片定位对乳腺有一定的辐射危害,这些缺陷限制了其在基层医院的应用。
为此,本研究在X线立体定位的基础上采用体表标记定位的方法指导手术切除活检,该方法在准确的立体定位下可取得与导丝定位相似的活检成功率,并能保证一定的阴性切缘范围。在保证病灶完整切除的同时,控制了创伤,减少了患者的放射曝光次数,避免了有创操作带来的风险,降低了患者的医疗费用。但该方法对影像科定位医生与外科手术医生之间的协作有更高的要求。外科医生应在定位现场与影像科医生充分沟通,在术前对患者的手术切除范围有准确的立体观,从而达到精准切除减少创伤的目的。
触诊阴性乳腺钙化灶的手术活检对乳腺癌的早期发现、早期诊断、早期治疗有重要意义,可明显改善患者预后,在外科与影像科合作下,乳腺X线立体定位体表标记的手术活检准确率高、创伤小、费用低,较导丝标记更适宜在基层医院推广。
[ 1 ] 陈万青, 郑荣寿.中国女性乳腺癌发病死亡和生存状况[J].中国肿瘤临床, 2015,42(13):668-674.
[ 2 ] 陈宏亮,王懋莉,张 征,等.乳腺癌真空辅助旋切术后保乳手术的可行性[J].中国临床医学,2016,23(6): 710-714.
[ 3 ] 徐开野, 汪登斌.X线在乳腺诊断摄影中的应用[J].中国医疗器械杂志, 1995,19(5):294-297.
[ 4 ] 沈镇宙, 柳光宇.重视乳腺癌癌前疾病的临床研究[J].中国实用外科杂志, 2000,20(5):259-260.
[ 5 ] OUÉDRAOGO S, DABAKUYO T S, GENTIL J, et al.Attending breast cancer screening alone does not explain the detection of tumours at an early stage[J].Eur J Cancer Prev, 2013,22(2):103-111.
[ 6 ] 莫 淼, 郑 莹, 柳光宇, 等.上海市女性乳腺癌有组织筛查和机会性筛查的成本效果分析[J].中华肿瘤杂志, 2015,37(12):944-951.
[ 7 ] MORIYA T.Diagnosis of non-palpable breast cancer(image-detected breast cancer)[J].Breast Cancer, 2005,12(4):249.
[ 8 ] OHNUKI K.Mammographic screening for non-palpable breast cancer in Japan[J].Breast Cancer, 2005,12(4):258-266.
[ 9 ] SAKKA E, PRENTZA A, KOUTSOURIS D.Classification algorithms for microcalcifications in mammograms (Review)[J].Oncol Rep, 2006,15 Spec no.:1049-1055.
[10] 李文萍, 王 颀, 张安秦, 等.乳腺导管内癌及伴微浸润的病理和临床特征[J].中华普通外科杂志, 2005,20(4):235-237.
[11] BERG W A, ARNOLDUS C L, TEFERRA E, et al.Biopsy of amorphous breast calcifications: pathologic outcome and yield at stereotactic biopsy[J].Radiology, 2001,221(2):495-503.
[12] BALL C G, BUTCHART M, MACFARLANE J K.Effect on biopsy technique of the breast imaging reporting and data system (BI-RADS) for nonpalpable mammographic abnormalities[J].Can J Surg, 2002,45(4):259-263.
[13] MICHEL S C, LÖW R, SINGER G, et al.Stereotactic Mammotome breast biopsy: routine clinical experience and correlation with BI-RADS--classification and histopathology[J].Praxis (Bern 1994), 2007,96(39):1459-1474.
[14] LIBERMAN L, ABRAMSON A F, SQUIRES F B, et al.The breast imaging reporting and data system: positive predictive value of mammographic features and final assessment categories[J].AJR Am J Roentgenol, 1998,171(1):35-40.
[15] TAN Y Y, WEE S B, TAN M P, et al.Positive predictive value of BI-RADS categorization in an Asian population[J] .Asian J Surg, 2004,27(3):186-191.
[16] 魏建南, 傅建民, 石 剑, 等.X线立体定位真空辅助活检术在早期年轻乳腺癌诊断中的应用[J].山东医药, 2012,52(14):41-43.
[17] TANG J, XIE X M, WANG X, et al.Radiocolloid in combination with methylene dye localization, rather than wire localization, is a preferred procedure for excisional biopsy of nonpalpable breast lesions[J].Ann Surg Oncol, 2011,18(1):109-113.
[18] 张奇兵, 管旌旌, 杨 明, 等.立位X线立体定位真空辅助空心针活检术在诊断乳腺微小钙化病变中的作用[J].中国老年学杂志, 2009,29(11):1379-1381.
[19] TONEGUTTI M, GIRARDI V.Stereotactic vacuum-assisted breast biopsy in 268 nonpalpable lesions[J].Radiol Med, 2008,113(1):65-75.
[20] ZUIANI C, MAZZARELLA F, LONDERO V, et al.Stereotactic vacuum-assisted breast biopsy: results, follow-up and correlation with radiological suspicion[J].Radiol Med, 2007,112(2):304-317.
[21] 葛玲玉.乳腺X线立体定位穿刺活检的现状、存在的问题及前景[J].国际外科学杂志, 2007,34(7):439-441.
[22] 李炳军, 张为群, 郝晓妍, 等.核素联合美蓝定位法与钢丝定位法在切除乳腺病灶中的对照研究[J].中国美容医学, 2013,22(20):2020-2022.
[23] 钱朝霞, 宋富珍, 刘 嵘, 等.立体定位导丝引导切检在临床未触及肿块的乳腺钼靶X线片内可疑恶性钙化灶中的应用[J].介入放射学杂志, 2010,19(10):780-783.
[24] JACKMAN R J, MARZONI F A JR, ROSENBERG J.False-negative diagnoses at stereotactic vacuum-assisted needle breast biopsy: long-term follow-up of 1,280 lesions and review of the literature[J].AJR Am J Roentgenol, 2009,192(2):341-351.
[25] MARKOPOULOS C, KOUSKOS E, REVENAS K, et al.Open surgical biopsy for nonpalpable breast lesions detected on screening mammography[J].Eur J Gynaecol Oncol, 2005,26(3):311-314.
[本文编辑] 廖晓瑜, 贾泽军
The application of localized biopsy with body surface marker guided by mammography in the diagnosis and treatment of non-palpable breast calcifications
XU Jing, JIANG Ying*, LIU Wen-shuai, QIU Yi-ran
Department of General Surgery, Zhongshan Hospital, Fudan University, Shanghai 200032, China
Objective: To investigate the clinical significance of localized biopsy with body surface marker guided by mammography in the diagnosis and treatment of non-palpable breast calcifications.Methods: The clinical data of 51 patients with non-palpable breast lesions and calcification shown by mammography, grade 4-5 in BI-RADS (breast imaging reporting and data system) from project collaboration units during January 2015 to May 2016 were retrospectively analyzed.Calcification excision biopsy guided by mammography was performed in all patients and further confirmed by pathological examination.Twenty-five patients’ biopsy were guided by stereotactic localizing wire, and 26 patients’ biopsy with body surface marker guided by mammography.Comparisons were made between the localization accuracy, size of negative resection margin and detection rate of malignant tumor.Results: In biopsy guided by stereotactic localizing wire, every patient underwent mammography 6 times on average, no complications occurred, and all patients had successful biopsy but one.The average negative resection margin was (30.6±8.7) mm, and the detection rate of malignant tumor was 11%.In biopsy with body surface marker guided by mammography, every patient underwent mammography 4 times on average, no complications occurred, and all patients had successful biopsy.The average negative resection margin was (29.1±5.6)mm, and the detection rate of malignant tumor was 20%.Conclusions: Under the cooperation of surgery and radiology, localized biopsy with body surface marker guided by mammography is high in accuracy, small in wound and low in cost, so it is more suitable for promotion in primary hospitals than biopsy guided by stereotactic localizing wire.
non-palpable breast lesion; calcification; localized biopsy
2016-09-28 [接受日期] 2017-01-16
上海市市级医院适宜技术项目(SHDC12014207).Supported by Projects of Appropriate Technology of Shanghai Municipal Hospitals (SHDC12014207).
徐 静,硕士,主治医师.E-mail: 13917596318@163.com
*通信作者(Corresponding author).Tel: 021-64041990-2563, E-mail: 13761802120@139.com
10.12025/j.issn.1008-6358.2017.20160919
R 816.6
A

