紫杉醇缓释微球对卵巢癌裸小鼠原位移植瘤的抑瘤效果
饶子亮, 王 弋, 王 诺, 熊仁清, 张明浩, 邝少松, 唐小江
(1. 广东省医学实验动物中心, 佛山528248; 2. 天大药业(珠海)有限公司, 珠海519070)
紫杉醇缓释微球对卵巢癌裸小鼠原位移植瘤的抑瘤效果
饶子亮1, 王 弋1, 王 诺1, 熊仁清2, 张明浩2, 邝少松1, 唐小江1
(1. 广东省医学实验动物中心, 佛山528248; 2. 天大药业(珠海)有限公司, 珠海519070)
目的 研究以新型聚乳酸磷酸酯聚合物(PLCE)为载体的紫杉醇缓释微球体内抑瘤效果。方法 采用HO8910人卵巢癌细胞株,手术接种于68只BALB/c裸小鼠卵巢包膜下。3周后,取肿块大小相对均匀的42只裸小鼠随机分成7组: 空白对照组、聚合物空白微球对照组、紫杉醇注射液组,紫杉醇缓释微球1中、低剂量组,紫杉醇缓释微球2中、低剂量组,每组6只。分组当日给药1次,连续观察一个月。结果 紫杉醇注射液抑瘤率57.0%; 紫杉醇缓释微球2中剂量抑瘤率77.1%,低剂量抑瘤率58.7%。结论 以新型PLCE为载体的紫杉醇缓释微球2(60 mg/kg)对卵巢癌裸小鼠原位移植瘤有良好的抑制效果,但是毒性仍然较大,需要进一步改进。
紫杉醇; 微球; 卵巢癌; 聚乳酸磷酸酯共聚物(PLCE)
紫杉醇是从红豆杉树(Taxaceae)的树皮中分离出的一种化疗药物[1],能诱导和促进微管蛋白聚合和组装, 从而阻止肿瘤细胞繁殖,是目前临床治疗公认的有效一线化疗药物[2]。然而,其应用的最大问题是不溶于水,临床上常用的紫杉醇针剂靠表面活性剂聚氧乙烯蓖麻油与脱水乙醇以1∶1的混合液溶解,该溶剂副作用大[3], 易引起严重的过敏反应。同时由于静脉给药, 时程长(连续24 h滴注),患者用药不便且使用受限。
以微型成球技术制备的微球作为药物递送系统具备了靶向给药、多种途径给药和缓释或控释药物等优点。在制备微球所用的载体材料中,可生物降解的合成高分子材料受到普遍重视并得到广泛应用[4]。本实验采用新型聚乳酸磷酸酯共聚物(PLCE)缓释微球, 并观察其应用于紫杉醇的体内抑瘤效果。
1 材料与方法
1.1 实验动物与饲养条件
6~7周龄雌性SPF级BALB/c裸小鼠76只, 由广东省医学实验动物中心提供[SCXK(粤)2013-0002]。饲养在广东省医学实验动物中心SPF级实验动物室IVC系统内[SYXK(粤)2013-0002], 室内保持20~26 ℃,相对湿度40%~70%,自由饮食, 饲料由广东省医学实验动物中心生产[SCXK(粤)2013-0002]。实验方案经广东省医学实验动物中心实验动物伦理委员会审查通过。
1.2 细胞
HO8910人卵巢癌细胞购自中国科学院上海细胞库。
1.3 主要试剂和仪器
主要仪器: CKX41型倒置显微镜, 日本Olympus公司; 311型恒温CO2孵箱,美国Thermo公司; SWCJ-2FD型超净工作台, 苏州净化有限公司; HWS-28型恒温水浴锅,上海一恒科技有限公司; MS 3 digital型振荡器,德国IKA公司; KDC-2046型低速冷冻离心机,科大创新股份有限公司中佳分公司。
主要试剂: DMEM培养液, 美国Gibco公司; 胎牛血清, 美国Hyclone公司; 青/链霉素双抗, 杭州吉诺生物医药有限公司; 胰酶, 杭州吉诺生物医药有限公司; PBS, 杭州吉诺生物医药有限公司。
1.4 实验方法
1.4.1 微球制备 紫杉醇缓释微球的制备工艺见图1,白色粉末, 成球形良好(图2)。紫杉醇缓释微球1,批号T130717,收率88.4%, 包封率90.7%, 颗粒直径14~76 μm; 紫杉醇缓释微球2, 批号T130822, 收率80.3%, 包封率99.1%, 颗粒直径14~76 μm。
1.4.2 接种 选用对数生长期的HO8910人卵巢癌细胞,经胰酶消化后,用DMEM培养基配成1× 107个/mL浓度的细胞悬液, 取裸小鼠8只, 注射于裸小鼠皮下0.2 mL/只。待皮下肿瘤直径达到1 cm时处死裸小鼠(约3周),切下瘤块除去坏死部分选用淡黄色或呈鱼肉状瘤组织置于生理盐水中剪成直径约为1 mm3的瘤块备用。68只裸小鼠戊巴比妥(45 mg/kg)腹腔注射麻醉,待裸小鼠麻醉后固定于操作板上,背部皮肤酒精消毒备皮,从左侧肋脊角下逐层切开背部皮肤、腹膜,进入腹腔,将卵巢掏出腹腔,用缝合线将大小为 1 mm3的移植瘤组织缝合至卵巢包膜下,操作结束后将卵巢送回腹腔,无菌丝线缝合腹膜和皮肤。
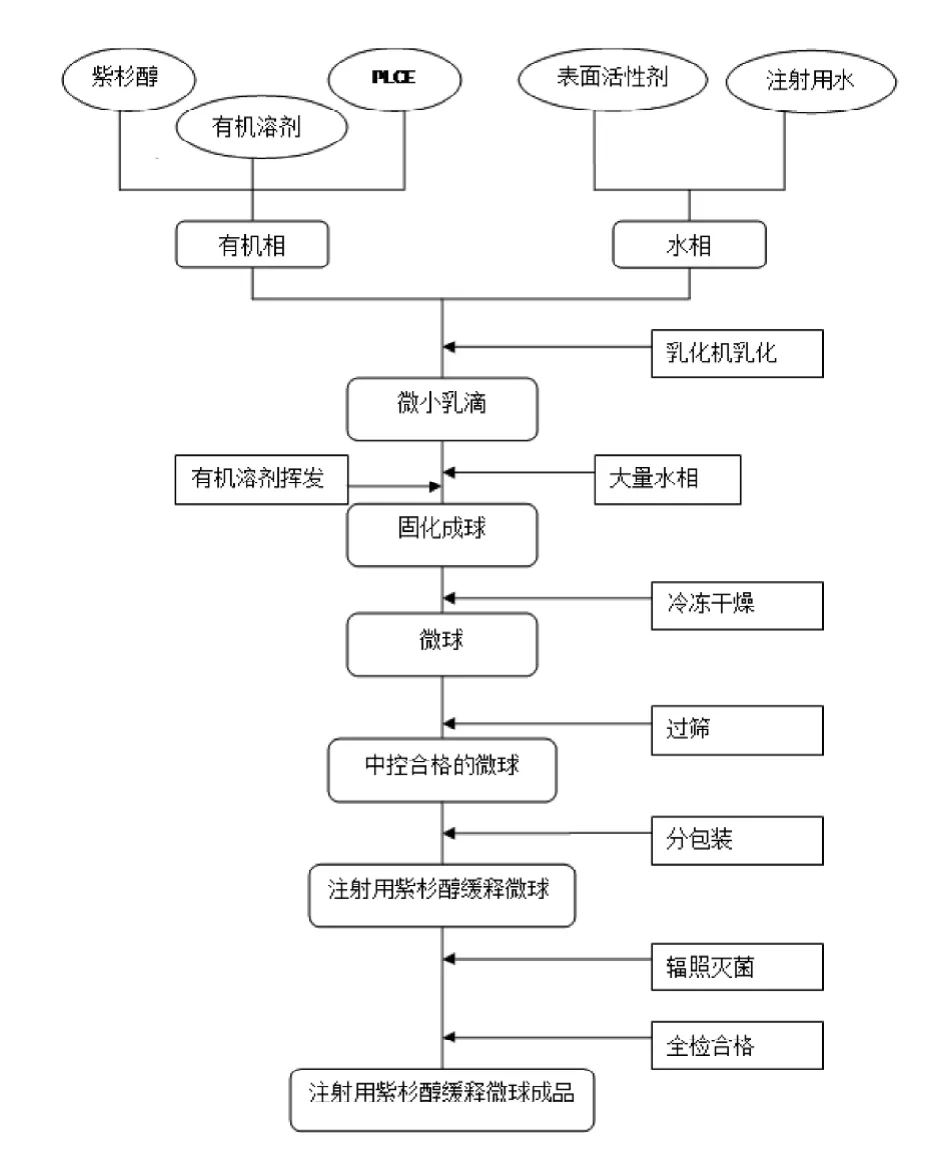
图 1 紫杉醇缓释微球制备工艺图

图 2 紫杉醇缓释微球形态电镜图
1.4.3 分组 3周后取肿块大小相对均匀的42只裸小鼠随机分成7组: 空白对照组、聚合物空白微球对照组(剂量为3 g/kg)、紫杉醇注射液组(剂量为50 mg/kg), 紫杉醇缓释微球1中、低剂量组(剂量分别为120 mg/kg、60 mg/kg), 紫杉醇缓释微球2中、低剂量组(剂量分别为120 mg/kg、60 mg/kg),每组6只。
1.4.4 给药 聚合物空白微球对照组裸小鼠腹腔注射150 mg/mL辅料微球注射液,紫杉醇注射液组裸小鼠腹腔注射2.5 mg/mL紫杉醇注射液,紫杉醇缓释微球1、2中、低剂量组裸小鼠分别腹腔注射6 mg/mL、3 mg/mL紫杉醇缓释微球注射液, 注射量为0.2 mL/10 g体质量,分组当日给药1次,每日观察1次,连续观察一个月。
1.4.5 观测指标 每日 1次观察裸小鼠精神状态、活动力、反应、大小便形态、有无腹水产生、有无腹泻等;每周测量2次动物体质量; 实验结束时,取出肿瘤完整剥离后测量肿瘤体积(V=1/ 2ab2,a、b分别为最长和最短的两个直径),并称重肿瘤,计算肿瘤抑制率(%):

1.5 数据处理
2 结果
2.1 一般情况观察和体质量
紫杉醇注射液组和紫杉醇缓释微球组给药初期动物出现匍匐行走、精神萎靡、明显消瘦等症状,大便无稀烂。紫杉醇缓释微球组1、2中、低剂量组均有死亡。其他各组存活小鼠平均体质量均有所增加, 但组间无显著性差异(P>0.05)(表1)。
2.2 肿瘤体积和瘤重
辅料微球组肿瘤体积、瘤重与空白对照组比较无显著性差异(P>0.05)。与空白对照组比较,紫杉醇注射液组、紫杉醇缓释微球2低剂量组、中剂量组的肿瘤体积、瘤重显著降低(P<0.05)(表1)。
2.3 抑瘤率
紫杉醇注射液抑瘤率57.0%; 紫杉醇缓释微球2中剂量抑瘤率77.1%, 低剂量抑瘤率58.7%; 与空白对照组比较, 紫杉醇注射液组、紫杉醇缓释微球2低剂量组、紫杉醇缓释微球2中剂量组肿瘤重量显著降低(P<0.05); 与紫杉醇注射液组比较, 紫杉醇缓释微球2中剂量组肿瘤重量显著降低(P<0.05)(表1)。
3 讨论
紫杉醇是目前临床公认的卵巢癌一线化疗药物[5-9]。关于紫杉醇诱导肿瘤细胞凋亡的机制,普遍认为与其扰乱细胞微管系统有关。该药物导致有丝分裂停滞在G2 /M期,且随药物作用时间延长而阻滞作用增强[10],短时间内药物代谢完毕, 给药期间不能对肿瘤进行持续杀伤作用。另外, 紫杉醇在水中的溶解度约为0.25 μg/mL, 因而其体内有效利用率较低, 因此紫杉醇的有效治疗量(135 mg /m2) 相对较大,而高浓度的表面活性剂易引起患者过敏性反应,同时静脉滴注给药,一过性给药剂量过大,对机体的毒副作用过大。
抗肿瘤药物多具有毒性, 而且溶解性较差, 体内的生物利用度不高, 不适宜制成口服制剂,临床上常用的剂型为注射用溶液剂和冻干粉针剂,给药途径也比较单一,一般为静脉滴注, 给药过程复杂漫长。静脉滴注给药时,药物一过性给药剂量较大,对机体的整体伤害大,并且药物在短时间内代谢完毕,给药间期不能对肿瘤起到持续杀伤作用。同时,为解决药物的低溶解性, 所采用的溶剂往往也具有毒性,易引起多种不良反应。缓释给药制剂除了能够避免上述注射剂的不足之处,能够在特定部位持续释放药物,使药物的体内水平始终维持在有效浓度, 对于肿瘤等顽固病灶具有强大杀伤力。
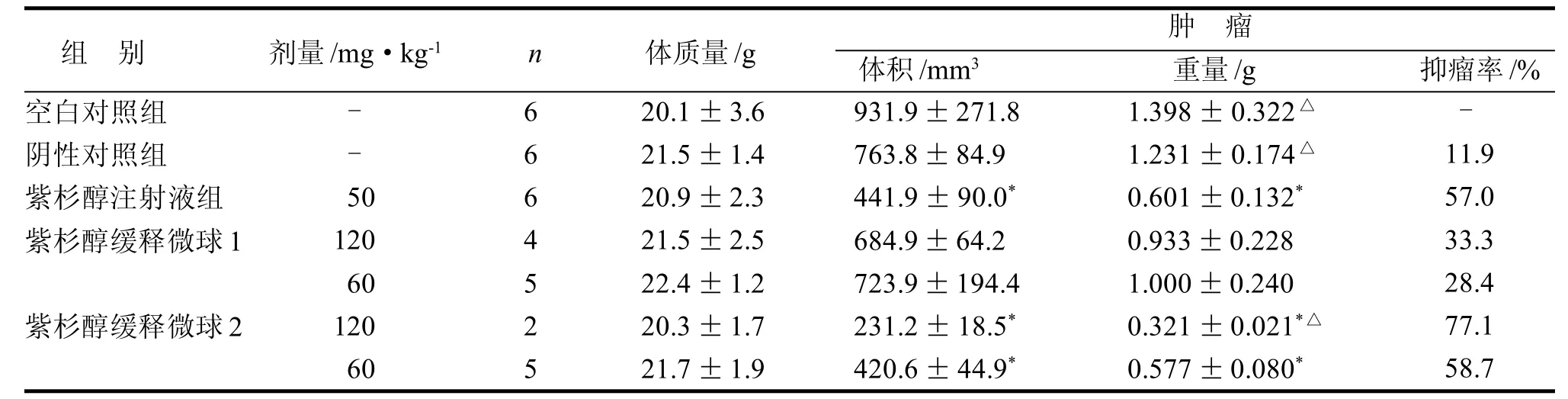
表 1 紫杉醇缓释微球对卵巢癌裸小鼠原位移植瘤的影响Table 1 Effect of PLCE on ovarian cancer orthotopic transplantation
本研究中的紫杉醇长效缓释微球, 是一种用生物可降解聚合物制成的缓释微球制剂。制备的2个批次紫杉醇缓释微球为白色粉末, 成球形好, 收率均大于80%, 包封率均大于90%, 颗粒直径14~76 μm。实验结果显示, 2个批次的紫杉醇缓释微球在60 mg/kg的剂量下动物存活情况较好, 紫杉醇缓释微球2的抑瘤率高于紫杉醇缓释微球1, 可能与紫杉醇缓释微球2的包封率更高有关。紫杉醇缓释微球2(60 mg/kg)对卵巢癌裸小鼠原位移植瘤有良好抑制效果, 但毒性仍然较大, 需进一步改进。
[1] Vaughn DJ, Brown AW Jr, Harker WC, et al. Multicenter phase II study of estramustine phosphate plus weekly paclitaxel in patientes with androgen-independent prostate carcinoma[J]. Cancer, 2004, 100(4):746-750.
[2] 张烁, 郭文彬, 朱梅. 载紫杉醇缓释微球的制备及其体外抑瘤效果的观察[J]. 山东大学学报: 医学版, 2011, 49(12): 39-47.
[3] 王美清. 紫杉醇的临床毒副作用分析及对策[J]. 中国热带医学, 2007, 7(2):237-239.
[4] Ruan G, Feng SS. Preparation and characterization of poly (lactic acid)-poly(ethylene glycol)-poly(lactic acid) (PLAPEC-PLA) micro-spheres for controlled release of paclitaxel [J]. Biomaterials, 2003, 24(27):5037-5044.
[5] Liu Z, Zhu YY, Li ZY, et al. Evaluation of the efficacy of paclitaxel with curcumin combination in ovarian cancer cells [J]. Oncol Lett, 2016, 12(5):3944-3948.
[6] Tyulyandina A, Harrison D, Yin W, et al. Alofanib, an allosteric FGFR2 inhibitor, has potent effects on ovarian cancer growth in preclinical studies[J]. Invest New Drugs, 2016(3). [Epub ahead of print]
[7] Ai B, Bie Z, Zhang S, et al. Paclitaxel targets VEGF-mediated angiogenesis in ovarian cancer treatment[J]. Am J Cancer Res, 2016, 6(8):1624-1635.
[8] Osman MA, Elkady MS, Nasr KE. Weekly Paclitaxel versus three-weekly Paclitaxel in recurrent platinum-resistant epithelialovarian and peritoneal cancers: A phase iii study [J]. Clin Med Insights Oncol, 2016, 10:35-41.
[9] Ishiguro K, Zhu YL, Lin ZP, et al. Cataloging antineoplastic agents according to their effectiveness against platinumresistant and platinum-sensitive ovarian carcinoma cell lines [J]. J Transl Sci, 2016, 2(2):117-124.
[10] 余志英, 李丽文, 杜静, 等. 紫杉醇诱导卵巢癌细胞凋亡及细胞周期改变的研究[J]. 中国医师杂志, 2006, 18(3):322-324.
Inhibition of Paclitaxel-Poly Lactic Acid Phosphate(PLCE) Microspheres on Growth of Ovarian Cancer Transplanted in Nude Mice
RAO Zi-liang1, WANG Yi1, WANG Nuo1, XIONG Ren-qing2, ZHANG MING-hao2, LOU Cai-xia1, KUANG Shao-song1, TANG Xiao-jiang1
(1. Guang Dong Medical Laboratory Animal Center, Foshan 528248, China; 2. Tianda Pharmaceuticals Limited, Zhuhai 519070, China)
ObjectiveTo observe the antitumor effect of paclitaxel- novel copolymer of poly lactic acid phosphate (PLCE) microspheres on proliferation of ovarian cancer.MethodsThe human overiam cancer (HO8910) were implanted into the ovarian capsule of 68 nude mice. Three weeks later, 42 tumor bearing nude mice were randomly divided into 7 groups as follow, blank control group, negative control group, paclitarel injection group, paclitaxel-PLCE microspheres 1 high and low dose group, and paclitaxel-PLCE microspheres 2 high and low dose group, with 6 nude mice in each group. The drug was administered 1 time a day, and the growth of the tumor were continuously observed for one month.ResultsThe tumor inhibition rate of paclitarel injection was 57.0%, and tumor inhibition rate of paclitaxel-PLCE microspheres 2 high and low dose group were 77.1% and 58.7% respectively.ConclusionPaclitaxel-PLCE microspheres have a strong inhibitory effect on HO8910 ovarian cancer transplanted in nude mice.
Paclitaxel; Microspheres; Ovarian cancer; Poly lactic acid phosphate (PLCE)
R965.1 Q95-33
A
1674-5817(2017)02-0136-04
10.3969/j.issn.1674-5817.2017.02.010
2016-11-14
广东省科技计划项目(2016A030303027、2013B060300033、2016A030303026)
饶子亮(1983-), 男, 副主任药师, 从事抗肿瘤药物筛选研究。E-mail: 343806059@qq.com
邝少松(1973-), 女, 高级兽医师, 主要从事比较医学研究。E-mail: kuangss@126.com

