Krüppel样因子5和肿瘤坏死因子受体超家族成员11a在宫颈癌组织及细胞中的表达及其作用
常凌雅,马 冬,李 鸥,王新月,张 琪,张丽杰,闫锡钊,郑寰宇
华北理工大学 唐山工人医院妇二科,河北唐山 063000
·论 著·
Krüppel样因子5和肿瘤坏死因子受体超家族成员11a在宫颈癌组织及细胞中的表达及其作用
常凌雅,马 冬,李 鸥,王新月,张 琪,张丽杰,闫锡钊,郑寰宇
华北理工大学 唐山工人医院妇二科,河北唐山 063000
目的 探讨Krüppel样因子5 (KLF5)和肿瘤坏死因子受体超家族成员11a(TNFRSF11a)在宫颈癌组织中的表达及对宫颈癌细胞增殖、迁移和侵袭的作用。方法 利用基因芯片筛查宫颈组织中细胞应答炎症反应的相关基因mRNA的表达。采用实时荧光定量PCR对芯片检测的结果进行验证。免疫双荧光染色检测宫颈组织中KLF5和TNFRSF11a的共表达。在人宫颈癌HeLa细胞中,采用脂质体转染特异性小分子干扰RNA分别敲低KLF5和TNFRSF11a的表达,构建KLF5超表达腺病毒,感染细胞过表达KLF5。Western blot检测细胞内相关蛋白水平变化。采用双荧光素酶报告基因检测转录因子KLF5对TNFRSF11a的表达调控作用。CCK8和Transwell实验检测细胞增殖和迁移侵袭情况。临床分析TNFRSF11a的mRNA表达与宫颈癌临床病理参数的关系。结果 基因芯片结果证实宫颈鳞癌组织中基因TNFRSF11a、KLF5较正常宫颈组织表达上调(P=0.002,P=0.045),实时荧光定量PCR结果证实与正常宫颈组织相比,宫颈上皮内瘤变(CIN) Ⅰ、CIN Ⅱ-Ⅲ、宫颈鳞癌组织中KLF5和TNFRSF11a的mRNA表达结果均上调(KLF5:F=32.79,P=0.018,P=0.014,P=0.011;TNFRSF11a:F=36.72,P=0.013,P=0.010,P=0.009)。免疫双荧光染色结果证实与正常宫颈组织相比,CIN Ⅰ、CIN Ⅱ-Ⅲ、宫颈鳞癌组织中KLF5和TNFRSF11a的蛋白表达结果均上调(KLF5:F=42.38,P=0.014,P=0.008,P=0.002;TNFRSF11a:F=35.42,P=0.021,P=0.012,P=0.004)。体外实验证实KLF5靶向调控TNFRSF11a的表达并促进宫颈癌细胞的增殖和迁移侵袭。临床分析显示TNFRSF11a的mRNA表达与肿瘤病理分级、临床分期、肌层浸润深度、淋巴结转移正相关(P<0.05)。结论 KLF5和TNFRSF11a与宫颈癌相关;KLF5通过上调TNFRSF11a的表达促进宫颈癌细胞的增殖和侵袭、转移。
宫颈癌;Krüppel样因子5;肿瘤坏死因子受体超家族成员11a;增殖;侵袭
ActaAcadMedSin,2017,39(2):196-205
近年来宫颈癌发病年轻化的趋势较为明显,放化疗及靶向新药物治疗预后仍有约30%的患者出现局部复发或远处转移[1]。由于宫颈癌的发病机制仍不明确,因此,适当的个体化宫颈癌治疗仍难以实现。Krüppel样因子5(Krüppel like factors 5,KLF5)作为重要的转录因子可以通过调控靶基因影响细胞的增殖、迁移侵袭等生物学功能[2]。已有报道KLF5在宫颈癌的发生发展过程中发挥促进作用[3],而其在宫颈癌中低表达也曾被报道[4],所以KLF5对宫颈癌的作用仍需探讨。肿瘤坏死因子受体超家族(tumor necrosis factor receptor superfamily,TNFRSF)11a是TNFRSF的成员之一,其在骨转移较多发生的乳腺癌[5]、前列腺癌细胞[6]中被发现高表达,且作为癌症骨转移患者的一个不良预后因素[5]。同时研究显示肿瘤坏死因子超家族(tumor necrosis factor superfamily,TNFSF)11/TNFRSF11a可促进宫颈癌细胞HeLa和SiHa的增殖[7],提示TNFRSF11a具有促进宫颈癌发生发展的潜在可能性。然而KLF5和TNFRSF11a在宫颈癌组织中的表达和其相互关系是否影响肿瘤的发生发展尚不清楚。因此,本研究旨在通过临床分析KLF5和TNFRSF11a在宫颈癌变中的表达及采用体外实验研究KLF5是否通过调控TNFRSF11a影响宫颈癌细胞生物学功能,从而为宫颈癌的临床诊断、治疗及预后提供分子靶点。
材料和方法
芯片组织标本 用于分析基因差异表达的3例宫颈鳞癌组织及3例正常宫颈组织均来自唐山市工人医院,采用简单随机抽样的抽签法选取,分别将标本组织提取总RNA送公司用于基因芯片检测。
宫颈组织标本 选取2013年3月至2015年6月唐山市工人医院行宫颈活检及手术治疗病例,临床资料完整,且术前未接受放化疗治疗,共147例,其中正常宫颈43例、宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN)66例(其中CIN Ⅰ21例、CIN Ⅱ-Ⅲ 45例)、宫颈鳞癌(cervical squamous cell carcinoma,CSCC)38例。患者年龄、初潮年龄、性伴侣数、妊娠次数、流产次数、抽烟及饮酒情况差异均无统计学意义(P>0.05)。所有研究标本的收集均获得患者知情同意,并经两位病理医师确诊诊断。根据WHO细胞分化标准,高、中分化者24例、低分化者14例;国际妇产科联盟分期,Ⅰ期26例、Ⅱ期12例。有淋巴结转移11例、无淋巴结转移者27例。
基因芯片检测 Trizol试剂提取样本总RNA,采用NanoDrop- 1000定量及电泳检测RNA完整性。应用Agilent Scanner G2505C扫描Affymetrix表达谱芯片结果,原始数据用Command Console Software 4.0读取,质控合格的数据归一化处理采用NimbleScan软件,用RMA算法进行计算。差异基因筛选标准为变化幅度≥2为上调基因,变化幅度<-2为下调基因。采用GO分析差异表达基因的生物学功能。实验由上海康成生物有限责任公司完成。
体外细胞培养 HeLa人宫颈癌细胞株由河北医科大学附属第四医院肿瘤研究所馈赠,分别以含10%胎牛血清RPMI 1640培养基、5%二氧化碳、37℃恒温培养箱中常规培养,细胞密度4×104/L,取对数生长期细胞用于以下实验。293A细胞由河北医科大学附属第四医院肿瘤研究所馈赠,高糖伯克改良伊格尔培养基+10%胎牛血清,5%二氧化碳,37℃恒温培养箱中培养。
免疫双荧光法检测KLF5和TNFRSF11a的表达 所有宫颈组织标本均经4%多聚甲醛液固定,固定好的组织经乙醇脱水,二甲苯透明,石蜡包埋,切片厚4 μm。以上标本采用间接免疫荧光法,按说明书操作。KLF5兔抗人多克隆抗体,TNFRSF11a鼠抗人多克隆抗体,Fluorescein标记的荧光二抗和Rhodamine标记的荧光二抗(KPL公司)及4’,6-二脒基- 2-苯基吲哚(Sigma公司)核染色。激光共聚焦荧光显微镜下观察摄片,Image Pro-Plus 6.0(Media Cybernetics,Inc.,U.S.A)图像分析软件分析KLF5和TNFRSF11a表达的荧光强度。
实时荧光定量PCR检测mRNA表达 按Trizol试剂盒说明书提取组织或细胞总RNA,以RNA为模板,采用PCR逆转录试剂盒(美国Invitrogen 公司)逆转录合成cDNA后,采用 实时荧光定量PCR反应试剂盒(美国Invitrogen 公司)进行实时荧光定量PCR反应,内参为β-actin。应用 Primer Premier 软件,分别设计上下游引物:KLF5:正向引物:5’-AAGCTACAATACGCTTGGCCT- 3’;反向引物:5’-TTGGAGAG- ACTGGGATTGC- 3’;TNFRSF11a:正向引物:5’-CC- GCCTAAGTGGAGATAAGGAAA- 3’;反向引物:5’-AAGTTCATCACCTGCCCGCT- 3’;肾连蛋白:正向引物:5’-GTGGCCCAGGCAAATAGTGT- 3’;反向引物:5’-GTTGGCACACAGGCTGACA- 3’;细胞因子信号转导抑制因子5:正向引物:5’-CTCCTTCGGCCTTCACCTAC- 3’;反向引物:5’-ATAAAATCGTGACCAATAGCAGGC- 3’;睫状神经营养因子受体:正向引物:5’-GCGCCCGAGAAAGGACTCTA- 3’;反向引物:5’-AGCAGCCATCTCTTCACCAC- 3’;C-X-C趋化因子配体13:正向引物:5’-ACTCTGCTAATGAGCCTGGAC- 3’;反向引物:5’-CCTTGGACTGGAGAGAGGCT- 3’;磷脂酶C β脂:正向引物:5’-GATGAGCCCAGATGGCCG- 3’;反向引物:5’-AGTTGAGTCATCATCCCACTTGA- 3’;白细胞介素6信号传感器:正向引物:5’-CCTGTGACTTTCAAGGGAACTT- 3’;反向引物:5’-GATTCAGGGCTTCCTGGTCC- 3’;β-actin:正向引物:5’-GAAAGCCTGCCGGTGACTAA- 3’;反向引物:5’-AGGAAAAGCATCACCCGGAG- 3’。扩增反应条件:95℃、2 min,95℃、15 s,72℃、35 s,40个循环。以公式2-△△Ct(Ct为循环阈值)计算目的基因mRNA的表达水平,每组实验重复3次。
体外细胞实验 河北医科大学生物化学研究室馈赠绿色荧光蛋白表达的腺病毒和KLF5表达的腺病毒。293A细胞接种于培养皿,细胞达60%~80%汇合时,加入病毒原液,24 h后观察荧光表达,3~4 d后约90%细胞表达荧光时离心收集细胞,经反复冻融3次后,高速离心收集上清液得到较高滴度的重组腺病毒,-80℃保存备用。KLF5基因过表达采用腺病毒感染,KLF5和TNFRSF11a基因敲低采用Lipo2000脂质体介导靶向短发夹RNA转染HeLa细胞。其中KLF5特异性小分子干扰RNA为:正向引物:5’-C- GAUUACCCUGGUUGCACA- 3’,反向引物:5’-AAG- CUCACCUGAGGACUCA- 3’;TNFRSF11a特异性小分子干扰RNA:正向引物:5’-GATCCCCGCGCTGACAG- CTAATTTG- 3’,反向引物:5’-AGCTTAAAAAGCGCTGACAGCTAATTT- 3’。非特异性小分子干扰RNA购自江苏吉玛公司。按照Lipo2000说明书操作转染细胞。
Western blot方法检测细胞蛋白表达 兔抗KLF5多克隆抗体和鼠抗TNFRSF11a抗体(Sigma 公司);辣根过氧化物酶标记的羊抗兔IgG、羊抗鼠IgG二抗,增强型化学发光底物试剂盒(江苏碧云天生物技术研究所);细胞裂解法提取细胞总蛋白,采用BCA法检测总蛋白含量,10% SDS-PAGE凝胶电泳,硝酸纤维膜转印,5%脱脂奶粉封闭,一抗(1∶100稀释)4℃过夜孵育、洗膜、二抗(1∶2000稀释)避光室温孵育,洗膜,显影。β-actin为内参蛋白。通过Image J图像分析软件分析条带灰度值,以目标蛋白条带灰度值/内参条带灰度值表示目的基因相对蛋白表达水平,每组实验重复3次。
双荧光素酶报告基因分析 克隆TNFRSF11a近端启动子+1~2000 bp序列并插入到荧光素酶报告基因质粒(pGL3-basic)中。在24孔板中培养293A细胞,当细胞密度为60%~80%时进行转染。分别转染TNFRSF11a启动子报告基因质粒0.6 μg及内参照pRL-β-actin 5 ng。每组设3个复孔。每孔转染后继续培养24 h,细胞分别感染绿色荧光蛋白腺病毒和KLF5腺病毒4 h。转染48 h后应用双荧光素报告基因检测荧光素酶活性。
CCK- 8法检测细胞生长活性 HeLa细胞接种于96孔板,每孔100 μl细胞悬液,待细胞贴壁后进行分组培养,每组设3个复孔,分别培养24、48、72、96 h后,每孔加入10 μl CCK- 8溶液,设置1个无细胞孔调零,培养箱内继续孵育4 h,酶标仪在450 nm处测定光密度值,绘制细胞生长曲线。
Transwell检测细胞的侵袭能力 将存活的HeLa细胞种入已铺好Matrigel基质胶的Transwell小室上层,行无血清培养36 h,吸去孔中培养基,用PBS洗2次,4%多聚甲醛固定30 min,稍微晾干后用结晶紫染色20 min,用棉签擦去上室面上的细胞,PBS洗3次,取出小室,晾干,镜下拍照。100倍显微镜下计数上下左右中5个随机不同视野的穿膜细胞数,取平均值。实验重复3次。细胞迁移实验:方法同侵袭实验,但Transwell上室不用基质胶处理,观察时间为24 h。
统计学处理 应用SPSS 19.0软件进行数据分析,计数资料采用百分率表示,组间对比采用χ2检验;计量资料均经正态性及方差齐性检验,以均数±标准差表示,两组间比较采用t检验,多组间比较采用单因素方差分析,组间两两比较采用q检验,采用Spearman秩相关分析,P<0.05为差异有统计学意义。
结 果
宫颈组织基因芯片结果分析及验证 在质量保证的前提下,采用包括22 000个人类基因的 oligo 芯片。GO分析结果显示,与正常组织相比,宫颈鳞癌组织中细胞应答炎症反应的相关基因上调表达(图1、表1)。采用实时荧光定量PCR实验对芯片检测结果中的8个上调基因进行验证,结果显示宫颈癌组织中KLF5、Npnt、Socs5、TNFRSF11a、Cxcll3、Il6st较正常组织表达显著上调(t=5.230,P=0.035;t=6.343,P=0.024;t=7.231,P=0.019;t=17.460,P=0.003;t=8.548,P=0.013;t=11.998,P=0.007),Cntfr、Plcb1表达有上调趋势,但差异无统计学意义(t=3.721,P=0.065;t=4.109,P=0.054)(图2)。
宫颈组织中KLF5和TNFRSF11a的mRNA表达水平及相关性 与正常对照组相比,KLF5和TNFRSF11a的mRNA在CINⅠ组、CINⅡ-Ⅲ组和CSCC组中的表达水平逐渐升高,差异有统计学意义(KLF5:F=32.79,P=0.018,P=0.014,P=0.011;TNFRSF11a:F=36.72,P=0.013,P=0.010,P=0.009),与CINⅡ-Ⅲ组相比,CSCC组中KLF5和TNFRSF11a的mRNA表达水平增高,差异有统计学意义(KLF5:q=2.792,P=0.018;TNFRSF11a:q=2.801,P=0.012)(图3)。采用Spearman法检验不同宫颈组织中KLF5与TNFRSF11a的mRNA表达的相关性,在CINⅠ组中KLF5与TNFRSF11a的mRNA表达无相关性;在CINⅡ-Ⅲ组中KLF5与TNFRSF11a的mRNA表达呈正相关(r=0.360,P=0.015);在宫颈癌组织中KLF5与TNFRSF11a的mRNA表达呈正相关(r=0.353,P=0.030)。
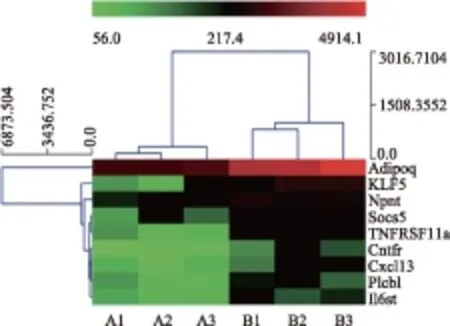
Adipoq:脂联素;KLF5:Krüppel样因子5;Npnt:肾连蛋白;Socs5:细胞因子信号转导抑制因子5;TNFRSF11a:肿瘤坏死因子受体超家族成员11a;Cntfr:睫状神经营养因子受体;Cxcl13:C-X-C趋化因子配体13;Plcb1:磷脂酶Cβ1;Il6st:白细胞介素6信号传感器
Adipoq:adiponectin;KLF5:Krüppel like factors 5;Npnt:neph- ronectin;Socs5:suppressor of cytokine signaling 5;TNFRSF11a:tumor necrosis factor receptor superfamily member 11a;Cntfr:ciliary neurotrophic factor receptor;Cxcl13:C-X-C motif chemokine ligand 13;Plcb1:phospholipase C beta 1;Il6st:interleukin 6 signal transducer
A. 正常宫颈组织;B. 宫颈癌组织
A. normal cervical tissues;B. cervical squamous carcinomas tissues
图 1 宫颈组织基因芯片测序图
Fig 1 Heatmap of genes involved in cervical tissues

表 1 正常宫颈组织及宫颈癌组织基因表达差异分析

CSCC:宫颈鳞癌;与正常对照组比较,aP=0.035;bP=0.024;cP=0.019;dP=0.003;eP=0.013;fP=0.007
CSCC:cervical squamous cell carcinoma;aP=0.035,bP=0.024,cP=0.019,dP=0.003,eP=0.013,fP=0.007 compared with control group
图 2 基因实时荧光定量PCR检测结果
Fig 2 Result of gene chip in reverse transcription quantitative real-time polymerase chain reaction
宫颈组织中KLF5和TNFRSF11a的表达 4’,6-二脒基- 2-苯基吲哚免疫荧光染色试剂盒检测不同人宫颈组织中的KLF5和TNFRSF11a的表达显示,KLF5和TNFRSF11a共表达于宫颈组织,随着宫颈癌变的进展,KLF5和TNFRSF11a表达增高,荧光强度增加,差异有统计学意义(KLF5:F=42.38,P=0.014,P=0.008,P=0.002;TNFRSF11a:F=35.42,P=0.021,P=0.012,P=0.004)(图4)。

CINⅠ:宫颈上皮内瘤变Ⅰ级;CINⅡ-Ⅲ:宫颈上皮内瘤变Ⅱ-Ⅲ级;CSCC:宫颈鳞癌;与正常对照组相比,aP=0.018,bP=0.013,cP=0.014,dP=0.010,eP=0.011,fP=0.009;与CINⅡ-Ⅲ组相比,gP=0.018,hP=0.012
CINⅠ:cervical intraepithelial neoplasiaⅠ;CINⅡ-Ⅲ:cervical intraepithelial neoplasiaⅡ-Ⅲ;CSCC:cervical squamous cell carcinoma;aP=0.018,bP=0.013,cP=0.014,dP=0.010,eP=0.011,fP=0.009 compared with control group;gP=0.018,hP=0.012 compared with CINⅡ-Ⅲ group
图 3 KLF5和TNFRSF11a在不同宫颈组织中的mRNA表达
Fig 3 The mRNA expressions of KLF5 and TNFRSF11a in different cervical tissues
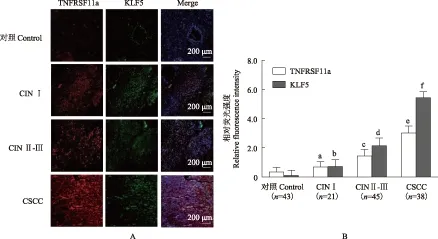
与正常对照组相比,aP=0.014,bP=0.021,cP=0.008,dP=0.012,eP=0.002,fP=0.004
aP=0.014,bP=0.021,cP=0.008,dP=0.012,eP=0.002,fP=0.004 compared with control group
A. KLF5(红色)和TNFRSF11a(绿色)的免疫荧光染色结果(×200);B.不同宫颈组织免疫荧光染色后荧光强度统计结果
A. immunofluorescence staining of KLF5 (red) and TNFRSF11a (green) (×200);B. the statistical results of fluorescence intensity for different cervical tissue
图 4 不同宫颈组织中KLF5和TNFRSF11a的表达
Fig 4 Expressions of KLF5 and TNFRSF11a in different cervical tissue
KLF5靶向调控TNFRSF11a的表达 HeLa细胞分别感染腺病毒过表达KLF5或采用脂质体转染小干扰RNA敲低KLF5表达,经检验转染效率达70%~80%。PCR和Western blot研究结果显示:在基础水平和TNF-α诱导情况下,HeLa细胞过表达KLF5均能够显著增加TNFRSF11a的转录(图5A)和蛋白翻译水平(与绿色荧光蛋白表达的腺病毒组相比,F=15.32,P=0.034,P=0.029,P=0.009)(图5C);相反,敲低HeLa细胞KLF5的表达能够阻止基础水平和TNF-α诱导的TNFRSF11a的转录(图5B)和蛋白翻译水平(与非特异性小分子干扰RNA组相比,F=20.01,P=0.012,P=0.015,P=0.022)(图5D)。荧光素酶报告基因显示293A细胞感染KLF5表达腺病毒后荧光素酶活性明显增强(t=4.11,P=0.015)(图5E)。
KLF5依赖TNFRSF11a的表达促进HeLa细胞的增殖、迁移和侵袭 CCK8和Transwell实验证实,尽管在HeLa细胞中感染KLF5,腺病毒过表达KLF5可促进HeLa细胞的增殖和迁移侵袭,脂质体介导转染TNFRSF11a特异性小分子干扰RNA 敲低TNFRSF11a的内源性表达能够抑制HeLa细胞的增殖和迁移侵袭,但是敲低TNFRSF11a后再过表达KLF5仍然抑制HeLa细胞的增殖、迁移和侵袭能力[与对照组相比,F48 h=10.04,P=0.072,P=0.036,P=0.057;F72 h=19.16,P=0.061,P=0.029,P=0.017;F96 h=23.51,P=0.012,P=0.022,P=0.020(图6B);与对照组相比,F=35.21,P=0.035,P=0.015,P=0.049(图6C);与对照组相比,F=28.96,P=0.047,P=0.011,P=0.039(图6D)]。
TNFRSF11a的mRNA表达与宫颈癌临床病理参数的关系 将宫颈癌组中TNFRSF11a的mRNA表达结果与临床病理参数进行相关性分析,结果显示TNFRSF11a mRNA的表达与肿瘤病理分级、临床分期、肌层浸润深度和淋巴结转移均呈正相关(P<0.05)(表2)。
讨 论
宫颈癌在全球女性最常见的癌症中排第2位[1],是由前体上皮组织从低度鳞状上皮内病变到高度鳞状上皮内损伤,并最终导致癌变[8]。宫颈癌具有较强的侵袭迁移能力,其局部复发和远处转移影响宫颈癌患者的治疗效果及预后,但有关其增殖及侵袭迁移的分子通路尚不清楚。
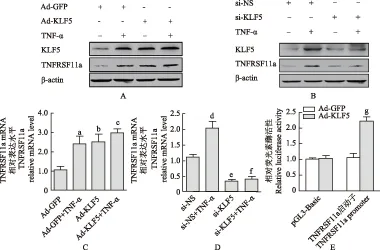
Ad-KLF5:KLF5重组腺病毒;Ad-GFP:绿色荧光蛋白重组腺病毒;TNF-α:肿瘤坏死因子α;si-KLF5:KLF5特异性小分子干扰RNA;si-NS:非特异性小分子干扰RNA;pGL3-Basic:荧光素酶报告基因质粒3-Basic;与Ad-GFP组相比,aP=0.034,bP=0.029,cP=0.009;与si-NS组相比,dP=0.012,eP=0.015,fP=0.022;与pGL3-Basic组相比,gP=0.015
Ad-KLF5:adenovirus containing-KLF5;Ad-GFP:adenovirus containing-green fluorescent protein;TNF-α:tumor necrosis factor-α;si-KLF5:small interfering-KLF5;si-NS:small interfering-non-specificity RNA;pGL3-Basic:luciferase reporter gene plasmid 3-Basic;aP=0.034,bP=0.029,cP=0.009 compared with Ad-GFP group;dP=0.012,eP=0.015,fP=0.022 compared with si-NS group;gP=0.015 compared with pGL3-Basic group
A. 过表达KLF5后HeLa细胞内KLF5、TNFRSF11a蛋白水平;B. 敲低KLF5后HeLa细胞内KLF5、TNFRSF11a蛋白水平;C. 过表达KLF5后HeLa细胞内TNFRSF11a的mRNA水平;D. 敲低KLF5后HeLa细胞内TNFRSF11a的mRNA水平;E. 双荧光素酶报告基因检测在293A 细胞中KLF5激活TNFRSF11a基因启动子
A. the protein level of KLF5 and TNFRSF11a in HeLa cells after overexpression KLF5;B. the protein level of KLF5 and TNFRSF11a in HeLa cells after knockdown KLF5;C. the mRNA level of TNFRSF11a in HeLa cells after overexpression KLF5;D. the mRNA level of TNFRSF11a in HeLa cells after knockdown KLF5;E. the TNFRSF11a gene promoter was significantly activated by KLF5 in 293A cells,as determined by dual-luciferase assays
图 5 KLF5调控TNFRSF11a的表达
Fig 5 KLF5 targeting regulated the expression of TNFRSF11a
炎症在肿瘤发生发展过程中发挥重要作用,本研究选取正常宫颈组织及宫颈癌组织行基因芯片及实时荧光定量PCR检测,细胞应答炎症反应的相关基因TNFRSF11a、Il6st、Cxcll3、Socs5、KLF5、Npnt在宫颈癌中表达较正常组织显著上调。有研究发现多个信号通路参与宫颈癌的发生与发展,如核转录因子κΒ信号通路[9]、Janus激酶-信号传导及转录激活因子信号通路[10]、细胞外调节MAP激酶信号通路[11],激活的信号转导通路将胞外信号转变为核内信号,通过转录因子的激活导致下游基因的表达或抑制,并发挥相应的生物学作用。转录因子KLF5被发现通过激活ERK通路促进乳腺癌的生长[12],TNFRSF11a被其配体激活后可诱导细胞外调节MAP激酶通路调控多种病理生理过程[13]。因此有必要进一步研究KLF5和TNFRSF11a是否与宫颈癌变过程有关及二者的相关性。
KLF5在许多肿瘤类型中异常表达,研究显示其在部分三阴性的乳腺癌病例中特异性高表达[14];同样在前列腺癌中,其表达与正常组织相比明显上调[15];而在肠道肿瘤和腺瘤性病变中,KLF5的表达下调[16]。这些结果表明在不同的肿瘤细胞中KLF5的表达有所不同。Marrero-Rodríguez等[3]研究显示KLF5在正常组织、低度鳞状上皮内病变、高度鳞状上皮内病变和宫颈癌样本中的表达有逐渐上调趋势,而Botezatu等[4]研究显示转化生长因子β、含WW结构域的E3泛素蛋白连接酶1在CIN Ⅱ-Ⅲ和宫颈癌样本中表达上调,而KLF5在宫颈癌中下调。以上研究KLF5在宫颈癌中表达的结果相反,可能是由于其在肿瘤发生中具有环境相关性或者研究方法的不同所致,因此仍需探讨其在宫颈癌变中的作用。本研究通过实时荧光定量PCR和免疫双荧光染色检测证实随着宫颈病变的进展,KLF5的mRNA和蛋白表达水平均上调(P<0.05),提示其可能促进宫颈组织癌变。
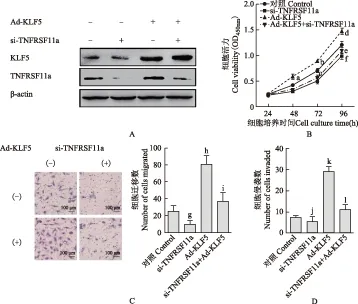
si-TNFRSF11a:TNFRSF11a特异性小分子干扰RNA;与对照组相比,aP=0.036,bP=0.029,cP=0.017,dP=0.022,eP=0.020,fP=0.012;与对照组相比,gP=0.035,hP=0.015,iP=0.049;与对照组相比,jP=0.047,kP=0.011,lP=0.039
si-TNFRSF11a:smal linterfering-TNFRSF11a RNA;aP=0.036,bP=0.029,cP=0.017,dP=0.022,eP=0.020,fP=0.012 compared with control group;gP=0.035,hP=0.015,iP=0.049 compared with control group;jP=0.047,kP=0.011,lP=0.039 compared with control group
A. HeLa细胞内KLF5和TNFRSF11a蛋白水平;B. HeLa细胞的增殖情况;C. HeLa细胞的迁移情况;D. HeLa细胞的侵袭情况
A. the protein level of KLF5 and TNFRSF11a in HeLa cells;B. the proliferation of HeLa cells;C. the migration of HeLa cells;D. the invasion of HeLa cells
图 6 KLF5通过TNFRSF11a促进HeLa细胞的增殖、迁移及侵袭
Fig 6 KLF5 promote proliferation,migration,and invasion of HeLa cells dependant-TNFRSF11a expression

表 2 TNFRSF11a的mRNA表达与宫颈癌临床病理特征的关系(2-△△Ct,x-±s)
研究显示TNFRSF11a在乳腺癌中上调,与肿瘤组织病理级别正相关,且作为乳腺癌骨转移患者的一个不良预后因素[5];其在前列腺癌细胞中也被发现高表达,并被认为在细胞生存和转移中发挥重要作用[6]。已有报道TNFRSF11a可异常表达在宫颈癌组织中[17],同时研究已显示TNFSF11/TNFRSF11a可促进宫颈癌细胞HeLa和SiHa的增殖[7]。本研究显示在CSCC和CIN组织中TNFRSF11a表达上调,且与肿瘤病理分级、临床分期、肌层浸润深度、淋巴结转移正相关(P<0.05),提示其可能与宫颈癌变有关。
目前已证明KLF5可通过增强或抑制许多有关细胞周期、血管生成相关基因的转录致癌。例如其可以通过紧密控制成纤维细胞生长因子结合蛋白癌基因表达促进细胞增殖、生存以及肿瘤生长[12]。同时KLF5在多个生长因子的信号通路中发挥重要作用,包括肿瘤坏死因子、蛋白激酶C、转化生长因子-β、类视黄醇和雄激素等[18]。研究显示肿瘤坏死因子超家族/肿瘤坏死因子受体超家族成员功能包括监管细胞的分化、增殖和生存[19]。本研究证实KLF5和TNFRSF11a在宫颈病变组织中表达正相关。体外研究显示KLF5可通过调控TNFRSF11a表达进而促进HeLa细胞的增殖、迁移及侵袭,提示KLF5与TNFRSF11a可能存在上下游关系参与宫颈癌变相关调控机制。
人乳头瘤病毒的感染与宫颈癌的发生发展关系密切,已有报道在CSCC患者中发现人乳头状瘤病毒18感染并将致癌基因整合于KLF5第4外显子[20],但其是否影响KLF5的表达,进而参与TNFRSF11a表达调控和相关信号途径机制未见报道。因此,笔者将进一步研究KLF5调控TNFRSF11a的表达是通过何种信号途径改变细胞生物学活性,以期发现新的宫颈癌变治疗的药物靶点。
[1]Siegel RL,Miller KD,Jemal A. Cancer statistics,2015[J]. Cancer J Clin,2015,65(1):5-29.
[2]Dong JT,Chen C. Essential role of KLF5 transcription factor in cell proliferation and differentiation and itsimplications for human diseases[J]. Cell Mol Life S,2009,66(16):2691- 2706.
[3]Marrero-Rodríguez D,Taniguchi-Ponciano K,Jimenez-Vega F,et al. Krüppel-like factor 5 as potential molecular marker in cervical cancer and the KLF family profile expression[J]. Tumor Biol,2014,35(11):11399- 11407.
[4]Botezatu A,Goia-Ruanu CD,Stănescu AD,et al. WWP1,TGF β and KLF5 gene expression levels as new possible factors involved in cervical oncogenesis[J]. Revista Romnă de Medicină de Laborator Vol,2011,19(1/4):47- 54.
[5]Zhang L,Teng Y,Zhang Y,et al. Receptor activator for nuclear factor κ B expression predicts poor prognosis in breast cancer patients with bone metastasis but not in patients with visceral metastasis[J]. J Clin Pathol,2012,65(1):36- 40.
[6]杨全力,郑玉梅,顾雪松. 配体 RANKL-受体RANK信号在前列腺癌细胞生存和转移中扮演重要角色[J]. 中国计划生育学杂志,2007,14(11):700- 704.
[7]Shang WQ,Li H,Liu LB,et al. RANKL/RANK interaction promotes the growth of cervical cancer cells by strengthening the dialogue between cervical cancer cells and regulation of IL- 8 secretion[J]. Oncol Rep,2015,34(6):3007- 3016
[8]Woodman CBJ,Collins SI,Young LS. The natural history of cervical HPV infection:unresolved issues[J]. Nat Rev Cancer,2007,7(1):11- 22.
[9]Ramdass B,Maliekal TT,Lakshmi S,et al. Coexpression of Notch1 and NF-κB signaling pathway components in human cervical cancer progression[J]. Gynecol Oncol,2007,104(2):352- 361.
[10]Lopez TV,Lappin TRJ,Maxwell P,et al. Autocrine/paracrine erythropoietin signalling promotes JAK/STAT-dependent proliferation of human cervical cancer cells[J]. Int J Cancer,2011,129(11):2566- 2576.
[11]Parnell EA,Calleja-Macias IE,Kalantari M,et al. Muscarinic cholinergic signaling in cervical cancer cells affects cell motility via ERK1/2 signaling[J]. Life Sciences,2012,91(21):1093- 1098.
[12]Liu R,Zheng HQ,Zhou Z,et al. KLF5 promotes breast cell survival partially through fibroblast growth factor-binding protein 1-pERK-mediated dual specificity MKP- 1 protein phosphorylation and stabilization[J]. J Biol Chem,2009,284(25):16791- 16798.
[13]Wada T,Nakashima T,Hiroshi N,et al. RANKL-RANK signaling in osteoclastogenesis and bone disease[J]. Trends Mol Med,2006,12(1):17- 25.
[14]Chen CJ,Lin SE,Lin YM,et al. Association of expression of kruppel-like factor 4 and kruppel-like factor 5 with the clinical manifestations of breast cancer[J]. Pathol Oncol Res,2012,18(2):161- 168.
[15]Chaib H,Cockrell EK,Rubin MA,et al. Profiling and verification of gene expression patterns in normal and malignant human prostate tissues by cDNA microarray analysis[J]. Neoplasia,2001,3(1):43- 52.
[16]Chen C,Bhalala HV,Vessella RL,et al. KLF5 is frequently deleted and down-regulated but rarely mutated in prostate cancer[J]. Prostate,2003,55(2):81- 88.
[17]Santini D,Perrone G,Roato I,et al. Expression pattern of receptor activator of NFkB (RANK) in a series of primary solidtumors and related metastases[J]. J Cell Physiol,2011,226(3):780- 784.
[18]Adam PJ,Regan CP,Hautmann MB,et al. Positive-and negative-acting Krüppel-like transcription factors bind a transforming growth factor β control element required for expression of the smooth muscle cell differentiation marker SM22αinvivo[J]. J Biol Chem,2000,275(48):37798- 37806.
[19]Locksley RM,Killeen N,Lenardo MJ. The TNF and TNF receptor superfamilies:integrating mammalian biology[J]. Cell,2001,104(4):487- 501.
[20]Kraus I,Driesch C,Vinokurova S,et al. The majority of viral-cellular fusion transcripts in cervical carcinomas cotranscribe cellular sequences of known or predicted genes[J]. Cancer Res,2008,68(7):2514- 2522.
Expressions and Functions of Krüppel Like Factor 5 and Tumor Necrosis Factor Receptor Superfamily Member 11a in Cervical Cancer Tissues and Cells
CHANG Lingya,MA Dong,LI Ou,WANG Xinyue,ZHANG Qi,ZHANG Lijie,YAN Xizhao,ZHENG Huanyu
Department of Obstetrics and Gynecology,Workers’ Hospital of Tangshan, North China University of Science and Technology,Tangshan,Hebei 063000,China
Corresponding author:ZHENG Huanyu Tel:0315- 3722603,E-mail:zheng_huan_yu@163.com
Objective To investigate the expressions of Krüppel like factor 5 (KLF5) and tumor necrosis factor receptor superfamily member 11a (TNFRSF11a) in cervical cancer tissues and their effect on proliferation,migration,and invasion of HeLa cells. Methods Microarray technology was used to detect the mRNA expression of gene in cytocine stimulusin cervical tissues,and the result was verified by real-time fluorescence quantitative polymerase chain reaction. The expressions of KLF5 and TNFRSF11a in cervical tissues were detected by double immunofluorescence staining. HeLa cells were transfected with specific small interfering RNA to knock down the endogenous TNFRSF11a and KLF5 and were infected with adenovirus containing KLF5 to over-express KLF5,respectively. Protein level was detected by Western blot. The regulatory effect of KLF5 on candidate target gene (TNFRSF11a) was determined by dual-luciferase reporter assay. The activity of the cell proliferation,migration,and invasion was detected by using cell counting kit- 8 assay and Transwell assay. Results The results of microarray technology showed that the expressions of KLF5 and TNFRSF11a were significantly higher in cervical squamous cell carcinoma tissues compared with normal cervical tissues (P=0.002,P=0.045),and real-time fluorescence quantitative polymerase chain reaction showed that the mRNA expressions of KLF5 and TNFRSF11a were significantly higher in cervical intraepithelial neoplasia (CIN) Ⅰ,CINⅡ-Ⅲ and cervical squamous cell carcinoma tissues compared with normal cervical tissues (KLF5:F=32.79,P=0.018,P=0.014,andP=0.011;TNFRSF11a:F=36.72,P=0.013,P=0.010,andP=0.009) and double immunofluorescence staining showed that the protein expressions of KLF5 and TNFRSF11a were significantly higher in CIN Ⅰ,CIN Ⅱ-Ⅲ and cervical squamous cell carcinoma tissues compared with normal cervical tissues (KLF5:F=42.38,P=0.014,P=0.008,andP=0.002;TNFRSF11a:F=35.42,P=0.021,P=0.012,andP=0.004) and increased with the carcinogenesis. The experimentinvitroconfirmed that KLF5 promotes proliferation,migration,and invasion of HeLa by up-regulating TNFRSF11a expression. Clinical analysis showed that the expression of TNFRSF11a mRNA was positively correlated with tumor pathological grading,clinical stage,depth of invasion,and lymph node metastasis (allP<0.05). Conclusions KLF5 and TNFRSF11a are related to cervical cancer. KLF5 promote the proliferation,migration,and invasion of cervical cancer cells partly by upregulating the transcription of TNFRSF11a.
cervical cancer;Krüppel like factor 5;tumor necrosis factor receptor superfamily member 11a;proliferation;invasion
郑寰宇 电话:0315- 3722603,电子邮件:zheng_huan_yu@163.com
R737.33
A
1000- 503X(2017)02- 0196- 10
10.3881/j.issn.1000- 503X.2017.02.006
2016- 08- 22)

