香加皮对斑马鱼发育毒性及心脏毒性的影响
冯娅茹 赵崇军 倪媛媛 田敬欢 夏青 张文婷 樊娇娇 马志强 林瑞超
·论著·
香加皮对斑马鱼发育毒性及心脏毒性的影响
冯娅茹 赵崇军 倪媛媛 田敬欢 夏青 张文婷 樊娇娇 马志强 林瑞超
目的 探讨香加皮水提液对斑马鱼的发育毒性及不同暴露时间药物对心脏毒性的影响。方法 参照经济合作与发展组织推荐的方法,将受精后6小时(6 hour-post-fertilization,6 hpf)胚胎暴露在含有不同浓度香加皮水溶液的24孔板中,分别在24、48、72、96 hpf阶段测定胚胎/幼鱼的自主抽动次数、心率、孵化率、死亡率等指标。随后,使用不同浓度的香加皮水溶液处理发育至48、72、96 hpf的斑马鱼24小时,通过死亡率确定不同暴露阶段对斑马鱼心脏毒性的影响。结果 各暴露组24 hpf自主抽动次数增加、48 hpf心率以及72 hpf孵化率显著降低,与正常对照组相比均有显著性差异(P<0.05);24 hpf低浓度给药组胚胎发育迟缓、眼点未发育、头部偏小或未发育,高浓度组发育畸形或停留在体节期;48 hpf胚胎卵黄囊畸形、黑色素生成抑制、尾芽未脱落;72 hpf 幼鱼出现身体弯曲、心包水肿、卵黄囊畸形等中毒症状。不同发育阶段斑马鱼急性毒性暴露实验结果表明:香加皮对48、72、96 hpf斑马鱼的半数致死浓度(LC50)分别为:0.866 mg/mL、0.693 mg/mL和0.843 mg/mL。结论 香加皮对斑马鱼具有明显的发育毒性和心脏毒性,且48 hpf斑马鱼非常适合进行心脏毒性药物筛选。
香加皮; 发育毒性; 心脏毒性; 斑马鱼
香加皮Cortex Periplocae亦称北五加皮,为萝藦科植物杠柳PeriplocasepiumPunge的干燥根皮,有祛风湿、强筋骨的功效,常用于治疗风寒湿痹,腰膝酸软,心悸气短,下肢浮肿[1]。香加皮为药典规定的有毒药,误用、剂量过大以及长期服用皆可引起机体出现心率减慢、早搏、房室传导阻滞等心脏中毒症状,甚至致死[2],但其并非孕妇禁忌药,有关发育毒性的研究也未见报道。
作为一种脊椎动物模型,斑马鱼与人类基因相似度高达87%,具有完整的组织器官。斑马鱼胚胎母体外发育,发育时间短,数量大,早期胚胎透明,可直接在显微镜下观察各组织脏器形态变化及血液流动情况[3],能够极大地弥补体内实验与体外实验之间的间隙。最重要的是,斑马鱼胚胎及幼鱼对大多数药物的反应与人类临床反应相似[4-5]。因此斑马鱼可作为评价药物潜在发育毒性及器官毒性的理想模型。
本实验通过斑马鱼模型初步探讨香加皮对斑马鱼的发育毒性以及不同发育阶段给药对斑马鱼心脏毒性的影响,以期为临床安全用药提供依据。
1 材料与方法
1.1 实验动物
斑马鱼(AB-type)由本实验室循环养殖系统饲养提供,循环养殖水根据Brand等[6-7]的方法配制。水温控制在(28±0.5)℃,pH值7.0~7.2,电导率450~550 μS/cm,光照/黑暗周期为14小时/10小时。成年斑马鱼每日喂食3次人工孵化的丰年虫幼体。实验前一晚暗周期开始之前,将成年雌雄斑马鱼按1∶2或1∶1配对,放入带隔板的产卵盒中,第2天早晨给予光照,抽掉隔板。产卵完成后,缓缓晃动产卵盒,以便让鱼卵更好地受精,随后用吸管将鱼卵收集于含有孵化水的干净无菌培养皿中,用培养液清洗鱼卵数次以除去未受精卵、粪便等杂物,将发育完整受精卵放于生化培养箱中培养。
1.2 仪器与材料
香加皮为安国圣山药业有限公司提供,经北京中医药大学刘春生教授鉴定为萝藦科植物杠柳PeriplocasepiumPunge的干燥成熟种子,斑马鱼循环水养殖系统(北京爱生科技公司);TE-2000-S光学倒置显微镜(NIKON);NaCl、KCl、Na2HPO4、K2HPO4、MgSO4、NaHCO3、CaCl2,(分析纯,北京化工);1 mL,5 mL移液器(eppendorf);胰蛋白酶(Protease from Streptomyces griseus,sigma,P6911);恒温培养箱LRH-250Z(广州瑞明仪器有限公司);真空干燥箱DZF-6050B(上海一恒科学仪器有限公司);旋蒸仪R-1001-VN(郑州长城科工贸有限公司)。
1.3 香加皮样品制备
香加皮水提液:取香加皮饮片,粉碎后过40目筛,称取50 g香加皮粉末,加入10倍量的水提取2次,每次2小时,过滤后浓缩,真空干燥。
斑马鱼胚胎培养液:按照Zebrafish Book标准配制NaCl 0.137 mol/L、KCl 5.4 mol/L、Na2HPO40.25 mol/L、K2HPO40.44 mol/L、CaCl21.3 mol/L、MgSO41.0 mol/L、NaHCO34.2 mol/L的水溶液。
香加皮储备液的配制:精密称取0.2 g香加皮提取物粉末,溶于50 mL的养殖水中,超声30分钟,配置成4 mg/mL的母液。
1.4 发育毒性的评价
1.4.1 香加皮样品溶液的配制 在预实验的基础上,用胚胎培养液将母液稀释至0.5、0.7、0.9、1.1、1.3 mg/mL六个浓度梯度。
1.4.2 香加皮样品溶液处理斑马鱼胚胎 在显微镜下选取受精后6小时左右(hour-post-fertilization,6 hpf~8 hpf)且发育正常的胚胎,并将其随机转入含有不同浓度香加皮溶液的24孔板,每板设置5个药物浓度,一个空白组,每孔5枚胚胎。28.5℃恒温生化培养箱中培养,每隔24小时更换香加皮样品溶液1次,以保证溶液中各参数稳定。取不同亲本的胚胎重复实验三次。
1.4.3 香加皮对斑马鱼胚胎发育影响的观测 以培养液中发育的胚胎为正常对照组,通过倒置光学显微镜于24、48、72和96 hpf时间点观察染毒后胚胎的发育情况与形态变化并详细拍照记录,统计胚胎发育全过程的死亡数及畸形数、计算LC50。
1.4.4 斑马鱼胚胎24 hpf自主抽动的测定 胚胎发育至24 hpf时尾部表现出强烈的抽动。记录24 hpf时每个浓度下1分钟内胚胎的自主抽动次数,每一个浓度下取7枚胚胎进行统计(n=7)。
1.4.5 斑马鱼胚胎48 hpf心率的测定 斑马鱼胚胎在48 hpf时心脏已基本发育完全,即出现规律的心跳,实验中记录了48 hpf时每个浓度下胚胎10秒内心率,每一个浓度取7枚胚胎进行统计(n=7)。
1.4.6 斑马鱼孵化率的测定 统计不同浓度处理组中斑马鱼胚胎的孵化率(孵化率=已孵化胚胎/总胚胎个数×100%)。由于胚胎在48 hpf时开始孵化,直到96 hpf时完成孵化,因此,分别选择72、96 hpf统计胚胎的孵化率。
1.5 不同发育阶段(48、72、96 hpf)斑马鱼心脏毒性评价
为了进一步探究香加皮对不同发育阶段斑马鱼心脏毒性的影响,在显微镜下选取形态发育正常的48、72、96 hpf的斑马鱼胚胎及幼鱼(48 hpf胚胎需用胰蛋白酶脱去卵膜)转入含有不同浓度香加皮溶液的12孔板处理24小时,通过死亡率来评价香加皮对不同时间段斑马鱼心脏毒性的的影响。取不同亲本的胚胎及幼鱼重复实验3次。
1.6 统计学处理
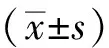
2 结果
2.1 香加皮水溶液对不同发育阶段斑马鱼胚胎发育表型的影响
24 hpf胚胎发育畸形情况如图1所示:相比于正常对照组,低浓度给药组胚胎发育迟缓,眼点未发育,头部偏小或未发育,见图B、C。高浓度组发育畸形,见图D或停留在体节期,自主运动缺失,见图E。
48 hpf胚胎发育畸形情况如图2所示:卵黄囊畸形,见图B。黑色素生成抑制,见图C~E。尾芽未脱落,见图B~E。高浓度组发育受到抑制。
72 hpf幼鱼发育畸形情况如图3所示:卵黄囊畸形,见图B~D。心包水肿,见图B、C。黑色素生成抑制,见图D。

注:A:对照组;B:1.25 mg/mL香加皮水总提取物;C:1.5 mg/mL香加皮水总提取物;D:2 mg/mL香加皮水总提取物;E:3 mg/mL香加皮水总提取物
图1 香加皮对24 hpf斑马鱼形态发育的影响(×10)
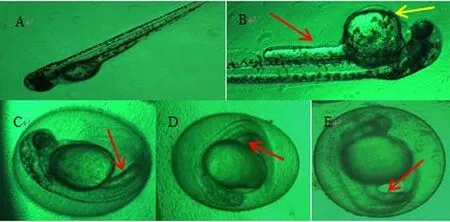
注:A:对照组;B:0.15 mg/mL香加皮水总提取物;C:1mg/mL香加皮水总提取物;D:1.5 mg/mL香加皮水总提取物;E:3mg/mL香加皮水总提取物(红色箭头标注表示尾节未脱落,黄色箭头标注表示卵黄囊畸形)
图2 香加皮对48 hpf斑马鱼形态发育的影响(×10)
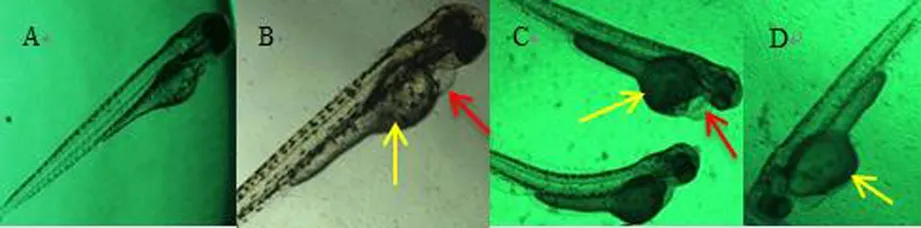
注:A:对照组;B:0.75 mg/mL香加皮水总提取物;C:1.25 mg/mL香加皮水总提取物;D:1.25 mg/mL香加皮水总提取物
(红色箭头标注表示心包水肿,黄色箭头标注表示卵黄囊畸形)
图3 香加皮对72 hpf斑马鱼形态发育的影响(×10)
2.2 香加皮对斑马鱼24 hpf自主抽动的影响
倒置显微镜下观察并记录24 hpf斑马鱼1分钟内的自主抽动次数。方差分析结果表明各给药组与正常对照组之间具有显著的统计学差异(P<0.01)。见表1。
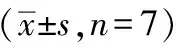
表1 香加皮对24 hpf胚胎自主抽动的影响
注: 与对照组相比,aP<0.01。
2.3 香加皮对48 hpf斑马鱼心率的影响
倒置显微镜下统计斑马鱼10秒内心脏跳动次数。方差分析结果显示各给药组与正常对照组之间有显著的统计学差异(P<0.01)。见表2。
表2 香加皮对48 hpf心率的影响
注: 与对照组相比,aP<0.01。
2.4 香加皮对斑马鱼孵化率的影响
48 hpf胚胎进入孵化期,但48 hpf时所有给药组的胚胎均无孵化,故48 hpf未做统计。72 hpf大部分胚胎孵化完全,方差分析结果显示0.9 mg/mL及其以上浓度组与正常对照组相比具有显著性差异(P<0.01),见表3。
2.5 香加皮对各个发育阶段斑马鱼心脏毒性
48、72、96 hpf的斑马鱼暴露24小时后,心脏毒性明显,通过死亡率-浓度曲线计算的半数致死浓度(LC50)分别为:0.866、0.693、0.843 mg/mL,见图4。
结果显示,72 hpf斑马鱼对香加皮较为敏感,48 hpf斑马鱼的LC50与96 hpf相似,表明48 hpf斑马鱼适合进行药物心脏毒性研究。
表3 香加皮水总提取物对72 hpf胚胎孵化率的影响
注: 与对照组相比,aP<0.01。
3 讨论
香加皮中含有十几种杠柳苷及苷元,该化学成分能够对机体产生明显的强心作用,同时也可能会抑制心肌细胞膜Na+-K+-ATP酶而产生心脏毒性[8-9]。
传统的发育毒性评价一般以啮齿类动物鼠及非啮齿类动物兔为模型进行研究[10],成本较高且相关测试不能覆盖胚胎发育的全过程[11]。斑马鱼作为一种新的动物模型,繁殖能力强,生命周期短,成本低,早期胚胎透明,在显微镜下可直接观察到体内各器官的发育过程及药物对器官发育的致畸效应[12],而且它的毒性特征与哺乳动物非常类似[13]。
此外,斑马鱼可以不依赖于完整的心血管系统,甚至在整个心血管循环缺失的情况下仍然能生存一段时间,逐步成为了研究心脏毒性药物筛选的可替代动物模型[14-16]。总之,斑马鱼模型将体外动物模型和体内细胞模型的优势进行有效结合,越来越多的应用于临床候选药物的安全性及有效性评估。
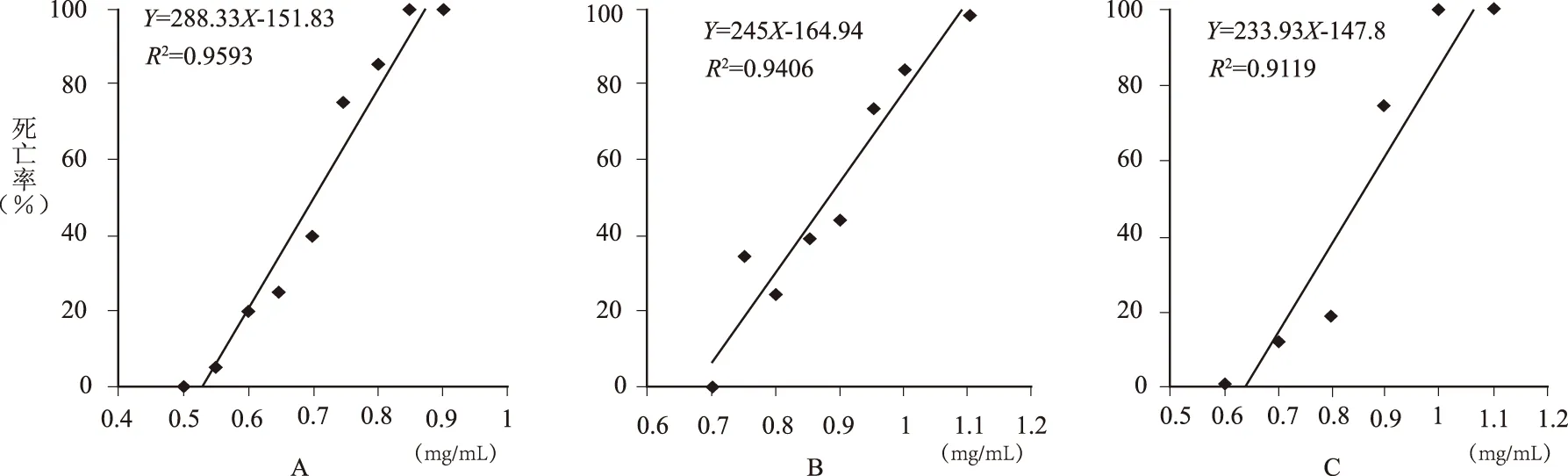
注: A:48 hpf;B:72 hpf;C:96 hpf
图4 不同发育阶段斑马鱼毒效曲线
本实验以斑马鱼为模型,通过对胚胎自主抽动、心率、孵化率、死亡率的研究来评估香加皮对斑马鱼发育的影响。斑马鱼自主抽动是运动神经系统功能发育的一种表现[17]。本实验中,正常对照组斑马鱼在24 hpf自主抽动数为5.5次/分钟,与文献报道相符[18]。与对照组相比,低浓度处理组即出现差别,且随浓度增加抽动次数增加。此外,高浓度处理组(3 mg/mL)中胚胎发育停留在体节期。综上表明香加皮可抑制早期胚胎发育,有一定的神经毒性。
胚胎发育过程中心脏是最早发生并发挥功能的器官,完整的心脏功能对于胚胎的正常发育起着关键作用,斑马鱼胚胎发育至48 hpf心率基本趋于稳定[19-20]。实验结果表明香加皮会导致48 hpf斑马鱼胚胎的心脏出现表型和功能异常,如心包水肿,心率降低等并呈现剂量相关性,这与文献报道香加皮临床中毒症状相符合[2]。此外,香加皮能够抑制斑马鱼的孵化过程,处理组与对照组之间具有显著性差异。结果表明,香加皮对斑马鱼具有明显的发育毒性。
24 hpf斑马鱼心脏开始出现心率,48 hpf斑马鱼心脏发育完全[6]并发挥完全功能。因此,针对香加皮的心脏毒性,笔者选定不同发育阶段(48、72、96 hpf)的斑马鱼染毒24小时后统计死亡数,计算LC50值,进而评价香加皮对不同发育阶段斑马鱼心脏毒性的影响。急性毒性试验表明,香加皮对48 hpf、96 hpf斑马鱼的毒性大小相似,进一步验证了48 hpf斑马鱼适合作为心脏毒性研究的开始阶段,但是72 hpf斑马鱼对香加皮较为敏感,这可能是由于香加皮影响了斑马鱼的某一脏器发育,例如肝脏或者肠道发育,但实验结果仍需进一步验证。
香加皮虽为《中国人民共和国药典》2015版明确规定的有毒药,但并非孕妇禁忌药。而本次实验表明香加皮具有明显的发育毒性及心脏毒性,以期能为临床安全、合理用药提供依据,为今后有关香加皮毒性机制的研究做参考。
[1] 国家药典委员会.中华人民共和国药典(一部)[S].北京:化学工业出版社,2015:257-268.
[2] 梅全喜,毕焕新.现代中药药理手册[M].北京:中国中医药出社,1998:421.
[3] Goldsmith P.Zebrafish as a pharmacological tool: the how, why and when[J].Current Opinion in Pharmacology,2004,4(5):504-512.
[4] Mittelstadt SW,Hemenway CL, Craig MP,et al.Evaluation of zebrafish embryos as a model for assessing inhibition of hERG [J].Journal of Pharmacological and Toxicological Methods,2008,57(2):100-105.
[5] Zhu JJ,Xu YQ,He JH,et al.Human cardiotoxic drugs delivered by soaking and microinjection induce cardiovascular toxicity in zebrafish[J].Journal of Applied toxicology,2014,34(2):139-148.
[6] WESTERFIELD M.The Zebrafish Book: A Guide for the Laboratory Use of Zebrafish[M].University of Oregon Press,1993.
[7] Brand M, Granato M, Nusslein-Volhard C. Keeping and Raising Zebrafish[M].Oxford:Oxford Mniversity Press,2002:7-37.
[8] 王利萍,刘建利.香加皮的化学成分和药理作用研究进展[J].中草药,2009,(3):493-496.
[9] 李天祥,张丽娟,刘虹,等.香加皮的研究进展[J].北京中医药,2008,27(12):960-963.
[10] Rovida C, Hartung T. Re-evaluation of animal numbers and costs for In vivo tests to accomplish REACH legislation requirements for chemicals[J].Altex,2009,26(3):187-208.
[11] Selderslaghs IW, Van RAR, et al.Development of a screening assay to identify teratogenic and embryotoxic chemicals using the zebrafish embryo[J].Reproductive Toxicology,2009,28(3):308-320.
[12] Hill A, Howard Cu, Cossins A. Neurodevelopmental defects in zebrafish (Danio rerio) at environmentally relevant dioxin (TCDD) concentrations[J].Toxicological Sciences,2003,76(2):392-399.
[13] He JH , Guo SY ,Zhu F, et al.A zebrafish phenotypic assay for assessing drug-induced hepatotoxicity[J].Journal of Pharmacological and Toxicological Methods,2013,67(1):25-32.
[14] Thisse C, Zon LI. Organogenesis-heart and blood formation from the zebrafish point of view[J].Science,2002,295(5554):457-462.
[15] Chen JN, Haffter P, Odenthal J,et al. Mutation affecting the cardiovascular system and other internal organs in zebrafish [J]. Development,1996,123:293-302.
[16] Zhong TP, Childs S, Leu JP,et al. Gridlock signaling pathway fashions the first embryonic artery[J]. Nature,2001,414(6860):216-220.
[17] Kimmel CB, Ballard WW, Kimmel SR, et al. Stages of embryonic development of the zebrafish[J].Developmental dynamics,1995,203(3):253-310.
[18] Saint-Amant L, Drapeau P. Time course of the development of motor behaviors in the zebrafish embryo[J].Journal of Neurobiology,1998,37(4):622-632.
[19] Kitambi S S, Nilsson E S, Sekyrova P, et al. Small molecule screening platform for assessment of cardio- vascular toxicity on adult Zebrafish heart[J]. BMC Physiology,2012,12(1):3-9.
[20] 王思锋,刘可春,王希敏,等.雷公藤红素对斑马鱼胚胎心脏毒性的初步研究[J].中国药理学通报,2009,25(5):634-636.
(本文编辑: 禹佳)
Effects of Cortex Periplocae on zebrafish developmental toxicity and cardiac toxicity
FENGYaru,ZHAOChongjun,NIYuanyuan,etal.
SchoolofChineseMateriaMedica,BeijingUniversityofChineseMedicine,Beijing100102,China
LINRuichao,E-mail:linrch307@sina.com.cn
Objective To study the toxic effects of Cortex Periplocae on zebrafish embryo development, and the effects of different exposure duration on the heart toxicity. Methods The methods recommended by Organization for Economic Co-operation and Development was refered, zebrafish embryos of 6 hour-post-fertilization were exposed to 24-well plates with aqueous extraction of Cortex Periplocae of various concentrations. Spontaneous movements, heart rate, hatching rate, mortality rate in 24 hpf and 48 hpf were used to assess the effects of Cortex Periplocae on the zebrafish development under the microscope. Zebrafish at 48 hpf, 72 hpf, 96 hpf were treated with aqueous extraction of cortex periplocae with various concentrations for 24h to determine the effects of different exposure duration on the heart toxicity. Results Compared with the normal control group, the number of spontaneous movements of 24 hpf, heart rate of 48 hpf and the hatching rate of 72 hpf were significantly lower in the exposed group,the results had significant difference (P<0.05). Embryos of 24 hpf exposed to low concentration showed immature development of head and eyes spot, and embryos in high concentration group were malformed or stayed in the segmentation period. Embryos of 48 hpf showed malformation of visceral yolk sac, inhibition of melanin and tail bud was not fallen off. After 72 hpf, the abnormality of zebrafish was observed for curved body, pericardial edema, yolk sac edema. Experimental result of acute toxicity exposure at different developmental stages of zebrafish showed that the median lethal concentration(LC50) were 0.866 mg/mL, 0.693 mg/mL, 0.843 mg/mL respectively. Conclusion Cortex Periplocae had significant toxic effect on the development of zebrafish embryos and heart. Moreover, 48hpf zebrafish is well suited for drug screening of cardiac toxicity.
Zebrafish; Cortex Periplocae; Developmental toxicity; Cardiac toxicity
北京市科学研究与研究生培养共建项目(2050205)
100102 北京中医药大学中药学院 中药品质评价北京市重点实验室[冯娅茹(硕士研究生)、赵崇军、倪媛媛、田敬欢、夏青、樊娇娇、张文婷、马志强、林瑞超]
冯娅茹(1993- ),女,2015级在读硕士研究生。研究方向:中药毒性成分研究。E-mail:1043742239@qq.com
林瑞超(1954- ),博士,教授,研究员,博士生导师。研究方向:中药质量控制与物质基础研究。E-mail:linrch307@sina.com.cn
R285.5
A
10.3969/j.issn.1674-1749.2017.05.006
2016-04-22)

