QuEChERS-高效液相色谱法测定杨梅果实中苯醚甲环唑和乙基多杀菌素的农药多残留
王天玉,姚周麟,平新亮,张伟清,冯先橘,林 媚
(浙江省柑桔研究所,浙江 台州 318026)
QuEChERS-高效液相色谱法测定杨梅果实中苯醚甲环唑和乙基多杀菌素的农药多残留
王天玉,姚周麟,平新亮,张伟清,冯先橘,林 媚*
(浙江省柑桔研究所,浙江 台州 318026)
解决杨梅果实中苯醚甲环唑和乙基多杀菌素的农药残留问题,建立一种能同时测定杨梅果实中这两种农药的高效液相色谱分析方法。样品经乙腈提取,QuEChERS法净化,以乙腈-甲醇-水作为流动相,采用梯度洗脱,在波长254 nm下对待测组分进行检测,外标法定量。结果表明,在0.05~10.00 mg·L-1,采用空白基质溶液做溶剂配制苯醚甲环唑和乙基多杀菌素的标准工作溶液,峰面积与相应的质量浓度间呈现良好的线性关系,相关系数均大于0.999;在0.08~0.50 mg·kg-1的添加水平下,苯醚甲环唑平均回收率为86.58%~94.90%,RSD(相对标准偏差)为5.21%~8.64%;乙基多杀菌素平均回收率为86.44%~88.70%,RSD为3.28%~8.31%。这2种农药在杨梅果实中的定量限LOQ均为0.08 mg·kg-1,检出限LOD均为0.01 mg·kg-1。该方法满足农药残留分析要求,简单易行,且净化效果好,适用于杨梅果实中苯醚甲环唑和乙基多杀菌素的农药多残留分析。
QuEChERS; 高效液相色谱法; 苯醚甲环唑; 乙基多杀菌素; 杨梅果实; 农药残留
杨梅在种植过程中会遭受到各种病虫害的影响,如癌肿病、褐斑病、白腐病、卷叶蛾、松毛虫、介壳虫、果蝇等,农药的大量使用使杨梅果实中的农药超标,严重影响人们的健康。因此,低毒易降解农药受到青睐[1]。其中,苯醚甲环唑(difenoconazole)和乙基多杀菌素(spinetoram,图1)对杨梅病虫害防效较为显著。苯醚甲环唑是三唑类甾醇脱甲基化抑制剂,抑制细胞壁甾醇的生物合成,常应用于果树、蔬菜等作物,有效防治黑星病、黑痘病、白腐病、斑点落叶病、白粉病、褐斑病、锈病、条锈病、赤霉病等。乙基多杀菌素是从放线菌刺糖多孢菌(saccharopolyspora spinosa)发酵产生的,是多杀菌素(spinosad)的换代产品,其原药的有效成分是乙基多杀菌素-J和乙基多杀菌素-L的混合物(比值为3∶1),其杀虫生物活性无显著差异,可用来防治水果、蔬菜和坚果上的重要害虫,尤其对苹果蠢蛾等难防治害虫效果明显[2-4]。这两种农药属于低毒易降解农药,但使用不合理,仍有农药残留超标的风险。
目前,国内外关于苯醚甲环唑和乙基多杀菌素的原药及其在水体、土壤、蔬菜、水果等基质中的残留分析方法已有不少报道,如苯醚甲环唑多采用气相色谱法、液相色谱法、气相色谱-质谱联用和高效液相色谱-质谱联用法等[5-10]。乙基多杀菌素作为近年来新上市的农药,关于其在环境中的残留分析方法报道较少,主要采用液相色谱法和液相色谱-质谱联用法等[11-15],而在基质较为复杂的杨梅中同时测定苯醚甲环唑和乙基多杀菌素残留的方法尚未见报道。本试验采用QuEChERS-高效液相色谱法对这两种农药进行残留分析方法研究[16-20],能解决样品基质前处理繁琐或仪器设备昂贵等问题,具有简单、节省溶剂、分析速度快等特点,能更突出环境友好和减少污染,对评价与监测杨梅果实中的农药残留状况提供参考。
图1 苯醚甲环唑和乙基多杀菌素结构式
1 材料与方法
1.1 仪器、试剂及供试样品
1260高效液相色谱仪(带VWD紫外检测器,美国Agilent公司);Milli-Q超纯水系统(德国Millipore公司);DS-1高速组织捣碎机(上海标本模型厂);MS3旋涡机(德国IKA公司);SK250KUDOS超声波清洗器(上海科导超声仪器有限公司);V-800旋转蒸发仪(瑞士BÜCHI公司);Anke TDL-40B离心机(上海安亭科学仪器厂)。
PSA、C18、GCB、MgSO4(美国Agilent公司);乙腈(AR和HPLC)、甲醇(AR和HPLC)、氯化钠(AR)均购于国药集团化学试剂有限公司。
苯醚甲环唑标准品(98.5%,国家标准物质中心);乙基多杀菌素标准品(95.0%,德国Dr.Ehrensorfer公司);杨梅样品(浙江省柑桔研究所实验田,经检测不含苯醚甲环唑和乙基多杀菌素)。
1.2 试验方法
1.2.1 样品的提取
将新鲜的杨梅去核后匀浆,称取制备样品10.00 g(精确至0.01 g),置于25 mL具塞离心管中,加入10 mL乙腈、2 g NaCl,旋涡30 s后,超声提取5 min,于3 000 r·min-1下离心5 min,待净化。
1.2.2 提取液的净化
取全部上清液于15 mL的离心管中,加入萃取剂PSA 200 mg、MgSO4400 mg,旋涡1 min后,静止沉淀,过0.22 μm有机膜,量取8 mL,旋转蒸发仪浓缩至1 mL左右,氮气吹干,乙腈定容至1 mL,待进样。
1.3 液相色谱条件
色谱柱:Agilent C18柱(4.6 mm×250 mm,5 μm);流动相:乙腈-甲醇-水;梯度洗脱程序为0 min(58%∶0∶42%)→15 min(58%∶0∶42%)→17 min(0∶92%∶8%)→38 min(0∶92%∶8%)→40 min(58%∶0∶42%);流速1 mL·min-1;进样量20 μL;柱温30 ℃;检测波长254 nm;以保留时间定性,基质匹配外标法峰面积定量。
1.4 标准溶液的配制和线性相关性测定
标准储备溶液。准确称取苯醚甲环唑和乙基多杀菌素标准品0.050 8和0.052 6 g,用乙腈配制成质量浓度均为500 mg·L-1的标准溶液,于3 ℃下储存,备用。
基质匹配标准曲线。吸取适量的标准储备液,分别用乙腈和空白基质逐步稀释成质量浓度为10,5,3,1,0.5,0.1和0.05 mg·L-1的一系列标准工作溶液,在1.3的条件下,分别进样20 μL,平行测定3次,以标准品质量浓度为横坐标,峰面积为纵坐标作线性回归,绘制标准曲线。
1.5 基质效应
基质效应指样品中除目标分析物以外的其它成分对待测物测定值的影响。杨梅果实中含有大量的糖类、酸类和花色素等成分,这些成分可能对农药的检测响应有一定的干扰,为准确评价基质对测定结果准确度的影响,同时选取乙腈和空白基质溶液分别配制的标准工作溶液,比较实际样品和空白溶剂在色谱分析中的响应值,对基质效应进行评价,根据公式ME计算基质效应,当<1时,表现为降低信号响应;当>1时,表现为增强信号响应。
ME/%=As/Ao×100。
式中,ME表示为基质效应;As表示为空白基质标准品响应值;Ao表示为空白溶剂标准品响应值。
2 结果与分析
2.1 提取溶剂的选择
苯醚甲环唑和乙基多杀菌素易溶于大多数有机溶剂,而杨梅样品中含有大量水分,溶液相似相溶,则选取甲醇和乙腈作为提取溶剂,两者回收率都在92%以上。且乙腈能够在提取过程中加入盐和水进行分层,便于净化,故选取乙腈作为最终提取溶剂。
2.2 吸附剂的选取
分散固相萃取是近几年发展迅速的前处理方法,对脂肪酸、色素、糖类等物质的吸附效果好且操作比固相萃取简单,成本更低,被广泛应用于蔬菜、水果的农药残留检测[15-18]。本试验根据2种农药的结构特点和吸附剂的吸附特性,分别对QuEChERS中的3种吸附剂PSA、C18、GCB进行农药回收率的比较。在3种处理中,分别在离心管中添加2 mL苯醚甲环唑/乙基多杀菌素混合标样(1∶4)和不同量的吸附剂(100 mg PSA、100 mg C18、15 mg GCB),每处理重复3次。
图2表明,GCB虽然对一些色素多的样品具有较好的净化效果,但其对含有平面结构的农药具有很强的亲和力,对乙基多杀菌素的吸附较强;C18含碳量10%,具有疏水作用,对非极性组分有一定的吸附作用[19-20];PSA与氨基有相似的吸附特性,可有效的去除脂肪酸、有机酸和一些极性的杂质,对这2种农药的吸附最小,可作为最佳吸附剂。
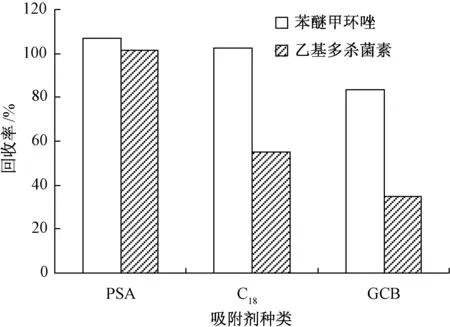
图2 不同吸附剂对苯醚甲环唑和乙基多杀菌素回收率的影响
2.3 吸附剂量的优化选择
按照1.2的试验方法,分别对杨梅样品进行不同PSA吸附量(100、200、300、400 mg)的试验;研究表明,随着PSA量的加大,杨梅样品提取液颜色会越来越浅,当加入一定量的时候再无颜色变化,液相色谱测定表明,色素的干扰也随着吸附剂量的加大逐渐减少。考虑成本因素,当PSA的量为200 mg时,能得到较好的除杂效果,最终选取此量作为最佳用量。
2.4 进样条件的优化
杨梅样品含有复杂的基质,对样品干扰较大,故选取合适的流动相是关键。试验表明,由于苯醚甲环唑含有同分异构体,当选取甲醇和水作为流动相时,在杂质不影响出样峰的情况下,2种异构体出现交叉干扰;当选取乙腈和水时,其强的洗脱能力,则出现好的峰型;乙基多杀菌素出峰时间较晚,当选取乙腈作为流动相时,强的洗脱效果引起杂质对峰的干扰较大,不易把峰分开,而甲醇则有良好的峰型;通过改变乙腈、甲醇、水三种溶剂的比例,按照1.3进样条件,采用梯度洗脱能够得到这两种农药在杨梅样品中较好的峰型。
2.5 方法的线性范围和基质效应
样品基质对不同的农药大多数情况下存在抑制效应。一般认为,这种效应在85%~115%不存在基质效应。本试验结果表明,杨梅样品对苯醚甲环唑和乙基多杀菌素均存在一定基质效应;通常采用基质匹配标准曲线可有效消除样品基质效应,这2种农药在 0.05~10.00 mg·L-1均具有良好的线性关系(表1)。

表1 2种农药的线性回归方程和基质效应评价
2.6 方法的准确度和精密度
选取不含苯醚甲环唑和乙基多杀菌素的杨梅样品进行回收率的测定,称取匀浆的样品10.00 g(精确到0.01 g),3个处理样品中各添加一定量的农药,每处理样品重复6次,按1.2节的试验方法进行样品的提取、净化和检测,试验结果表明,苯醚甲环唑的平均回收率在86.58%~94.90%,RSD(相对标准偏差)5.21%~8.64%;乙基多杀菌素的回收率在86.44%~88.70%,RSD在3.28%~8.31%(表2),结果准确度高,精密度好;以3倍空白样品基线噪音来确定检出限(LOD)均为0.01 mg·kg-1,以最小添加水平确定方法的定量限(LOQ)均为0.08 mg·kg-1,色谱图见图3~4。
2.7 实际样品的验证结果
通过本试验方法,分别于水果市场、超市、农贸市场和农户采集20几个批次杨梅样品进行苯醚甲环唑和乙基多杀菌素的农药残留检测,结果均未检测出这2种农药残留。
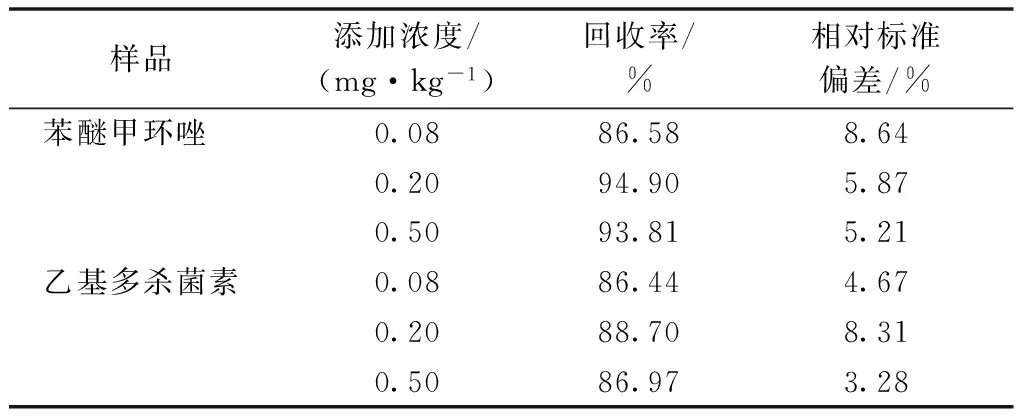
表2 苯醚甲环唑和乙基多杀菌素在杨梅果实中的 平均添加回收率及相对标准偏差

图3 空白样品的色谱
图4 添加0.08 mg·kg-1农药样品的色谱
3 小结
本研究建立以乙腈为提取剂,经QuEChERS方法净化,液相色谱检测杨梅样品中苯醚甲环唑和乙基多杀菌素两种农药的残留分析方法。由于杨梅样品中复杂的基质,对农药检测的干扰较大,通过对各种吸附剂的筛选,优化前处理过程,并对流动相采用了梯度洗脱方式,取得良好的目标化合物和杂质分离,填补了杨梅样品上面这两种农药的残留分析方法空白,基质空白校正减少了样品的基质效应。该方法操作简单、分析快速、灵敏度高、实用性强;同时样品前处理中有机溶剂的少量使用,可以降低了成本,减少污染;通过液相色谱分析,可以更好的解决设备昂贵方面的限制,方便方法的应用,也为各种水果中苯醚甲环唑和乙基多杀菌素的农药残留分析提供参考依据。
[1] 颜丽菊,徐春燕,王康强. 杨梅栽培技术[M]. 北京:中国农业出版社,2007.
[2] 王远,邢丽杰,郝家勇,等. 高效液相色谱-串联质谱法测定蔬菜中苯醚甲环唑的残留量[J]. 食品科学,2011,32(18):296-299.
[3] 陈国,朱勇,赵健,等. 乙基多杀菌素在稻田水、土壤和水稻植株中的残留及消解动态[J]. 农药学学报,2014,16(2):153-158.
[4] 夏华兴,陈明亮,刘维新,等. 氟啶虫胺腈与乙基多杀菌素混用防治水稻迁移性害虫田间药效试验[J]. 现代农药,2013,12(3):52-53,56.
[5] GUO C,LI J Z,GUO B Y,et al. Determination and safety evaluation of difenoconazole residues in apples and soils[J]. Bull Environ Contam Toxicol,2010,85(4):427-431.
[6] FERREIRA J A, SANTOS L F, SOUZA N R, et al. MSPD sample preparation approach for reversed-phase liquid chromatographic analysis of pesticide residues in stem of coconut palm[J]. Bulletin of Environmental Contamination and Toxicology, 2013, 91(2):160-164.
[7] 王军,刘丰茂,温家钧,等. 苯醚甲环唑在茶叶中的残留量及其在茶汤中的浸出动态研究[J]. 农药学学报,2010,12(3):299-302.
[8] 安晶晶,刘新刚,董丰收,等. 超高效液相色谱-串联质谱法测定土壤、蔬菜及水果中苯醚甲环唑和丙环唑残留[J]. 农药,2009,48(7):506-508.
[9] 薛晓航,戴守辉,张璐珊,等. QuEChERS/GC-MS快速分析土壤中的苯醚甲环唑残留[J].农药学学报,2010,12(3):309-312.
[10] 王军,温家钧,边侠玲,等.柑橘和土壤中苯醚甲环唑残留动态研究及安全性评价[J]. 西南农业学报,2009,22(3):644-647.
[11] LIU X,EL-ATY A M A,PARK J Y,et al. Determination of spinetoram in leafy vegetable crops using liquid chromatography and confirmation via tandem mass spectrometry [J]. Biomedical Chromatography,2011,25(10):1099-1106.
[12] PARK K H,CHOI J H,EI-ATY A M A,et al. Determination of spinetoram and its metabolites in amaranth and parsley using QuEChERS-based extraction and liquid chromatograpy-tandem mass spectrometry[J]. Food Chem,2012,134(4):2552-2559.
[13] 赵瑶瑶,秦旭,秦冬梅,等. XDE-175及其代谢物在甘蓝和土壤中的残留动态研究[J]. 农业环境科学学报,2009,28(5):1032-1036.
[14] MALHAT F M. Simultaneous determination of spinetoram residues in tomato by high performance liquid chromatography combined with QuEChERS method [J]. Bull Environ Contam Toxicol,2013,90:222-226.
[15] 孙敏,曹赵云,刘慧,等. PSA分散固相萃取和高效液相色谱-质谱法测定蔬菜中多杀菌素的残留量[J]. 分析试验室,2010,29(8):70-74.
[16] 粟有志,周均,孟茹,等. QuEChERS-液相色谱-串联质谱法测定果蔬及其制品中噻霉酮残留[J]. 农药学学报,2016,18(1):135-140.
[17] BIZIUK M,STOCKA J. Multiresidue methods for determination of currently used pesticides in fruits and vegetables using QuEChERS technique [J]. Int J Environ Sci Dev,2015,6(1):18-22.
[18] HU M F,LIU X G,DONG F S,et al. Determination of ametoctradin residue in fruits and vegetables by modified quick,easy,cheap,effective,rugged and safe method using ultra-performance liquid chromatography/tandem mass spectrometry[J]. Food Chem,2015,175:395-400.
[19] ANASTASSIADES M,LEHOTAY S J,STAJNBAHER D,et al. Fast and easy multiresidue method employing acetonitrile extraction/partitioning and “dispersive solid-phase extraction” for the determination of pesticide residues in produce[J]. Journal of AOAC International,2003,86(2):412-431.
[20] 董静,潘玉香,朱莉萍,等. 果蔬中54种农药残留的QuEChERS/GC-MS快速分析[J]. 分析测试学报,2008,27(1):66-69.
(责任编辑:张瑞麟)
2017-01-11
台州市科学技术局资助项目(162ny12)
王天玉,男,湖北襄阳人,助理研究员,硕士,从事农药与环境毒理学研究工作,E-mail:wangtianyu2011@163.com。
林 媚,E-mail:1311219778@qq.com。
10.16178/j.issn.0528-9017.20170410
S667.6
B
0528-9017(2017)04-0583-04
文献著录格式:王天玉,姚周麟,平新亮,等. QuEChERS-高效液相色谱法测定杨梅果实中苯醚甲环唑和乙基多杀菌素的农药多残留[J].浙江农业科学,2017,58(4):583-586,589.

