猪圆环病毒2型和猪伪狂犬病毒混合感染对仔猪血液生理生化指标的影响
刘永波,舒相华,吴常月,谢相悦,凌万旭,颜宏奎,宋春莲*
(1.云南农业大学动物科学技术学院,昆明650201;2.昆明伟牧得生物科技有限公司,云南昆明,650201)
猪圆环病毒2型和猪伪狂犬病毒混合感染对仔猪血液生理生化指标的影响
刘永波1,舒相华1,吴常月1,谢相悦1,凌万旭2,颜宏奎2,宋春莲1*
(1.云南农业大学动物科学技术学院,昆明650201;2.昆明伟牧得生物科技有限公司,云南昆明,650201)
为了解猪圆环病毒2型和猪伪狂犬病毒混合感染对仔猪血液生理生化指标的影响,本实验将34头仔猪分为第I组(PRV单感染组)、第Ⅱ组(PCV2单感染组)、第Ⅱ组(PCV2和PRV混合感染组)及对照组。分别在实验0、3、7、14、21、35天空腹前腔静脉采血分离血清,检测血清中IgG和血液生理指标。结果表明混合感染组IgG和对照组差异不显著,红细胞和血红蛋白和对照组比较在第14天差异显著,白细胞、淋巴细胞、中性粒细胞各时间段均显著低于对照组。该研究从血液学方面解释了PCV2和PRV混合感染的发病机制。
PCV2;PRV;混合感染;IgG;红细胞;白细胞
猪圆环病毒2型 (Porcine Circovirus Type 2, PCV2)是圆环病毒科的单链DNA病毒,该病原体与其他病毒或细菌病原体混合感染引起的猪圆环病毒相关疾病 (Porcine Circovirus-associated Disease,PCVAD),在世界范围内引起巨大经济损失[1]。由该病毒引起的断奶仔猪多系统衰弱综合征(Postweaning Multisystemic Wasting Syndrome ,PMWS)和猪呼吸道疾病综合征(Porcine RespiratoryDisease Complex,PRDC)以及其他一些等临床疾病近年来已在国际兽医领域引起高度重视[2]。猪伪狂犬病毒(Pseudorabies Virus,PRV)又称猪疱疹病毒Ⅰ型,是猪伪狂犬病的主要病原,因其拥有广泛的宿主,近年来被认为作为疱疹病毒的模型生物具有重要研究价值[3]。猪伪狂犬病可引起仔猪和保育猪致死性脑炎、育肥猪呼吸系统疾病和母猪的繁殖障碍[4],由于它可在感染猪外周神经系统产生终生的潜在影响,因此增加了该病的净化难度[5]。了解猪圆环病毒2型和猪伪狂犬病毒混合感染对仔猪血清生理生化指标的影响,对于研究两种疾病混合感染对仔猪血液指标的影响及发病机制意义重大。
1 材料与方法
1.1 实验材料
长白猪(公母各半,共34头,50日龄,未接种任何疫苗,PCV-2、PRV抗原检测阴性,适应饲喂7天);实验仔猪分为4组:第I组为PRV单感染组10头;第II组为PCV2单感染组10头;第III组为PRV+PCV2混合感染组10头;第IV组为对照组4头。
1.2 仪器与主要试剂
离心机、血清振荡器、恒温培养箱、双重纯水蒸馏器、Thermo酶标仪、立式压力蒸汽灭菌器、冰箱、全自动血液生化仪、全自动血液分析仪、PRV(106.5TCID50/ml)、PCV2(106TCID50/ml),PCV2和PRV由云南农业大学动物传染病实验室提供,均为第三代病毒。
1.3 实验方法
1.3.1 接种病毒
第Ⅰ组颈部肌肉注射PRV2ml;第Ⅱ组颈部肌肉注射PCV 2ml;第Ⅲ组颈部肌肉注射PRV 1ml和PCV2 1ml;第IV组颈部肌肉注射生理盐水2ml。
1.3.2 采血及检测
分别在实验第0、3、7、14、21、35天前腔静脉采血,分离血清冷藏备用。全自动血液生化仪检测血清IgG指标,全自动血液生化仪检测RBC、HGB、WBC、NEUT、LY和PLT各项血常规指标。
2 结果
因混合感染10头仔组在第12天起陆续死亡,故各项实验数据只采集到第14天。
2.1 免疫球蛋白(IgG)

图2.1免疫球蛋白IgG变化规律
由图2.1可见,各感染组的免疫球蛋白IgG在0-3天下降,低于对照组。PCV2和PRV单感染组都呈现先下降后上升的趋势,且第3天达最低峰值,第35天达最高峰值。PCV2和PRV单感染组比较在第 21、35天差压极显著(P<0.01),PCV2单感染组与对照组比较在第3天差异极显著(P<0.01)。混合感染与对照组比较,在3、7、14天差异均不显著。
2.2 红细胞数量(RBC)

图2.2 红细胞数量变化规律
如图2.2可见,3个感染组红细胞数量均低于对照组,PCV2单感染在第14天达最低峰值,与其他时间点相比,差异显著(p<0.05)。PRV单感染组红细胞数量低于对照组,但二者差异不显著。混合感染组在第7-14天红细胞数量上升,在第14天与对照组比较差异显著(p<0.05)。
2.3 血红蛋白计数(HGB)

图2.3 血红蛋白变含量变化规律
如图2.3可见,血红蛋白计数3个感染组总体上均低于对照组,PCV2单感染在第14天达最低峰值,与其他时间点相比,差异显著(p<0.05)。PRV单感染组血红蛋白计数总体上均低于对照组,但二者差异不显著(p>0.05)。混合感染组第7-14天上升,在第14天与对照组比较差异显著(p<0.05)。
2.4 白细胞总数(WBC)
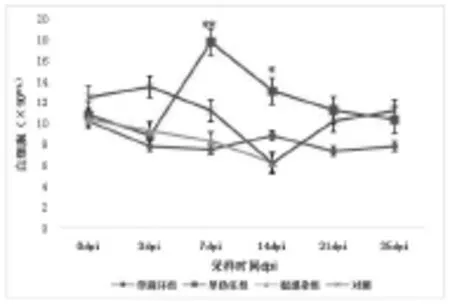
图2.4 白细胞数量变化规律
如图2.4可见,PCV2单感染组除第14天外均低于对照组,与对照组比较每个时间点差异均不显著(P>0.05)。PRV单感染组第0-3天下降,第3-7天快速上升,在第7天达最高峰值,与第14天比较差异不显著(P>0.05),与其他时间点比较差异显著(P<0.05),后逐渐下降。混合感染组呈现下降趋势,在第14天达最低峰值,与0、3、7天比较差异显著(P<0.05),与对照组比较在第14天差异不显著 (P>0.05),其余时间差异显著(P<0. 05)。
2.5 淋巴细胞数(LYM)

图2.5 淋巴细胞数量变化规律
由表图2.5可见,淋巴细胞数3个感染组均低于对照组,与对照组比较各时间点均为差异极显著(P<0.01)。均在第3天快速下降,第3-35天呈现较低的水平。混合感染组与2个单感染组比较在3、7、14天均低于两个单感染组,且在第7、14天差异显著(P<0.05)。
2.6 中性粒细胞数(GRA)
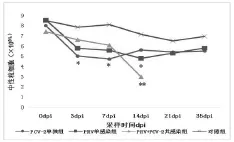
图2.6 中性粒细胞数量变化规律
由图2.6可见,中性粒细胞数3个实验组第3-35天均明显低于对照组,2个单感染组在第0-3天呈快速下降趋势,第3-7天缓慢下降,在第3、7、14天与对照组比较差异显著(P<0.05),后逐渐上升,第35天接近对照组;混合感染组在第0-7天缓慢下降,第7-14天快速下降,14天明显低于对照组,差异极显著(P<0.01)。
2.7 血小板数目(PLT)

图2.7 血小板细胞数量变化规律
从图表5.13可见,3个感染组血小板均低于对照组,单感染PCV2呈现先下降后上升的趋势,在第3天低于对照组,差异显著(P<0.05),第7天差异极显著(P<0.01),14天以后与对照组差异不显著(P>0.05)。PRV单感染组呈现下降,上升,在再下降,再上升的趋势,与对照组比较在第0、14天差异不显著(P>0.05),第3、7、21天差异极显著(P<0.01),第35天差异显著(P<0.05)。混合感染组先下降,再上升、再下降的趋势,与对照组比较在第3、14天差异极显著 (P<0.01),第7天差异显著(P<0.05)。
3 讨论
IgG是血清主要的抗体成分,约占血清Ig的75%,是唯一可以通过胎盘的免疫球蛋白。IgG的功能作用主要在机体免疫中起保护作用,大多数抗菌、抗病毒、具有多种生物学活性等,能有效地预防相应的感染性疾病[6]。免疫球蛋白IgG均呈现第0-3天下降,说明机体免疫机能下降,两个单感染组第3-21天上升,提示机体可能出现急性炎症反应。PCV2和PRV单感染组和混合感染组红细胞和血红蛋白均为先下降后上升的趋势,这可能是在临床上表现为先贫血后出血、淤血的主要原因。血小板计数异常是严重感染病变常见的临床表现,临床常把血小板计数作为监测感染凝血功能的简易指标[7]。三个实验组血小板均呈现较大的波动,偏高提示有组织炎症或内脏器官有出血、淤血,偏低可能是病毒引起造血系统受到损伤。PRV单感染组白细胞在3-7天急剧上升,这与仔猪表现的高热症状吻合,PCV2单感染组和混合感染组总体上呈白细胞总体下降,说明机体免疫功能低下。三个实验组仔猪淋巴细胞和中性粒细胞数量均显著低于对照组,说明机体造血系统受到损害,进而细胞吞噬功能下降,记忆、递呈、分化能力下降,这也是机体免疫抑制的主要表现之一。
猪圆环病毒2型与猪伪狂犬病混合感染可加速病猪的死亡,且临床表现呈非典型化,给养猪业造成了极大危害。由于两种病毒的混合感染常常合并其他病菌大量繁殖,且具有非典型性发病特征,给该病的诊断、预防和控制增加了很大难度[8]。研究PCV-2和PRV混合感染对于仔猪血液生理生化指标的影响,对于从血液学方面解释该病免疫抑制的机理具有重大意义。
[1]Luca Ferrari,PaoloBorghetti et al.MemoryTcell proliferative responses and IFN-γ productivitysustain long-lastingefficacy ofa Cap-based PCV2 vaccine upon PCV2 naturalinfection and associated disease.[J]. VeterinaryResearch.2014,45:44-60.
[2]Changhoon Park,Yeonsu Oh et al.Comparative Effects of Vaccination against Porcine Circovirus Type 2(PCV2) and Porcine Reproductive and RespiratorySyndrome Virusin a PCV2-PRRSVChallengeModel.[J].Clinical and Vaccine Immunology.2013,5(20):369-376.
[3]Yi-Quan Wu,Di-Jun Chen,Hua-Bin He et al. Pseudorabies Virus Infected Porcine Epithelial Cell Line Generates a Diverse Set ofHost MicroRNAs and a Special Cluster ofViral MicroRNAs.[J].PLOSONE. 2012,7:1-12.
[4]ZhenqingGu,Chengcai Hou,HaifengSun.Emergence of highlyvirulent pseudorabies virus in southern China.[J]. TheCanadianJournalofVeterinaryResearch.2015;79: 221–228.
[5]Hahn EC,Fadl-Alla B,Lichtensteiger CA.Variation of Aujeszky,s disease viruses in wild swine in USA.Vet Microbio.l 2010;143:45–51.
[6]刘生杰,朱茂英,顾士彬等.免疫球蛋白G(IgG)三种提取方法比较[J].畜牧兽医科学.2007,11(23):38-43.
[7]虞文魁,李维勤等.腹腔感染病人的血小板变化及其临床意义.[J].中国实用外科杂志.2005,5(23):292-295.
[8]王慧,宋宏晓,师丽刚等.猪繁殖与呼吸综合征、猪圆环病毒2型、猪伪狂犬病病毒混合感染的检测分析. [J].中国畜牧兽医.2012,39,(9):173-177.
S858.28
B
1003-8655(2017)02-0003-03
云南省科技惠民计划项目(2013CH001);昆明市科技合作重点项目(20130201AH023027)。
刘永波(1989-),河南人,男,硕士研究生,研究方向为动物疫病防控及中药免疫学, E-mail: 757259269@qq.com。
宋春莲(1972-),云南晋宁人,女,讲师,博士,E-mai1:466569879@qq.com。

