喜炎平注射液符合说明书适应症用药安全性的系统评价
陈媛媛+谢雁鸣+廖星+陈红玉

[摘要]系统评价喜炎平注射液符合说明书适应症用药的安全性。计算机检索国内、外8个数据库中有关喜炎平注射液符合说明书适应症(支气管炎、扁桃体炎、细菌性痢疾)用药的临床研究,根据纳排标准筛选文献,按照国际公认的评价标准进行质量评估,提取数据,并做分析。纳入118个研究,最终分析94个研究,包括70个随机对照试验,8个非随机对照试验,16个病例报告,共4716名患者使用喜炎平注射液,发生0例不良事件(AE),148例不良反应(ADR)。其中15例严重不良反应,包括1例植物状态,4例过敏性休克及其他心血管一般损害等;133例一般ADR中以腹泻最多,皮疹次之。大部分研究按说明书剂量使用。现有证据表明,临床应用中不合理配伍及使用可能导致部分ADR。大部分研究无法获知具体用药过程及患者情况,不能明确推测ADR与年龄、溶媒等关系。建议临床工作者按相关规定及标准判读因果关系,并上报不良反应报告,为评价此药安全性提供更多有力证据。
[关键词]喜炎平;说明书用药;系统评价;不良反应/事件;安全性
喜炎平注射液荣获多项国家专利,2010年获国药准字,拥有自主知识产权。最新版说明书记载其是一种具有清热解毒、止咳止痢功效,用于治疗支气管炎、扁桃体炎、细菌性痢疾等疾病的中药注射剂,成分为穿心莲内酯磺化物。上市30多年,临床应用广泛,其安全性也备受关注,国家食品药品监督管理总局于2012年6月25日发布《药品不良反应信息通报》(第48期)“警惕喜炎平注射液和脉络宁注射液的严重过敏反应”中提及喜炎平注射液严重不良反应中过敏反应所占比例较大。
迄今为止有许多临床试验或系统评价对喜炎平注射液的有效性及安全性进行了评价,但此类评价主要针对某类疾病,侧重于有效性,对安全性重视不足。有多篇关于喜炎平不良反应的文献分析,其纳入文献多为病例报告。2011年已有研究者发表了喜炎平不良反应的系统评价,依据PRIZMA评价标准,该研究报告质量偏低,且时隔4年,有新的安全性相关数据可供再分析。2012年江西青峰药业有限公司对喜炎平注射液说明书进行修订,由之前的“小儿酌减或遵医嘱”具体规定了小儿1日剂量为5~10mg·kg-1。基于上述情况,有必要更新喜炎平安全性的系统评价。本研究将全面收集符合喜炎平注射液说明书适应症用药情况下的安全性或不良反应方面的数据及文献信息,进行系统评价,为临床应用提供安全性评价证据。
1材料与方法
1.1检索策略
以“xiyanping”,“xiyanping injection”为检索词检索Cochrane图书馆,Embase,Web of science,Med.line。以“喜炎平”为检索词检索中国期刊全文数据库(CNKI),中国生物医学文献数据库(CBM),万方数据库,中文科技期刊全文数据库(VIP),ClinicalTrials,检索位置为题名。检索时间均为建库时间至2015年10月。硕博士论文及会议摘要等文献在上述前3个中文数据库中已检索。
1.2纳入与排除标准
1.2.1纳入标准
研究对象:临床应用喜炎平注射液的患者,疾病诊断为支气管炎、扁桃体炎、细菌性痢疾,不限年龄、性别;干预措施:单独使用或与其他药物联用,给药方式不限;结局指标:研究结果报道的不良反应/不良事件;研究类型:随机对照试验、非随机对照试验、队列研究、病例系列、病例对照、病例报告。
1.2.2排除标准
研究對象:临床诊断为说明书以外疾病应用喜炎平注射液的患者;研究类型:动物实验、基础研究、综述类评论性文献;重复的文献、重复发表或所用数据有重叠的文献;文中未涉及喜炎平“安全性”、“不良反应”或“副作用”;数据无法提取的文献;相关的横断面研究,如一些基于个别医院的调研。
1.3数据提取及文献质量评价
利用NoteExpress3软件对检索结果进行筛选,2个人(陈媛媛、陈红玉)根据篇名和摘要信息分别独立排除不符合纳入标准的文献,对于符合纳入标准或不确定的文献,下载全文信息进一步确定。分别筛选完成后进行核对,针对有歧义的文献,找第3方(谢雁鸣、廖星)定夺。
随机对照试验文献质量按Cochrane Reviewer'sHandbook 5.1评价标准条目和工具,根据“偏倚风险的评估工具(Version5.1.0)”评价;非随机对照试验文献质量参照TREND声明评估;观察性研究如队列、病例对照等按照STROBE进行质量评价;病例报告参考CARE进行质量评价。
1.4信息提取
在Excel中制定“文献信息提取表”,主要提取:研究一般情况、研究类型、疾病、总样本量、年龄、用药情况、给药方式、疗程、剂量、溶媒、观察的安全性结局指标、实际报告的ADR和AE。提取数据时特殊情况根据Cochrane手册处理,如①3组对照试验:2组未使用喜炎平的试验合在一起对比喜炎平组,2组均使用喜炎平但剂量不同按病例系列提取;②随机对照试验:2组均用喜炎平但用法用量不同降级为2个病例系列提取,2组均用喜炎平且用法用量相同合并为1个病例系列。
2结果
2.1文献检索结果
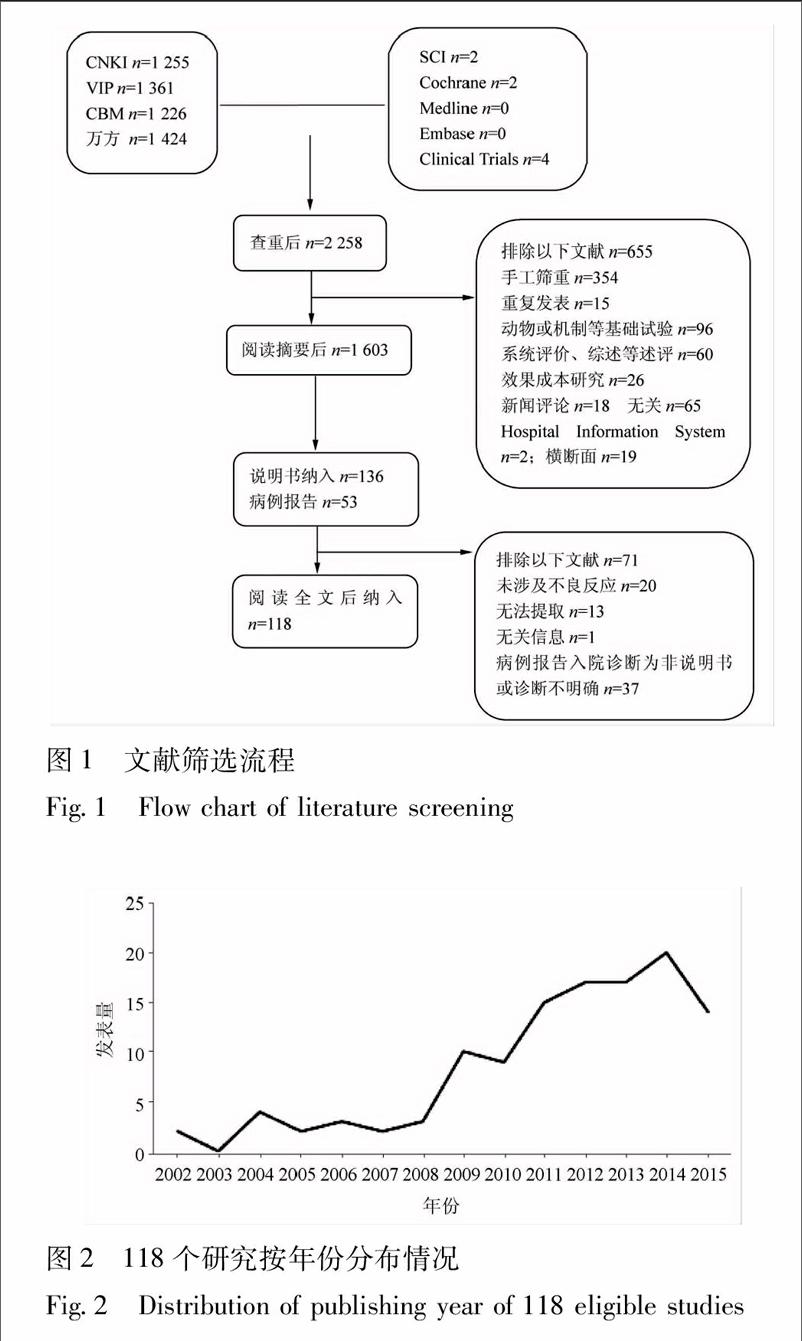
初检中文文献5266篇,英文文献8篇。剔除重复后剩余2258篇,阅读摘要剔除明显不符合纳入标准的文献655篇,符合纳入标准或需要进一步下载全文确定的文献189篇,阅读全文后排除71篇,最终纳入文献118篇。均为中文文献。详细流程见图1,文献发表量见图2。
2.2纳入研究的一般情况
共纳入118个研究,其中24个研究观察指标和结果未提及ADR/AE,而在讨论中有“该药副作用小、安全性高”等相关描述,此类研究不做质量评价和信息提取。共分析94个研究,包括70个随机对照试验,8个非随机对照试验,16个病例报告,再无其他类型的研究。所纳入分析的94个研究中43个研究报道发生不良反应,仅1个研究报道发生不良事件为0。共4716名患者使用喜炎平注射液,发生不良反应的有148例,占总人数3.14%。94个研究中17个研究报告了安全性指标,其余均未提及。纳入研究一般情况见表1。
2.3纳入研究的质量评价
70个随机对照试验按照Cochrane手册“偏倚风险的评估工具(Version5.1.0)”进行方法学质量评价:1个研究使用随机数字表分组,且采用单盲;15个研究告知随机分配方法,7个研究低偏倚风险,8个研究高偏倚风险,其余54个研究仅提及随机但未告知具体分配方法;均未提及分配隐藏;因未得知每个研究的研究方案,故不清楚结局数据是否完整、是否存在选择性报告和其他偏倚。评价结果:8个研究为B级,62个研究为C级。8个非随机对照试验:根据TREND声明评价,12分以上为高质量研究。评价结果:均为低质量研究。
16个病例报告:按照CARE评价,7分以上为高质量研究。评价结果:只有1个为高质量研究,其余均为低质量研究。
2.4 ADR/AE结果分析
16个病例报告与78个其他类型研究相比,患者情况、用药及ADR描述差异较大,因此分为两部分分析,
2.4.1 16个病例报告基本特征具体情况见表2。
2.4.2 16个病例报告一般情况
纳入16个病例报告涉及16名患者共发生16例不良反应。不良反应按照国家药品不良反应报告和监测管理办法分级,共14例严重不良反应,2例一般不良反应。按照《WHO不良反应术语集》累及系统划分,不良反应主要表现在心血管系统、全身损害、皮肤及其附件损害、呼吸系统和胃肠损害等。
2.4.2.1严重不良反应发生情况14例严重不良反应中最严重的1例是植物状态,患者无药物过敏史,未与其他药物联用,推测与喜炎平关系较大;严重不良反应中过敏性休克较常见,共4个研究,3个研究单独用药,1个研究与其他药物联用,但先使用喜炎平且不良反应出现在使用喜炎平过程中,推测与喜炎平相关;中枢及外周神经系统不良反应较少见,仅1例,与复方甘草酸苷合用,原始研究者认为不良反应与喜炎平相关;呼吸系统不良反应1例,单独用药,推测与喜炎平关系较大。
2.4.2.2一般不良反应发生情况2例一般不良反应中1例。。全身大面积皮疹,原始研究者不能确定是其他药物引发还是与喜炎平合用引发;1例肠痉挛,具体用药不明确,无法推测其与喜炎平关系,具体见表3。
2.4.2.3不良反应与过敏史关系6个研究报告了过敏史情况,占37.5%。其中严重不良反应报道5例,2个研究有炎琥宁和头孢过敏史,3个研究无过敏史;一般不良反应报道1例,患者无过敏史。由于样本量小且报道不全,不能明确不良反应与过敏史关系。
2.4.2.4不良反应与剂量关系严重不良反应中1个研究未标明剂量,9个5岁以下儿童,儿童用药剂量按体重换算,仅2个研究说明体重,参照WHO儿童体重标准换算后,仅有1个研究用药剂量轻微超出说明书具体标准;一般不良反应中2个研究剂量未超出说明书使用。由有限数据推测,尚不能推测不良反应与剂量有关系。
2.4.2.5不良反应发生时间
有4个研究未报道不良反应出现时间,1个研究描述不准确,其他研究不良反应出现时间在滴注喜炎平20min之内,其中5 min最为常见,共5个研究,占31.25%。
2.4.2.6不良反应愈后16个研究均说明了愈后情况,除1例“持续植物状态”,其他均缓解好转。
2.4.3其他研究类型结果
2.4.3.1部分研究数据处理对于RCT中治疗组、对照组均使用喜炎平治疗但剂量、给药途径不同的研究降级为病例系列提取数据;RCT中治疗组、对照组均使用喜炎平且用法用量相同的研究合并为1个病例系列提取;分为3组对比研究的按以下处理:①2组未使用喜炎平的试验合在一起对比喜炎平组;②2组均使用喜炎平但剂量不同按病例系列提取。因此将78个研究进行拆分和转换后,共得到83个研究,包括64个随机对照试验,7个非随机对照试验,12个病例系列。
有2个研究描述为“高剂量组不良反应4例,呕吐伴腹泻1例,轻度腹泻4例”,提取数据时按照“共发生不良反应4例,发生轻度腹泻4例次,呕吐伴腹泻1例次”。
2.4.3.2 64个随机对照试验基本特征64个研究涉及3 621名患者,均为联合用药;7个研究使用雾化吸入,1个研究未报告给药途径,1个研究给药途径为静脉滴注或肌肉注射;仅1个研究报告发生0例不良事件,其余均为不良反应,43个研究报告未出現不良反应,21个研究报告不良反应78例。10个研究报告了处理措施,治疗后均好转。
2.4.3.3 7个非随机对照试验基本特征具体见表4,12个病例系列见表5。
2.4.4其他类型研究一般情况
共分析83个研究,涉及4 700名患者,仅1个研究提及不良事件为0,不良反应4例;其他研究均为不良反应。共发生132例不良反应,1个研究“发生1例过敏反应”,未进行描述,将其他不良反应按照国家药品不良反应报告和监测管理办法分级,有1例严重不良反应,131例一般不良反应;按照《WHO不良反应术语集》累及系统划分,不良反应主要表现在胃肠损害、皮肤及附件损害、用药部位损害、呼吸系统损害和中枢及外周神经系统损害。
2.4.4.1是否联合用药83个研究中仅1个研究单独用药,其他研究均与其他药物或常规治疗联合使用,无法具体明确不良反应与喜炎平关系。
2.4.4.2不良反应发生情况纳入83个研究中1个研究未描述其不良反应,其余82个研究,131例不良反应中,有1例严重不良反应,表现为呼吸困难;一般不良反应中以腹泻最常见,占30.12%,皮疹次之,寒颤高热较少见,具体见表6。
2.4.4.3不同给药途径ADR结果分析83个研究中,1个研究未报告给药途径,1个研究给药途径为静脉滴注或肌肉注射,未进行数据分析。其他研究包括静脉滴注、雾化吸入2种给药途径,以静脉滴注为主,占91.64%。雾化吸入不良反应发生频率低,仅0.52%。说明书中未将雾化吸入作为喜炎平注射液的给药途径。
2.4.4.4不同剂量ADR结果分析按给药途径分不同剂量对比结果,73个研究采用静脉滴注,其中1个研究未报告剂量,1个研究剂量不明确,未进行数据分析,静脉滴注出现不良反应最多的剂量为0.4 mL·kg-1·d-1,占30.23%;用量最多为500mg,未见不良反应。8个研究采用雾化吸入,雾化吸入用量为50 mg,出现不良反应2例,具体见表7。
2.4.4.5不同年龄ADR结果分析83个研究涉及4700名患者,其中5个研究描述为“治疗组小于1岁8例,1~6岁28例,大于6岁24例”,无法获得确切数据;13个研究未报告具体年龄;年龄区间跨度较大,无法明确推测不良反应与年龄关系。
2.4.4.6不同溶媒ADR结果分析73个研究使用静脉滴注,10个研究未报告溶媒,7个研究使用“5%葡萄糖或生理盐水”或“10%葡萄糖或生理盐水”,分析3281名患者数据,其中以5%葡萄糖作为溶媒使用最多,占91.71%,不良反应发生频率为2.69%;0.9%氯化钠作为溶媒使用较少,占1.83%,不良反应发生频率为0;说明书未将10%葡萄糖列为溶媒,具体见表8。
3讨论
3.1不良反应/事件评定
本研究共分析94个研究,仅1个研究提及不良事件,其余均为不良反应。根据《现代药学名词手册》收录的WHO定义,不良反应是“药物在正常的人用剂量下,用于疾病的预防、诊断、治疗或调节生理功能时发生的有害的或非预期的反应”不良事件定义相对于不良反应“在国际上有一种习惯,把与药物有一定关系出现的非用药目的的反应称不良反应,而不能与用药肯定相关及不可能相关发生的反应称为不良事件”。国际ADR因果关系评价方法大多以Karch和Lasagna评定办法引为基本准则,我国ADR因果关系参考依据主要是《药品不良反应报告和监测管理办法》,其于2012年再次修订,但大部分研究并没有说明按照相关参考依据进行因果关系评定,建议临床工作者及时按照相关规定上报不良反应并规范报告标准,为评价药品安全性提供可靠依据。
3.2不良反应原因探讨
3.2.1常见不良反应原因
根据上述分析结果可知,喜炎平不良反应中最常见为腹泻,有动物试验研究喜炎平的急性毒性和长期毒性,结果显示其主要不良反应在胃肠道和注射部位,血清学、尿液、心电图及眼科检查未见明显异常,出现一过性的呕吐或腹泻的动物经组织病理学检查未发现胃肠异常变化,原始研究者推测与药物性质寒凉有关;其次为皮疹,有研究进展指出中药注射剂过敏反应很大部分属于类过敏反应,就症状而言其与过敏反应高度相似,以皮损症状居多,首次用药即可出现速发性变态反应症状。其中有动物研究对喜炎平的皮肤类过敏反应进行分析,结果指出,“喜炎平过敏反应为阴性,临床剂量下类过敏反应为强阳性,随剂量增加而加重”。
3.2.2不良反应与药物配伍
有研究报道喜炎平注射液与头孢他啶、利巴韦林等16种药物联合使用后不溶微粒数量明显增加,且均超出药典规定数量,也有研究提出了相关配伍禁忌,提醒医务工作者按照说明书警告不要将喜炎平与上述药物在同一容器混合使用。
3.2.3不良反应与溶媒
纳入研究中绝大部分使用5%葡萄糖作为溶媒,有研究表明作为稀释剂药液,相同浓度下0.9%氯化钠产生的不溶微粒较5%葡萄糖少;用药浓度对不溶微粒也有较大影响,随着药液使用量增加不溶微粒也逐渐增多。本次研究中发现使用0.9%氯化钠为溶媒不良反应发生频率小于5%葡萄糖,但因只有60人使用0.9%氯化钠作为溶媒,且无法获知放置时间,尚不能推测不良反应与溶媒关系;该研究同时发现不溶微粒随放置时间延长而增加,为确保临床安全用药,建议放置时间不宜超过4 h,药液使用量不宜大于20mL。
3.2.4不良反应与剂量
纳入94个研究中仅1个用药轻微超出标准剂量,以现有研究难以推測不良反应与剂量的关系。有基于真实世界的喜炎平注射液HIS临床剂量应用分析的研究也得出相同结论。
3.2.5不良反应与年龄
纳入研究的样本量年龄跨度大,且无法明确发生不良反应患者的年龄,无法明确推测不良反应与年龄关系。
3.3本研究与喜炎平注射液说明书对比
本研究限定说明书适应症,而对超出说明书的溶媒、给药方式等使用喜炎平时所发生的ADR,也纳入本研究分析,归为广义ADR。喜炎平在临床使用中除说明书用药外,主要用于手足口病、上呼吸道感染、肠炎等,2010年将喜炎平列入治疗手足口的中成药,治疗甲型H1N1流感的中药注射剂,也被列为治疗发热伴血小板减少的推荐用药;用法方面,临床应用雾化吸人治疗上呼吸道感染等,疗效较好,安全性有待进一步佐证,建议做相关研究以增加临床用药途径和安全性;本研究结果显示喜炎平的不良反应中胃肠系统损害为51.81%,而说明书中并未体现腹泻、恶心、呕吐等,出现4例过敏性休克,说明书也尚未记载。
3.4本研究局限性
本研究尽量全面检索符合说明书适应症的临床研究,但纳入研究质量偏低,且主要是研究有效性,不良反应事件常为次要指标,无法明确滴速、用药浓度、患者具体情况,不能明确不良反应与以上因素的因果关系,仍需要开展以安全性为主要结局指标的大样本、多中心、长期性的研究提供有力证据。另外,本研究不涉及相关利益冲突。

