心肌Cav1.2钙通道NT片段的提取纯化及其与CaM的相互作用
苏敬阳,邵冬雪,雷明,康泽,赵君,方涵田,郭凤,赵美眯,郝丽英,封瑞
(中国医科大学药学院药物毒理学教研室,沈阳110122)
心肌Cav1.2钙通道NT片段的提取纯化及其与CaM的相互作用
苏敬阳,邵冬雪,雷明,康泽,赵君,方涵田,郭凤,赵美眯,郝丽英,封瑞
(中国医科大学药学院药物毒理学教研室,沈阳110122)
目的探讨心肌Cav1.2钙通道NT蛋白片段提取与纯化的方法,并研究其与CaM的相互作用。方法将NT的cDNA插入pGEX-6p-3质粒载体后,转化大肠杆菌BL-21感受态细胞,大量培养并利用异丙基硫代-β-D半乳糖苷(IPTG)诱导NT的GST融合蛋白表达,GS-4B beads分离纯化,PreScission蛋白酶切除GST标签,进行十二烷基硫酸钠-聚丙烯酰氨凝胶电泳(SDSPAGE)检测蛋白纯度和相对分子质量。采用GST pull-down实验研究NT片段与CaM的相互作用。结果SDS-PAGE结果显示成功纯化获得NT蛋白片段,且具有较高的纯度。GST pull-down实验结果显示NT可与CaM结合,且具有浓度依赖性。结论本研究成功制备与纯化了心肌Cav1.2钙通道NT蛋白片段,为深入研究蛋白相互作用及NT的生物学功能奠定了基础。
NT;提取;纯化;CaM;GST pull-down实验
L型电压门控钙离子通道控制细胞钙离子(Ca2+)对膜电位变化的反应,并在心肌动作电位的产生、兴奋收缩偶联、激素和神经递质的分泌、释放等过程中起着重要的调节作用[1-5]。其中Cav1.2钙通道在心肌中高表达,是Ca2+进入细胞的主要途径,其C末端近端的PreIQ和IQ基序是公认的CaM结合位点,与CaM的相互结合在钙依赖性易化(Ca2+-dependent facilitation,CDF)和钙依赖性失活(Ca2+-dependent inactivation,CDI)调节过程中有显著作用[6-8]。然而,除了C末端的CaM结合区域外,还包括N末端的结合区域。据报道[9],L型钙通道N末端的色氨酸残基(心肌中W82位点,神经元中W52位点)是CaM的结合位点,参与钙通道CDI的发生,这个结合区域被命名为NSCaTE(N-terminal spatial Ca2+transforming element)。研究发现,Cav1.2钙通道N末端包含蛋白激酶的结合位点,这表明与钙通道C末端相同,CaM与蛋白激酶的作用靶点邻近。可见,心肌Cav1.2钙通道NT对机体调节有重要作用和研究意义。
本研究探讨了心肌Cav1.2钙通道NT蛋白片段提取与纯化的方法,并利用GST pull-down实验研究了其与CaM的相互作用,为深入研究蛋白相互作用及NT的生物学功能奠定了基础。
1 材料与方法
1.1 材料
pGEX-6p-3/CaM质粒由日本鹿儿岛大学KAMEYAMA教授惠赠;pGEX-6p-3/NT质粒由上海生工生物工程股份有限公司合成及提供;异丙基硫代-β-D半乳糖苷(isopropyl-beta-D-thiogalactopyranoside,IPTG)、氨苄西林(ampicillin,Amp)、溶菌酶(lysozyme,LYS)、N-十二烷基肌氨酸钠(N-laurylsarcosine,N-Lau)、TritonX-100均购自Sigma公司;Glutathione-Sepharose 4B beads(GS-4B beads)、PreScission Protease,购自英国GE Healthcare公司。
1.2 方法
1.2.1 GST-NT融合蛋白的诱导及表达:将重组质粒pGEX-6P-3/NT转化入E.coliBL-21感受态细胞中,在含有50 μg/mL Amp的LB培养液中培养,37℃水浴、100 r/min振荡过夜。当OD600在0.6~1.0范围内,加入终浓度为1 mmol/L的IPTG,37℃水浴、110 r/min振荡4 h诱导重组蛋白表达。
1.2.2 NT蛋白的提取纯化:诱导表达重组蛋白4 h后,将菌液4 000 r/min离心10 min,弃掉上清收集沉淀。将沉淀用磷酸盐缓冲液(phosphate bufer,PBS)重悬(20 mL PBS/400 mL菌液),加入20 mg/mL溶菌酶LYS和1 mol/L DTT各200 μL,15%的N-Lau 2 mL,混匀后冰上放置30 min。用超声波细胞粉碎机处理20 min,超声3 s停7 s,6℃。后加入30%TritonX-100 667 μL,冰上放置30 min。15 000 r/min离心10 min,取上清置于15 mL EP管中,与PBS洗过的GS-4B beads在4℃冰箱内孵育摇晃过夜。第2日清晨800 r/min离心弃上清,beads用5 mL Tris buffer洗4次,然后转移至2 mL EP管中,加495 μL Tris buffer、5 μL PreScission蛋白酶,室温旋转5 h。牛血清白蛋白(bovine serum albumin,BSA)为标准品,Bradford法测蛋白浓度。
1.2.3 NT蛋白纯度的鉴定:分别将超声后NT菌液、酶切之前的GST-NT融合蛋白、酶切后的沉淀beads和上清NT蛋白,经5×loading缓冲液室温处理后,煮沸5 min,进行15%SDS-PAGE电泳确认,考马斯亮蓝染色,根据蛋白条带位置比对marker条带位置检测纯化的NT相对分子量和纯度。
1.2.4 CaM的分离纯化:CaM蛋白的分离纯化参照本实验室之前的研究方法[10]。
1.2.5 GST pull-down实验观察NT与CaM的相互作用:取连接于GS-4B beads的GST-NT蛋白40 μL于2 mL EP管中,加入CaM(终浓度分别为0.35,0.7,1.4,2.1,3.5,7.0,10.0 μmol/L),0.1 mol/L CaCl26 μL([Ca2+]2 mmol/L),Tris Buffer(pH 8.0)补齐到300 μL的体系。4℃,孵育4 h。800 r/min,离心3 min,转移至1.5 mL EP管中,离心弃上清,同样步骤用Tris Buffer(pH 8.0)清洗beads 2遍,最后一遍吸净上清。加入15 μL 5×SDS loading buffer洗脱处理,煮沸5 min,上清经15%SDS-PAGE电泳确认。
2 结果
2.1 NT蛋白的提取与纯化
本研究采用超声破碎法获得GST-NT融合蛋白,此融合蛋白经PreScission蛋白酶酶切后,得到高纯度的NT蛋白。将超声后的菌液、GST-NT融合蛋白以及经PreScission蛋白酶酶切之后的沉淀beads、上清分别进行15%SDS-PAGE电泳,经考马斯亮蓝染色、脱色后,在表观分子量约为40 000(GST-NT)、26 000(GST)和14 000(NT)处出现蛋白条带,与预期结果一致。表明经PreScission蛋白酶酶切后,上清中获得纯度较高的NT蛋白,而沉淀中主要为GST蛋白。说明PreScission蛋白酶能够切掉GST-NT蛋白上的GST标签,得到纯度较高的NT蛋白片段。见图1。
2.2 GST-NT与CaM相互作用
提取与纯化得到的GST-NT蛋白与CaM进行pull-down实验,在2 mmol/L[Ca2+]条件下,GST-NT与不同浓度的CaM蛋白孵育,然后进行15%聚丙烯酰胺凝胶电泳,经考马斯亮蓝染色、灰度值分析后,CaM可与GST-NT结合,随着反应体系中的CaM浓度的增加,结合到GST-NT上的CaM也逐渐增加,呈浓度依赖性,表明GST-NT具有与CaM结合的能力。见图2。
3 讨论
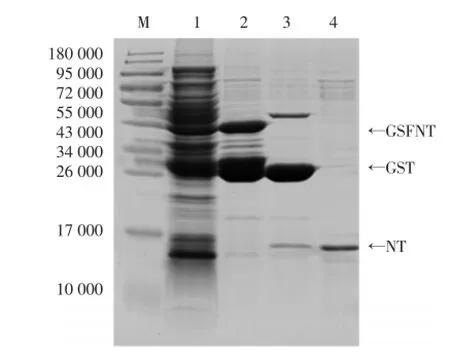
图1 PreScission蛋白酶酶切NT蛋白Fig.1Purification of the NT peptide after cleavage with PreScission protease to remove the GST tag
心肌Cav1.2钙通道调节控制细胞内很多重要的反应,CaM是调节Cav1.2钙通道活性过程中的钙感受器[9,11],CaM可与钙通道C末端IQ区域、PreIQ区域、Ⅰ-Ⅱ环以及N末端等区域结合,从而调节钙通道的CDF和CDI。近年来,钙通道C末端IQ区域和PreIQ区域与CaM的结合作用以及可能的生理与病理学意义得到了广泛的研究,而N末端的研究相对较少,因此,提取纯化NT蛋白片段对探寻心肌Cav1.2钙通道的相关生物学功能具有重要的意义。前期研究证实CaM与Cav1.2钙通道的结合具有浓度依赖性和Ca2+依赖性。有研究[12]发现,某些合成短肽或多肽片段只能结合一个CaM蛋白分子,这表明在很多大的蛋白分子中仅有一个CaM结合位点。然而在Cav1.2通道的C末端的IQ和PreIQ区域存在多个CaM结合位点[7-8],可结合多个CaM蛋白分子[13]。不仅如此,研究[9,14]发现,除了Cav1.2钙通道C末端外,N末端也可能存在CaM结合位点,且应具有更重要的功能意义。本研究进一步证实了在[Ca2+]为2 mmol/L条件下,CaM与NT蛋白片段存在浓度依赖性的结合作用,推测这种结合作用在维持钙通道功能方面起到关键作用,然而更为详细的结合模式需要进一步的实验研究。
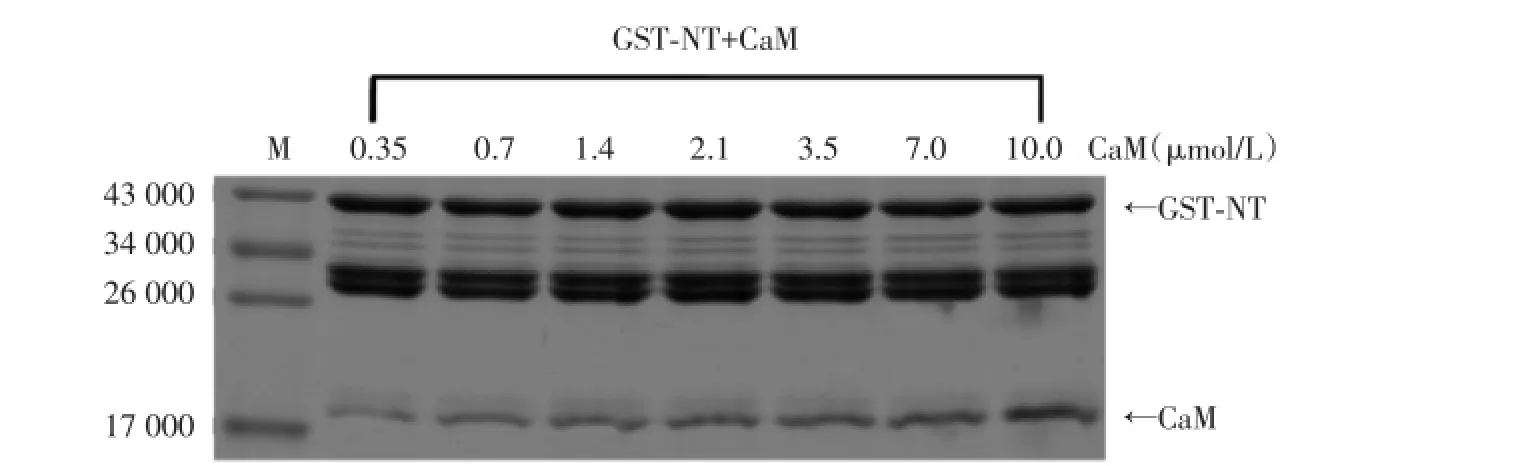
图2 CaM与GST-NT结合的浓度依赖性Fig.2Concentration-dependent binding of CaM to GST-NT
本研究中采用超声破碎法获得GST-NT重组蛋白,应用PreScission蛋白酶酶切GST标签,酶切效率高,GST标签几乎全部被切下,提取纯化出的单纯NT蛋白片段的纯度较高。而其他通道蛋白如CT1片段用此法则不能够制备出,单纯应用PreScission蛋白酶虽然能够提取纯化出CT3蛋白片段,但浓度低,需要加DTT才能获得高浓度蛋白片段。因此,NT蛋白片段的提取纯化相对简单易操作,效率高。目前,在提取纯化NT蛋白片段的研究中,尚未采用B-per试剂盒、变性再复性、联合应用DTT等方法,也并未对NT蛋白片段与CaM突变体的结合作进一步研究,这些有待于在今后的实验中进一步证实。
综上所述,本研究成功提取纯化了NT蛋白片段,同时鉴定了NT蛋白片段的纯度和相对分子质量,利用GST pull-down实验方法完成了其与CaM的相互作用,为深入研究NT与其他蛋白的相互作用及其生物学意义奠定了坚实的基础。
[1]CATTERALL WA.Structure and regulation of voltage-gated Ca2+channels[J].Annu Rev Cell Dev Biol,2000,16:521-555.DOI:10.1146/annurev.cellbio.16.1.521.
[2]NYSTORIAK MA,NIEVES-CINTRON M,NAVEDO MF.Capturing single L-type Ca2+channel function with optics[J].Biochim Biophys Acta,2013,1833(7):1657-1664.DOI:10.1016/j.bbamcr.2012.10.027.
[3]SATIN J,SCHRODER EA,CRUMP SM.L-type calcium channel auto-regulation of transcription[J].Cell Calcium,2011,49(5):306-313.DOI:10.1016/j.ceca.2011.01.001.
[4]SCHRODER E,BYSE M,SATIN J.L-type calcium channel C terminus autoregulates transcription[J].Circ Res,2009,104(12):1373-1381.DOI:10.1161/CIRCRESAHA.108.191387.
[5]MAGYAR J,JENES A,KISTAMAS K,et al.Long term regulation of cardiac L-type calcium channel by small G proteins[J].Curr Med Chem,2011,18(24):3714-3719.DOI:10.2174/092986711796642 436.
[6]BLAICH A,PAHLAVAN S,TIAN Q,et al.Mutation of the calmodulin binding motif IQ of the L-type Cav1.2 Ca2+channel to EQ induces dilated cardiomyopathy and death[J].J Biol Chem,2012,287(27):22616-22625.DOI:10.1074/jbc.M112.357921.
[7]PITT GS,ZUHLKE RD,HUDMON A,et al.Molecular basis of calmodulin tethering and Ca2+-dependent inactivation of L-type Ca2+channels[J].J Biol Chem,2001,276(33):30794-30802.DOI:10.1074/jbc.M104959200.
[8]KIM J,GHOSH S,NUNZIATO DA,et al.Identification of the components controlling inactivation of voltage-gated Ca2+channels[J]. Neuron,2004,41(5):745-754.DOI:org/10.1016/S0896-6273(04)00081-9.
[9]DICK IE,TADROSS MR,LIANG H,et al.A modular switch for spatial Ca2+selectivity in the calmodulin regulation of Cav channels[J]. Nature,2008,451(7180):830-834.DOI:10.1038/nature06529.
[10]何桂林,郭凤,封瑞,等.重组钙调蛋白及其突变体蛋白的分离纯化及活性鉴定[J].中国生化药物杂志,2012,33(6):743-746.
[11]LEE A,ZHOU H,SCHEUER T,et al.Molecular determinants of Ca2+/calmodulin-dependent regulation of Cav2.1 channels[J]. Proc Natl Acad Sci USA,2003,100(26):16059-16064.DOI:10.1074/jbc.M111.292581.
[12]XIONG L,KLEEREKOPER QK,HE R,et al.Sites on calmodulin that interact with the C-terminal tail of Cav1.2 channel[J].J Biol Chem,2005,280(8):7070-7079.DOI:10.1074/jbc.M410558200.
[13]FALLON JL,BAKER MR,XIONG L,et al.Crystal structure of dimeric cardiac L-type calcium channel regulatory domains bridged by Ca2+calmodulins[J].Proc Natl Acad Sci USA,2009,106(13):5135-5140.DOI:10.1073/pnas.0807487106.
[14]ASMARA H,MINOBE E,SAUD ZA,et al.Interactions of calmodulin with the multiple binding sites of Cav1.2 Ca2+channels[J].J Pharmacol Sci,2010,112(4):397-404.DOI:10.1254/jphs.09342 FP.
(编辑 于溪)
Expression and Purification of an N-terminal Fragment of the Cav1.2 Calcium Channel and Characterization of Its Interaction with Calmodulin
SU Jingyang,SHAO Dongxue,LEI Ming,KANG Ze,ZHAO Jun,FANG Hantian,GUO Feng,ZHAO Meimi,HAO Liying,FENG Rui
(Department of Pharmaceutical Toxicology,School of Pharmacy,China Medical University,Shenyang 110122,China)
ObjectiveTo investigate a method for the purification of the N-terminal peptide fragment(NT)of the myocardial calcium channel Cav1.2,and characterize its interaction with calmodulin(CaM).MethodsEscherichia coliBL-21 cells were transformed with plasmid pGEX-6p -3/NTharboringtheNT-GSTfusiongene.ThecellsharboringpGEX-6p-3/NTwereculturedandproteinexpressionwasinducedwithisopropyl-β-D-thiogalactoside(IPTG).Then,the GST-NT fusion protein was purified by using glutathione Sepharose 4B(GS-4B)beads.GST was cleaved off with the PreScission protease,and SDS-PAGE was performed to detect the purity and relative molecular weight of the purified peptide.Further,GST pull-down assay was performed to characterize the interaction of the NT peptide with CaM.ResultsSDS-PAGE analysis showed that the NT peptide was successfully purified,with high purity.Results of the GST pull-down assay showed that the NT peptide could interact with CaM.ConclusionThis study establishes a method for the purification of the NT peptide and lays the foundation for further research on the interaction partners and biological functions of NT.
NT;extraction;purification;CaM;GST pull-down assay
R96
A
0258-4646(2017)05-0397-04
10.12007/j.issn.0258-4646.2017.05.004
国家自然科学基金(31400981,31471091);大学生创新计划项目(2015069,201510159068,201510159047,2016101 59000064)
苏敬阳(1992-),女,硕士研究生.
封瑞,E-mail:fengrui527@163.com
2016-11-10
网络出版时间:

