磷石膏制备高纯硫酸钙的循环工艺
黄朝德,张泽强,邵一鑫,孙桦林,余 洪
(武汉工程大学资源与土木工程学院,湖北 武汉430074)
磷石膏制备高纯硫酸钙的循环工艺
黄朝德,张泽强*,邵一鑫,孙桦林,余 洪
(武汉工程大学资源与土木工程学院,湖北 武汉430074)
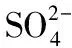
磷石膏;循环工艺;除杂;高纯硫酸钙

磷石膏的综合利用是一个全球性的难题。目前,欧美等国家的磷石膏综合利用率已经超过40%,日本甚至达到了100%,而我国综合利用率还不到20%[9-10]。磷石膏的综合利用主要在以下几个方面:(1)农业方面,用作土壤改良剂、复合肥原料等[11];(2)建材方面,用作建筑石膏、石膏水泥等[12-13];(3)化工方面,用于生产硫酸铵、碳酸钙、硫酸等[14-15]。尽管磷石膏资源化综合利用的途径很多,但受成本等诸多因素影响,各种方法还未得到广泛的推广和应用。作者采用化学试剂循环利用工艺,用磷石膏制备高纯度的硫酸钙产品,既可解决磷石膏堆存问题,又可产生较好的经济效益和社会效益。
1 实验
1.1 原料
磷石膏原料取自湖北宜昌某化工厂。X-射线衍射分析结果表明,磷石膏中主要成分为CaSO4,其次为SiO2,还有少量胶磷矿和硅铝酸盐。其主要成分化学分析结果见表1,其中CaSO4的质量分数为70.38%。
表1 磷石膏主要成分的化学分析/%

Tab.1 Chemical analysis of main composition in phosphogypsum/%
1.2 原理
用NaOH溶液分解磷石膏,可将其中的CaSO4·2H2O转化为Ca(OH)2和Na2SO4,得到钙渣和Na2SO4溶液。其主要反应为:
CaSO4·2H2O+2NaOH→Na2SO4+Ca(OH)2↓+2 H2O
(1)
反应(1)在298 K(25 ℃)时,标准吉布斯自由能△Gθ=-81.33 kJ,标准热效应△Hθ=-66.43 kJ,说明它是一放热反应,热力学上很容易自发进行。
由于钙渣中除Ca(OH)2外还含一些其它杂质,品质不高,只能用作一般的建筑材料。要提高其附加值,还需进一步除杂处理。钙渣中杂质主要是酸不溶渣,故用盐酸来溶解其中的Ca2+,除去酸不溶渣,得到较纯的CaCl2溶液。其主要反应为:
Ca(OH)2+2HCl→CaCl2+2H2O
(2)
鉴于硫酸的酸性比盐酸强,将硫酸加到CaCl2溶液中,可发生交换反应,得到CaSO4沉淀,同时生成盐酸。其主要反应为:
CaCl2+H2SO4→CaSO4↓+2HCl
(3)
磷石膏经过上述反应后,得到的固相产物有高纯CaSO4和酸不溶渣,液相产物有盐酸和Na2SO4溶液。其中,盐酸溶液可直接循环用于溶解钙渣中的Ca2+,Na2SO4溶液则可用双极膜电渗析法电解,得到NaOH和H2SO4溶液[16]。其反应为:
Na2SO4+2H2O→2NaOH+H2SO4
(4)
电解产生的NaOH可循环用于分解磷石膏,产生的H2SO4可循环用于与CaCl2进行交换反应,以沉淀出高纯硫酸钙产品。所以,采用化学试剂循环利用工艺处理磷石膏,得到的主要是纯度和附加值较高的硫酸钙产品及少量酸不溶渣。
1.3 方法
用双极膜电渗析法电解Na2SO4溶液,已有较深入的研究,详见文献[16]。分解磷石膏得到的Na2SO4溶液,浓度约为1.06 mol·L-1。经双极膜电渗析后,可以获得浓度约为2.40 mol·L-1的NaOH溶液和浓度约为1.20 mol·L-1的H2SO4溶液,Na2SO4电解转化率为87.57%。
实验均在室温下进行。取适量磷石膏样品置于锥形瓶中,在搅拌下缓缓加入适量浓度为2.40 mol·L-1的NaOH溶液,反应10 min后过滤得到Na2SO4溶液和钙渣。测定Na2SO4溶液中SO3含量,计算其占磷石膏中SO3的质量分数,得到CaSO4转化率,用于评价磷石膏分解效果。将钙渣用适量盐酸溶解,得到CaCl2溶液和酸不溶渣。测定酸不溶渣的质量,计算其占磷石膏的质量分数,得到酸不溶渣产率,用于确定溶解钙渣的适宜工艺条件。将CaCl2溶液与适量硫酸溶液混合,进行交换反应,沉淀出高纯硫酸钙产品。测定硫酸钙的质量,计算其占磷石膏的质量分数,得到硫酸钙产率,用于确定硫酸溶液交换沉淀硫酸钙的适宜工艺条件。最后将在较优工艺条件下得到的硫酸钙产品进行化学分析,计算CaSO4的纯度和回收率,评价硫酸钙产品的制备效果。化学试剂用量是实验考察的重要因素,为便于技术经济核算,均用单位质量磷石膏消耗的化学试剂物质的量表示(mol·kg-1)。
2 结果与讨论
2.1 氢氧化钠分解磷石膏实验
由式(1)可知,NaOH分解磷石膏属复分解反应,热力学上很容易自发进行。实验表明,影响磷石膏分解效果的关键因素为NaOH用量,其它因素影响较小。理论上NaOH用量应为磷石膏中CaSO4物质的量的2倍。考察NaOH用量对CaSO4转化率的影响,结果见图1。

图1 NaOH用量对CaSO4转化率的影响
由图1可见,CaSO4转化率随NaOH用量增大而提高,但NaOH用量达到11.4 mol·kg-1后,CaSO4转化率提高已不明显,故适宜的NaOH用量为11.4 mol·kg-1,此时磷石膏中CaSO4转化率为93.62%。
2.2 盐酸提纯钙渣实验
用盐酸提纯钙渣实际上是盐酸与Ca(OH)2间的酸碱中和反应。实验表明其反应速率非常快,而且放出大量的热量。由式(2)可知,理论上盐酸用量应为钙渣中Ca(OH)2物质的量的2倍。考察盐酸用量对酸不溶渣产率的影响,结果见图2。
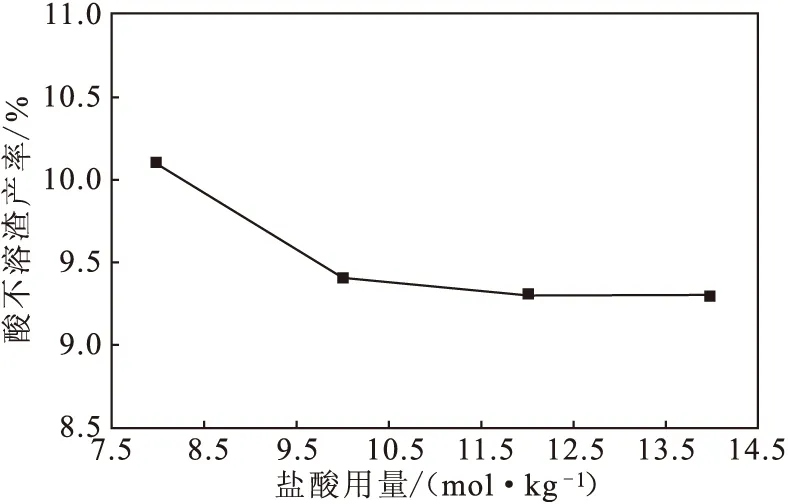
图2 盐酸用量对酸不溶渣产率的影响
由图2可见,随着盐酸用量增大,溶解出的Ca2+增多,酸不溶渣产率降低。但盐酸用量达到10.0 mol·kg-1后,酸不溶渣产率变化不再明显,故适宜的盐酸用量为10.0 mol·kg-1。
固定盐酸用量为10.0 mol·kg-1,考察盐酸浓度对钙溶解效果的影响,结果见图3。
由图3可见,酸不溶渣产率随盐酸浓度变化的幅度较小。表明,钙溶解效果主要取决于盐酸用量,浓度的影响并不明显,盐酸溶液循环利用时即使浓度较稀,也不会对其效果有大的影响。
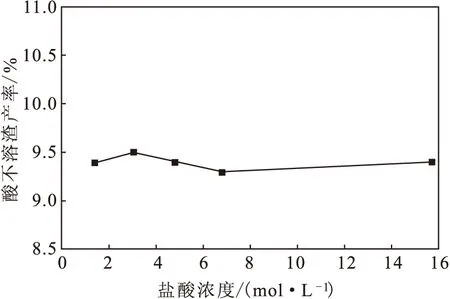
图3 盐酸浓度对酸不溶渣产率的影响
2.3 硫酸沉淀钙制备高纯硫酸钙实验
用盐酸溶解钙渣中的Ca2+后,得到的CaCl2溶液用硫酸沉淀钙,不仅能回收Ca2+制备高纯硫酸钙产品,还能回收氯离子得到盐酸再循环利用。在此过程中,盐酸起交换平台的作用。根据化学反应的质量守衡原理,由式(3)可知,硫酸用量应使其加入的H+物质的量与盐酸中H+物质的量保持平衡,即硫酸的用量应为5.0 mol·kg-1。在此用量条件下,将不同浓度的硫酸溶液加到CaCl2溶液中,用于沉淀硫酸钙产品,结果如图4所示。
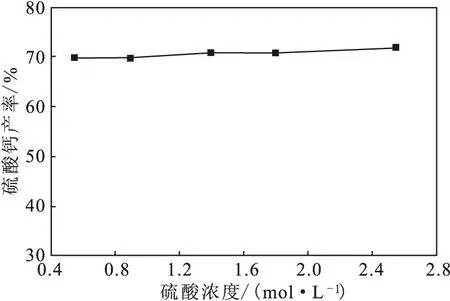
图4 硫酸浓度对硫酸钙产率的影响
由图4可见,随着硫酸浓度的增大,硫酸钙产率略微升高。与盐酸溶解Ca2+相似,硫酸沉淀Ca2+的效果也主要取决于其用量,硫酸浓度的影响不大,不同硫酸浓度下得到的硫酸钙产率相差不大,这对硫酸溶液的循环利用也是有利的。
2.4 综合实验结果
根据上述工艺条件实验,选择NaOH用量为11.4 mol·kg-1,盐酸用量为10.0 mol·kg-1、浓度为1.44 mol·L-1,硫酸用量为5.0 mol·kg-1、浓度为0.54 mol·L-1,进行循环利用工艺的综合实验,并对得到的硫酸钙产品进行化学分析和计算,结果见表2和表3。

表2 硫酸钙产品成分分析结果/%Tab.2 Analysis results of composition in calcium sulfate product/%
表3 综合实验计算结果/%
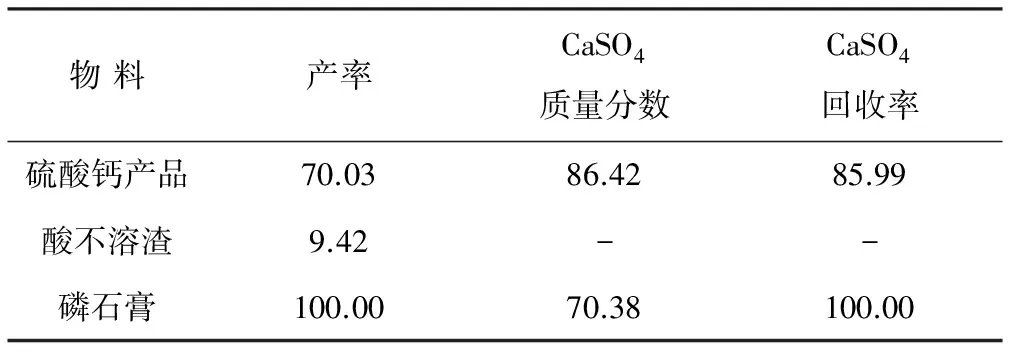
Tab.3 Comprehensive experimental results/%
由表2、表3可知,磷石膏经循环利用工艺处理后,所得最终硫酸钙产品中,CaSO4的质量分数为86.42%,回收率为85.99%。若扣除产品中质量分数为13.30%的水分,CaSO4纯度达到了99.72%,完全能满足高纯硫酸钙产品的应用需求。
3 结论
(1)采用化学试剂循环利用工艺,以磷石膏为原料,可以制备出纯度高达99.72%的硫酸钙产品,CaSO4回收率为85.99%。
(2)影响高纯硫酸钙产品制备效果的关键因素是化学试剂的用量,化学试剂的浓度对制备效果的影响不大。适宜的化学试剂用量为:NaOH 11.4 mol·kg-1,盐酸10.0 mol·kg-1,硫酸5.0 mol·kg-1。
(3)采用化学试剂循环利用工艺,化学试剂的消耗非常少,整个过程最后只有纯度和附加值较高的硫酸钙产品及少量酸不溶渣,既能降低经济成本,也可减轻环境压力。
[1] 张永志.重视磷石膏的综合利用促进磷肥工业可持续发展[J].磷肥与复肥,2009,24(2):11-13.
[2] 杨沛浩.磷石膏的综合利用[J].中国资源综合利用,2009,27(1):13-15.
[3] 李滢.磷石膏的综合应用[J].云南化工,2007,34(6):74-80.
[4] 胡振玉,王健,张先,等.磷石膏的综合利用[J].中国矿山工程,2004,33(4):41-44.
[5] 韩青,罗康碧,李沪萍,等.磷石膏开发利用现状[J].化工科技,2012,20(1):53-58.
[6] 孙志立.中国磷石膏资源化利用的展望与思考[J].硫酸工业,2016(1):55-58.
[7] 马林转,宁平,杨月红,等.磷石膏的综合利用与应重视问题[J].磷肥与复肥,2007,22(1):54-55.
[8] 马俊.磷石膏直接制备高纯度碳酸钙研究[D].昆明:昆明理工大学,2014.
[9] 戴取秀.磷石膏分解渣CaO纯化及元素迁移变化研究[D].昆明:昆明理工大学,2013.
[11] POTGIETER J H,POTGIETER S S,McCRINDLE R I,et al.An investigation into the effect of various chemical and physical treatments of a South African phosphogypsum to render it suitable as a set retarder for cement[J].Cement and Concrete Research,2003,33:1223-1227.
[12] PAPASTEFANOU C,STOULOS S,IOANNIDOU A,et al.The application of phosphogypsum in agriculture and the radiological impact[J].Journal of Environmental Radioactivity,2006,89:188-198.
[13] NAYAK A K,SHARMA D K,MISHRA V K,et al.Effect of phosphogypsum amendment on fluoride content of soil and plants under rice (Oryzasativa)-wheat(Triticumaestivum) system in sodic soil of Indo-Gangetic plains[J].Indian Journal of Agricultural Sciences,2009,79(8):615-619.
[14] DENEV Y G,DENEV G D,POPOV A N.Surface modification of phosphogypsum used as reinforcing material in polyethylene composites[J].Journal of Elastomers and Plastics,2009,41(2):119-132..
[15] SINGH M.Utilisation of phosphogypsum.a broad review[J].Indian Concrete Journal,2005,74(41):40-48.
[16] 罗鸣锐.双极膜电渗析法循环利用磷石膏的影响因素[D].武汉:武汉工程大学,2016.
Cyclic Process of Preparing High Purity Calcium Sulfate from Phosphogypsum
HUANG Chao-de,ZHANG Ze-qiang,SHAO Yi-xin,SUN Hua-lin,YU Hong
(SchoolofResourceandCivilEngineering,WuhanInstituteofTechnology,Wuhan430074,China)

phosphogypsum;recyclingtechnology;removingimpurities;highpuritycalciumsulfate
国家自然科学基金资助项目(51374156)
2016-12-12
黄朝德(1992-),男,湖北黄石人,硕士研究生,研究方向:二次资源综合利用,E-mail:huangchaode5201314@qq.com;
张泽强,教授,E-mail:490062132@qq.com。
10.3969/j.issn.1672-5425.2017.03.013
TQ132.32
A
1672-5425(2017)03-0053-04
黄朝德,张泽强,邵一鑫,等.磷石膏制备高纯硫酸钙的循环工艺[J].化学与生物工程,2017,34(3):53-56.

