免疫球蛋白IgG3恒定区和触珠蛋白与肺结核病的相关性分析
施力颖 牟宝华 江婷婷
免疫球蛋白IgG3恒定区和触珠蛋白与肺结核病的相关性分析
施力颖 牟宝华 江婷婷
目的 探讨免疫球蛋白IgG3恒定区(IGHG3)和触珠蛋白(HPT)与肺结核病的相关性。方法 采用ELISA法检测IGHG3和HPT在50例初治肺结核病患者和36例健康对照者血清中的含量;并收集肺结核病患者临床检测资料,包括血浆纤维蛋白原(FIB)、PT、APTT、TT、血糖、C反应蛋白(CRP)、TG等检测指标,分析差异情况以及IGHG3和HPT与患者临床检测结果的相关性。结果 肺结核病患者IGHG3、HPT含量明显高于健康对照组(均P<0.01)。肺结核病患者FIB、APTT、CRP值与正常范围有明显差异(均P<0.05)。IGHG3含量与CRP含量呈正相关(r=0.372,P=0.014),HPT含量与肺结核病患者空洞型病变呈正相关(r=0.28,P= 0.04)。通过逻辑回归将IGHG3和HPT组成蛋白质模型,ROC曲线结果显示该模型鉴别肺结核病和健康对照组的灵敏度为90.90%,特异度为80.80%,AUC值为0.866。结论 IGHG3和HPT可能是肺结核病潜在生物标志物。
肺结核病 血清 免疫
肺结核病是结核分枝杆菌(Mtb)感染引起的慢性肺部感染性疾病,占各器官结核病总数的80%以上。据WHO最新报道,2015年全球新发肺结核病患者1 040万例,死亡人数达180万例[1]。血清蛋白质参与机体凝血、免疫、代谢、物质交换、运输、生长信号调节等多种重要的生理功能,其组成和含量变化,受机体病理状态的影响,对于疾病的致病机制、分子标志物和药物作用靶点研究具有重要意义。因此,研究肺结核病患者血清差异表达蛋白质对肺结核病的防控具有重要作用。研究表明,肺结核病患者机体会对Mtb产生迟发型超敏反应,与巨噬细胞表面Fc受体的提呈作用及病理改变密切相关[2]。免疫球蛋白G(IgG)是血清中含量最高的免疫球蛋白,具有重要的免疫学功能,人IgG3对蛋白质及多肽类抗原的亲和力较强,可与Fc受体结合,免疫功能较强[3],但在肺结核病患者与正常人之间的差异情况却未曾研究。肺结核病患者组织肉芽肿内的巨噬细胞处于低氧状态[4],能抑制Mtb感染[5]。当组织低氧时,会引起触珠蛋白(HPT)含量升高,这类蛋白质在肺结核病患者与正常人之间的差异情况也未曾研究。因此,笔者拟采用ELISA法测定肺结核病患者血清中IgG3恒定区(IGHG3)和HPT含量,并与健康人群进行对照,分析两者与肺结核病的相关性。
1 对象和方法
1.1 对象 收集2012年1月到2014年5月中国医科大学绍兴医院的初治活动性肺结核病患者50例,男25例,女25例,年龄18~75(41.54±15.50)岁。依据中国卫生部发布的肺结核病诊断标准,凡符合下列项目之一者即确诊为肺结核病:(1)痰结核菌检查阳性(包括涂片或培养);(2)痰结核菌阴性,胸部X线检查有典型的活动性结核病变表现;(3)疑似肺结核病者,经临床X线检查随访、观察后,可排除其他肺部病变;(4)临床上已排除其他原因引起之胸腔积液,可诊断结核性胸膜炎。排除AIDS、肺外结核、糖尿病、乙肝等其他疾病,以及免疫抑制剂使用者。收集2012年1月到2014年5月浙江医院的健康献血者36例作为健康对照组,男17例,女19例,年龄18~75(43.06±16.38)岁。无肺结核病、糖尿病、乙肝、AIDS等疾病。本研究经每位受试者知情同意,并由华南理工大学医学院伦理委员会批准。两组患者性别、年龄等一般资料比较均无统计学差异(均P>0.05)。
1.2 IGHG3、HPT检测 受试者均于晨起空腹抽血5.0ml于不抗凝真空采血管中,4h内于4℃、3 000r/min离心10min,吸取上层血清,血清分装后保存于-80℃备用。同时,收集受试者临床检测资料。人IGHG3 ELISA试剂盒(中国CUSABIO公司),其稀释倍数为1∶5 000,检测范围是2.75~2 000ng/ml;人Haptoglobin ELISA试剂盒(英国Abcam公司),其稀释倍数为1∶2 000,最低检测浓度是0.07μg/ml。具体实验操作:(1)使用前将试剂盒中所有试剂、工作标准品和样品,置于室温20~30℃。(2)取出96孔板,并在每孔加入25μl标准品或样品,立即向每个孔中加入25μl生物素化的蛋白质,混匀后盖上密封胶带,室温孵育1h。(3)用200μl洗涤缓冲液洗涤5次,倒出内容物,在吸水纸巾上轻拍4~5次,彻底清除液体。(4)每孔中加入50μl链霉菌抗生物素蛋白-过氧化物酶连接物(SP连接物),室温孵育30min。(5)再次洗涤5次。(6)每孔加入50μl底物,并于室温孵育10min或直至液体颜色变蓝。(7)每孔加入50μl终止液,并立即于450nm处读取吸光度。进行两次实验重复。ELISA试剂盒所使用的96孔板,其底部预先包被有被测蛋白质的特异性抗体,待加入标准品或被检样本后,相应的蛋白质会与预先包被的抗体结合,孵育和洗涤后;加入的生物素化的特异性蛋白质抗体,会与已固定的蛋白质结合,孵育和洗涤后;加入SP连接物与之结合;最后加入显色底物,孵育后终止显色。采用微孔板分光光度计(美国Bio-Rad公司)检测吸光度值,根据检测到的吸光度值,绘制的标准曲线测量出样本中的蛋白质含量。
1.3 肺结核病患者临床检测指标分析 对患者临床检测指标进行收集和统计分析,包括血浆纤维蛋白原(FIB)、PT、APTT、TT、血糖、C反应蛋白(CRP)、TG等临床检测值,并与正常范围中值进行比较。观察肺结核病患者胸部CT检查结果:是否存在空洞型病变存以及空洞型病变的类型。
1.4 统计学处理 应用SPSS version 16.0和GraphPad Prism version 5统计软件,正态分布的计量资料以表示,两组间比较采用t检验;非正态分布的计量资料以中位数,两组间比较采用Mann-Whitney U检验。采用单样本t检验检测肺结核病患者临床检测结果,用Spearman相关分析蛋白质检测值与临床检测指标的相关性。使用MedCalc软件(version 11.4)进行ROC曲线分析蛋白质的灵敏度和特异度,通过逻辑回归方法建立蛋白质模型。
2 结果
2.1 两组患者IGHG3和HPT含量及ROC曲线分析ELISA实验结果显示,肺结核病患者组IGHG3含量为2.16μg/μl,HPT含量为 1 632.31μg/ml,健康对照组IGHG3含量为1.02μg/μl,HPT含量为796.00μg/ml,两组IGHG3、HPT含量的比较差异均有统计学意义(均P<0.01);ROC曲线分析结果显示,IGHG3蛋白的AUC为0.79,灵敏度为74.0%,特异度为79.4%(图1a);HPT蛋白AUC值为0.684,灵敏度为48.0%,特异度为86.1%(图1b)。通过逻辑回归建立蛋白质模型,逻辑回归方程为Logit(p)=-2.6441+1.1693×(IGHG3)+0.0009406×(HPT),该模型鉴别诊断肺结核病AUC值为0.866,灵敏度为90.90%,特异度为80.80%(图1c)。
2.2 肺结核病患者临床检查指标分析 肺结核病患者FIB、APTT、CRP值与正常范围比较差异均有统计学意义(均P<0.01),PT、TT、血糖、TG值与正常范围比较差异均无统计学意义(均P>0.05),详见表1。根据患者胸部CT检查结果,将病理改变分为空洞型和非空洞型,空洞型肺结核包括虫蚀样空洞、薄壁空洞、干酪空洞和纤维空洞,包括多发空洞或单发空洞;CT检查结果显示无空洞的患者为非空洞型肺结核。在进行统计学分析时,将空洞型患者标记为1,将非空洞型患者标记为0,再采用Spearman相关分析结核空洞型、非空洞型与IGHG3、HPT含量的相关性;同时,分析FIB、PT、APTT、TT、血糖等检测结果与IGHG3和HPT含量的相关性。分析结果显示,IGHG3与CRP呈正相关(r=0.372,P= 0.014),HPT与肺结核病患者空洞病变呈正相关(r= 0.280,P=0.04),IGHG3、HPT与其他临床检测指标无相关性,详见表2。
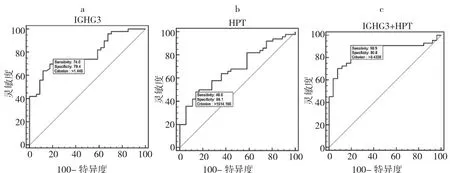
图1 IGHG3、HPT的ROC曲线分析图(a:IGHG3;b:HPT;c:IGHG3+HPT)

表1 肺结核病患者临床检测指标结果分析

表2 IGHG3、HPT与临床检测指标的相关性
3 讨论
肺结核病是一种慢性感染性疾病,固有免疫在Mtb入侵时起着机体免疫首要防线的关键作用[6],肉芽肿的形成是肺结核病的重要病理过程,其与单核细胞和巨噬细胞等免疫过程相关[7]。随着Mtb感染程度的不同,患者可表现为不同的病理改变。肺结核病的病理改变主要有增生性病变、渗出性病变、变质性病变。病理改变情况受机体的免疫力、变态反应性,以及Mtb的入侵数量和毒力强度影响较大。本研究检测结果显示,肺结核病患者FIB、APTT、CRP水平与正常范围有统计学差异,表明患者的凝血可能存在异常,并且可能存在急性炎症反应。
有研究表明固有免疫应答与肺结核病的进展不无相关[8-9],这种免疫应答机制同样会导致机体的组织损伤[10]。机体会针对Mtb及其代谢产物产生迟发型超敏反应(Ⅳ型变态反应),它以T淋巴细胞为介导,并以巨噬细胞为效应细胞,以另一亚群T淋巴细胞释放炎性介质、淋巴细胞毒素等,使局部组织出现渗出性炎症甚至干酪样坏死,表现为病灶恶化、浸润、进展等病理变化[2]。IGHG3能与中性粒细胞、巨噬细胞上的IgG Fc受体(FcγR)结合,从而发挥对巨噬细胞的调理作用,并促进巨噬细胞吞噬功能;IGHG3还能与树突细胞表面表达的FcγRI高亲和结合[11],增加树突细胞将抗原提呈给T淋巴细胞的作用[12]。本实验中,肺结核病患者IGHG3水平显著高于健康对照组。此外,本研究还发现患者IGHG3含量与急性炎症反应蛋白CRP含量存在显著正相关。因此,笔者认为IGHG3与肺结核病患者的Ⅳ型变态反应相关,可能是通过巨噬细胞作用及T淋巴细胞的介导的相关作用参与肺结核病的病理改变过程;同时,升高的IGHG3还可能与患者的急性炎症反应相关。
有研究表明低氧状态能抑制Mtb感染[5],Mtb侵入机体巨噬细胞形成肉芽肿[13],而肉芽肿内及被Mtb感染的巨噬细胞处于低氧状态[14]。组织低氧状态会导致血液中Hb含量增加。Hb能将肺表面的氧运输至需氧组织,提高血液中的氧利用率,但Hb含量增加导致氧自由基的产生,从而引起组织氧化性损伤的发生[15]。HPT是一种急性反应蛋白,能结合并消除Hb。本实验中,肺结核病患者血清HPT含量显著高于正常人,笔者认为HPT可能与肺结核病患者的组织低氧状况相关,与患者病理改变相关,HPT含量的升高有助于减少低氧引起的组织氧化性损伤的发生。
空洞是肺结核病的常见影像学表现,是由浸润型肺结核、肺结核球的干酪样坏死组织发生液化、脱落和排出形成。肺结核空洞的形成是结核活动性的表现之一[16]。当机体免疫力低下,结核杆菌感染后病变不易局限时,组织容易液化坏死而形成空洞[17]。肺结核病患者HPT含量显著高于健康睡着组,并与空洞的存在呈正相关,表明肺结核病患者血清HPT含量的升高,提示了患者结核活动性的增强。
此外,ROC曲线分析和逻辑回归分析结果显示,IGHG3和HPT组成的蛋白质模型,在诊断肺结核病患者时具有良好的灵敏度和特异度,该蛋白质模型的AUC为0.866,表明血清IGHG3和HPT是肺结核病的潜在生物标志物。
[1] World Health Organization.GlobalTuberculosis Report 2016.http: //www.who.int/mediacentre/factsheets/fs104/en/
[2] Lange C,Sester M.TB or not TB:the role of immunodiagnosis[J]. EurJ Immunol,2012,42(11):2840-2843.doi:10.1002/eji.201242950.
[3] Bruhns P,Iannascoli B,England P,et al.Specificity and affinity of human Fcgamma receptors and their polymorphic variants for human IgG subclasses[J].Blood,2009,113(16):3716-3725.doi: 10.1182/blood-2008-09-179754.
[4] Tsai M C,Chakravarty S,Zhu G,et al.Characterization of the tuberculous granuloma in murine and human lungs:cellular composition and relative tissue oxygen tension[J].Cell Microbiol, 2006,8(2):218-232.doi:10.1111/j.1462-5822.2005.00612.x.
[5] Froguel P,Ndiaye N C,Bonnefond A,et al.A Genome-Wide Association Study Identifies rs2000999 as a Strong Genetic Determinant of Circulating Haptoglobin Levels[J].PLOS ONE,2012,7 (3):e32327.doi:10.1371/journal.pone.0032327.
[6] Wang C,Li Y Y,Li X,et al.Serum complement C4b,fibronectin, and prolidase are associated with the pathological changes of pulmonarytuberculosis[J].BMCInfectDis,2014,14:52.doi:10.1186/ 1471-2334-14-52.
[7]李雪冰,李宝兰,赖百塘,等.肺结核患者血清MMP-9和VEGF水平检测的临床研究[J].中国防痨杂志,2007,29(2):184-185.
[8] Kleinnijenhuis J,Oosting M,Joosten L A,et al.Innate immune recognition of Mycobacterium tuberculosis[J].Clin Dev Immunol, 2011,2011:405310.doi:10.1155/2011/405310.
[9] VankayalapatiR,Barnes P F.Innate and adaptive immune responses to human Mycobacterium tuberculosis infection[J].Tuberculosis(Edinb),2009,89(Suppl1):S77-S80.doi:10.1016/S1472-9792(09)70018-6.
[10] Hernandez-Pando R,Orozco H,Aguilar D.Factors that deregulate the protective immune response in tuberculosis[J].Arch Immunol Ther Exp(Warsz),2009,57(5):355-367.doi:10.1007/ s00005-009-0042-9.
[11] Nimmerjahn F,Ravetch J V.Fcγ receptors as regulators of immune responses[J].Nat Rev Immunol,2008,8(1):34-47.doi:10. 1038/nri2206.
[12] Maglione P J,Xu J,Casadevall A,et al.Fc γ receptors regulate immune activation and susceptibility during Mycobacterium tuberculosis infection[J].J Immunol,2008,180(5):3329-3338.
[13] Russell D G,Cardona P J,Kim M J,et al.Foamy macrophages and the progression of the human tuberculosis granuloma[J]. Nat Nat Immunol,2009,10(9):943-948.doi:10.1038/ni.1781.
[14] Nickel D,Busch M,Mayer D,et al.Hypoxia triggers the expression of human β defensin 2 and antimicrobial activity against Mycobacterium tuberculosis in human macrophages[J].J Immunol,2012,188(8):4001-4007.doi:10.4049/jimmunol.
[15] Babu R,Bagley J H,Di C,et al.Thrombin and hemin as central factors in the mechanisms of intracerebral hemorrhage-induced secondary brain injury and as potential targets for intervention[J].Neurosurg Focus,2012,32(4):E8.doi:10.3171/ 2012.1.FOCUS11366.
[16] 杨钧,张海青,周新华,等.肺结核空洞的CT表现及病理基础[J].中国医学影像技术,2007,23(12):1831-1833.
[17] 卜建玲,马玙.糖尿病与肺结核[J].中国抗生素杂志,2004,29(12): 738-741.
Serum IGHG3 and HPT levels in patients with pulmonary tuberculosis
SHI Liying,MOU Baohua,JIANG Tingting.Department of Clinical Laboratory,Zhejiang Hospital,Hangzhou 310013,China
Tuberculosis Serum Immunity
2017-01-16)
(本文编辑:严玮雯)
10.12056/j.issn.1006-2785.2017.39.9.2017-130
华南理工大学医学院科学研究项目(yxy2016006)
310013 杭州,浙江医院检验科(施力颖);中国医科大学绍兴医院科教科(牟宝华);华南理工大学医学院(江婷婷)
江婷婷,E-mail:ttjiang@scut.edu.cn
【 Abstract】 Objective To investigate serum Ig Gamma-3 Chain C Region(IGHG3)and Haptoglobin(HPT)levels in patients with pulmonary tuberculosis(TB).Methods Serum IGHG3 and HPT levels were tested by enzyme linked immunosorbent assay (ELISA)in 50 TB patients and 36 healthy subjects.Plasma fibrinogen(FIB),prothrombin time(PT),activated partial thromboplastin time(APTT),thromboplastin time(TT),blood glucose,C reaction protein(CRP),triglyceride(TG)were measured. Results Serum IGHG3)and HPT levels in TB patients were significant higher than those in healthy controls(P<0.0001 and P= 0.0037).There were significant differences in plasma FIB,APTT and CRP levels between TB patients and healthy controls (P= 0.04,P=0.004,P=0.0001,respectively).Serum IGHG3 level was significantly correlated with serum CRP(r=0.372,P=0.014),and the serum HPT level was significantly correlated with the existence of tuberculosis cavity(r=0.28,P=0.04).A protein model consisting of IGHG3 and HPT was established by logistic regression analysis,and the sensitivity,specificity,and area under curve(AUC)of the model was 90.90%,80.80%,and 0.866,respectively. Conclusion IGHG3 and HPT may be potential biomarkers for TB patients.

