蒙药对乳腺癌化疗复发后肿瘤标志物及预后的影响Δ
刘战平 刘俊彪
(内蒙古国际蒙医医院,内蒙古 呼和浩特 010065)
蒙药对乳腺癌化疗复发后肿瘤标志物及预后的影响Δ
刘战平 刘俊彪*
(内蒙古国际蒙医医院,内蒙古 呼和浩特 010065)
目的:评估蒙药暖宫七味丸和乌力吉18味丸对晚期乳腺癌患者预后及肿瘤标志物的影响。方法:回顾性分析我院96例晚期乳腺癌患者的临床资料,手术和辅助化疗后复发60例,复发后解救化疗进展36例。96例患者采取精确放疗加蒙药等综合治疗,分析患者预后及肿瘤标志物的影响因素。结果:全组患者的肿瘤标志物相对下降,中位生存期为21.8月。单因素及多因素分析显示,病理类型、转移脏器数目及转移脏器、卡氏评分和蒙药疗程是晚期乳腺癌疗效的影响因素。结论:加用蒙药的综合治疗相对延长乳腺癌晚期患者的生存时间,降低血清肿瘤标志物。
蒙药;乳腺癌化疗复发;肿瘤标志物;预后
乳腺癌发病率在全球居女性肿瘤患者首位[1]。在中国,乳腺癌占全球新增乳腺癌的12.2%,死亡率占乳腺癌死亡人数的9.6%,且乳腺癌发病年轻化[2]。尽管医学的进步很大地改善了乳腺癌的生存状况,但复发和转移仍是患者死亡的主要因素[3]。研究报道称,大约30%的乳腺癌患者伴有复发和转移。肿瘤一旦出现复发和转移,多数患者很难通过化疗获益[4]。为进一步研究晚期乳腺癌的治疗策略,本文分析96例乳腺癌术后化疗复发患者行蒙药综合治疗,观察远期治疗效果,现报道如下。
1 临床资料及方法
1.1 临床资料:选取2011年3月~2012年10月内蒙古医院96例术后化疗复发患者行蒙药综合治疗,进行回顾性分析。纳入标准:乳腺癌病理诊断明确、Ⅳ期患者,Karnofsky(KPS)评分≥60分,辅助化疗后复发、解救化疗后进展的患者接受过规律蒙药治疗和精确放疗,随访复查无脱落或2015年6月研究终止时间。
1.2 治疗方法:采用精确放疗同步蒙药、内分泌等综合治疗,定期检测CEA、CA125和CA153无明显升高,影像检查证实转移灶得到控制且无新病灶产生的患者,给予每年4~8疗程的蒙药及其他综合治疗。定期复查CEA、CA125和CA153有明显增高、行系统检查或PET-CT检查发现新病灶者仍坚持进一步治疗。
1.2.1 精确放疗:采用三维适形后程补充放射技术,CT模拟机层厚5mm扫描,结合其他相关影像检查,医生工作站勾画靶区,进行三维治疗计划。90%等剂量曲线给予1.9Gy/次,5次/周,8MVX和(或)15MVX线直线加速器实施外照射。对恶性胸水患者采用半胸膜精确放射,肝多发转移﹤3cm、肝肾功及血常规正常者,先行1.7Gy/次的全肝照射15-18次。脑转移全脑照射20次后,缩野补充照射残存病灶10次。较大转移灶放疗30次后仍有残留者,予以后程补充放疗。中位照射剂量骨、肺、肝、脑转移者分别为40、52、55和58Gy。
1.2.2 蒙药治疗:入选的患者均予以和放疗同步的蒙药治疗。具体用法:暖宫七味丸9~11粒/次/日、晨服,乌力吉18味丸9~10粒/次/日、晚服。3周为1疗程。定期检测CEA、CA125和CA153无明显升高,影像检查证实转移灶得到控制且无新病灶产生的患者,肝肾功能正常者,给予每年4~8疗程的蒙药巩固治疗。
1.2.3 内分泌治疗:激素受体阳性的予以内分泌治疗,绝经前予以他莫昔芬20mg/d,半年后未绝经者加用卵巢功能抑制剂治疗;绝经后予以芳香化酶抑制剂治疗,口服来曲唑2.5mg/d。疾病进展时更换内分泌治疗。
1.2.4 双磷酸盐治疗:伴有骨转移的患者予以唑来膦酸钠4mg/次静滴,每4周1次,定期检测CEA、CA125和CA153无明显升高,影像检查证实转移灶得到控制且无新病灶产生的患者,连用8-10次。发现新骨转移灶则停止用药。
1.3 随访:随访复查无脱落或2015年6月研究终止,随访率为98.96%,失访1例,按死亡计算。
1.4 疗效评价
1.4.1 近期疗效和远期疗效:复发转移时间及复发转移率、生存率,中位生存期(OS)。所有研究患者每3个月复查1次,复查内容:体格检查,肿瘤标志物、生化、胸X-ray,B超、骨扫描等。复发转移标准:有明确病理证实的复发转移病灶或有影像学确凿证据并且经2位专科医师判定且结论一致。
1.4.2 相关检验指标血清肿瘤标志物CA125、CA153及CEA采用化学发光法检测治疗前和治疗后1月的。
2 统计学处理
采用SPSS19.0统计软件进行统计分析。采用Cox回归分析法进行多因素分析,显著性检验采用Logrank法,生存率计算采用Kaplan-Meier方法;P<0.05表示差异有统计学意义。
3 研究结果
3.1 血清肿瘤标志物:乳腺癌化疗复发后肿瘤标志物普遍升高,蒙药与精准放疗等综合治疗后CEA、CA125和CA153明显下降,见表1。

表1 96例晚期乳腺癌患者化疗复发后加用蒙药 综合治疗前后血清肿瘤标志物水平变化
治疗前后肿瘤标志物测量值比较,P<0.05
3.2 近期疗效和远期疗效:转移灶完全缓解23例,部分缓解35例,稳定38例,总有效率为60.4%(58/96),无局部进展病例。96例晚期乳腺癌患者的1年生存率为83.3%,3年生存率为27.1%,5年生存率为19.8%,OS为21.8月。
3.3 单因素分析:病理类型为非浸润性导管癌、重要脏器脑肝肺无转移、转移器官少、Karnofsky评分≥80分和蒙药多疗程巩固治疗的患者预后好,P<0.05;患者年龄、激素受体、Her-2受体、既往化疗及内分泌治疗类型、高危风险和放疗剂量对预后无明显影响,P>0.05,见表2。

表2 96例乳腺癌患者化疗复发后加用蒙药综合 治疗远期疗效影响因素的单因素分析
3.4 多因素分析:单因素分析中有统计学意义的因素行Cox多因素回归分析显示,非浸润性乳腺癌、无脑转移和蒙药巩固治疗6疗程以上者是晚期乳腺癌患者化疗复发后个体化治疗的保护因素,P<0.05,见表3。
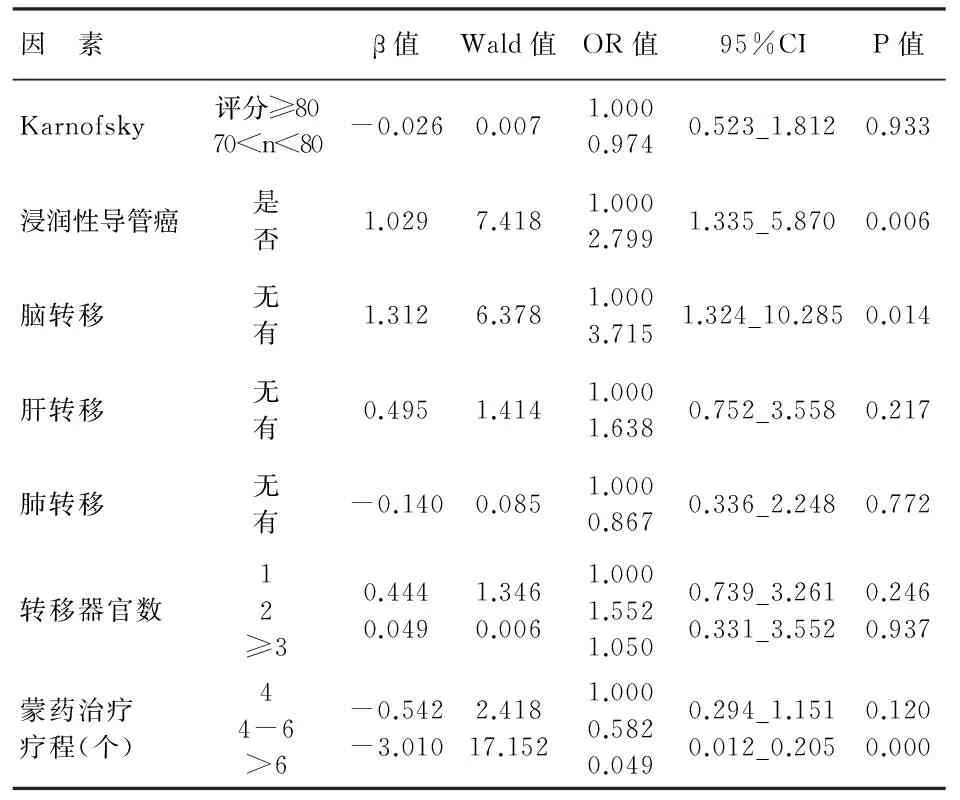
表3 96例乳腺癌化疗复发后加用蒙药综合治疗 远期疗效影响因素的多因素分析
3.5 安全性评价:本研究安全性监测结果表明,在治疗过程中,无严重不良反应,治疗后血常规、心电图无明显异常变化,肝、肾功能轻度增高分别为6.3%(6/96)和5.2%(5/96),提示无明显毒副作用。全组无3、4级急性放射性肝、肺损伤病例。
4 讨论
晚期乳腺癌患者治疗策略以延长生存时间、提高生活质量为主。主要包括个体化化疗、分子亚型的内分泌治疗、生物靶向治疗[5-7],中药通过滋补阴虚、调节肝经起到了治疗和预防乳腺癌复发和转移的格局[8]。立即手术对于Ⅳ期乳腺癌患者的总生存期不能获益,局部手术仅为辅助治疗[9]。所以个体化综合治疗方案选择甚为重要。
德国GBG26研究组[10]将晚期乳腺癌患者随机分为曲妥珠单抗联合卡培他滨组和卡培他滨单药组,OS分别为18.8月和13.3月,P=0.02。Hermine研究[11]证实,手术化疗后进展的乳腺癌患者行靶向治疗与未行靶向治疗相比,OS分别为21.3月和14.3月。张文霞等[12]选用吉西他滨联合顺铂作为晚期乳腺癌的二线或三线治疗方案,三阴性乳腺癌组OS为20.6月,非三阴性乳腺癌组为18.8月。姜晗昉[13]等结果显示,使用白蛋白结合型紫杉醇单药或联合方案一线治疗转移性乳腺癌患者8例,中位PFS为7.0个月,中位OS为15.0个月。本文研究发现,术后辅助化疗复发60例,解救化疗后失败36例,通过加用蒙药的个体化综合治疗,1、3、5年生存率分别是83.3%(80/96),27.1%(26/96),19.8%(19/96)。OS为21.8月,明显高于上述文献报道单独化疗组,等同于靶向治疗组。TBC-RC006实验表明[14],Her-2阳性乳腺癌患者,拉帕替尼联合曲妥珠单抗靶向疗效相当于化疗效果,能全面封锁ER和Her-2受体,证明了Her-2阳性的乳腺癌患者可能不需要化疗的提议。本文对乳腺癌化疗复发的患者,加用蒙药综合治疗,中位OS与曲妥珠单抗靶向治疗组基本相同,蒙药联合放疗的综合治疗能否取代晚期乳腺癌患者的化疗,需要进一步多中心大数据的研究与支持。
乳腺癌放化疗的选择需要患者的卡氏评分。卡氏评分是反应患者日常生活状况的指标。Niikura研究发现,卡氏评分是晚期乳腺癌的独立预后因素,卡氏评分高的生存时间较长[15]。本文研究发现,患者一般身体状况较好的患者生存时间较长,与文献报道一致。可能是身体状况较好的患者自身免疫及耐受力强,能更好地对抗肿瘤细胞侵袭及药物的毒付作用。
晚期乳腺癌转移器官数目是影响生存时间的主要因素。GerberB研究发现[16],乳腺癌脑转移患者接受放疗后的OS为6个月。日本学者Erten等[17]选择吉西他滨+顺铂治疗脑转移的晚期乳腺癌,三阴性乳腺癌患者取得更好的有效率(66.6%)和更长的生存期(9.2月)。胡赛男等[18]研究71例乳腺癌患者治疗中有17例出现脑转移,脑转移后行局部放疗或ν刀治疗,继续行曲妥珠单抗治疗与终止的患者中位OS分别为12月和6月。本文中脑转移患者接受蒙药综合治疗后的OS为11月。高于单独放疗及化疗组,等同于靶向治疗组。Pentheroudakis等[19]对500例乳腺癌肝转移患者进行随访,总生存期为16.3月,5年预计生存率为8.5%。王佳玉等[20]对协和医院肿瘤科1985~2002年间收治的女性乳腺癌首发肝转移患者进行研究,肝转移后OS为16月,中位至疾病进展时间(TTP)为7.4月。张灵小等[21]研究发现,乳腺癌肝转移后OS为20月,PFS为9月,肝转移后1、2、3年生存率分别为69.8%、43.4%和31.7%。本文分析结果显示,乳腺癌肝转移的患者OS为17月,与文献报道基本一致。Friedel等[22]发现,乳腺癌首发肺转移患者的预后明显优于首发肝转移和脑转移患者,中位OS为12~20月;邱梅清等[23]结果显示,乳腺癌肺转移后5年生存率达17.9%,中位OS为21(2~107)月,本文肺转移的患者OS为19月,与文献报道基本相同。蒙药加放疗的综合治疗对乳腺癌脑转移患者疗效明显,对肝、肺转移患者等同于常规治疗,究其原因可能与规范化个体化放疗及蒙药治疗有关。
转移部位是乳腺癌晚期的独立预后因素。本文中单个、2个及3个以上器官转移者的OS分别为31、18和13月。多因素分析显示,脑转移是晚期乳腺癌预后的独立因素。与文献报道[24]有一致性。
血清肿瘤标志物CEACA125CA153的检测广泛用于乳腺癌的疗效评价,它的变化和肿瘤治疗效果密切相关[25]。血清CA153水平与乳腺癌病情变化相平行,可早于影像学方法检出乳腺癌的复发和转移,为预测乳腺癌转移的极好指标。美国临床肿瘤协会推荐CA153用于转移性乳腺癌患者的治疗监测,表达升高则指示治疗失败[26],为癌症转移及死亡的独立预后因子。中蒙药通过滋补阴虚、调节肝经起到了辅助治疗和预防乳腺癌复发和转移的很大作用[8]。本文选用蒙药结合放疗治疗96例乳腺癌术后复发患者,与治疗前比较,CEACA125CA153下降明显。
综上所述,新理念指导下,加用蒙药的个体化综合治疗对乳腺癌化疗复发患者可相对获得较长生存时间,毒副作用较小。蒙药可能通过影响雌激素受体而达到治疗乳腺癌的作用[27],联合个体化精准放疗能提高乳腺癌化疗复发患者的生活质量,延长生存时间。肿瘤标志物动态检测可评估乳腺癌患者的治疗情况,方法简便易行,是提供个体化治疗的依据之一。
[1]Siegel R,Naishadham D,Jemal A.Cancer statistics 2013[J].CA Cancer J Clin,2013,63:11- 30.
[2]Fan L,Strasser-Weippl K,Li JJ,et al.Breast cancer in China[J].Lancet Oncol,2014,15 (7) :e279- 289.
[3]American Cancer Society.Cancer Facts & Figures 2013[R].Atlanta:American Cancer Society,2013.
[4]Giovannetti E,Erozenci A,Smit J,et al.Molecular mechanisms underlying the role of micro-RNAs (miRNAs) in anticancer drug resistance and implications for clinical practice[J].Crit Rev Oncol Hematol,2012,81:103- 122.
[5]高国璇,刘荫华.2014年ASCO乳腺癌临床实践指南解读-HER-2阴性 (或未知) 晚期乳腺癌化学和靶向治疗[J].中国实用外科杂志,2015, (01) .62-66.
[6]PCR proves valid surrogate endpoint[J].Cancer Discov,2014,4 (2) :137- 138.
[7]Majewski IJ,Nuciforo P,Mittempergher L,et al.PIK3CA mutations are associated with decreased benefit to neoadjuvant human epidermal growth factor receptor 2-targeted therapies in breast cancer[J].J Clin Oncol,2015,33 (12) :1334- 1339.
[8]Lee YW,Chen TL,Shih YR,et al.Adjunctive traditional Chinese medicine therapy improves survival in patients with advanced breast cancer:a population-based study[J].Cancer,2014,120(9):1338-44.
[9]郑新宇.2015年NCCN临床实践指南关于Ⅳ期、转移复发乳腺癌部分解读[J].中国实用外科杂志,2015, (07) :739- 743.
[10]Von MG,Schwedler K,Schmidt M,et al.Trastuzumab beyond progression:overall survival analysis of the GBG 26/BIG 3-05 phaseⅢ study in HER2-positive breast cancer[J].Eur Cancer,2011,47(15):2273-81.
[11]Extra JM,Antoine EC,Vincent-Salomon A,et al.Efficacy of trastuzumab in routine clinical practice and after progression for metastatic breast cancer patients:the observational Hermine study[J].Oncologist,2010,15(8):799-809.
[12]张文霞,张一卓,邹富琴.三阴和非三阴性乳腺癌吉西他滨联合顺铂治疗对照研究[J].中华肿瘤防治杂志,2013,(22):1751-1754.
[13]姜晗昉,李惠平,王超颖,等.白蛋白结合型紫杉醇治疗晚期乳腺癌的临床观察[J].肿瘤,2013,(03):251-257.
[14]Rimawi MF,Mayer IA,Forero A,et al.Multicenter phase II study of neoadjuvant lapatinib and trastuzumab with hormonal therapy and without chemotherapy in patients with human epidermal growth factor receptor-2 over expressing breast cancer:TBCRC 006[J].J Clin Oncol,2013,31 (14) :1726- 1731.
[15]Niikura N,Liu J,Hayashi N,et al.Treatment outcome and prognostic factors for patients with hone-only metastases of breast cancer:a single-institution retrospective analysis[J].Oncologist,2011,16:155-164.
[16]Gerber B,Freund M,Reimer T.Recurrent breast cancer:treatment strategies for maintaining and prolonging good quality of life[J].Dtsch Arztebl Int,2010,107:85-90.
[17]Erten C,Demir L,Somali L,et al.Cisplatin plus qemiitabine for treaement of breast cancer patients with brain metastases;apreferential option of triple negative patients?[J].Asian Pac J Cancer,2013,14(6):33711-33717.
[18]胡赛男,张莉莉.跨线曲妥珠单抗联合不同化疗方案治疗HER2阳性晚期乳腺癌的临床研究[J].肿瘤防治研究,2016,(01):39-44.
[19]Pentheroudakis G,ountzilas G,Bafaloukos D,et al.Metastatic breast cancer with liver metastases:a registry analysis of clinicopathologic,management and outcome characteristics of 500 women[J].Breast Cancer Res Treat,2006,97:237-244.
[20]王佳玉,徐兵河,田丽军,等.乳腺癌肝转移的临床病程与预后分析[J].中华肿瘤杂志,2006,28:612-616.
[21]张灵小,王佳玉,袁芃,等.146例乳腺癌首发肝转移患者的临床病程与预后多因素分析[J].中国肿瘤临床与康复.2012.(01):28-33.
[22]Friedel G,Pastorino U,Ginsherg RJ,et al.Results of lung metastasectomy from breast cancer:prognostic criteria on the basis of 467 cases of the Ihternational Registry of Lung Metastases[J].Eur J Cardiovase Surg,2002,22:335-344.
[23]邱梅清,佟仲生,郝春芳,等.乳腺癌肺转移117例临床病理特征及预后相关因素分析[J].肿瘤.2012.(11):907-912+918.
[24]Jung B,Sereika SM,Linkov F,et al.The effect of delays in treatment for breast cancer metastasis on survival[J].Breast Cancer Res Treat,2011,130:953-964.
[25]张全军,向云.乳腺癌患者血清肿瘤标志物水平与预后关系[J].中国公共卫生,2014,(12):1559-1561.
[26]Velaiutham S,Taib NA,Ng KL,et al.Does the pre-operative value of serum CA15-3 correlate with survival in breast cancer[J].Asian Pac J Cancer Prev,2008,9:445 -448.
[27]王鹏坤.蒙药治疗乳腺增生对雌激素水平影响的临床观察[J] 中国民族医药杂志,2014,(11) ,15.
2017年1月3日收稿
内蒙古卫计委医疗卫生科研项目(项目编号:201302016)
刘站平(1969-),医学本科,副主任医师,于内蒙古国际蒙医医院工作。
R291.2
B
1006-6810(2017)04-0007-04
*通讯作者:刘俊彪(1972-),医学博士,副主任医师,联系电话:13848133538,邮箱:1525579734@qq.com

