臭氧氧化后处理对肾脏缺血再灌注损伤的作用
陈国晓,刘修恒,张祥生,丁德刚,朱晓博,陈鑫,闫天中
[1.河南省人民医院(郑州大学人民医院)泌尿外科,河南 郑州 450003;2.武汉大学人民医院(湖北省人民医院)泌尿外科,湖北 武汉 430060]
臭氧氧化后处理对肾脏缺血再灌注损伤的作用
陈国晓1,刘修恒2,张祥生1,丁德刚1,朱晓博1,陈鑫1,闫天中1
[1.河南省人民医院(郑州大学人民医院)泌尿外科,河南 郑州 450003;2.武汉大学人民医院(湖北省人民医院)泌尿外科,湖北 武汉 430060]
目的研究臭氧O3氧化后处理对大鼠肾脏缺血再灌注所致肾脏慢性纤维化的作用及相关机制。方法将72例SD大鼠随机分为4组:假手术组(S组)、单纯缺血再灌注组(I/R组)、O3氧化后处理组(I/R+O3组)、氧气O2后处理组(I/R+O2组),每组4只。每组在模型复制成功后2周检测血清肌酐(Scr)和血浆尿素氮(BUN),2和10周取肾脏标本,进行苏木精-伊红染色法染色、Masson染色,以及免疫组织化学法检测转化生长因子β1(TGF-β1)、α-平滑肌肌动蛋白(α-SMA)的表达。结果术后2周各组的血清Scr、血浆BUN基本恢复到正常范围,两组比较,差异无统计学意义(P>0.05)。术后10周Masson染色显示,肾纤维化程度,其他3组较S组重(P<0.05),I/R+O3组较I/R组、I/R+O2组轻(P<0.05),而I/R组与I/R+O2组比较,差异无统计学意义(P>0.05)。与S组比较,其他3组TGF-β1、α-SMA的表达增强(P<0.05);与I/R组比较,I/R+O3组的表达减弱(P<0.05);I/R组与I/R+O2组比较,差异无统计学意义(P>0.05)。结论O3后处理可以减轻缺血再灌注损伤肾脏的慢性纤维化,其机制可能与O3后处理抑制转化生长因子-β1/Smad信号通路激活有关。
缺血再灌注损伤;肾纤维化;臭氧氧化后处理
由于肾移植等泌尿外科手术中肾脏的缺血不可避免,因此如何预防和减轻缺血再灌注损伤,一直是临床上研究肾脏保护的热点课题。臭氧O3氧化预处理可以减轻肾脏的缺血再灌注损伤。但是臭氧氧化后处理对缺血再灌注损伤远期作用的相关文献少有报道。本研究旨在进一步研究臭氧后处理对大鼠缺血再灌注损伤肾脏纤维化的作用,以及可能的机制,为临床保护缺血再灌注损伤提供基础理论依据。
1 材料与方法
1.1 材料
Sprague-Dawley级(SD)大鼠,清洁级,雄性,体重250~300 g。室温20~22℃,12 h昼/夜循环照明,湿度60%~80%,常规饮食,大鼠适应性喂养7 d后使用。
1.2 方法
1.2.1 模型 复制大鼠肾脏缺血再灌注模型:大鼠术前禁食12 h,3%戊巴比妥钠50 mg/kg腹腔注射麻醉生效后,将大鼠仰卧位固定于鼠台上,去毛,75%乙醇消毒,500 u肝素钠腹腔注射,实验中体温(直肠温度)保持在37℃左右。行腹部正中切口,逐层切开皮肤,腹直肌及腹膜,暴露左右肾脏,游离左、右肾蒂,切除右侧肾脏。用无损伤动脉夹夹闭左侧肾蒂,肾脏颜色变为暗红色即确认将肾脏血流阻断,50 min后松开血管夹恢复肾脏血供,肾脏颜色变为鲜红即为血流恢复,此为肾缺血再灌注模型。
1.2.2 分组 72例SD大鼠,随机分为4组,每组18例。假手术组(sham-operated control group,S组),单纯缺血再灌注组(ischemia reperfusion group,I/R组),臭氧氧化后处理组(ozone oxidative post-conditioning group,I/R+O3组),氧气O2后处理组(oxygen post-conditioning group,I/R+O2组)。S组切除右侧肾脏,仅行游离左侧肾蒂而不夹闭,切口用生理盐水纱布覆盖,暴露50 min后关腹;I/R组切除右侧肾脏,用无损伤动脉夹夹闭左侧肾蒂,肾脏颜色变为暗红色即确认将肾脏血流阻断,50 min后松开血管夹恢复肾脏血供,肾脏颜色变为鲜红即为血流恢复再灌注;I/R+O3组在I/R组基础上,再灌注成功后,从SD大鼠肛门按照1 mg/kg吹入O3和氧气的混合气体(臭氧浓度为50μg/ml),1次/d,持续2周;I/R+ O2组在I/R组基础上,再灌注成功后,按照13mg/kg从SD大鼠肛门吹入氧气,1次/d,持续2周。
4组所有SD大鼠经不同的手术及处理后,缝合伤口,麻醉苏醒后回鼠笼。术后每只大鼠腹腔注射青霉素20万IU/d,抗感染,连续3 d。术后所有动物在鼠笼中活动,正常获得水和食物。术后2周分别于下腔静脉采血,并于术后第2和10周,每组取9只大鼠肾脏标本。动物用静脉注射10%氯化钾处死。
1.2.3 标本采集 术后2周,3%戊巴比妥钠50 mg/kg大鼠腹腔注射麻醉生效后,大鼠仰卧位固定于手术台上,腹部消毒后剖腹,在无菌条件下抽取下腔静脉血液2~3 ml,将血液标本注入放有分离胶和促凝剂的试管,常温3 000 r/min离心15 min后留取上清液,置入-20℃冰箱冷冻保存,分别测定血血清肌酐(serum creatinine,Scr)和血浆尿素氮(blood urea nitrogen,BUN)。
于术后2和10周,每组各取9例SD大鼠,3%戊巴比妥钠50 mg/kg大鼠腹腔注射麻醉生效后,大鼠仰卧位固定于手术台上,去毛,75%乙醇消毒,500 u肝素钠腹腔注射,实验中体温(直肠温度)保持在37℃左右。切取左侧肾脏标本,并处死动物。用生理盐水通过肾动脉将肾脏灌注至变白,充分冲净肾脏血管中积存的血液,冲洗肾脏表面血液,滤纸吸干表面水份,冠状剖开肾脏,切取皮质块,经10%中性多聚甲醛固定后制备切片。常规苏木精-伊红染色法(hematoxylin-eosin staining,HE)染色、Masson染色及免疫组织化学法检测。
1.3 观察指标
1.3.1 Scr、BUN浓度 将血液标本注入放有抗凝剂和分离胶的试管常温1 500 r/min离心15 min,取上层血清置入-20℃冰箱冷冻保存,将血液标本送至本院检验科使用7170全自动生化分析仪(日本日立公司)测定Scr、BUN浓度。
1.3.2 组织形态学观察 在事先设计的时间点处死大鼠,切取左侧肾脏组织,10%多聚缓冲甲醛溶液固定24 h,制备切片,分别使用HE染色观察肾组织形态学变化;Masson染色观察肾组织纤维化变化,肾小管间质纤维化程度根据皮质和外髓质部受损面积占每高倍镜面积(×200)的百分比来判断;免疫组织化学法检测转化生长因子β1(transforming growth factor-β1,TGF-β1)、α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)的表达;用图像分析软件Image-Pro Plus 6.0(美国Media Cybernetics公司)进行分析,根据公式:累计光密度/阳性表达区面积=平均光密度值(optical delnsity,OD),计算OD值,进而定量比较各组的差异。
1.4 统计学方法
数据分析采用SPSS 17.0统计软件,计量资料以均数±标准差(±s)表示,多组间比较用单因素方差分析,组间两两比较用SNK-q检验,P<0.05为差异有统计学意义。
2 结果
2.1 缺血再灌注2周后大鼠肾功能和组织病理形态学的变化
根据尿素氮和肌酐来评价肾功能,2周后各组的肌酐、尿素氮基本恢复到缺血前水平,组间比较,差异无统计学意义(P>0.05)。见表1和图1。
但是通过HE染色可以看出肾组织形态学改变却不尽一致,I/R+O3组引起的肾小管间质损伤已恢复,并接近正常,组织形态学接近于S组,而I/R组和I/R+O2组却仍有小管变形、水肿、空泡、炎症细胞浸润、间质区变宽等病理改变。见图2。
表1 4组大鼠术后第2周Scr、BUN水平比较(n=18,±s)

表1 4组大鼠术后第2周Scr、BUN水平比较(n=18,±s)
组别BUN/(mmol/L)S组 29.8±3.17 7.01±1.68 I/R组 29.7±3.08 7.78±1.52 I/R+O3组 28.9±4.04 7.12±1.70 I/R+O2组 29.8±3.37 7.72±1.67 F值 0.290 1.059 P值 0.833 0.372 Scr/(μmol/L)
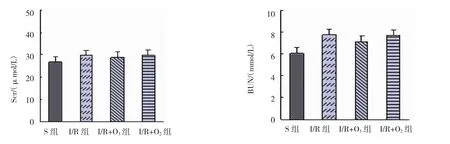
图1 术后2周各组Scr、BUN的变化 (n=18,±s)
Masson染色显示,I/R组、I/R+O2组小管间质已经有纤维化趋势,而S组、I/R+O3组尚无明显变化。见图3。
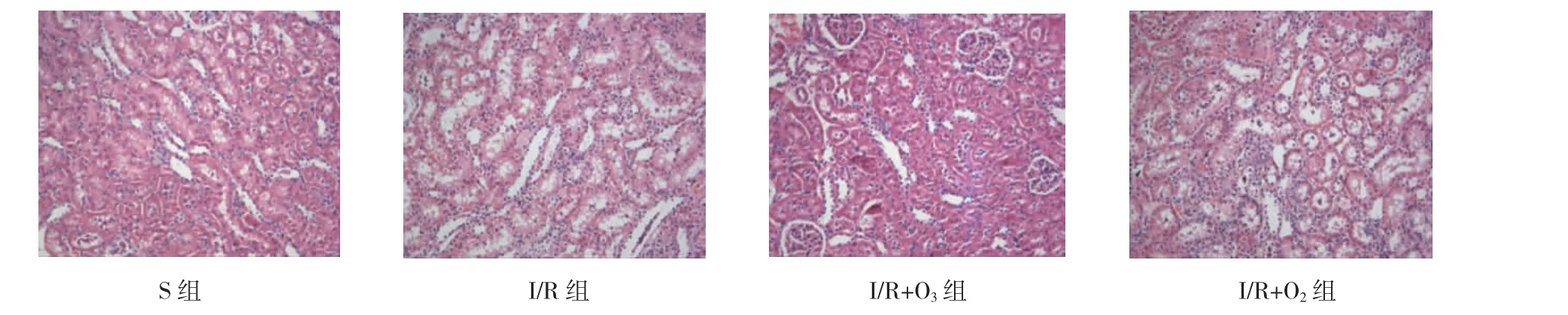
图2 术后2周各组肾组织病理形态学变化 (HE染色×200)
2.2 缺血再灌注10周后大鼠肾组织病理形态学变化
HE染色切片观察,各组肾小球未见明显改变,I/R组皮质及外髓质部分肾小管上皮细胞肿胀变性,少量炎症细胞浸润。总体来看4组间差异无统计学意义。
肾小管间质纤维化程度根据皮质和外髓质部受损面积占每高倍镜面积(×200)的百分比来判断。S组大鼠肾纤维化程度为(1.12±0.19)%,I/R组为(39.01±1.56)%,I/R+O3组为(18.02±1.58)%,I/R+ O2组为(37.80±5.89)%。Masson染色表现为:I/R组肾小管有萎缩、管腔扩张、胶原纤维沉积、间质区增宽,有炎症细胞浸润,出现呈条索状和片状分布的纤维化表现并且与I/R+O2组相似,S组无明显纤维化,而I/R+O3组纤维化明显减轻。4组间Masson染色比较,差异有统计学意义(F=294.394,P=0.000),且I/R组、I/R+O3组、I/R+O2组与S组比较,差异有统计学意义(t=25.494、11.360和24.686,P=0.000),I/R+ O2组与I/R组比较,差异无统计学意义(t=0.808,P=1.000),I/R+O3组与I/R组、I/R+O2组肾小管间质纤维化程度比较,差异有统计学意义(t=14.133和13.326,P=0.000),I/R+O3组较I/R组、I/R+O2组低。见图4。
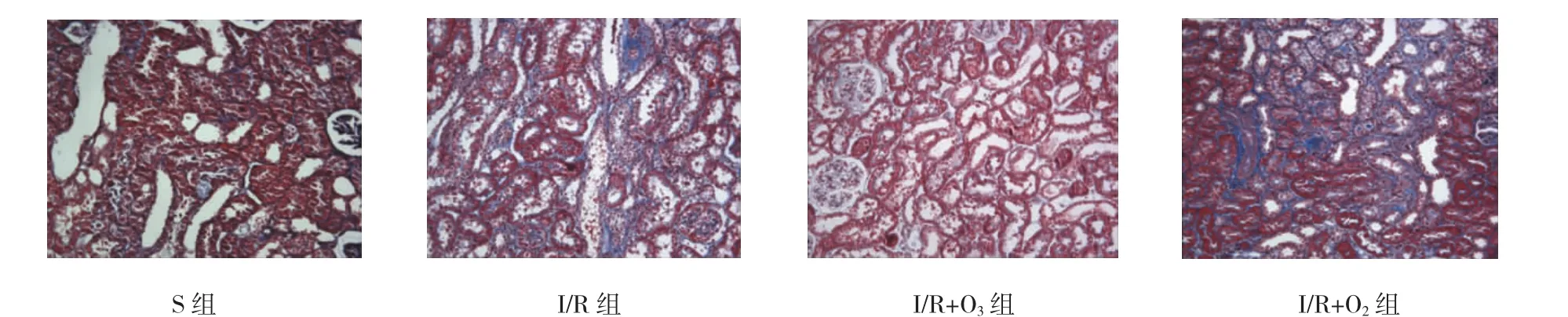
图3 术后2周各组肾组织病理形态学变化 (Masson染色×200)

图4 术后10周各组肾组织病理形态学变化 (Masson染色×200)
2.3 缺血再灌注10周后大鼠肾组织α-SMA、TGF-β1的表达
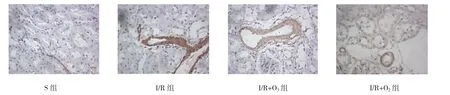
图5 术后10周各组α-SMA表达的变化 (免疫组织化学法×400)
免疫组织化学法检测结果显示,α-SMA的表达主要在间质和血管,而TGF-β1的表达主要在肾小管上皮细胞内,两者的阳性区域与纤维化分布位置较为一致。用图像分析软件Image-Pro Plus 6.0分析,计算平均OD值来比较各组差异。α-SMA、TGF-β1在S组表达很弱,在I/R组肾脏表达较强,并且与I/R+ O2组比较,差异无统计学意义;而在臭氧氧化后处理组较I/R组及I/R+O2组表达减弱(P<0.05)。4组α-SMA、TGF-β1表达比较,差异有统计学意义(F= 2 709.119和2 606.613、P=0.000),且I/R组、I/R+O3组、I/R+O2组的α-SMA、TGF-β1与S组比较,差异有统计学意义(tα-SMA=76.213、27.772和72.753,Pα-SMA= 0.000;tTGF-β1=76.086、25.825和68.906,PTGF-β1=0.000);I/R+O2组与I/R组的α-SMA、TGF-β1比较,差异无统计学意义(t=3.460和7.180,P=0.061和0.082);I/R+O3组α-SMA、TGF-β1与I/R组、I/R+O2组比较,差异有统计学意义(tα-SMA=48.442和44.981,Pα-SMA= 0.000;tTGF-β1=50.261和43.081,PTGF-β1=0.000),I/R+ O3组较I/R组、I/R+O2组低。见表2和图5、6。
表2 各组大鼠α-SMA、TGF-β1的表达比较(n=9,±s)
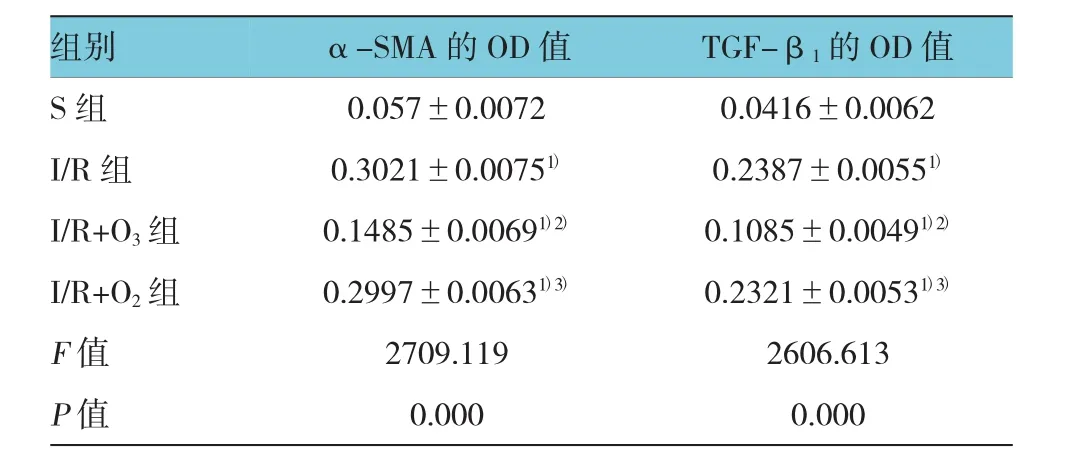
表2 各组大鼠α-SMA、TGF-β1的表达比较(n=9,±s)
注:1)与S组比较,P<0.05;2)与I/R组比较,P<0.05;3)与I/R组比较,P>0.05
组别TGF-β1的OD值S组 0.057±0.0072 0.0416±0.0062 I/R组 0.3021±0.00751) 0.2387±0.00551)I/R+O3组 0.1485±0.00691)2) 0.1085±0.00491)2)I/R+O2组 0.2997±0.00631)3) 0.2321±0.00531)3)F值 2709.119 2606.613 P值 0.000 0.000 α-SMA的OD值
图6 术后10周各组TGF-β1表达的变化 (免疫组织化学法×400)
3 讨论
自从再灌注损伤现象被报道后,围绕保护或减轻缺血再灌注损伤的研究就没有停止过。2002年缺血后处理的概念被提出[1],由于其现实的可行性高而备受关注。其实广义的后处理还包括药物干预、化学干预等缺血再灌注发生以后其他人为干预措施,如本研究中用臭氧氧化后处理发生缺血再灌注损伤的肾脏。
国内外一些研究证实,臭氧氧化预处理可以对缺血再灌注损伤的肾脏及其他器官有保护作用[2-3]。JOSE等[4]报道,臭氧氧化后处理对再灌注损伤导致的急性肾衰竭也有保护作用,并指出可能的机制有:刺激内源性抗氧化系统,诱导组织对氧自由基的抵抗力;增加血液循环和加快氧代谢;降低氧化应激;降低钙超载;增加内源性腺苷和NO的水平;减弱肾脏细胞凋亡的水平。但国内外有关臭氧后处理对缺血再灌注损伤远期保护作用的相关报道却不多。同时,动物实验和临床实验均表明,严重的缺血再灌注损伤不仅可以引起急性肾功能衰竭,而且可以导致慢性肾小管间质纤维化[5]。而肾间质纤维化是各种病因肾脏疾病进展到终末期肾病的共同通路。
有学者称,再灌注期间,肾小管有很强的增殖修复能力,再灌注损伤可以完全改善[6]。但有研究发现,一旦损伤程度超过某一临界值,肾小管损伤就是不可逆的,肾小管的结构和功能就不能完全恢复[7]。轻度的肾缺血再灌注损伤随着时间的推移,肾功能及肾脏的病理改变会逐步恢复正常,但是当发生的肾缺血再灌注损伤较严重时,由损伤导致的肾小管会发生不可逆性改变,表现为肾小管间质纤维化[8]。另有研究表明,中度的肾小管间质纤维化病变尽管没有引起血尿素氮,肌酐等指标异常升高,但是缺血性肾衰竭的存活者遗留有不同程度的慢性肾脏功能和结构损害[9-10]。
关于大鼠缺血再灌注模型的复制方法,相关文献报道不一,基本包括COHRANCE[11]和LEE等[12]复制的模型,其中肾缺血时间尤为重要。缺血时间过短,远期纤维化不明显,而缺血时间过长则会大大提高大鼠死亡率,本研究所采用的缺血50 min是在LEE等[12]复制模型的基础上,结合预实验而确立。本研究术后2周各组血Scr和BUN显示肾功能虽然基本恢复正常,但是病理形态学上仍存在异常,Masson染色显示有纤维化趋势。而术后10周,缺血再灌注组出现的间质纤维化就十分明显,与此相对应的是肉眼观肾脏体积增大,肾脏表面不再光滑,粗糙呈颗粒样凹凸不平。这说明在本研究中缺血再灌注已经造成不可逆的肾脏慢性损伤,10周出现较明显的肾间质纤维化。可以理解为50min的较长时间缺血,造成肾脏持续的明显损伤,使肾脏在血流复灌后第10周出现较明显的肾间质纤维化。说明本实验通过缺血再灌注损伤复制的大鼠肾纤维化模型是成功。但是具体缺血时间的长短,对应引起肾脏纤维化的程度的轻重,以及两者是否一致,还有待进一步研究。
本研究结果显示,臭氧氧化后处理减轻肾小管间质纤维化病变,同时还使肾组织α-SMA、TGF-β1的表达降低。
α-SMA是肌成纤维细胞的标志,而肌成纤维细胞是成纤维细胞的活化形式,同时也是细胞外基质胶原成分的主要来源[13]。在正常肾组织中α-SMA仅在动脉平滑肌细胞中表达,而本研究术后10周的肾间质中可以看到其表达增加,说明早期肾间质中成纤维细胞已活化。
TGF-β1被公认为是众多纤维因子中的重要一个,其与受体结合,通过细胞内信号转导而活化靶基因,从而产生一系列靶蛋白,该蛋白可以通多种途径或其他机制使肌成纤维细胞增多。TGF-β1有多条下游信号通路,其中又以Smad信号通路在多种组织器官的纤维化过程中发挥重要作用[14]。许多对TGF-β1/Smad通路的研究发现,通过拮抗TGF-β1活化可以减轻肾间质纤维化[15]。OVERSTREET等[16]研究也发现,通过激活TGF-β1信号传导通路可导致肾脏纤维化。
而笔者研究发现,术后10周单纯缺血再灌注组的α-SMA、TGF-β1表达较假手术组增强,与此同时其纤维化程度也较对照组假手术组增强。提示缺血再灌注所导致的肾小管间质纤维化可能与肌成纤维细胞增多及TGF-β1/Smad信号通路激活有关。
另外,在笔者的研究中发现,α-SMA、TGF-β1在I/R组肾脏表达都增强,并且与I/R+O2组比较差异无统计学意义,而在O3后处理组与之比较,表达减弱,在假手术组无明显表达。这提示O3后处理对缺血再灌注损伤造成的肾纤维化无明显作用,同时排除其对观察臭氧后处理对肾纤维化作用效果的干扰。O3后处理组肾间质纤维化程度较单纯缺血再灌注组明显减轻,同时其α-SMA、TGF-β1表达减弱,两者相一致,则提示臭氧氧化后处理减轻组织纤维化的作用可能与其抑制TGF-β1/Smad信号通路激活有关。
综上所述,本研究提示较严重的肾脏缺血再灌注则可以引起肾小管间质纤维化,其机制可能与肌成纤维细胞增多,以及TGF-β1/Smad信号通路激活有关;而臭氧氧化后处理则可能通过抑制该信号通路而减轻肾脏的纤维化改变。至于更详细的抑制该信号通路机制,还有待进一步探讨。臭氧氧化后处理在临床上较具有现实可行性,有一定的运用前景,本课题研究为其提供一定的理论基础。
[1]BAXTER G F,YELLON D M.Current trends and controversies in ischemia-reperfusion research-meeting report of the Hatter institute 3rd international workshop on cardioprotection[J].Basic Res Cardiol,2003,98(2):133-136.
[2]邱涛,周江桥,陈晖,等.臭氧氧化预处理在肾缺血再灌注损伤中对内皮型一氧化氮合酶表达的影响[J].中华移植杂志:电子版, 2013,2:83-88.
[3]XING B,CHEN H,WANG L,et al.Ozone oxidative preconditioning protects the rat kidney from reperfusion injury via modulation of the TLR4-NF-κB pathway[J].Acta Cir Bras,2015,30(1): 60-66.
[4]JOSE L C,YANELIS T,SILVIA M,et al.Ozone oxidative post-conditioning in acute renal failure[J].Journal of Pharmacy and Pharmacology,2009,61:221-227.
[5]AKAN M,OZBILGIN S,BOZTAS N,et al.Effect of magnesium sulfate on renal ischemia-reperfusion injury in streptozotocin-induced diabetic rats[J].Eur Rev Med Pharmacol,2016,20(8): 1642-1655.
[6]ERGIN B,INCE C.Hypertonic saline improves renal oxygenation,renal function and inflammation following ischemia/reperfusion-induced acute kidney injury[J].Intensive Care Med Exp, 2015,3(1):1-2.
[7]GOBE G C,JOHNSON D W.Distal tubular epithelial cells of the kidney:potential support for proximal tubular cell survival after renal injury[J].Int J Biochem Cell Biol,2007,39(9):1551-1561.
[8]MENKE J,IWATA Y,RABACAL W A,et al.CSF-1 signals directly to renal tubular epithelial cells to mediate repair in mice[J]. J Clin Invest,2009,119(8):2330-2342.
[9]JIANG S,CHEN Y,ZOU J,et al.Diverse effects of ischemic pretreatments on the long-term renal damage induced by ischemia-reperfusion[J].Am J Nephrol,2009,30(5):440-449.
[10]WEI Q,XIAO X,FOGLE P,et al.Changes in metabolic profiles during acute kidney injury and recovery following ischemia/ reperfusion[J].PLoS One,2014,9(9):DOI:10.1371/journal.pone. 0106647.
[11]COCHRANE J,WILLIAMS B T,BANERJEE A,et al.Ischemic preconditioning at tenuates functional,metabolic,and morphologic injury from ischemic acute renal failure in the rat[J].Ren Fail,1999,21:135-145.
[12]LEE H T,EMALA C W.Protective effect s of renal ischemic preconditioning and adenosine pretreatment role of A (1)and A(3)receptors[J].AM J Physiol Renal Physiol,2000,278:380-387.
[13]HIRABARU M,MOCHIZUKIK K,TAKATSUKI M,et al.Expression of alpha smooth muscle actin in living donor liver transplant recipients[J].World J Gastroenterol,2014,20(22): 7067-7074.
[14]MENG X M,NIKOLIC-PATERSON D J,LAN H Y.TGF-β: the master regulator of fibrosis[J].Nat Rev Nephrol,2016,12(6): 325-338.
[15]HU N,DUAN J LI H,et al.Hydroxysafflor yellow a ameliorates renal fibrosis by suppressing TGF-β1-induced epithelialto-mesenchymal transition[J].PLoS One,2016,11(4):DOI: 10.1371/journal.pone.0153409.
[16]OVERSTREET J M,SAMARAKOON R,MELDRUM K K,et al. Redox control of p53 in the transcriptional regulation of TGF-betal target genens through SMAD cooperativity[J].Cell Signal, 2014,26(7):1427-1436.
(童颖丹 编辑)
Ozone oxidative post-conditioning protects rat kidney from ischemia reperfusion injury
Guo-xiao Chen1,Xiu-heng Liu2,Xiang-sheng Zhang1,De-gang Ding1, Xiao-bo Zhu1,Xin Chen1,Tian-zhong Yan1
[1.Department of Urology,Henan Provincial People's Hospital(People's Hospital of Zhengzhou University),Zhengzhou,Henan 450003,China;2.Department of Urology,the People's Hospital of Wuhan University(Hubei Provincial People's Hospital),Wuhan,Hubei 430060,China]
ObjectiveTo explore the effect of ozone oxidative post-conditioning on chronic renal fibrosis induced by ischemia reperfusion injury in rats and the mechanism.MethodsTotally 72 adult male SD rats were randomly divided into four groups (18 in each):sham-operation control group (S group),ischemia reperfusion group (I/R group),ozone oxidative post-conditioning group (I/R+O3group)and oxygen postconditioning group(I/R+O2group).Serum creatinine(Scr)and blood urea nitrogen(BUN)levels were evaluated 2 w after successful modeling.Renal specimens were obtained in the 2th and 10th week respectively,and the renal tissues were stained by HE and Masson staining.The protein expressions of transforming growth factorβ1(TGF-β1)and α-smooth muscle actin(α-SMA)were determined by immunohistochemistry analysis.ResultsAfter two weeks of treatment,Scr and BUN of each group basically returned to normal levels,and there were no significant differences among the four groups (P>0.05).Ten weeks after operation,Masson staining revealed renal fibrosis of the I/R,I/R+O2and I/R+O3groups was more serious than that of the S group (P< 0.05),renal fibrosis of the I/R+O3group was milder than taht of the I/R and I/R+O2groups (P<0.05),whilethere was no difference between the I/R group and the I/R+O2group (P>0.05).The protein expressions of TGF-β1and α-SMA of the I/R,I/R+O2and I/R+O3groups were higher than those of the S group (P<0.05); and compared with the I/R group,the expressions of TGF-β1and α-SMA were lower in the I/R+O3group (P< 0.05).There was no difference in the expression of TGF-β1or α-SMA between the I/R+O2group and the I/R group (P>0.05).ConclusionsOzone oxidative post-conditioning can relieve chronic renal fibrosis caused by ischemic reperfusion injury,and inhibition of activation of TGF-β1/Smad signaling pathway may be one of the mechanisms.
ischemia/reperfusion injury;renal fibrosis;ozone oxidative post-conditioning
R692
A
10.3969/j.issn.1005-8982.2017.09.004
1005-8982(2017)09-0019-06
2016-07-06
张祥生,E-mail:zxs9818@126.com,Tel:15037103077

