钙离子对木聚糖酶Xyn10A热稳定性的影响
陈秀霞,王亮亮,张瑜,李迅,王飞
(南京林业大学化学工程学院,江苏省林业资源高效加工利用协同创新中心,江苏省农林生物质资源化学利用国家重点实验室培育点,江苏省生物质绿色燃料与化学品重点实验室,南京 210037)
钙离子对木聚糖酶Xyn10A热稳定性的影响
陈秀霞,王亮亮,张瑜,李迅,王飞*
(南京林业大学化学工程学院,江苏省林业资源高效加工利用协同创新中心,江苏省农林生物质资源化学利用国家重点实验室培育点,江苏省生物质绿色燃料与化学品重点实验室,南京 210037)
木聚糖酶广泛应用于食品、饲料、纺织、能源等领域。在生产过程中木聚糖酶的热稳定性较为重要,它直接影响酶的反应温度及使用效率。添加Ca2+能够显著提高来源于ThermotogathermarumDSM 5069的木聚糖酶Xyn10A在高温(85℃)条件下的热稳定性。为解析Xyn10A酶蛋白中的Ca2+结合区域及热稳定性机制,笔者采用蛋白质结构模拟和定点突变技术以确定该结合区域,并分析其对于酶热稳定性的影响机制。酶蛋白的建模和结构比对结果表明,GH10家族木聚糖酶的结构保守性远大于其序列保守性;木聚糖酶Xyn10A中局部环区(712IYRDNATKYEIPP724)涉及Ca2+的结合功能,同时其热稳定性依赖于该环区与Ca2+之间的亲和力。对该环区的定点突变和删除突变导致Xyn10A无法有效地结合Ca2+。Ca2+可与酶蛋白中的(712IYRDNATKYEIPP724)环区形成配位键,显著降低Xyn10A酶催化结构域的柔性和自由度,使Xyn10A酶能够在高温下保持优良的热稳定性,进而有效地发挥其高温催化水解木聚糖的能力。
嗜热木聚糖酶;Ca2+结合区域;热稳定性;结构模拟;定点突变
木聚糖是半纤维素的主要成分,是仅次于纤维素的第二大有机可再生生物资源[1-4]。半纤维素的有效降解需要一系列半纤维素水解酶系的参与,其中木聚糖酶是木聚糖水解的关键酶,负责水解木聚糖主链的β-1,4-糖苷键生成低聚木糖和木糖[5-6]。根据酶蛋白氨基酸序列的同源性,木聚糖酶主要属于两个糖苷水解酶家族(glycoside
hydrolase family, GH),即GH10和GH11[7]。GH10家族木聚糖酶含有较多结构域,如催化结构域(catalytic domain, CD)、纤维素结合结构域(cellulose binding domain, CBD),其相对分子质量一般大于30 000,且其催化产物中单糖较多,在结构上呈现碗状结构[8]。与GH11家族木聚糖酶相比,GH10家族木聚糖酶在耐高温以及耐酸碱性方面更具优越性。木聚糖酶广泛应用于食品、饲料、纺织和能源工业[9-11],但在应用过程中仍然存在诸多问题,如在纸浆处理和饲料质粒加工过程中需要对产品进行高温处理,这对木聚糖酶的热稳定性要求较高,因而木聚糖酶的热稳定性成为国内外研究学者关注的热点[12-13]。
随蛋白晶体结构研究的不断深入,大量蛋白质三维结构逐渐被解析,为从分子水平研究酶的催化过程和机制提供了微观的结构信息。理性设计的基础是要了解蛋白质的三维结构,但由于诸多原因,目前很多蛋白质的三维结构尚未解析。因此,可利用蛋白质三维结构模拟技术从蛋白质的一级结构出发,预测出未知蛋白质的空间结构,通过理性设计等蛋白质工程技术对酶进行相关改造[14],研究酶的结构与功能的关系等。
金属离子能够影响酶的底物专一性、催化能力、热稳定性等。其中,Ca2+对酶的热稳定性影响较为显著。曾静等[15]发现来源于极端嗜热古生菌(Thermococcuskodakarensis)KOD1的嗜热淀粉酶在Ca2+结合区域的突变N110A/D155A/D164A不利于Ca2+维持淀粉酶的热稳定性,Ca2+通过与天冬氨酸和天冬酰胺侧链残基之间相互作用,形成稳定结构以保持淀粉酶的热稳定性;Goh等[16]发现来源于芽孢杆菌(Bacillussp.)G1的环糊精葡萄糖基转移酶(CGT酶)在Ca2+结合位点CaⅠ处的S182G突变能显著提高其热稳定性,Ca2+结合位点沿酶分子结构中环的伸展和短α-螺旋出现,其表现为变形的U形;Li等[17]发现来源于环状芽孢杆菌(B.circulans)STB01的β-CGT酶在Ca2+结合位点CaⅢ处A315D和D577K突变能提高其热稳定性,Ca2+结合位点连接酶分子结构中相关残基并桥接酶蛋白的不同部分,稳定折叠结构。Spurway等[18]的研究表明,来源于荧光假单胞菌(Pseudomonasfluorescenssubsp.Cellulosa)的木聚糖酶A存在一个环区,Ca2+能与环区部分氨基酸残基以及羰基等作用以稳定结构,避免酶在高温下失活。由此可见,酶的Ca2+结合区域总是处于酶分子的柔性部位,Ca2+的添加与此区域的氨基酸侧链残基等相互作用形成稳定的结构,从而保持高温下酶分子的热稳定性。
本实验室在前期研究中发现来源于ThermotogathermarumDSM 5069的耐热木聚糖酶Xyn10A在Ca2+存在的条件下,于85℃下保温2 h,仍能保持良好的热稳定性[19]。基于此,本研究通过同源建模和定点突变技术确定了木聚糖酶Xyn10A的Ca2+结合区域,并分析了该区域中影响Ca2+结合的关键位点及其提高木聚糖酶Xyn10A热稳定性的机制,以期为Ca2+对木聚糖酶热稳定性深入研究奠定基础。
1 材料与方法
1.1 试验材料
大肠杆菌(Escherichiacoli)TOP10、BL21(DE3)和pET-20b质粒均购自Novagen公司(Darmstadt, Germany)。DNA聚合酶、限制性内切酶、DNA Marker、T4 多聚核苷酸激酶、T4 DNA连接酶等均购自Takara公司(大连);PCR纯化试剂盒和质粒提取试剂盒均购自Biomiga公司(上海);常用生化试剂氨苄青霉素(Amp)、异丙基-β-D-硫代半乳糖苷(IPTG)、榉木木聚糖均购于Sigma公司;其他生化试剂及药品均为国产分析纯。重组质粒pET-20b-xyn10A为本实验室构建[19]。引物合成和测序服务均由南京斯普金生物科技有限公司完成。
1.2 培养基及菌种
LLB(low-salt LB)培养基[20]配方为(质量浓度):10 g/L胰蛋白胨、5 g/L酵母提取物、5 g/L NaCl;在每升液体LLB中加入15 g琼脂粉即为固体LLB培养基。大肠杆菌TOP10菌株用于质粒的提取和保持;大肠杆菌BL21(DE3)菌株用于目的蛋白的表达。
1.3 试验方法
1.3.1 木聚糖酶Xyn10A结构模拟
蛋白质正确的折叠结构是蛋白质行使功能的必要条件,通过对蛋白质三维结构的模拟,可以进一步获取蛋白质功能信息。本研究将木聚糖酶Xyn10A催化结构域的氨基酸序列在线提交至I-TASSER服务器(http:∥zhanglab.ccmb.med.umich.edu/I-TASSER/)进行蛋白质结构模拟。根据服务器反馈的建模结果,选取得分最高的模拟结构用于后续分析。利用PyMOL软件对相关蛋白质结构进行可视化操作和编辑。
1.3.2 木聚糖酶的定点突变
采用蛋白质结构模拟技术,预测蛋白质空间结构,从氨基酸化学结构角度分析其分子结构与功能之间的关系,然后通过定点突变技术确定涉及蛋白质热稳定性的相关位点和区域。因此,本研究通过模拟Xyn10A催化结构域的蛋白质结构,并根据结构信息进行定点突变,确定潜在的Ca2+结合区域。
以重组质粒pET-20b-xyn10A为模板,采用一步反向PCR方法,首先将4个氨基酸残基D715、N716、Y720和E721同时突变成丙氨酸(A),即D715A、N716A、Y720A和E721A,构建突变体Catb1;然后在Catb1基础上将Y713、R714、T718和K7194个氨基酸残基同时突变为苯丙氨酸(F),即Y713F、R714F、T718F和K719F,构建突变体Catb2;对肽段712IYRDNATKYEIPP724区域进行缺失突变,构建缺失突变体Catb3。Catb1、Catb2和Catb3相关突变引物的信息见表1。

表1 引物信息Table 1 Primer information
注:横线标示为突变点的三联体密码子。
突变体Catb1的PCR反应条件:94℃预变性3 min;94℃变性30 s;60℃退火30 s;72℃延伸7.5 min,共21个循环;72℃延伸5 min。突变体Catb2和Catb3的PCR反应条件:98℃变性10 s;55℃退火5 s;72℃延伸1 min,共25个循环;72℃延伸3 min。
对上述PCR扩增产物进行1%的琼脂糖凝胶电泳检测。阳性PCR扩增产物经过限制性内切酶DpnⅠ处理和纯化后,直接转化至大肠杆菌TOP10感受态细胞中,转化产物涂布于含有氨苄青霉素(100 μg/mL)LLB固体平板,然后于37℃培养箱中静置过夜培养,随机挑取阳性转化子进行测序。
1.3.3 突变木聚糖酶的诱导表达
将经过测序验证的突变体质粒分别转化至大肠杆菌BL21(DE3)感受态细胞中,分别随机挑取突变体单菌落于5 mL液体LLB(Amp, 100 μg/mL)中进行活化培养,然后以体积分数为2%的接种量接种于200 mL液体LLB培养基中,扩大培养(37℃)至OD600为0.8左右,然后添加诱导剂IPTG至终浓度为0.5 mmol/L,在25℃、转速120 r/min条件下诱导10 h,使大肠杆菌培养物产酶。离心收集菌体(10 000 r/min, 5 min),弃去上层清液,保留菌体,用去离子水洗涤菌体3遍,最后重悬于预冷的结合缓冲液(20 mmol/L Tris-HCl、0.5 mmol/L NaCl、5 mmol/L咪唑,pH=7.4)中,超声波破碎细胞。
1.3.4 突变木聚糖酶的分离纯化
在冰浴中以300 Hz频率超声波破碎细胞,每次超声破碎2 s,间隔5 s,直至菌液透明。高速离心(4℃, 12 000 r/min, 15 min)细胞裂解液,收集上层清液,即为粗酶液。将粗酶液置于70℃下处理20 min,4℃,12 000 r/min离心40 min后保留上层清液。由于重组酶的C端均含有组氨酸标签(His-tag),因此,通过AKTA purifier UPC 10系统进行镍柱亲和层析。收集洗脱产物,并通过10% SDS-PAGE分析重组酶的表达和纯化情况。
1.3.5 木聚糖酶酶活的测定方法
采用3,5-二硝基水杨酸比色法(3,5-dinitrosalicylic acid, DNS)测定木聚糖酶活性。在1.5 mL离心管中加入140 μL 咪唑-邻苯二甲酸氢钾缓冲液(50 mmol/L, pH=7.0)和50 μL质量分数为0.5%底物榉木木聚糖,在最适反应温度下保温5 min,加入10 μL稀释一定倍数的木聚糖酶酶液,置于最适反应温度反应10 min,加入300 μL DNS终止反应,沸水浴显色5 min,最后置于冰水浴中冷却。通过酶标仪测定550 nm处的吸光度变化值[19]计算重组酶酶活。酶活单位定义:每分钟催化分解木聚糖产生1 μmol还原性糖所需的酶量为一个木聚糖酶活性单位(U)。以牛血清白蛋白(bovine serum albumin, BSA)为标准蛋白,采用Bradford法测定蛋白浓度[21]。
1.3.6 木聚糖酶最适反应温度的测定
分别在70,75,80,85,90,95和100 ℃下测定原始酶Xyn10A和突变木聚糖酶的酶活(以各自最高酶活定义为100%)。
1.3.7 木聚糖酶温度稳定性的测定
在适当浓度的原始酶Xyn10A和突变木聚糖酶中加入终浓度为5 mmol/L的CaCl2,分别以不加CaCl2的酶液为对照,置于85℃下保温0,30,60,90和120 min,于各自的最适条件下测定酶活力。
将已添加CaCl2的突变体Catb3酶液分别置于70,75和80℃保温0,30,60,90和120 min,于pH 7.0、80℃条件下测定酶活力(相对酶活均以添加5 mmol/L Ca2+的原始酶Xyn10A保温0 min的酶活力作为对照)。
2 结果与分析
2.1 Ca2+突变位点的确定
由蛋白质结构模拟结果可见,木聚糖酶Xyn10A催化结构域是一个典型的(β/α)8折叠桶结构(图1a),建模结果符合CAZy数据库(http:∥www.cazy.org/)中GH10家族的结构特点。已有研究结果表明,Ca2+能够提高来源于荧光假单胞菌(P.fluorescens)的木聚糖酶Xylanase A(XylA)的热稳定性[22],因此,本研究将木聚糖酶Xyn10A催化结构域的模拟结构与含有Ca2+的XylA的结晶结构(PDB entry:1E5N, chain A)进行空间比对。尽管这两种木聚糖酶的氨基酸序列相似性仅为33.5%,但结构比对叠合结果显示,两种蛋白结构高度一致,二者主链碳原子的均方根偏差(RMSDCa)仅为0.086 7 nm(图1a)。
从木聚糖酶XylA和Xyn10A叠合结构可以看出,在Ca2+附近的微环境中,两个木聚糖酶中均存在一个loop结构(图1b),该loop结构涉及木聚糖酶与Ca2+的专一性结合。因此,推测木聚糖酶Xyn10A中loop区域712IYRDNATKYEIPP724的如下氨基酸残基均可能涉及Ca2+结合位点:第713位酪氨酸(Y713),第714位精氨酸(R714),第715位天冬氨酸(D715),第716位天冬酰胺(N716),第718位苏氨酸(T718),第719位赖氨酸(K719),第720位酪氨酸(Y720)和第721位谷氨酸(E721)。丙氨酸扫描突变方法广泛用于蛋白质活性中心、蛋白质间相互作用、蛋白质稳定性等方面研究。丙氨酸的侧链较小,主要是一个甲基基团(—CH3),用丙氨酸替换其他氨基酸,一般只改变侧链Cb以外的构象,而不会改变蛋白质主链的构象。然而,由于丙氨酸的密码子是GCN,富含碱基G,局部区域内进行丙氨酸突变又会造成DNA和mRNA局部鸟嘌呤的富集,不利于基因的转录和翻译;而苯丙氨酸的密码子为TTT、TTC,富含碱基T,有助于减弱或消除GCN所带来的不利影响[23-24]。丙氨酸和苯丙氨酸均为疏水性氨基酸,可破坏残基侧链和Ca2+之间的极性相互作用。因此,将可能涉及Ca2+结合的位点突变成丙氨酸或者苯丙氨酸有助于识别涉及Ca2+结合的位点。

图1 Xyn10A(红色飘带)与XylA(灰色飘带)的 蛋白质结构比对Fig. 1 Structural alignment of xylanases Xyn10A (red ribbon) and XylA (gray ribbon)
2.2 突变质粒的构建
以pET-20b-xyn10A重组质粒为模板,反向PCR扩增构建突变体Catb1和Catb3;以突变体Catb1的质粒为模板,反向PCR扩增构建突变体Catb2。琼脂糖凝胶核酸电泳显示3个突变体的PCR条带大小与理论大小相符合,其中突变体Catb1和Catb2为7 217 bp,突变体Catb3为7 178 bp(图2),测序验证正确。
2.3 突变木聚糖酶的诱导表达及分离纯化将阳性克隆突变体按照1.3.3方法诱导产酶,经镍柱亲和纯化,咪唑洗脱液浓度为100 mmol/L时,目的蛋白被洗脱。3种突变体蛋白经10% SDS-PAGE分析,洗脱样均在SDS-PAGE凝胶电泳上几乎显示为单一条带(图3),分子质量大小均为130 ku左右,大小与理论预测值基本一致,表明亲和层析纯化后得到的蛋白即为木聚糖酶目标蛋白。突变体Catb1的纯化倍数和回收率分别为4.36和58.6%;突变体Catb2的纯化倍数和回收率分别为4.02和44.6%;突变体Catb3的纯化倍数和回收率分别为4.10和51.7%。纯化后的突变体Catb1、Catb2和Catb3比酶活分别为52.27,47.37和19.47 U/mg,而原始酶Xyn10A比酶活为100 U/mg,与原始酶的比酶活相比,突变体的比酶活均有所下降。
a)Catb1 PCR产物凝胶电泳图;b)Catb2 PCR产物凝胶电泳图;c)Catb3 PCR产物凝胶电泳图 M:DNA marker;1:Catb1反向PCR的产物;2:Catb2反向PCR的产物;3:Catb3反向PCR的产物图2 定点突变PCR产物的琼脂糖凝胶电泳Fig. 2 The PCR products by site-directed mutagenesis

a)Catb1纯化前后SDS-PAGE电泳图;b)Catb2纯化前后SDS-PAGE电泳图;c)Catb3纯化前后SDS-PAGE电泳图 M:标准蛋白质分子质量;1:Catb1粗酶液;2:Catb1 70℃热处理20 min后;3:Catb1 100 mmol/L咪唑洗脱液;4:Catb2粗酶液; 5:Catb2 70℃热处理20 min后;6:Catb2 100 mmol/L咪唑洗脱液;7:Catb3粗酶液;8:Catb3 70℃热处理20 min后; 9:Catb3 100 mmol/L咪唑洗脱液图3 突变木聚糖酶的SDS-PAGE分析Fig. 3 SDS-PAGE analyses of mutant xylanases
2.4 突变木聚糖酶的最适反应温度
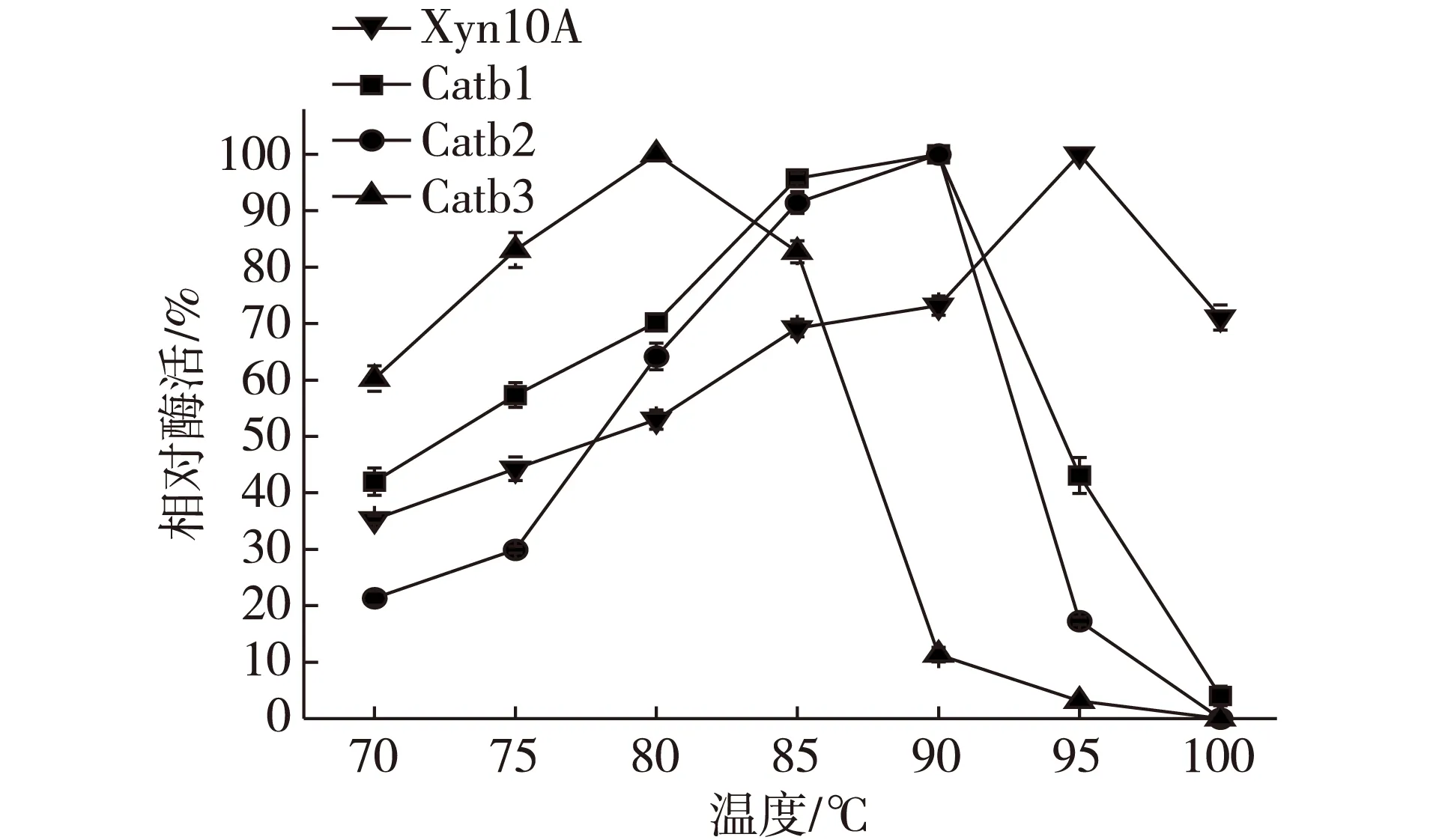
图4 突变木聚糖酶的最适温度Fig. 4 Optimum temperature of mutant xylanases
原始酶和突变木聚糖酶的最适反应温度结果见图4,原始酶在70℃时,其相对酶活仅为35%左右,随反应温度的升高,在95℃时酶活达到最大值,温度继续升高至100℃时,其相对酶活降至约71%;突变体Catb1在70℃时,其相对酶活仅为42%左右,随反应温度升高,在90℃时酶活达到最大值,温度继续升高达到100℃时,其相对酶活降至4%左右;突变体Catb2在70℃时,其相对酶活只有21%左右,随反应温度升高,在90℃时酶活达到最大值,当温度为100℃时,酶活力丧失;突变体Catb3在70℃时,其相对酶活约60%,在80℃时酶活达到最大值,当温度继续升高,酶活力显著下降,在100℃时酶活力为0。
试验数据表明,突变体Catb1和Catb2的耐热性均有所下降,最适温度均为90℃,较原始酶最适温度均下降了5℃,由于D、N、Y,R、T、K、Y和E均为极性氨基酸,其中带负电荷的酸性氨基酸残基D和E很有可能与Ca2+发生静电作用形成离子键从而稳定结构,侧链含羟基(—OH)氨基酸残基Y、T和侧链含酰胺基氨基酸残基N可能与Ca2+形成配位键,而突变为中性氨基酸后,减弱了Ca2+与环区的相互作用,从而导致最适温度的下降;而突变体Catb3的耐热性显著降低,最适温度仅为80℃,较原始酶下降了15℃,说明除这些极性氨基酸的侧链,该环区的其他部位也可能与Ca2+相互作用。
2.5 突变木聚糖酶的温度稳定性
原始酶与突变木聚糖酶的温度稳定性结果见图5a。添加Ca2+的原始酶保持较高热稳定性,保温60~120 min内酶活力基本保持96%左右的初始活力;未添加Ca2+的原始酶的酶活力呈明显下降趋势,保温120 min后相对酶活仅为23%左右。
添加Ca2+后突变体Catb1和Catb2的酶活力也呈下降趋势,保温0 min时Catb1和Catb2的酶活力分别为添加Ca2+的原始酶初始活力的61%和66%左右,而保温120 min后Catb1和Catb2相对酶活仅剩43%和46%左右;未添加Ca2+的突变体Catb1和Catb2初始酶活分别为59%和66%左右,而保温120 min后酶活力分别下降至13%和17%左右;添加Ca2+的突变体Catb3的热稳定性显著下降,保温0 min时其相对酶活约为34%,保温120 min后酶活则完全丧失;突变体Catb3未添加Ca2+与添加Ca2+的相对酶活变化曲线基本一致。
添加CaCl2的突变体Catb3在70,75和80℃下的温度稳定性结果见图5b。Catb3在70℃下保温120 min后相对酶活下降5%左右,75℃下保温120 min后相对酶活下降7%左右,于80℃下保温120 min后相对酶活下降10%左右。
试验结果显示,Ca2+能够显著提高原始酶Xyn10A的热稳定性,但对3个突变体表现出不同程度影响。原始酶和3个突变体在85℃下保温0 min初始酶活差异较为显著,可能是由于3个突变体的最适反应温度发生了改变。在85℃条件下保温120 min后,添加与未添加Ca2+的原始酶Xyn10A的酶活比约为4.15;添加与未添加Ca2+的突变体Catb1的酶活比约为3.24;添加与不添加Ca2+的突变体Catb2的酶活比约为2.68,但Ca2+对于突变体Catb3几乎未现明显稳定作用,说明突变后Ca2+对突变体Catb1、Catb2、Catb3的热稳定作用逐渐减弱并丧失,且Ca2+在70,75和80℃条件下也无法提高突变体Catb3热稳定性。这表明原始酶Xyn10A的局部环区712IYRDNATKYEIPP724涉及Ca2+的结合功能,Ca2+通过该环区提高原始酶Xyn10A的热稳定性。

a)Xyn10A、Catb1、Catb2和Catb3添加5 mmol/L Ca2+以及未添加Ca2+在85℃下的热稳定性; b)添加5 mmol/L Ca2+的Catb3在70,75和80℃下的热稳定性图5 突变木聚糖酶的温度稳定性Fig. 5 Temperature stability of mutant xylanases
3 结 论
本研究采用蛋白质结构模拟方法对Xyn10A酶蛋白进行了结构预测,推断Xyn10A酶蛋白的环区712IYRDNATKYEIPP724涉及Ca2+的结合。对该环区进行定点突变和删除突变,获得3个突变体Catb1、Catb2和Catb3。3个突变体均保持催化活力,且蛋白质模拟结构表明环区712IYRDNATKYEIPP724位于Xyn10A酶蛋白表面,远离其催化活性中心,故该环区定点突变不会引起酶催化活性中心理化性质改变。对结果分析发现,在原始酶结构中Ca2+与环区712IYRDNATKYEIPP724之间形成离子键和配位键,限制了环区的结构自由度,从而有助于原始酶Xyn10A在高温条件下保持整个催化结构域的结构刚性,确保功能残基保持合适的构象,发挥催化能力。Xyn10A酶蛋白环区中除极性氨基酸残基侧链参与Ca2+与环区相互作用外,环区某些主链酰胺键中的羰基也参与其中,使Ca2+对突变体Catb1和Catb2的热稳定作用减弱。而在缺失突变体Catb3结构中,环区712IYRDNATKYEIPP724完全从Xyn10A酶催化结构域中删除,彻底破坏了Ca2+与环区之间的相互作用,从而导致Ca2+对突变体Catb3热稳定作用的丧失。本试验结果虽然得到Ca2+与木聚糖酶的结合区域,但突变体热稳定性均下降,因此,今后还需对此段区域尝试其他突变以获得比原始酶热稳定性更好的突变体。
[1]代云静, 李婵娟, 汤文浩, 等. N63D及A143E定点突变对枯草芽孢杆菌木聚糖酶最适pH及活性的影响[J]. 农业生物技术学报, 2015, 23(12):1617-1624. DAI Y J, LI C J, TANG W H, et al.Mutations at N63D and A143E change the pH optimum and activity of xylanase fromBacillussubtilis[J]. Journal of Agricultural Biotechnology, 2015, 23(12):1617-1624.
[2]李思佳, 王亚伟, 付正, 等. 嗜热真菌木聚糖酶1YNA及其双硫键突变体在毕赤酵母中的表达[J]. 中国生物工程杂志, 2013, 33(3):74-79.
[3]ZHOU J, WU Q, ZHANG R, et al. A thermo-halo-tolerant and proteinase-resistant endoxylanase fromBacillussp. HJ14[J]. Folia Microbiologica, 2014, 59(5):423-431.
[4]SHI H, LI X, GU H X, et al. Biochemical properties of a novel thermostable and highly xylose-tolerantβ-xylosidase/α-arabinosidase fromThermotogathermarum[J]. Biotechnology for Biofuels, 2013, 6(1):27.
[5]杨浩萌, 柏映国, 李江, 等. 木聚糖酶XYNB的N46D突变、表达及酶学性质变化[J]. 中国生物化学与分子生物学报, 2006, 22(3):204-211. YANG H M, BAI Y G, LI J, et al. N46D mutagenesis of xylanase XYNB and enzymatic changes of expression product[J]. Chinese Journal of Biochemistry and Molecular Biology, 2006, 22(3):204-211.
[6]LONG L F, SHI H, LI X, et al. Cloning, purification, and characterization of a thermostableβ-glucosidase fromThermotogathermarumDSM 5069[J]. Bioresources, 2016, 11(2):3165-3177.
[7]高树娟, 汪俊卿, 邬敏辰, 等. N端二硫键对11家族木聚糖酶热稳定性的影响[J]. 生物工程学报, 2012, 28(12):1441-1449. GAO S J, WANG J Q, WU M C, et al. Effect of N-terminal disulfide bridge on thermostability of family 11 xylanases[J]. Chinese Journal of Biotechnology, 2012, 28(12):1441-1449.
[8]刘亮伟, 杨海玉, 胡瑜, 等. F/10木聚糖酶研究进展[J]. 食品与生物技术学报, 2009, 28(6):727-732. LIU L W, YANG H Y, HU Y, et al. A review of F/10 xylanase[J]. Journal of Food Science and Biotechnology, 2009, 28(6):727-732.
[9]韩承业, 余世袁, 欧阳嘉, 等. 定点突变提高里氏木霉木聚糖酶(XYN II)的稳定性[J]. 生物工程学报, 2010, 26(5):623-629. HAN C Y, YU S Y, OUYANG J, et al. Enhancing stability ofTrichodermareeseixylanase(XYN II) by site-directed mutagenesis[J]. Chinese Journal of Biotechnology, 2010, 26(5):623-629.
[10]MITRA S, MUKHOPADHYAY B C, MANDAL A R, et al. Cloning, overexpression, and characterization of a novel alkali-thermostable xylanase fromGeobacillussp. WBI[J]. Journal Basic Microbiology, 2015, 55(4):527-537.
[11]杨诗逸,李琦,奚丽娅,等. 响应面法优化毕赤酵母基因工程菌表达木聚糖酶条件研究[J]. 林业工程学报, 2016, 1(6):88-94. YANG S Y, LI Q, XI L Y, et al. Optimization of fermentation conditions of recombinant pPICZαA-QxynB(GS115) for xylanase production by response surface methodology [J]. Journal of Forestry Engineering, 2016, 1(6):88-94.
[12]SHI H, ZHANG Y, ZHONG H, et al. Cloning, over-expression and characterization of a thermo-tolerant xylanase fromThermotogathermarum[J]. Biotechnology Letters, 2014, 36(3):587-593.
[13]柏文琴, 王钦宏, 马延和. 嗜热和嗜碱木聚糖酶研究进展[J]. 生物工程学报, 2014, 30(6):828-837. BAI W Q, WANG Q H, MA Y H. Progress in the thermophilic and alkalophilic xylanases[J]. Chinese Journal of Biotechnology, 2014, 30(6):828-837.
[14]余蓉, 吴梧桐, 李灵玲. 合理的分子设计与工程化蛋白质药物[J]. 药物生物技术, 2005, 12(6):401-411.
[15]曾静, 郭建军, 顾斌涛, 等. Ca2+结合位点对极端嗜热α-淀粉酶ApkA高温活性及热稳定性的影响[J]. 现代食品科技, 2016, 32(8):90-95. ZENG J, GUO J J, GU B T, et al. Effect of the Ca2+-binding site on thermal activity and stability of theThermococcuskodakarensishyperthermophilicα-Amylase ApkA[J]. Modern Food Science and Technology 2016, 32(8):90-95.
[16]GOH P H, ILLIAS R M, GOH K M. Rational mutagenesis of cyclodextrin glucanotransferase at the calcium binding regions for enhancement of thermostability[J]. International Journal of Molecular Sciences, 2012, 13(5):5307-5323.
[17]LI C M, BAN X F, GU Z B, et al. Calcium ion contribution to thermostability of cyclodextrin glycosyltransferase is closely related to calcium-binding site CaⅢ[J]. Journal of Agricultural and Food Chemistry, 2013, 61(37):8836-8841.
[18]SPURWAY T D, MORLAND C, COOPER A, et al. Calcium protects a mesophilic xylanase from proteinase inactivation and thermal unfolding[J]. Journal of Biological Chemistry, 1997, 272(28):17523-17530.
[19]SHI H, ZHANG Y, LI X, et al. A novel highly thermostable xylanase stimulated by Ca2+fromThermotogathermarum:cloning, expression and characterization[J]. Biotechnology for Biofuels, 2013, 6(1):1-9.
[20]GREEN M R, SAMBROOK J. Molecular cloning:a laboratory manual[M]. New York:Cold Spring Harbor Laboratory Press, 2012.
[21]BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry, 1976, 72(1):248-254.
[22]HARRIS G W, JENKINS J A, CONNERTON I, et al. Structure of the catalytic core of the family F xylanase fromPseudomonasfluorescensand identification of the xylopentaose-binding sites[J]. Structure, 1994, 2(11):1107-1116.
[23]LISBETH G, CARLIE D, CLAIR L, et al. Alanine scanning of a putative receptor binding surface of insulin-like growth factor-I[J]. Journal of Biological Chemistry, 2008, 283(30):20821-20829.
[24]RAMADOSS V, DEHEZ F, CHIPOT C. AlaScan:a graphical user interface for alanine scanning free-energy calculations[J]. Journal of Chemical Information and Modeling, 2016, 56(6):1122-1126.
Effect of Ca2+on thermostability of xylanase Xyn10A
CHEN Xiuxia, WANG Liangliang, ZHANG Yu, LI Xun, WANG Fei*
(College of Chemical Engineering, Nanjing Forestry University; Jiangsu Co-Innovation Center of Efficient Processing andUtilization of Forest Resources; Jiangsu Provincial State Key Laboratory Cultivation Base for Chemical Utilization of Agricultural andForest Biomass Resources; Jiangsu Key Lab. of Biomass-Based Green Fuels and Chemicals, Nanjing 210037, China)
Xylanases are able to hydrolyze theβ-1,4 glycosidic linkage of the backbone of xylan, participating in the hydrolysis process of hemicelluloses in nature. Due to their excellent catalytic abilities for the hydrolysis of xylan, xylanases are widely employed in many fields including food processing, feedstuff producing, textile processing and energy developing. Regarding the reaction temperature and efficiency of enzymes, the thermostability of xylanases is of great importance for industrial purposes. The results of our previous study showed that the addition of calcium divalent ion (Ca2+) can significantly enhance the thermostability of the xylanase (Xyn10A) from the thermophile Thermotoga thermarum DSM 5069 at 85℃. In order to find out the domain involved in the Ca2+binding in the Xyn10A, protein structure modeling and site-directed mutagenesis were carried out in this study, and the mechanism of thermostability of Xyn10A was analyzed. The results of structural simulation and superposition of Xyn10A showed that the conservation of protein structure was much higher than that of amino acid sequence. The local loop region from 712 to 724 (712IYRDNATKYEIPP724) was proven to be closely associated with Ca2+binding in Xyn10A. The multi-point substitution and deletion mutation were introduced into the loop region (712IYRDNATKYEIPP724). Compared to original Xyn10A, all mutants showed poorer thermostability, and even lost their ability to bind with Ca2+. It indicated that the thermostability of Xyn10A mainly depended on the affinity and interaction between the loop region (712IYRDNATKYEIPP724) and Ca2+. In the presence of Ca2+, the side chains and backbone of loop region (712IYRDNATKYEIPP724) interacted with Ca2+by forming a stable coordination complex, which greatly restricted the flexibility and freedom degree of the catalytic domain of Xyn10A. Therefore, the thermostability and the catalytic ability of Xyn10A were effectively maintained at higher temperature.
thermophilic xylanase; Ca2+binding domain; thermostability; structure modeling; site-directed mutagenesis
2016-12-19
2017-02-14
国家林业局“948”项目(2014-4-37);国家自然科学基金(31370572);江苏高校优势学科建设工程资助项目(PAPD)。
陈秀霞,女,研究方向为生物质能源及生物转化。通信作者:王飞,男,教授。E-mail:hgwf@njfu.edu.cn
Q71
A
2096-1359(2017)03-0076-07

