耐盐和非耐盐大麦幼苗叶片抗氧化及抗坏血酸–谷胱甘肽循环系统对 NaCl 胁迫的反应差异
李琲琲,刘志萍,张凤英,包海柱,孟繁昊,王聪,杨恒山,徐寿军*
耐盐和非耐盐大麦幼苗叶片抗氧化及抗坏血酸–谷胱甘肽循环系统对 NaCl 胁迫的反应差异
李琲琲1,刘志萍2,张凤英2,包海柱2,孟繁昊1,王聪1,杨恒山1,徐寿军1*
(1 内蒙古民族大学农学院,内蒙古通辽 028043;2 内蒙古农牧业科学研究院作物所,内蒙古呼和浩特 010031)
【目的】研究 NaCl 胁迫下,耐盐和非耐盐品系大麦幼苗叶片抗氧化系统及抗坏血酸–谷胱甘肽循环的反应差异。【方法】以耐盐品系 12pj-118 和非耐盐品系 12pj-045 为材料进行了水培试验。营养液中设定了 6 个NaCl 浓度:0、100、200、300、400、500 mmol/L。在大麦苗生长至 3 叶 1 心时,取样分析测定叶片中活性氧代谢、抗氧化酶活性以及抗坏血酸–谷胱甘肽循环变化。【结果】随着 NaCl 胁迫的增加,2 个品系的产生速率、H2O2含量和 MDA 含量均逐渐增加,耐盐品系 12pj-118 的增幅均小于非耐盐品系 12pj-045;SOD、POD、CAT、APX、GR 活性、AsA 含量、GSH 含量和 AsA/DHA 比值均呈先上升后下降的趋势。12pj-118 的SOD、POD、CAT 活性在各 NaCl 浓度胁迫下的增幅大于 12pj-045,降幅小于 12pj-045;12pj-118 的 APX、GR活性在同一盐浓度胁迫下的增幅均大于非耐盐品系 12pj-045,降幅小于 12pj-045;在各 NaCl 浓度下,12pj-118的 AsA 含量和 AsA/DHA 比值较对照增幅均大于 12pj-045;GSH/GSSG 比值呈波状变化,12pj-118 在较高 NaCl浓度下,仍能够维持较高的 GSH 含量和 GSH/GSSG 比值。显示 12pj-118 较 12pj-045 有较强的耐盐性。【结论】耐盐和非耐盐品系大麦叶片抗氧化及抗坏血酸–谷胱甘肽循环系统在 NaCl 胁迫下的反应不同。在一定范围内,随着盐胁迫增强,耐盐品系 12pj-118 叶片 SOD、POD、CAT、APX 和 GR 活性、AsA 和 GSH 含量增幅均大于非耐盐品系 12pj-045,降幅小于 12pj-045,表明叶片抗氧化及抗坏血酸–谷胱甘肽循环系统与大麦幼苗抗盐性密切相关。
大麦;NaCl 胁迫;抗氧化系统;抗坏血酸–谷胱甘肽循环
大麦生育期短、抗旱、耐瘠薄、耐盐碱、适应性强,是防止返盐、改良盐碱土、提高土地生产力的一种先锋作物。盐碱胁迫是大田作物生产的最大非生物胁迫之一,严重影响作物的产量、品质和效益,并间接造成生态环境恶化。膜系统是植物盐害的主要反应部位,膜结构和功能的完整性以及植物内源保护系统的抗胁迫能力主导离子的运输和分配,是决定植物耐盐性的关键因素。正常情况下,植物体内活性氧的产生和清除处于动态平衡状态,当植物遭受逆境胁迫时,代谢平衡被打破,产生大量的活性氧自由基,这些活性氧自由基直接或间接地启动膜脂过氧化进程,使得膜系统的完整性降低,电解质及有机小分子物质外渗,从而导致一系列生理生化代谢紊乱。植物为减轻自由基对细胞膜的伤害,在细胞内形成了复杂的活性氧清除系统[1],一类是保护酶系统,包括超氧化物歧化酶 (SOD)、过氧化物酶 (POD) 和过氧化氢酶 (CAT) 等,另一类是小分子抗氧化物质非酶系统,如抗坏血酸、谷胱甘肽等。关于盐胁迫对植物保护酶系统影响的研究,已有较多报道[2–8],但研究范围大多局限在小麦、水稻、玉米等作物叶片 SOD、POD 和 CAT 活性随着盐浓度增加而变化的趋势方面,用以说明低盐胁迫可诱导上述作物叶片提高 SOD、POD 和 CAT活性。关于盐胁迫对作物抗坏血酸–谷胱甘肽 (AsAGSH) 循环影响的研究,主要集中在野生植物和园艺作物上,证明了 AsA-GSH 循环是植株清除活性氧的主要机制,两种非酶促抗氧化物质 GSH 和 AsA 可参与植物体内清除 H2O2[9–12]。迄今为止,关于盐胁迫对大麦抗坏血酸–谷胱甘肽 (AsA-GSH) 循环影响的研究,尤其是盐胁迫下大麦不同抗盐性品种间其酶促反应和非酶促反应的差异,尚未见报道。本试验选择耐盐和非耐盐 2 个大麦品系,研究 NaCl 胁迫下,耐盐和非耐盐品系大麦幼苗叶片抗氧化系统及抗坏血酸–谷胱甘肽循环的反应差异,探索酶促反应及非酶促反应与大麦耐盐性的关系,为大麦耐盐性种质资源筛选以及耐盐大麦新品种选育提供理论依据。
1 材料与方法
1.1 试验材料
供试品系为 12pj-118 和 12pj-045,由内蒙古农牧业科学研究院提供,在此之前的研究中,对 52 个大麦品系 (包括 12PJ-118 和 12PJ-045) 进行了耐盐性筛选试验,将参试种子直播于上部直径 39 cm、下部直径 26 cm、高 34 cm 的塑料盆中,蛭石作基质,每品种栽 5 盆,每盆播种 30 粒,出苗后间苗至每盆 20株,随机排列。2 叶 1 心时开始 NaCl 处理。将 NaCl溶于日本园试营养液中,均匀浇入盆钵里,每隔 2 d浇液 1 次,每盆每次浇液 1 L。起始 NaCl 浓度为 70 mmol/L,以后每次浇液时递增 30 mmol/L,统计各个品种的半致死浓度 (植株 2/3 以上叶片黄化、萎蔫即视为死亡),并据此对不同品种的耐盐性进行分类。筛选结果表明,12pj-118 较耐盐,12pj-045 对盐胁迫较为敏感。
1.2 试验设计
试验于 2015 年 4 月~10 月在内蒙古民族大学农学院日光温室进行。选择籽粒饱满的试材,播种方法同 1.1。盐胁迫设 0、100、200、300、400、500 mmol/L 6 个处理,5 次重复,随机排列, 对照为不含NaCl 的营养液。待大麦幼苗生长至 3 叶 1 心时,将相应质量的 NaCl 混合于 1/4 浓度日本园试营养液(其配方见表 1),开始 NaCl 胁迫处理,每天浇灌营养液一次,每次浇 0.2 L。处理 10 d 即将出现盐害症状时,取大麦叶片,测定相关生理指标。

表1 营养液成分Table1 Nutrient solution formula
1.3 测定项目及方法
SOD 活性参照 Omran 的方法[13],POD 活性测定参照陈建勋等的方法[14],CAT 活性测定参照林植芳等[15]的方法测定。
抗坏血酸过氧化物酶 (APX) 活性测定参照Nakano 等[18]的方法,谷胱甘肽还原酶 (GR) 活性测定参照 Foyer 等[19]的方法,脱氧抗坏血酸 (AsA) 和氧化型抗坏血酸 (DHA) 含量按照 Jin 等[20]的方法测定,氧化型谷胱甘肽 (GSSG) 含量和还原型谷胱甘肽 (GSH)含量按照 Gossett 等[21]的方法测定。
1.4 数据统计与分析
数据使用 SPSS 12.0 软件进行差异显著性比较,用 Microsoft Excel 2003 进行数据计算、图表绘制。
2 结果与分析
2.1 NaCl 胁迫对大麦幼苗抗氧化系统的影响
2.1.1 NaCl 胁迫对大麦叶片活性氧的影响 由图 1 可知,12pj-118 的产生速率随 NaCl 浓度增加呈“升–降–升”的趋势,波动幅度不大,在各浓度(100、200、300、400、500 mmol/L) 下较对照增幅分别为 11.4%、22.7%、14.5%、23.4%、34.0%。12pj-045随 NaCl 浓度增加呈不断上升趋势,且在 300~500 mmol/L 浓度范围内大幅上升,较对照显著增加46.4%~96.7%。结果表明,12pj-118 在 300~500 mmol/L 浓度范围内,产生速率增幅均小于 12pj-045,表明 12pj-118 在较高盐浓度胁迫下维持了相对较低的产生速率。
由图 1 可知,2 个品系的 H2O2含量均随 NaCl 浓度的增加而不断上升,且各浓度下均与对照呈显著差异 (P < 0.01)。12pj-118 在 100 mmol/L 浓度时上升较平缓,在 500 mmol/L 时达到最大值,较对照显著上升 52.7%。12pj-045 随 NaCl 浓度的增加大幅上升,在 500 mmol/L 时,达到最大值,较对照显著增加 1.06 倍。结果表明,12pj-118 在各浓度 NaCl 胁迫下,H2O2含量上升幅度均小于 12pj-045,且在低浓度 NaCl 胁迫下,上升较平缓,说明 12pj-118 在各浓度 NaCl 胁迫下均保持了较低的 H2O2积累量。

图1 不同浓度 NaCl 胁迫下大麦幼苗产生速率和 H2O2含量Fig. 1producing rates and the H2O2contents of barley seedlings under different NaCl concentrations[注(Note):方柱上不同字母表示同一品系不同 NaCl 浓度间在 0.05 水平差异显著Different letters above the bars are significantly different among different NaCl concentrations for acultivar at the 0.05 level.]
2.1.2 NaCl 胁迫对大麦叶片 MDA 含量的影响 由图 2可知,12pj-118 的丙二醛含量随 NaCl 浓度的增加呈总体上升的趋势,在 400 mmol/L 时有所下降,随后又大幅上升,在 500 mmol/L 时达到峰值,较对照显著增加 50.4%。12pj-045 随 NaCl 浓度的增加呈大幅上升趋势,在各盐浓度胁迫下,较对照显著增加31.0%、48.1%、76.6%、81.9%、89.7%。结果表明,在各盐浓度胁迫下,12pj-118 丙二醛含量增幅均小于12pj-045,维持了相对较低的丙二醛含量。

图2 不同浓度 NaCl 胁迫下大麦幼苗丙二醛含量Fig. 2 MDA contents of barley seedlings under different NaCl concentrations[注(Note):方柱上不同字母表示同一品系不同 NaCl 浓度间在0.05 水平差异显著Different letters above the bars are significantly different among different NaCl concentrations for acultivar at the 0.05 level.]
2.1.3 NaCl 胁迫对大麦叶片保护酶活性的影响 由表 2可知,随着 NaCl 浓度的增加,2 个品系的 SOD、POD 和 CAT 活性均呈先上升后下降的趋势。2 个品系 SOD 活性均在 NaCl 浓度 200 mmol/L 时达到峰值,12pj-118 较对照显著升高 12.9%,12pj-045 显著升高 10.0%;12pj-118 在 NaCl 浓度 500 mmol/L 时达到最小值,与对照相当,12pj-045 在 NaCl 浓度 400、500 mmol/L 较对照显著下降 5.0%、8.8%。SOD 活性12pj-118 随 NaCl 浓度胁迫的增幅大于 12pj-045,降幅小于 12pj-045。
12pj-118 的 POD 活性在 NaCl 浓度 300 mmol/L时达到最大值,较对照显著升高 58.8%,在 NaCl 浓度 500 mmol/L 时达到最小值,较对照显著降低 12.0%;12pj-045 在 NaCl 浓度 200 mmol/L 达到最大值,较对照显著升高 59.4%,在 NaCl 浓度 500 mmol/L 较对照显著降低 18.8%。12pj-118 的 POD 活性达到峰值的NaCl 浓度以及在各 NaCl 浓度胁迫下活性的增幅均大于 12pj-045,降幅小于 12pj-045。
12pj-118 的 CAT 活性在 NaCl 浓度 300 mmol/L时达到最大值,较对照显著升高 1.69 倍,随后开始下降,在 NaCl 浓度 500 mmol/L 时达到最小值,较对照显著降低 15.7%。12pj-045 在 NaCl 浓度 200 mmol/L 即达到最大值,较对照显著升高 1.13 倍,随后开始下降,在 NaCl 浓度 400、500 mmol/L 显著低于对照,较对照下降 16.1%、22.2%。12pj-118 达到峰值的 NaCl 浓度较 12pj-045 及在各 NaCl 浓度胁迫下活性的增幅大于 12pj-045,降幅小于 12pj-045。
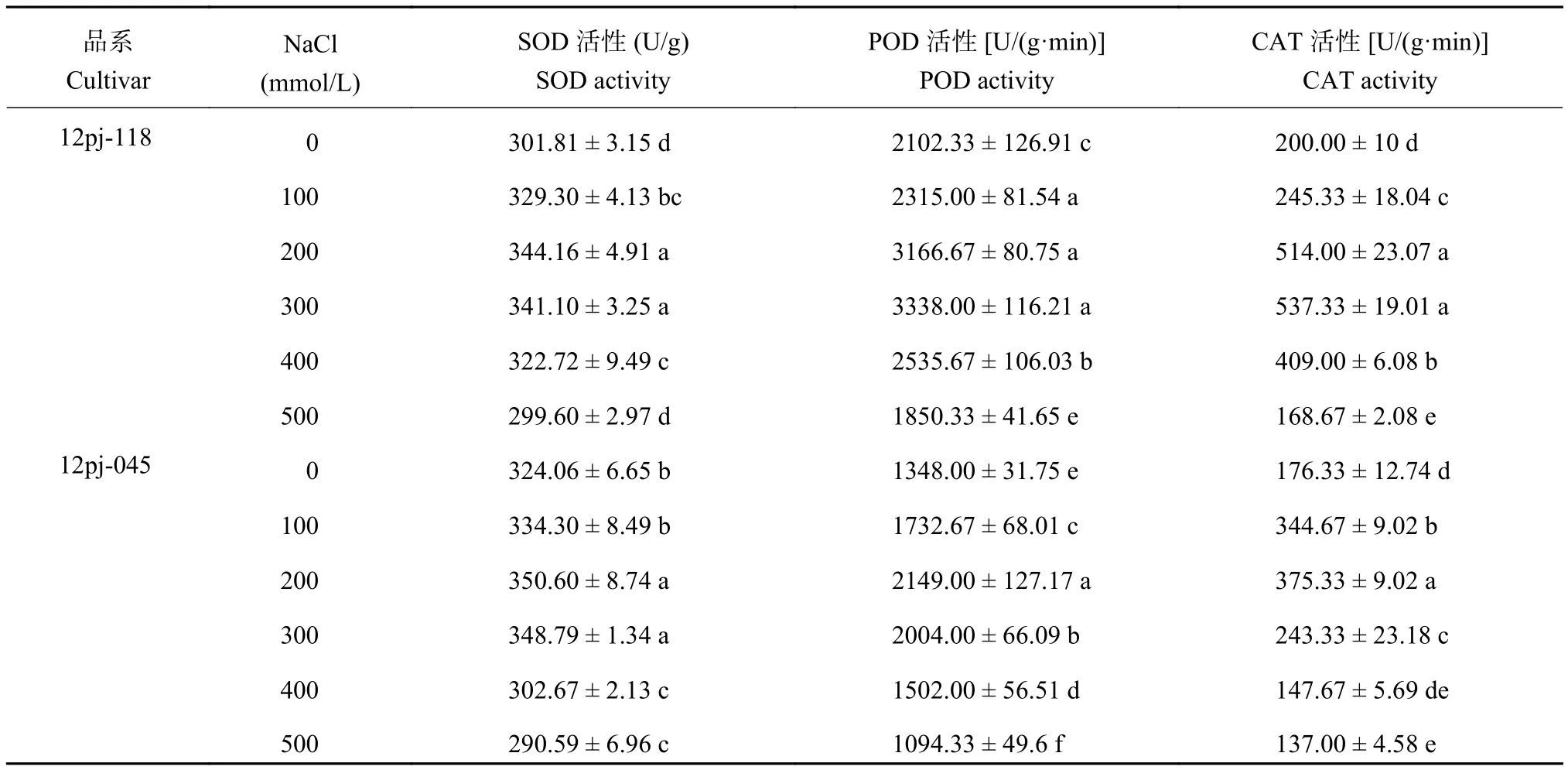
表2 不同浓度 NaCl 胁迫对大麦幼苗 SOD、POD、CAT 活性的影响Table2 SOD, POD and CAT activities of barley seedlings under different NaCl concentrations
2.2 NaCl 胁迫对大麦叶片抗坏血酸-谷胱甘肽循环的影响
2.2.1 NaCl 胁迫对大麦叶片 APX 活性的影响 由图 3可知,因受到 NaCl 胁迫的诱导,2 个品系 APX 活性均呈现上升,且均在 NaCl 浓度 200 mmol/L 时达到峰值,而后受到 NaCl 胁迫的抑制作用,开始下降。12pj-118 在 NaCl 浓度 200 mmol/L 浓度时较对照显著升高 97.4%,在 NaCl 浓度 500 mmol/L 下降至最小值,与对照无显著差异。12pj-045 在 NaCl 浓度 200 mmol/L 时,较对照显著升高 76.0%,在 NaCl 浓度500 mmol/L 下降至最小值,较对照显著下降 12.3%。结果表明,12pj-118 的 APX 活性在各 NaCl 浓度下的增幅均大于 12pj-045,说明其在各盐浓度下均能维持较高的酶活性。
2.2.2 NaCl 胁迫对大麦叶片 GR 活性的影响 由图 3可知,在较低浓度 NaCl 的诱导下,2 个品系 GR 活性开始增加,且均在 NaCl 浓度 300 mmol/L 时达到峰值。而后,较高浓度的 NaCl 又对 2 个品系 GR 活性产生抑制作用,使其不断降低。12pj-118 在 NaCl浓度 300 mmol/L 的峰值较对照显著提高 1.12 倍,在500 mmol/L 时下降至最小值,与对照无显著差异。12pj-045 在 NaCl 浓度 300 mmol/L 时,较对照显著升高 46.8%,在 400 mmol/L 时与对照差异不显著,在500 mmol/L 下降至最小值,较对照显著下降 19.8%。12pj-118 的 GR 活性在各 NaCl 浓度下的增幅均大于12pj-045。
2.2.3 NaCl 胁迫对大麦叶片 AsA、DHA 含量及AsA/DHA 比值的影响 由表 3 可知,2 个品系的 AsA含量均呈先上升后下降的趋势。12pj-118 在 NaCl 浓度 300 mmol/L 时达到峰值,12pj-045 在 NaCl 浓度200 mmol/L 时达到峰值;12pj-118 在 NaCl 浓度 300 mmol/L 时较对照显著升高 1.21 倍,在 500 mmol/L时达到最低,较对照显著降低 9.8%。12pj-045 在NaCl 浓度 200 mmol/L 时较对照显著升高 49.3%,在400 mmol/L 时与对照无显著差异,在 500 mmol/L 较对照显著降低 16.6%。12pj-118 的 AsA 含量达到峰值以及在各 NaCl 浓度胁迫下 AsA 含量的增幅均大于 12pj-045,降幅小于 12pj-045,说明 12pj-118 能够维持较高的 AsA 含量。
12pj-118 的 DHA 含量随 NaCl 浓度的升高呈先上升后下降的趋势,在 NaCl 浓度 300 mmol/L 时达到最大值,较对照显著升高 30.3%。12pj-045 的DHA 含量呈波动变化,各盐浓度胁迫下均显著高于对照 (P < 0.01)。12pj-118 在各个盐浓度下的增幅均小于 12pj-045,DHA 积累量相对较少。
2 个品系的 AsA/DHA 比值均呈先上升后下降的趋势。12pj-118 在 NaCl 浓度 100、200、300、400 mmol/L 较对照增幅分别为 43.9%、74.7%、69.5%、13.2%,在 NaCl 浓度 500 mmol/L 时为最小值,较对照显著降低 20.0%。12pj-045 在 100、200 mmol/L 浓度较对照增幅为 13.3%、24.8%,在 300~500 mmol/L时较对照显著降低 8.2%~38.6%。12pj-118 在各NaCl 浓度胁迫下的增幅均大于 12pj-045,说明 12pj-118 能够维持较高的 AsA/DHA 比值。

图3 不同浓度 NaCl 胁迫下大麦幼苗 APX 和 GR 活性Fig. 3 APX activity and GR activity of barley seedlings under different NaCl concentrations[注(Note):方柱上不同字母表示同一品系不同 NaCl 浓度间在 0.05 水平差异显著Different letters above the bars are significantly different among different NaCl concentrations for acultivar at the 0.05 level.]
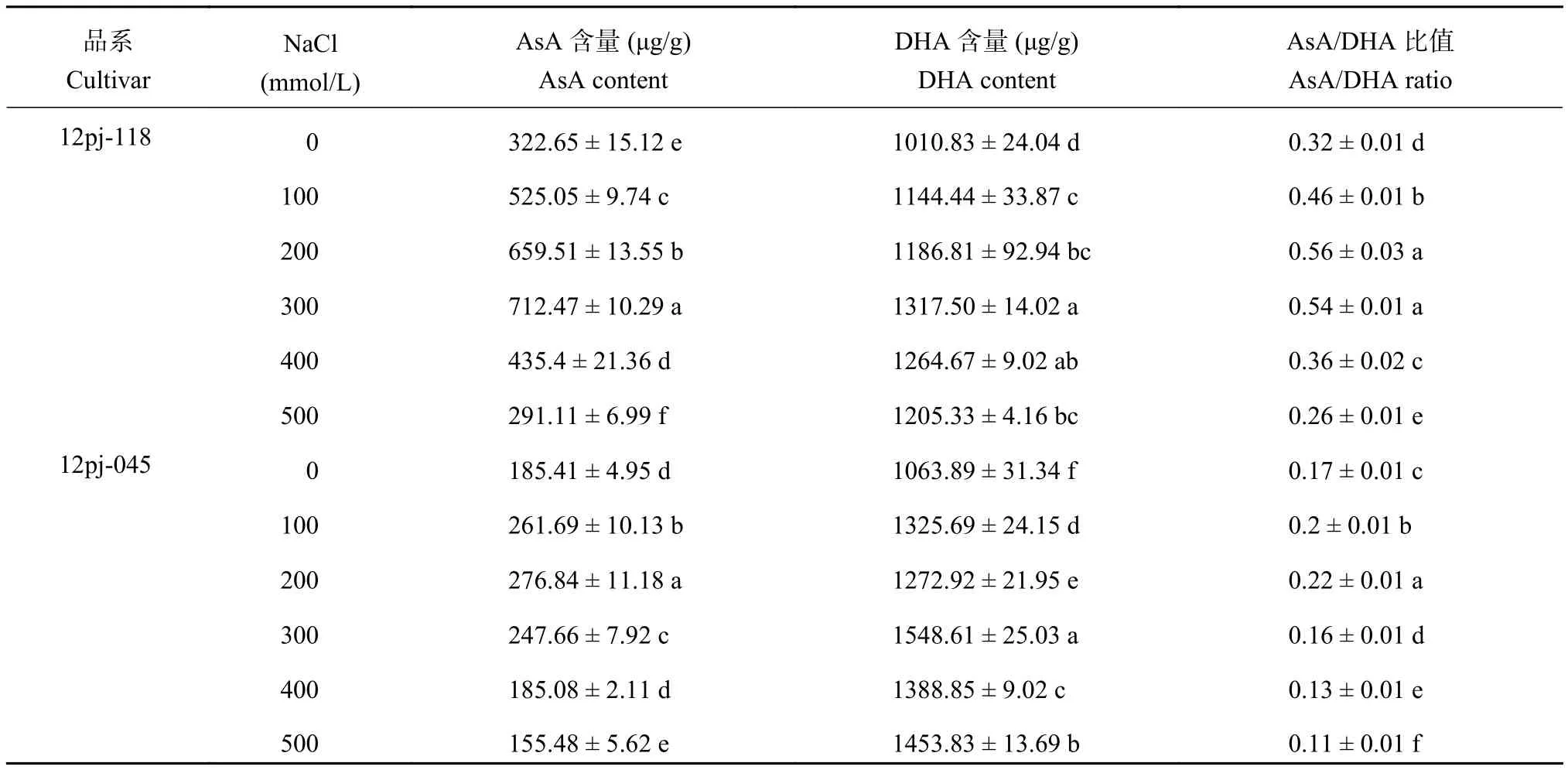
表3 NaCl 胁迫对大麦叶片 AsA、DHA 含量及 AsA/DHA 比值的影响Table3 Contents of AsA and DHA and AsA/DHA ratios of barley seedlings under different NaCl concentrations

表4 NaCl 胁迫对大麦叶片 GSH、GSSG 含量及 GSH/GSSG 比值的影响Table4 GSH contents, GSSG contents and GSH/GSSG ratios of barley seedlings under different NaCl concentrations
2.2.4 NaCl 胁迫对大麦叶片 GSH、GSSG 含量及GSH/GSSG 比值的影响 由表 4 可知,2 个品系的GSH 含量均呈先上升后下降的趋势。12pj-118 在NaCl 浓度 300 mmol/L 时达到峰值,12pj-045 在 200 mmol/L 浓度达到峰值,说明 12pj-118 比 12pj-045 达到峰值时的盐胁迫浓度更高。12pj-118 在 300 mmol/L时较对照显著升高 35.8%,随后开始下降,在 500 mmol/L 时与对照无显著差异。12pj-045 在 200 mmol/L时较对照显著升高 24.2%,随后开始下降,在 300~500 mmol/L 浓度范围较对照显著降低 4.0%、15.4%、19.4%。结果表明,12pj-118 在较高浓度 NaCl 胁迫下仍能达到峰值,且在 300~500 mmol/L 浓度范围增幅大于 12pj-045,降幅小于 12pj-045,说明12pj-118 能够维持较高的 GSH 含量。
12pj-118 的 GSSG 含量随 NaCl 浓度的增加呈先升高后下降的趋势,在 400 mmol/L 达到最大值,较对照显著升高 21.8%。12pj-045 的 GSSG 含量随NaCl 浓度的增加不断增加,在 500 mmol/L 浓度时达到峰值,较对照显著升高 35.5%。结果表明,在较高浓度 NaCl 胁迫下,12pj-118 的增幅小于 12pj-045,且有下降趋势,12pj-118 在较高盐浓度胁迫下维持了较低的 GSSG 积累量。
2 个品系 GSH/GSSG 比值均随 NaCl 浓度的增加呈波动变化。12pj-118 在 NaCl 浓度 300 mmol/L 较对照显著升高 13.0%,在 500 mmol/L 较对照显著降低24.1%,在其他浓度胁迫时与对照无显著差异。12pj-045在 NaCl 浓度 500 mmol/L 时较对照显著下降 40.5%。12pj-118 在各浓度 NaCl 胁迫下均维持了较高的GSH/GSSG 比值。
3 讨论
3.1 同一植物不同抗盐性品种在 NaCI 胁迫下酶促防御系统的反应差异
在植物体内的酶促防御系统中,SOD 作为抗氧化系统的主要成员,在活性氧清除过程中第一个发挥作用,首先催化植株体内的超氧阴离子自由基(发生歧化反应,生成 O2和 H2O2,有效地减轻了超氧阴离子自由基 (对细胞膜的损害。POD 和CAT 作为清除过氧化物的主要抗氧化酶,能够减轻细胞中有毒物质的毒害,从而使植物细胞能够忍耐或缓解一定程度上的破坏。同一植物不同抗盐性品种在 NaCl 胁迫下酶促防御系统的反应不同。盐胁迫下,随着 NaCl 浓度的增加,抗盐性不同的 2 个辣椒品种幼苗叶片中的 SOD、POD、CAT 活性呈先升高后下降的趋势,且抗盐品种 SOD、POD、CAT 活性出现峰值的 NaCl 浓度均高于非抗盐品种[22]。盐胁迫下,不同抗盐性玉米叶片中的 SOD、POD、CAT 活性变化不同。随着 NaCl 浓度的增加,抗盐玉米品种SOD 活性呈先下降后上升的趋势,非抗盐玉米品种呈先上升后下降趋势,POD 活性品种间变化不一,CAT 活性品种间变化一致,先升高后降低,且在同一 NaCl 浓度达到高峰,但抗盐品种与对照的增幅大于非抗盐品种的[23]。本研究结果显示,盐胁迫下,随着 NaCl 浓度的增加,抗盐性不同的 2 个大麦品系SOD、POD、CAT 活性变化均呈先上升后下降的趋势;就其活性达到峰值的 NaCl 浓度而言,抗盐品系的均高于非抗盐品系的;抗盐品系的 SOD、POD、CAT 活性在各 NaCl 浓度胁迫下的增幅大于非抗盐品系的,降幅小于非抗盐品系的。在 NaCl 胁迫下,同一植物不同抗盐性品种酶促防御系统的反应差异,进一步证明了植物较高的耐盐能力源于保护酶活性的增强。
3.2 同一植物不同抗盐性品种在 NaCl 胁迫下非酶促防御系统的反应差异
作为非酶促防御系统,抗坏血酸–谷胱甘肽循环(AsA-GSH) 能够清除大多数叶绿体中的 H2O2。抗坏血酸过氧化物酶 (APX) 和谷胱甘肽还原酶 (GR) 是循环中的主要催化酶,APX 在 AsA-GSH 中通过 AsA来清除 H2O2,被认为在清除 H2O2过程中起主要作用,GR 通过催化 GSSG 生成还原态的 GSH,使细胞内的谷胱甘肽处于还原状态。抗坏血酸 (AsA) 是植物体普遍存在的一种非酶促抗氧化剂,在 AsA-GSH中能够有效清除 H2O2,同时 AsA 还可直接清除。GSH 作为重要的还原物质,能够有效防止膜质过氧化,并且在 AsA 再生方面也起着重要作用。Shabala等报道,盐胁迫使盐敏感番茄根系中的 AsA 含量降低,DHA 含量明显升高,AsA/DHA 比值降低,代谢相关酶 APX 和单脱氢抗坏血酸还原酶活性也降低,而耐盐品种与之相反,表明番茄的耐盐性与AsA 含量、AsA/DHA 比值及其代谢相关酶的活性有关[25]。王聪等指出,NaCl 胁迫下,菜用大豆耐盐品种的 APX、DHAR、GR 活性及 AsA、GSH 含量增幅均大于相同时期的盐敏感品种,耐盐品种 DHA、GSSG 含量的降幅小于相同时期的盐敏感品种,说明在 NaCl 胁迫下,耐盐的菜用大豆品种能够维持AsA-GSH 循环快速有效进行,保证了 GSH 和 AsA的再生,从而有效抑制 H2O2的增加[26]。本试验中,随着 NaCl 浓度的增加,2 个大麦品系的 APX 和 GR活性、AsA 和 GSH 含量均呈先上升后下降的趋势;同一 NaCl 浓度下与对照相比,APX 和 GR 活性、AsA 和 GSH 含量的增幅耐盐品系均大于非耐盐品系的,降幅耐盐品系均小于非耐盐品系的,DHA、GSSG的含量与之相反。不同抗盐性大麦品系叶片非酶促防御系统的不同反应,表明叶片抗氧化及抗坏血酸–谷胱甘肽循环系统与大麦幼苗抗盐性密切相关。
作为有效防止植物膜质过氧化的重要物质,酶促防御系统与非酶促防御系统各项生理指标与产生速率和 H2O2、MDA 含量存在一定的相关性[27]。本研究对盐胁迫下大麦叶片、H2O2、MDA 与 SOD、POD、CAT、APX、GR、AsA、DHA、AsA/DHA、GSH、GSSG、GSH/GSSG 等生理指标进行了相关分析,结果表明,产生速率与 POD 活性、ASA 和GSH 含量、AsA/DHA 比值呈显著负相关 (P < 0.05),与 GSH/GSSG 比值呈极显著负相关 (P < 0.01);及GSSG 含量呈显著正相关 (P < 0.05),与 DHA 含量极显著正相关 (P < 0.01)。H2O2含量与 GSH 含量、AsA/ DHA 比值呈显著负相关 (P < 0.05),与 GSH/GSSG比值呈极显著负相关 (P < 0.01);与 GSSG 含量呈显著正相关 (P < 0.05),与 DHA 含量极显著正相关 (P < 0.01)。MDA 含量与 AsA/DHA 比值呈显著负相关 (P < 0.05),与 GSH/GSSG 比值呈极显著负相关 (P < 0.01);与 GSSG 含量呈显著正相关 (P < 0.05),与 DHA 含量极显著正相关 (P < 0.01)。表明 AsA–GSH 循环在减轻由 NaCl 胁迫引起的大麦叶片过氧化伤害过程中发挥了重要作用。
4 结论
耐盐和非耐盐品系大麦叶片抗氧化及抗坏血酸–谷胱甘肽循环系统在 NaCl 胁迫下的反应不同。在一定范围内,随着盐胁迫增强,耐盐品系 12pj-118 叶片 SOD、POD、CAT、APX 和 GR 活性、AsA 和GSH 含量增幅均大于非耐盐品系 12pj-045,降幅小于 12pj-045,表明叶片抗氧化及抗坏血酸–谷胱甘肽循环系统与大麦幼苗抗盐性密切相关。
[1]陈洁, 林栖凤. 植物耐盐生理及耐盐机理研究进展[J]. 海南大学学报(自然科学版), 2003, 21(2): 177–182. Chen J, Lin QF. Progress on salt tolerance physiology and mechanism of plants[J]. Natural Science Journal of Hainan University, 2003, 21(2): 177–182.
[2]刘爱荣, 张远兵, 汪建飞, 等. 适量施氮增强盐胁迫下高羊茅生长和抗氧化能力[J]. 农业工程学报, 2013, 29(15): 126–135. Liu AR, Zhang YB, Wang JF, et al. Appropriate nitrogen fertilizer strengthens growth and antioxidative ability of Festuca arundinacea under salt stress[J]. Transactions of the Chinese Society of Agricultural Engineering , 2013, 29(15): 126–135.
[3]Rahnama H, Ebrahimzadeh H. The effect of NaCl on antioxidant enzyme activities in potato seedlings[J]. Biologia Plantarum, 2005, 49(1): 93–97.
[4]孟祥浩, 刘义国, 张玉梅, 等. 不同小麦品种苗期抗氧化特性及根系活力对盐胁迫的响应[J]. 麦类作物学报, 2015, 35(8): 1168–1175. Meng XH, Liu YG, Zhang YM, et al. Responses of antioxidant properties and root activity of different wheat varieties to salt stress at seedling stage[J]. Journal of Triticeae Crops, 2015, 35(8): 1168–1175.
[5]王宁, 曹敏建, 于佳林, 等. NaCl胁迫对不同耐盐性玉米幼苗膜质过氧化及保护酶活性的影响[J]. 江苏农业科学, 2009, (4): 101–103. Wang N, Cao MJ, Yu JL, et al. Effect of NaCl stress on membranous oxidation and the activity of protective enzyme at maize seedling of different salt tolerance[J]. Jiangsu Agricultural Sciences, 2009, (4): 101–103.
[6]刘晓龙, 徐晨, 徐克章, 等. 不同供氮水平下盐胁迫对水稻光合特性和某些生理特性的影响[J]. 华南农业大学学报, 2015, 36(2): 6–12. Liu XL, Xu C, Xu KZ, et al. Effects of salt stress on photosynthetic characteristics and some physiological traits of rice varieties at different nitrogen levels[J]. Journal of South China Agricultural University, 2015, 36(2): 6–12.
[7]Sergio L, De Paola A, Cantore V, et al. Effect of salt stress on growth parameters, enzymatic antioxidant system, and lipid peroxidation in wild chicory (Cichorium intybus L.)[J]. Acta Physiologiae Plantarum, 2012, 34(6): 2349–2358.
[8]Ozturk L, Demir Y, Unlukara A, et al. Effects of long-term salt stress on antioxidant system, chlorophyll and proline contents in pea leaves[J]. Romanian Biotechnological Letters, 2012, 17(3): 7227–7236.
[9]吕新民, 杨怡帆, 鲁晓燕, 等. NaCl胁迫对酸枣幼苗AsA–GSH循环的影响[J]. 植物生理学报, 2016, 52(5): 736–744. Lü X M, Yang YF, Lu XY, et al. Effects of NaCl stress on the AsAGSH cycle in sour jujube seedlings[J]. Plant Physiology Journal, 2016, 52(5): 736–744.
[10]Ferreira-Silva SL, Voigt EL, Silva EN, et al. Partial oxidative protection by enzymatic and non-enzymatic components in cashew leaves under high salinity[J]. Biologia Plantarum, 2012, 56(1): 172–176.
[11]Shalata A, Mittova V, Volokita M, et al. Response of the cultivated tomato and its wild salt-tolerant relative Lycopersicon pennellii to salt-dependent oxidative stress: the root antioxidative system[J]. Physiologia Plantarum, 2001, 112(4): 487–494.
[12]Khalid O, Loubna B, Lyudmila L, et al. Enzymes of the glutathioneascorbate cycle in leaves and roots of rhizobia-inoculated faba bean plants (Vicia faba L.) under salinity stress[J]. European Journal of Soil Biology, 2014, 60: 98–103.
[13]Omran RG. Peroxide levels and the activities of catalase, peroxidase and indoleacetic acid oxidase during and after chilling cucumber seeding[J]. Plant Physiology, 1980, 65(2): 407–408.
[14]陈建勋, 王晓峰. 植物生理学实验指导[M]. 广州: 华南科技大学出版社, 2002. 120–121. Chen JX, Wang XF. Experimental guide for plant physiology [M]. Guangzhou: Southern China Science and Technology University Press, 2002. 120–121.
[15]林植芳, 李双顺, 林桂珠, 郭俊彦. 衰老叶片和叶绿体中H2O2的积累与膜脂过氧化的关系[J]. 植物生理学报, 1988, 14(1): 16–22. Lin ZF, Li SS, Lin GZ, Guo JY. The accumulation of hydrogen peroxide in senescing leaves and chloroplasts in relation to lipid peroxidation[J]. Acta Phytophysiologyca Sinica, 1988, 14(1): 16–22.
[16]王爱国, 罗广华. 植物的超氧物自由基与羟胺反应的定量关系[J].植物生理学通讯, 1990, 26(2): 55–57. Wang AG, Luo GH. Quantitative relation between the reaction of hydroxylamie and superoxide anion radicals in plants[J]. Plant Physiology Communication, 1990, 26(2): 55–57.
[17]李合生主编. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000. 119–120. Li HH. Experimental principle and technology of plant physiology and biochemistry [M]. Beijing: Higher Education Press, 2000. 119–120.
[18]Nakano Y, Asada K. Hydrogen peroxide is scavenged by ascrobatespecific peroxidase in spinach chloroplasts[J]. Plant Cell Physiology, 1981, 22: 867–880.
[19]Foyer CH, Halliwell B. The presence of glutathione and glutathione reductase in chloropasts: aproposed role in ascorbic acid metabolism[J]. Planta, 1976, 133(1): 21–25.
[20]Jin YH, Tao DL, Hao ZQ, et al. Environmental stresses and redox status of ascorbate[J]. Acta Botanica Sinica, 2003, 45(7): 795–801.
[21]Gossett DR, Millhollon EP, Lucas MC. Antioxidant response to NaCl stress in salt-tolerant and salt-sensitive cultivars of cotton[J]. Crop Science, 1994, 34(3): 706–714.
[22]周静, 徐强, 张婷. NaCl胁迫对不同品种辣椒幼苗生理生化特性的影响[J]. 西北农林科技大学学报(自然科学版), 2015, 43(2): 120–125. Zhou J, Xu Q, Zhang T. Effect of NaCl stress on physiological characteristic of seedlings of different pepper varieties[J]. Journal of Northwest A&F University (Natural Science Edition), 2015, 43(2): 120–125.
[23]周海林, 王庆祥. NaCl胁迫对甜、爆、糯玉米幼苗生长及活性氧代谢的影响[J]. 玉米科学, 2011, 19(5): 87–90. Zhou HL, Wang QX. Effect of NaCl stress on plant growth and active oxygen metabolismin seedlings of sweet, popand and glutinous corn[J]. Jounal of Maize Sciences, 2011, 19(5): 87–90.
[24]Foyer CH. Ascorbic acid [A]. Alseher RG, Hess JL. Antioxidants in higher plants [C]. Boea Raton: CRC Press, 1993, 31–58.
[25]Shabala SN, Shabala SI, Martynenko AI, et al. Salinity effect on bioelectric activity, growth, Na+accumulation and chlorophyll II fluorescence of maize leaves: a comparative survey and prospects for screening[J]. Australian Journal of Plant Physiology, 1998, 25(5): 609–616.
[26]王聪, 朱月林, 杨立飞, 陈磊. NaCl胁迫对菜用大豆种子抗坏血酸–谷胱甘肽循环的影响[J]. 植物营养与肥料学报, 2010, 16(5): 1209–1216. Wang C, Lin YL, Yang LF, Chen L. Effect of NaCl stress on ascorbate-glutathione cycle in vegetable soybean seeds[J]. Plant Nutrition and Fertilizer Science, 2010, 16(5): 1209–1216.
[27]马进, 郑钢, 裴翠明, 等. 抗坏血酸-谷胱甘肽循环在紫花苜蓿突变体耐盐性中的作用[J]. 植物生理学报, 2015, 51(10): 1749–1756. Ma J, Zheng G, Pei CM, et al. The function of ascorbate-glutathione cycle in salt tolerance of alfalfa mutant[J]. Plant Physiology Journal, 2015, 51(10): 1749–1756.
Response difference of antioxidant and ascorbate-glutathione cycle system to NaCl stress between salt tolerant and sensitive barley cultivars at the seedling stage
LI Bei-bei1, LIU Zhi-ping2, ZHANG Feng-ying2, BAO Hai-zhu2, MENG Fan-hao1, WANG Cong1,
YANG Heng-shan1, XU Shou-jun1*
( 1 College of Agronomy, Inner Mongolia University for Nationalities, Tongliao, Neimenggu 028043, China; 2 Institute of Agronomy, Inner Mongolia Academy of Agricultural Sciences, Huhhot, Inner Mongolia 010031, China )
【Objectives】The aim of this study was to compare the response differences of antioxidant and ascorbate-glutathione cycle system to NaCl stress between the salt tolerant and sensitive barley cultivars at the seedling stage.【Methods】A hydroponic experiment was conducted using salt-tolerant cultivar (12pj-118) and non-tolerant cultivar (12pj-045) of barley as materials. Six NaCl stress concentrations were set up, including 0, 100, 200, 300, 400 and 500 mmol/L. The plant samples were collected when the forth leaf emerged. The active oxygen metabolism, antioxidant enzyme activity and ascorbate glutathione cycle were determined.【Results】The results showed that theproduction rate, H2O2content and MDA content were increased gradually with theincrease of NaCl levels, and the increased rates of the 12pj-118 were lower than those of the 12pj-045. The activities of SOD, POD, CAT, GR and APX, the contents of AsA and GSH and the ratios of AsA/DHA were increased at first and then decreased. The increased rates of the SOD, POD and CAT activities were much higher in the 12pj-118 under different NaCl concentrations at first, and reduced rates were lower later. The increased rates of APX and GR activities of 12pj-118 were higher than those of 12pj-045 under the same salt concentration, and the reduced rates were lower. Under different NaCl concentrations, the increased rates of the AsA contents and AsA/DHA ratios of 12pj-118 were higher than those of 12pj-045. The ratios of GSH/GSSG showed awavy change in two barley cultivars, and the 12pj-118 was able to maintain high GSH contents and GSH/GSSG ratios under higher NaCl concentrations. These results indicated that the salt resistance of 12pj-118 was better than the 12pj-045.【Conclusions】The response of NaCl stress was different on antioxidant system and ascorbateglutathione cycle at the seedling stage. At agiven range, with the increase of NaCl concentration, the increased rates of the SOD, POD, CAT, APX, GR, AsA and GSH of the12pj-118 were much higher than those of the 12pj-045 under different NaCl concentrations, and reduced rates were lower. The results indicated that antioxidant activity and ascorbate glutathione cycle were closely related to salt tolerance of barley seedlings.
barley; NaCl stress; antioxidant enzymes; ascorbate-glutathione cycle
2016–08–17 接受日期:2017–02–06
国家自然科学基金项目(31360307);内蒙古自治区人才开发基金项目;内蒙古自治区“草原英才”工程项目;内蒙古民族大学研究生科技创新项目(NMDSS1430)资助。
李琲琲(1992—),女,内蒙古通辽人,硕士研究生,主要从事大麦栽培生理方面的研究。E-mail:libeibei126@yeah.net * 通信作者 E-mail:shoujun-xu@163.com

