太岳山油松林土壤活性碳和微生物特性随外源有机物的变化规律
张 岩, 张令珍, 徐美丽, 于一
(北京林业大学林学院,北京 100083)
太岳山油松林土壤活性碳和微生物特性随外源有机物的变化规律
张 岩, 张令珍, 徐美丽, 于一
(北京林业大学林学院,北京 100083)
为探讨不同外源碳添加对森林土壤微生物—土壤酶—活性碳库系统的影响规律,在山西太岳山油松林展开了外源碳添加的野外控制试验.试验设计为5种处理,按照250 g·m-2的当量,分别向油松林表层土壤中添加了生物炭、玉米秸秆、辽东栎叶、油松叶和木屑等有机物,以未添加的样方作为对照.研究表明:外源碳的输入,显著提高了碳库各组分的含量和微生物呼吸值(P<0.05).酶活性表现出明显差异,纤维素酶(BG、CBH)、几丁质酶(NAG)、氧化酶(PO、PER)活性分别在秸秆、木屑、油松处理下活性最高.代谢熵大小表现为:油松针叶>辽东栎阔叶>空白>木屑>生物炭>秸秆;微生物熵变化趋势与代谢熵值变化趋势相反.碳库活度、微生物代谢特性和酶活性之间的相关性表现为:纤维素酶和代谢熵成负相关关系,与微生物熵则成正相关关系.氧化酶则与此相反.结合试验结果得出:秸秆和生物炭相较于其他三种处理,具备更强的固碳能力,同时秸秆显著地提高了森林土壤碳的周转速率.
森林土壤微生物; 土壤酶; 活性碳
土壤碳库作为陆地生态系统最大碳储库[1],直接影响着大气中CO2的浓度变化[2].土壤中虽然含有丰富的碳储量,但决定其源或汇的关键有机碳却只占其中较少的一部分.相较于土壤中大部分不易被分解和利用的稳态碳,这部分有机碳则是微生物生长和繁殖的主要能量来源[3-5].同时微生物分泌的酶参与土壤中一切的生化过程.因此,土壤微生物—土壤酶—土壤活性碳库之间复杂的关系直接影响着整个陆地生态系统.
外源碳添加会对土壤微生物—土壤酶—活性碳库产生一系列的影响,同时添加外源碳的形式多样,如葡萄糖、纤维素等简单有机物、森林凋落物、秸秆、生物炭以及不同类型的有机物.外源碳输入土壤后有两种转化方式:一是被土壤生物分解矿化,最终转化为CO2和H2O等简单的无机物,这是土壤有机碳散失的主要途径.二是部分有机物在微生物作用下碳链解体和重组,形成更为复杂和顽固的新化合物,这是土壤有机碳的累积过程[6].上述两种转化过程,均伴随着微生物、土壤酶的全程参与.大量研究发现通常外源碳施入后短期内会引起土壤的激发效应,改变土壤微生物的群落结构和土壤酶活性[7],进而引起有机质各组分变化,增加土壤向空气中释放的碳量[8].研究表明[9],生物炭施用会促进N、P等矿质元素利用相关的土壤酶活性,而降低土壤碳矿化等生态学过程的土壤酶活性.不同质量凋落物的输入能引起土壤酶活性的变化,酶活性的改变反过来又影响凋落物的分解[10].不同秸秆量的输入试验表明:秸秆的输入提高了土壤纤维素酶的活性,而降低了氧化酶的活性[11].不同的外源碳添加对土壤有机碳各组分的含量和品质构成长期而复杂的影响[13].在室内模拟试验条件下,碳源的添加导致土壤原有有机碳的矿化速率增加以及总有机碳含量的下降[14-15].但在野外试验条件下,添加生物炭、玉米秸秆、凋落物等会增加土壤有机碳含量,尤其以土壤表层有机碳含量的增加最明显[16-17].Jien et al[18]发现生物炭添加可以明显减少土壤有机碳的损失.而Wardle et al[19]研究表明,添加生物炭会促进微生物对土壤有机质的利用效率,进而加快土壤有机碳的损失.作物秸秆的添加则会提高土壤有机质的输入量,增加土壤有机碳含量[20].Qiao et al[21]对森林生态系统碳源输入模拟试验的研究结果表明,增加碳源输入处理显著增加了土壤活性碳库的含量,额外的凋落物输入可刺激土壤现存的有机质的分解[22].由于针叶和阔叶的木质素含量不同,阔叶为18%~22%、针叶为25%~35%[23],其对土壤有机质周转的影响程度也有所不同.而不同性状和质量有机物的添加对森林土壤活性有机碳组分的动态调控,以及土壤酶在这一过程中的驱动机理,依然是森林土壤有机碳周转过程中亟需解决的问题.所以本文采取生物炭、秸秆、辽东栎叶、油松叶、木屑五种添加物,分别对土壤活性碳库、土壤酶活性和土壤微生物学性状进行探究.并对其微生物作用机制进行了初步的剖析,为探究人为调控土壤碳源的可利用性,科学地增加陆地生态系统的碳汇能力提供一定的参考.
1 材料与方法
1.1 试区概况
该研究是在国家林业局森林生态系统研究网络中的山西省太岳山生态站开展的.该生态站坐落在山西省沁源县灵空山林场,海拔在1 500~1 800 m,地理范围在36°31′N—36°66′N和12°01′E—112°15′E,属于暖温带半干旱大陆性季风气候,年均气温在8.6 ℃,年平均降水量600~700 mm,其中60%的降水集中在7-9月.土壤类型主要为褐土和棕壤土[24].植被类型以油松林(Pinustabulaeformis)和辽东栎林(Quercusliao-tungensis)为主,其他常见树种主要有华北落叶松(Larixprincipis-rupprechtii)、白桦(Betulaplatyphylla)和山杨(Populusdavidiana)等.立地特征:油松的平均胸径为22.04 cm;其他为9.04 cm.油松密度为920 株·hm-2;其他密度为83 株·hm-2.pH=5.67;N:1.31 g·kg-1;TOC:2.26 g·kg-1.
1.2 研究方法
1.2.1 试验设计 2014年4月下旬,在太岳山生态站西向约8 km处,选择一片地势平坦、长势良好的油松林,面积约2 400 m2,林龄约70 a.在距林缘至少10 m处,按东西走向布设30个2 m×2 m的小样方,样方间隔大于4 m.然后,按300 g·m-2的标准,向0~20 cm土壤中分别添加生物炭(Biochar: B)、秸秆(corn straw: C)、辽东栎叶(leaf debris: LD)、油松叶(Pinustabulaeformis carr. leaf: P)、木屑(sawdust: S).有机物添加量:C、LD、P、S需要添加500 g·m-2,每个样方添加总量为2 000 g;B需要添加320 g·m-2,每个样方添加有机物V的总量为1 280 g.
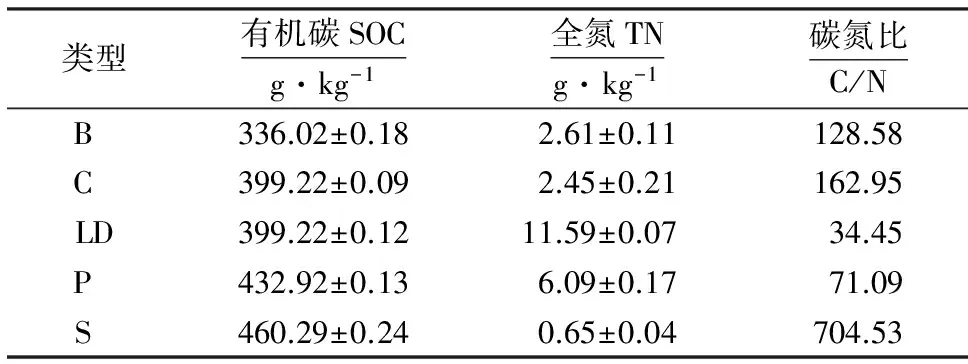
表1 添加物基本性状1)Table 1 Basic properties of selected exogenous organic matter
1)B:添加生物炭处理;C:添加玉米秸秆处理;S:添加木屑处理;L:添加辽东栎叶处理;P:添加油松叶处理.
添加方法:将5种有机物分别打碎,过2 mm筛备用,将样方内0~20 cm的土铲出,分别与有机物混合均匀,再填回原样方并还原样地表面.另设样方保持原状作为对照(CK),每种处理重复5次,一共布设30个2 m×2 m的小样方.外源碳添加物基本性状如表1所示.
1.2.2 土壤样品采集 在添加有机物前,用直径4 cm的土钻在每个小样方内钻取0~10 cm的土壤,装入自封袋带回实验室,进行样地本底值的测定.于2016年5月初,分别对每块2 m×2 m的样方中随机选取1个采样点,去除表面凋落物,使用内径4 cm的土钻采集0~10 cm的表层土样并混合.使用保温箱当天带回实验室,去除可见根系,过2 mm筛后分成2份,一部分土样自然风干,另一部分置于零下20 ℃冰箱内保存待测.
1.2.3 测定方法 (1)土壤活性碳的测定:土壤有机碳(SOC)的测定采用重铬酸钾容量法—外加热法[25].可溶性有机碳(DOC)采用热水浸提进行提取[26].其步骤如下:土∶水=1∶5(土3 g,去离子水15 mL)装入50 mL离心管中,在100 ℃水浴锅中加热1 h,静止4 h后,配平在3 500 r·min-1离心15 min,离心后的土壤上清液过0.45 μm滤膜得出滤液.滤液加5 mL 0.8 mol·L-1K2Cr2O7和5 mL浓H2SO4,在185 ℃下消煮5 min,0.2 mol·L-1Fe2SO4滴定.
易氧化态有机碳:采用333 mol·L-1KMnO4氧化法测定[27].稀释液利用751或紫外分光光度计(TU-1810)在565 nm波长处比色测定,按消耗1 mmol KMnO4溶液相当于氧化9 mg碳计算易氧化态有机碳含量.
微生物生物量碳(MBC)的测定采用氯仿熏蒸—K2SO4提取方法[28].浸出液用TOC(Jena Multi N/C 2100)测定.微生物生物量碳的换算系数为0.38.
(2)土壤酶活性的测定:本研究通过测定五种胞外酶活性评价微生物在土壤C转化中的功能,分别是水解酶,包括纤维素水解酶(β-1,4葡萄糖苷酶、纤维二糖水解酶)、几丁质酶(N-乙酰-葡萄糖苷酶);氧化酶包括参与木质素降解的酚氧化酶和过氧化物酶.用p-硝基苯酚(p-nitrophneol)作为底物[29].在37 ℃恒温培养1 h(其中纤维二糖水解酶为2 h)分别用于测定β-1,4-葡萄糖苷酶活性,纤维二糖水解酶和N-乙酰-葡萄糖苷酶活性,在410 nm的紫外分光光度计下进行比色测定.酚氧化酶活性和过氧化物酶活性采用L-DOPA(1-3,4-dihydroxyphenylalanine,左旋多巴胺)作为反应基质测定[29].在460 nm下比色测定.所有总的酶活性单位为μg·h-1·g-1soil..
(3)土壤微生物活性测定:土壤微生物呼吸(MR)的测定采用静态碱液吸收法.称取相当于干土15 g的新鲜土样,调节到土壤最大持水量的40%,将土样放入呼吸瓶中.将右边旋口打开通入空气,注入10 mL 0.1 mol·L-1NaOH溶液,然后关闭旋口,塞上橡皮塞,于25 ℃黑暗条件下连续培养6天,此后每2天测1次.土壤微生物呼吸释放的CO2由10 mL 0.1 mol·L-1NaOH 吸收,吸收后的碱液再用0.1 mol·L-1HCl标准溶液滴定[30].土壤微生物代谢熵(qCO2)为土壤呼吸与土壤微生物量碳的比值[31],其计算公式为:qCO2=MR/MBC.
(4)土壤碳库管理指数(Lefory et al., 1993)计算公式[32-33]:土壤活性有机碳含量/(mg·kg-1)=水溶性有机碳含量+微生物量碳含量+易氧化碳含量;稳态碳UA/(g·kg-1)=土壤有机碳含量—土壤活性有机碳含量;碳库活度A/%=土壤活性有机碳含量/土壤稳态碳含量.
1.3 数据处理
所得数据处理及图表制作采用Microsoft Excel 2007,方差分析、多重比较及回归分析均釆用SPSS 16.0,显著性检验采用LSD(P<0.05).
2 结果与分析
2.1 不同外源碳添加对活性碳库的影响
表2说明:外源碳的输入,显著提高了碳库各组分的含量.其中B和C的处理普遍高于其他处理.各处理下SOC含量和稳态碳情况一致,均表现为各处理下SOC和稳态碳显著高于对照(P<0.05),其中SOC分别高出对照组,B 56.7%、C 40.7%、LD 39.6%、P 42.8%、S 42.9%;稳态碳高于对照B 57%、C 38.4%、LD 43.1%、P 47.2%、S 49%.但5种处理间SOC含量和稳态碳并无显著性差异.不同处理下DOC含量为B>C>LD>P>S>CK,5种外源碳添加处理均显著高于对照(P<0.05),其中B和C处理下的DOC显著高于对照和P、S处理.不同处理下MBC和ROC的情况基本一致,均表现为B和C处理显著高于对照和其他处理,其中LD、P和S处理下的MBC含量也显著高于对照.碳库强度顺序为C>CK>B>LD>P>S,其中C处理显著高于除B处理和对照外的其他处理.
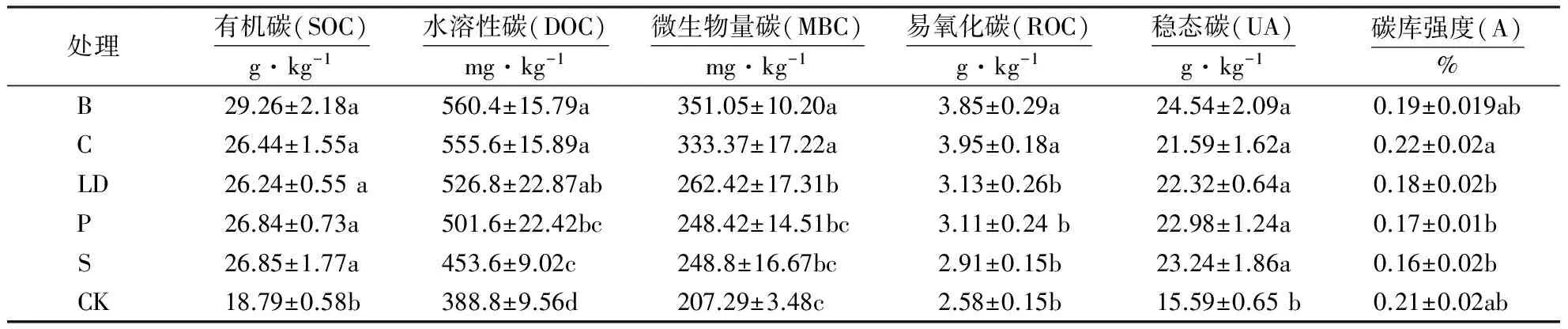
表2 不同外源碳处理间土壤活性碳库变化Table 2 Changes in labile carbon pools in treatments with different exogenous organic carbon
2.2 不同外源碳添加对土壤生物化学性状的影响
2.2.1 不同外源碳添加对土壤酶活性的影响 各外源碳添加处理对不同的土壤酶活性影响不同(图1).整体上纤维素酶BG、CBH不同处理下活性的大小顺序一致,均表现为C>B>LD>S>P>CK,其中B和C处理下的BG活性和CBH活性均显著高于对照和其他处理(P<0.05).不同处理下几丁质酶NAG活性则表现为S>C>LD>P>CK>B,S和C处理下的NAG活性显著高于对照和其他处理,其中S处理下的NAG活性最高(P<0.05).C处理则显著高于B、P、CK处理(P<0.05).氧化酶活性PO、PER活性大小顺序均表现为P>LD>S>CK>B>C,其中P处理下的PO、PER活性最高.其中P处理下的PO活性显著高于B、C处理和对照;而P处理下的PER的活性只显著高于B、C处理(P<0.05).
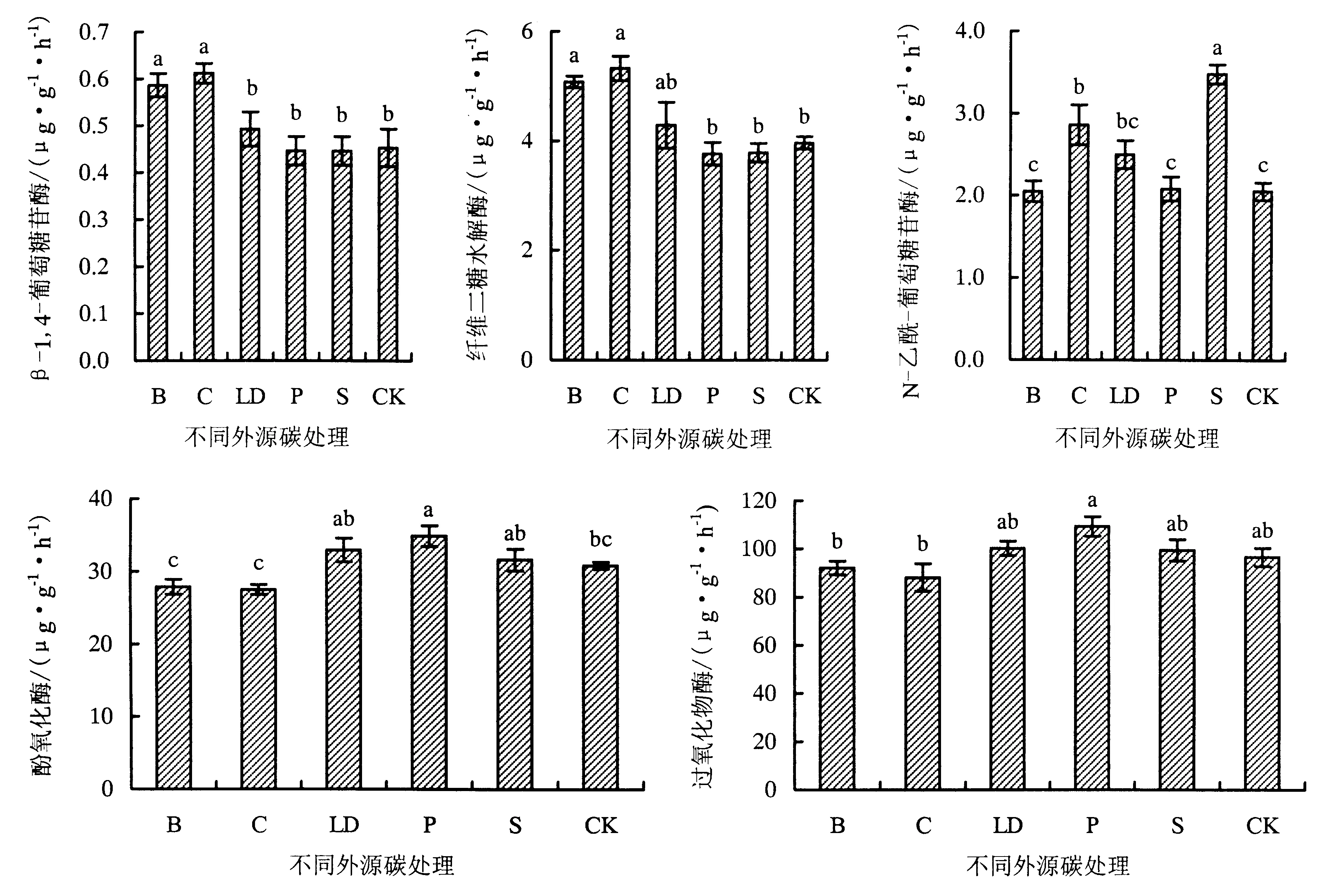
B:添加生物炭处理;C:添加玉米秸秆处理;S:添加木屑处理;L:添加辽东栎叶处理;P:添加油松叶处理.图1 不同外源碳处理下土壤酶活性变化Fig.1 Variations in soil enzyme activity in treatments with different exogenous organic carbon
2.2.2 不同外源碳添加对土壤微生物性状的影响 各外源碳的输入整体上提高了微生物的呼吸值(MB),各处理下的代谢熵和微生物熵也在一定程度上高于对照.表3结果表明:5种处理下微生物呼吸值(MB)均显著高于对照(P<0.05),但B和C处理下的微生物呼吸值又显著低于其他3种处理(P<0.05);LD、P、S处理下的代谢熵(qCO2)显著高于B、C处理和对照组(P<0.05),其中qCO2的顺序为P>LD>CK>S>B>C.而微生物熵(Cbio/Corg)的变化趋势与qCO2值变化趋势相反,即为C>CK>B>LD>S>P,其中B和C处理下的微生物熵是最高的,显著高于P、S处理和对照(P<0.05).
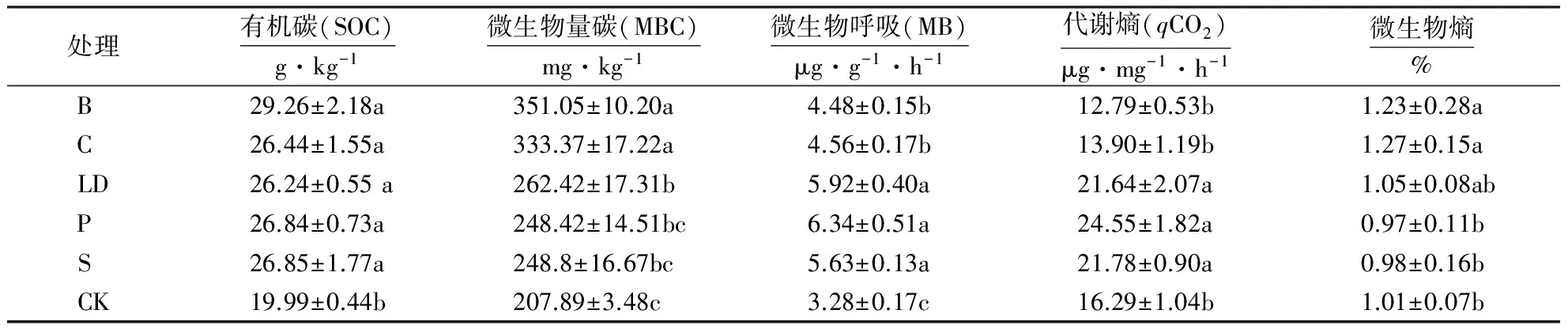
表3 不同外源碳处理间土壤微生物学性状的变化Table 3 Changes in soil microbial properties in treatments with different exogenous organic carbon
2.3 不同外源碳添加下碳库活度、土壤微生物代谢特性和酶活性之间的相关
表4结果可见:碳库活度、代谢熵和微生物熵与参与碳循环的酶活性之间的整体相关性不强,但仍能在一定程度上反应之间紧密的相关性.其中PO与碳库活性存在着一定程度的负相关关系;BG和BCH活性和代谢熵存在一定的负相关关系;而PO与PER和代谢熵存在显著的正相关关系(R=0.744,R=0.536),微生物熵与代谢熵结果相反,即BG和BCH活性和微生物熵存在正相关关系(R=0.594,0.508);PO与微生物熵存在负相关关系(R=0.539).不难得出:水解酶和代谢熵成负相关关系;与微生物熵则成正相关关系.氧化酶则与此相反.
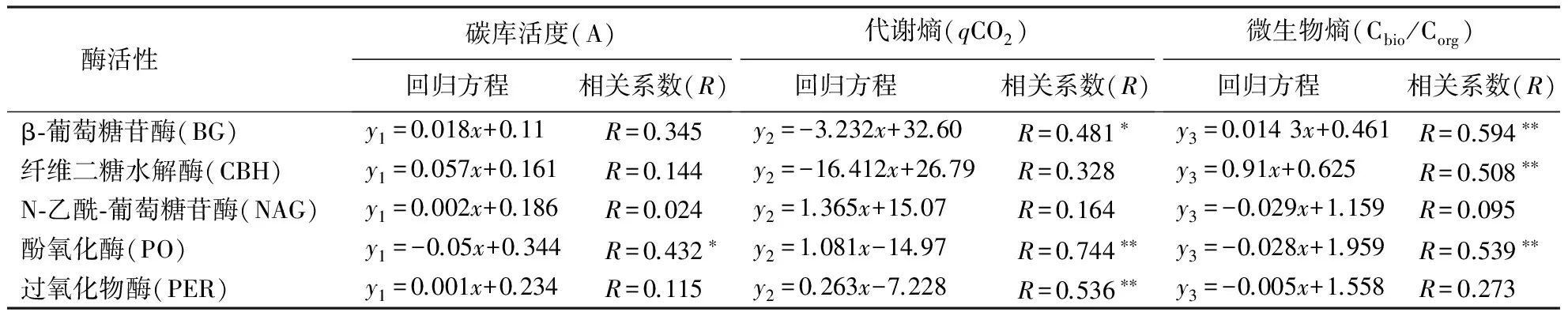
表4 不同外源碳处理下土壤酶活性与土壤微生物代谢特性关系函数(n=15)1)Table 4 Relationship between soil microbial metabolic features and soil enzymes in treatments with different exogenous organic carbon
1)x为各酶活性,y1为土壤碳库活度,y2为代谢熵(qCO2),y3为微生物熵(Cbio/Corg).
3 讨论
3.1 不同外源碳添加对活性碳库的影响
土壤有机C含量及其动态主要取决于土壤原有有机质分解,以及外源有机质输入与降解之间的平衡[32].外源碳输入土壤后通常情况下会提高有机碳含量,但由于外源碳的质与量的差异,其对土壤活性碳库各组分的影响存在很大的差异[35].本研究中各处理下有机碳和稳态碳含量均显著高于对照,这与前人的研究结果基本一致[16,36].其中,DOC含量在5种处理下均显著高于对照,由于DOC可作为碳源来促进微生物的周转,而在周转过程中微生物又通过分解有机物及本身的新陈代谢来增加DOC的含量[38],一定程度上DOC既是土壤微生物呼吸的底物来源,又是土壤中微生物呼吸的产物[39].因此,外源碳的输入对DOC的影响相对显著.同时本研究中MBC和ROC对5种外源碳输入的响应表现基本一致,其中生物炭增加的有机碳形式主要是微生物量碳[40],秸秆增加的有机碳形式主要是易氧化有机碳[41].这与本试验结果相符合.不同的外源碳输入土壤后对土壤微生物量影响存在很大差异,其原因主要有两个方面,其一是不同微生物群落对碳源利用能力的不同,碳源输入后导致不同微生物群落数量的增加或者减少;另一方面则是输入的外源碳有效性低于原土壤有机质,外源碳输入后微生物量没有明显变化[42].
本研究中各处理下的稳态碳含量均显著高于对照组,同时结合碳库强度数据不难得出:生物炭和秸秆的处理在一定程度上加快了土壤碳的周转速率.而秸秆处理对土壤活性碳库的影响相对显著.五种处理中,唯有秸秆处理既提高了稳态碳,又提高碳库活度.充分表明秸秆外源碳的输入加快了碳的周转速率.其可能是由于秸秆是非森林的土著碳源,对森林土壤中与碳相关的微生物刺激相对较大,同时秸秆又是C4植物,其本身含有与CO2的亲和力极强的PEP(CO2的受体),故对土壤中碳周转过程起着某种促进作用.其次,生物炭的输入也很大程度上提高了活性碳库的含量.
3.2 不同外源碳添加对酶活性的影响
Tateno[43]研究表明,限制酶的反应的因素不是酶的总数,而是可作为能源的物质供应.作为陆地生态系统碳周转过程中的最主要的3类聚合体,即纤维素、木质素和几丁质,它们既是碳的主要存在与转化形式,也是碳循环过程中主要的基质和产物[44].因此与这3类聚合体相关的酶活性的格局变化,在一定程度上代表着碳循环过程的强度和方向.
有研究发现:有机物输入对纤维素酶变化的影响,无论是低量输入还是高量输入,土壤酶活性均增强.其中,β-葡糖苷酶和纤维酶增强30%[45].本研究中纤维素酶(BG、CBH)在生物炭和秸秆处理下的活性均显著高于对照和其他处理,其中秸秆处理下BG、CBH活性情况与Zhao et al[46]的研究结论一致.秸秆为非森林土著碳源,本身可能对土壤微生物的刺激较大,其输入后微生物要分泌更多C获取酶从而用于降解有机质[47].关于生物炭的输入有研究发现:生物炭对酶分子的吸附对酶促反应结合位点形成保护,而阻止了酶促反应的进行[48].本研究结果表明:生物炭的添加提高了纤维素酶的活性,这与Wang et al[50,51]的研究结果相一致.由于生物炭特殊的物理特性(疏松多孔、较大比表面积、吸附性),其施用后必然会改变土壤的理化性状,并为微生物代谢提供了易分解的碳化合物,因此毫无疑问它将改变微生物的群落结构和功能[53].凋落物对土壤酶活性产生不同的影响,其主要原因可能是凋落物的不同导致土壤微生物量、区系组成以及代谢过程改变,致使主要由土壤微生物产生的土壤酶的数量和活性发生变化[54,55].本研究中凋落物输入(P、LD处理)下的纤维素酶活性无显著性变化.这可能是由于凋落物是森林中的土著碳源,其碳素对于土壤微生物有着极强的利用性,微生物群落无需分泌过多的水解酶(BG和CBH)来获取碳源;加之土壤本身对熟悉的外源物质具有一定的缓冲作用,因此凋落物的添加对土壤纤维酶格局并没有产生剧烈影响.
几丁质酶(NAG)与土壤有机碳和氮的转化关系密切,能将几丁质转化为氨基酸,是土壤矿质氮的主要来源[56].不同外源碳处理下,其活性表现为秸秆处理与木屑处理显著高于对照组,其中木屑添加物的C/N较高,一方面是其含碳量较高,另一方面又因其含氮量较低,因此木屑处理组相较其他处理的可利用氮素偏少,微生物不得不分泌更多与N素相关的酶,所以造成了木屑处理下的NAG显著高于对照组和其他处理.生物炭添加下的NAG活性显著降低,与Award et al[57]研究结果一致.
两种氧化酶(PO、PER)不同处理下的活性情况基本一致.均表现出秸秆和生物炭的添加显著抑制了PO、PER的活性,同时油松处理又显著促进了它们的活性.很多报道指出:氧化酶活性(PO、PER)源于真菌,在高土壤肥力条件下被抑制,主要是由于真菌不需要通过分解顽固化合物获取C或N[46].秸秆和生物炭一定程度上较其他处理C/N更均衡,微生物所必需的营养元素容易获得,因此很大程度上减少了氧化酶的分泌.有研究表明:酚氧化酶与过氧化物酶活性与凋落物C/N比呈负相关[58].这正与本研究情况相一致.同时土壤酚氧化酶活性在春季最高(与本研究土壤取样时间一致),加速木质素降解、腐殖化、碳矿化、溶解性有机碳的输出等,同时其活性低则会促进土壤有机碳的积累[59].由此,可推测生物炭、秸秆处理下的低酚氧化酶活性表征着其促进土壤有机碳的累积.
3.3 不同外源碳添加对微生物呼吸、qCO2、Cbio/Corg的影响
微生物呼吸是土壤向大气中排放CO2的主要形式.外源碳输入对土壤微生物呼吸具有一定的激发效应[61].已有研究表明:向土壤中添加生物炭、秸秆、凋落物等均会提高土壤的呼吸速率.本研究中五种外源碳输入也均提高了微生物呼吸值.土壤微生物代谢熵(qCO2),是土壤微生物呼吸与微生物量碳的比值.反映微生物利用土壤有机成分的效率和土壤生态系统演化的程度,qCO2值越低,表征着微生物碳利用效率越高[64].在本研究中生物炭和秸秆处理下的代谢熵显著低于其他处理,因此,生物炭和秸秆的输入较其他外源碳更能提高微生物碳的利用效率.微生物商是土壤微生物量碳占土壤有机碳含量的百分比.其中微生物商值越大,说明土壤有机碳周转越快[12].生物炭和秸秆处理下的微生物熵显著高于对照和其他处理,说明秸秆和生物炭的添加处理使土壤微生物呼吸消耗的碳比较少,能更有效的利用有机碳转化为微生物量碳.
3.4 不同外源碳添加下土壤酶与碳库活度、土壤微生物代谢特征之间的相关性
土壤酶系统是土壤中一切生化过程中的参与者,研究土壤微生物代谢—土壤活性有机碳库—土壤酶之间的相关性,对整个森林生态系统有着重要的作用[63].纤维素酶BG和CBH是参与土壤C获取过程中的相关酶,通常CBH以葡聚糖链暴露出的非还原性末端为基质水解产生纤维二糖,再由裂解二聚糖和多聚糖的BG将底物水解成葡萄糖,纤维素酶BG和CBH在降解有机碳复合的过程发挥重要作用,其水解产物(糖类)是土壤微生物的主要能量来源[62].在本研究中BG和CBH均与微生物熵成正比,而与微生物代谢熵成反比;与碳库活度相关性不明显.这意味着BG和CBH含量越高,微生物呼吸消耗的碳比例较小,建造微生物量碳的比例就越高.有研究得出β-葡萄糖苷酶等水解酶等对土壤有机碳的累积有着直接的正效应[30].因此,β-葡萄糖苷酶和纤维二糖水解酶对土壤的碳汇功能有着积极的正作用.
氧化酶PO和PER是土壤C氧化过程中的相关酶,同为土壤中主要木质素降解酶.其中酚氧化酶的活性与土壤腐殖质化程度密切相关[60],它能催化腐殖质中难以利用的芳香化合物转化分解为易被利用的化合物[52].而过氧化物酶参与着土壤腐殖质的合成过程[49],利用微生物和某些氧化酶的作用而在土壤中形成的H2O2和其他有机过氧化物中的氧,氧化土壤有机质,对腐殖质的形成具有重要作用.在本研究中,氧化酶与纤维素酶恰好相反,即与代谢熵成正比,与微生物熵成反比,与活性碳库相关性不明显.其中酚氧化酶与土壤代谢熵呈显著的正相关关系,即酚氧化酶越高,微生物利用养分的能力越低.同时有研究表明:酚氧化酶与土壤腐殖质化程度呈负相关,并对微生物量碳的调控存在负相关作用[30],其含量越高,越降低土壤肥力质量[37].这正与本研究不谋而和.但也有研究认为:土壤酚氧化酶和过氧化物酶广泛参与土壤有机质的腐殖化和矿化过程而被认为是土壤有机质平衡的限速酶类,在土壤有机质积累中同样发挥着重要作用[34].由于土壤活性碳库和微生物代谢本身的复杂性,加之其变化还受到土壤性质、环境条件等多方面的影响,使得酶活性与“活性碳库—微生物代谢”之间的调控机制存在着很大的不确定性.因此,对土壤微生物代谢—土壤活性有机碳库—土壤酶之间的机理,仍需进一步探索.
[1] 陶波,葛全胜,李克让,等.陆地生态系统碳循环研究进展[J].地理研究,2001,20(5):564-575.
[2] 陈泮勤.地球系统碳循环(精)[M].北京:地球系统碳循环,科学出版社,2004.
[3] RINNAN R, BÅÅTH E. Differential utilization of carbon substrates by bacteria and fungi in tundra soil.[J]. Applied & Environmental Microbiology, 2009,75(11):3 611-3 620.
[4] KIRKBY C A, RICHARDSON A E, WADE L J, et al. Carbon-nutrient stoichiometry to increase soil carbon sequestration[J]. Soil Biology & Biochemistry, 2013,60(5):77-86.
[5] HEES P A W V, JONES D L, FINLAY R, et al. The carbon we do not see—the impact of low molecular weight compounds on carbon dynamics and respiration in forest soils: a review[J]. Soil Biology & Biochemistry, 2005,37(1):1-13.
[6] LUNDQUIST E J, SCOW K M, JACKSON L E, et al. Rapid response of soil microbial communities from conventional, low input, and organic farming systems to a wet/dry cycle[J]. Soil Biology & Biochemistry, 1999,31(12):1 661-1 675.
[7] WANG Q K, WANG S L, XIAO-JUN Y U, et al. Soil carbon mineralization potential and its effect on soil active organic carbon in evergreen broadleaved forest and Chinese fir plantation[J]. Chinese Journal of Ecology, 2007,26(12):1 918-1 923.
[8] LORENZ K, LAL R. Biogeochemical C and N cycles in urban soils.[J]. Environment International, 2009,35(1):1-8.
[9] LEHMANN J, RILLIG M C, THIES J, et al. Biochar effects on soil biota—A review[J]. Soil Biology & Biochemistry, 2011,43(9):1 812-1 836.
[10] KRAKOMPERGER Z, TOTH J A, VARGA C, et al. The effect of letter input on siol enzyme activity in an Oak forest[J]. Cereal Research Communications, 2008,36(12):323-326.
[11] ZHAO S, LI K, ZHOU W, et al. Changes in soil microbial community, enzyme activities and organic matter fractions under long-term straw return in north-central China[J]. Agriculture Ecosystems & Environment, 2016,216(1):82-88.
[12] 张鹏,李涵,贾志宽,等.秸秆还田对宁南旱区土壤有机碳含量及土壤碳矿化的影响[J].农业环境科学学报,2011,30(12):2 518-2 525.
[13] PAUSCH J, KUZYAKOV Y. Soil organic carbon decomposition from recently added and older sources estimated by δ13C values of CO2, and organic matter[J]. Soil Biology & Biochemistry, 2012,55(12):40-47.
[14] FONTAINE S, BARDOUX G, ABBADIE L, et al. Carbon input to soil may decrease soil carbon content[J]. Ecology Letters, 2004,7(4):314-320.
[15] NOTTINGHAM A T, GRIFFITHS H, CHAMBERLAIN P M, et al. Soil priming by sugar and leaf-litter substrates: A link to microbial groups[J]. Applied Soil Ecology, 2009,42(3):183-190.
[16] 李成芳,寇志奎,张枝盛,等.秸秆还田对免耕稻田温室气体排放及土壤有机碳固定的影响[J].农业环境科学学报,2011,30(11):2 362-2 367.
[17] 慕平,张恩和,王汉宁,等.不同年限全量玉米秸秆还田对玉米生长发育及土壤理化性状的影响[J].中国生态农业学报,2012,20(3):291-296.
[18] JIEN S H, WANG C S. Effects of biochar on soil properties and erosion potential in a highly weathered soil[J]. Catena, 2013,110(110):225-233.
[19] WARDLE D A, NILSSON M C, ZACKRISSON O. Fire-derived charcoal causes loss of forest humus[J]. Science, 2008,320(5876):629-629.
[20] OYEDELE D J, SCHJONNING P, SIBBESEN E, et al. Aggregation and organic matter fractions of three Nigerian soils as affected by soil disturbance and incorporation of plant material[J]. Soil & Tillage Research, 1999(98):105-114.
[21] NA Q, DOUGLAS S, BLAGODATSKAYA E, et al. Labile carbon retention compensates for CO2, released by priming in forest soils[J]. Global Change Biology, 2013,20(6):1 943-1 954.
[22] NADELHOFFER K J, BOONE R D, BOWDEN R D, et al. The DIRT Experiment: Litter and Root Influences on Forest Soil Organic Matter Stocks and Function[M]// FOSTER D, ABER J. Forest Landscape Dynamics in New England: Ecosystem Structure and Function as a Consequence of 5000 Years of Change, Oxford:Oxford University Press,2004.
[23] FARRELL R L, KIRK T K, TIEN M. Novel enzymes which catalyze the degradation and modification of lignin: US, US 4687741 A[P]. 1987.
[24] 朱建奎,韩海荣,伊力塔,等.山西太岳山典型森林群落土壤有机质及氮素研究[J].林业资源管理,2009(2):70-75.
[25] 刘世杰,窦森.重铬酸钾氧化法用于黑碳分析的条件探讨[J].吉林农业大学学报,2010,32(3):316-320.
[26] JAFFRAIN J, GERARD F, MEYER M, et al. Assessing the quality of dissolved organic matter in forest soils using ultraviolet absorption spectrophotometry[J]. Soil Science Society of America Journal, 2007,71(6):1 851-1 858.
[27] MING-GANG X U, RONG Y U, SUN X F, et al. Effects of long-term fertilization on labile organic matter and carbon management index (CMI) of the typical soils of China[J]. Plant Nutrition & Fertilizer Science, 2006,12(4):65-71.
[28] 鲁如坤.土壤农业化学分析方法[M].北京:中国农业科技出版社,1999.
[29] SINSABAUGH R L, LAUBER C L, WEINTRAUB M N, et al. Stoichiometry of soil enzyme activity at global scale[J]. Ecology Letters, 2008,11(11):1 252-1 264.
[30] 尤业明.宝天曼森林土壤碳转化的微生物调控机制[D].北京:北京林业大学,2014.
[31] LIU W, XU W, HONG J, et al. Interannual variability of soil microbial biomass and respiration in responses to topography, annual burning and N addition in a semiarid temperate steppe[J]. Geoderma, 2010,158(3):259-267.
[32] 吴建富,曾华研,潘晓华,等.稻草还田方式对双季水稻产量和土壤碳库管理指数的影响[J].应用生态学报,2013,24(6):1 572-1 578.
[33] LEFROY R D B, BLAIR G J, STRONG W M. Changes in soil organic matter with cropping as measured by organic carbon fractions and 13C natural isotope abundance[J]. Plant & Soil, 1993,155-156(1):399-402.
[34] 高璟赟.稻田土壤氧化酶活性与有机碳转化关系研究[D].武汉:华中农业大学,2010.
[35] YAN D, WANG D, YANG L. Long-term effect of chemical fertilizer, straw, and manure on labile organic matter fractions in a paddy soil[J]. Biology & Fertility of Soils, 2007,44(1):93-101.
[36] JAFFRAIN J, GERARD F, MEYER M, et al. Assessing the quality of dissolved organic matter in forest soils using ultraviolet absorption spectrophotometry[J]. Soil Science Society of America Journal, 2007,71(6):1 851-1 858.
[37] GUAN S-Y. Soil Enzyme and Study Method[M]. Beijing: Agricultural Press, 1986.
[38] 丁永亮.不同秸秆还田方式对土壤生物学特征的影响[D].咸阳:西北农林科技大学,2013.
[39] 吴静,陈书涛,胡正华,等.不同温度下的土壤微生物呼吸及其与水溶性有机碳和转化酶的关系[J].环境科学,2015,36(4):1 497-1 506.
[40] SMITH J L, COLLINS H P, BAILEY V L. The effect of young biochar on soil respiration[J]. Soil Biology & Biochemistry, 2010,42(12):2 345-2 347.
[41] 张鹏,李涵,贾志宽,等.秸秆还田对宁南旱区土壤有机碳含量及土壤碳矿化的影响[J].农业环境科学学报,2011,30(12):2 518-2 525.
[42] 贺云龙,齐玉春,彭琴,等.外源碳输入对陆地生态系统碳循环关键过程的影响及其微生物学驱动机制[J].生态学报,2017(2):1-9.
[43] TATENO M. Limitations of available substrates for the expression of cellulase and protease activities in soil[J]. Soil Biology & Biochemistry, 1988,20(1):117-118.
[45] DEBOSZ K, RASMUSSEN P H, PEDERSEN A R. Temporal variations in microbial biomass C and cellulolytic enzyme activity in arable soils: effects of organic matter input. Applied Soil Ecology, 1999,13(3):209-218.
[46] ZHAO S, LI K, ZHOU W, et al. Changes in soil microbial community, enzyme activities and organic matter fractions under long-term straw return in north-central China[J]. Agriculture Ecosystems & Environment, 2016,216(1):82-88.
[47] NOVAK J M, BUSSCHER W J, LAIRD D L, et al. Impact of biochar amendment on fertility of a southeastern Coastal Plain soil.[J]. Soil Science, 2009,174(2):105-112.
[48] LEHMANN J D, JOSEPH S. Biochar for Environmental Management: Science and Technology[J]. Science and Technology, 2009,25(1):15 801-15 811.
[49] LI-HUA T U, TING-XING H U, ZHANG J, et al. Soil enzyme activities in a Pleioblastus amurus plantation in Rainy Area of West China under simulated nitrogen deposition[J]. Chinese Journal of Applied Ecology, 2009,20(12):2 943-2 948.
[50] WANG X, SONG D, LIANG G, et al. Maize biochar addition rate influences soil enzyme activity and microbial community composition in a fluvo-aquic soil[J]. Applied Soil Ecology, 2015,96(11):265-272.
[51] LAMMIRATO C, MILTNER A, KAESTNER M. Effects of wood char and activated carbon on the hydrolysis of cellobiose by β-glucosidase fromAspergillusniger[J]. Soil Biology & Biochemistry, 2011,43(9):1 936-1 942.
[52] DEC J, HAIDER K, BOLLAG J M. Release of substituents from phenolic compounds during oxidative coupling reactions[J]. Chemosphere, 2003,52(3):549-56.
[53] NOVAK J M, BUSSCHER W J, LAIRD D L, et al. Impact of biochar amendment on fertility of a southeastern Coastal Plain soil.[J]. Soil Science, 2009,174(2):105-112.
[54] 葛晓改,肖文发,曾立雄,等.三峡库区马尾松林土壤—凋落物层酶活性对凋落物分解的影响[J].生态学报,2014,34(9):2 228-2 237.
[55] KRAKOMPERGER Z, TOTH J A, VARGA C, et al. The effect of litter input on soil enzyme activity in an oak forest[J]. Cereal Research Communications, 2008,36(10)323-326.
[56] EKENLER M, TABATABAI M. β-Glucosaminidase activity of soils: effect of cropping systems and its relationship to nitrogen mineralization[J]. Biology & Fertility of Soils, 2002,36(5):367-376.
[57] AWAD Y M, BLAGODATSKAYA E, YONG S O, et al. Effects of polyacrylamide, biopolymer, and biochar on decomposition of soil organic matter and plant residues as determined by14C and enzyme activities[J]. European Journal of Soil Biology, 2012,48:1-10.
[58] KEIBLINGER K M, SCHNEIDER T, ROSCHITZKI B, et al. Effects of stoichiometry and temperature perturbations on beech leaf litter decomposition, enzyme activities and protein expression[J]. Biogeosciences & Discussions, 2013,54(1):30-37.
[59] HU S, ZHANG Y, SHI R J, et al. Temporal variations of soil microbial biomass and enzyme activities during the secondary succession of primary broadleaved-Pinuskoraiensis forests in Changbai Mountains of Northeast.[J]. Chinese Journal of Applied Ecology, 2013,24(2):366.
[60] LIU J G, ZHANG W, YAN-BIN L I, et al. Effects of long-term continuous cropping system of cotton on soil physical-chemical properties and activities of soil enzyme in oasis in Xinjiang[J]. Scientia Agricultura Sinica, 2009,42(2):725-733.
[61] KUZYAKOV Y, FRIEDEL J K, STAHR K. Review of mechanisms and quantification of priming effects[J]. Soil Biology & Biochemistry, 2000,32(11-12):1 485-1 498.
[63] 谢龙莲.桉树人工林土壤微生物动态变化研究[D].海口:华南热带农业大学,2005.
[64] 立天宇, 康峰峰,韩海荣,等.冀北辽河源自然保护区土壤微生物碳代谢对阔叶林叶凋落物组成的响应[J].应用生态学报,2015,26(3):715-722.
(责任编辑:吴显达)
Variations in labile soil carbon and microbial activity by organic matter input inPinusforest in Taiyue mountain
ZHANG Yan, ZHANG Lingzhen, XU Meili, YU Yi
( Forestry College, Beijing Forestry University, Beijing 100083)
To explore the feasibility of exogenous carbon on improving soil microbial organism, enzyme and labile soil carbon pool in forest, 5 types of carbon sources including biochar, corn stem, oak leaf,pinusleaf and sawdust were added at 250 g·m-2inpinusforest in Shanxi, with no addition as control. The results indicated that all constituents of soil organic carbon and microbial respiration were greatly affected by organic matter additions (P<0.05). Corn stem, wood stem andpinusleaf significantly increased cellulose enzyme activities (BG, CBH), chitinase (NAG) and oxidase (PO, PER). Level of soil microbial metabolic quotient (qCO2) of various input declined sequentially in the following order ofpinusleaf, oak leaf, the control, sawdust, biochar and corn stem, with microbial quotient (Cbio/Corg) being in the opposite sequence. Cellulose level was negatively correlated withqCO2, but positively correlated with Cbio/Corg. To summarize, corn stem and biochar demonstrated higher sequestration ability than 3 other materials. What′s more, straw improves the turnover rate of forest soil carbon significantly.
soil microbial organism; enzyme; labile soil carbon pool
2016-10-09
2016-11-22
国家重点研发计划课题项目(2016YFD0600205).
张岩(1992-),女,硕士研究生.研究方向:森林土壤碳循环微生物作用机制.Email:623263587@qq.com.
S718.5
A
1671-5470(2017)03-0284-09
10.13323/j.cnki.j.fafu(nat.sci.).2017.03.009

