解磷细菌对巨尾桉根际土壤酸性磷酸酶活性的影响
崔 邢, 张 亮,林勇明,2, 吴承祯,2,3, 谢安强,2, 陈 灿,2, 李 键,2, 洪 滔,2
(1.福建农林大学林学院,福建 福州 350002;2.福建省高校森林生态系统经营与过程重点实验室,福建 福州 350002;3.武夷学院生态与资源工程学院,福建 南平 354300)
解磷细菌对巨尾桉根际土壤酸性磷酸酶活性的影响
崔 邢1, 张 亮1,林勇明1,2, 吴承祯1,2,3, 谢安强1,2, 陈 灿1,2, 李 键1,2, 洪 滔1,2
(1.福建农林大学林学院,福建 福州 350002;2.福建省高校森林生态系统经营与过程重点实验室,福建 福州 350002;3.武夷学院生态与资源工程学院,福建 南平 354300)
为探究解磷细菌与土壤酸性磷酸酶活性的关系,以解无机磷细菌P7、P19和解有机磷细菌YP17为解磷菌剂,以巨尾桉幼苗作为研究对象,以4种森林土壤为基质进行盆栽试验,设置1×106cfu·mL-1(低)、0.5×107cfu·mL-1(中)、1×107cfu·mL-1(高) 3个菌浓度处理以及空白对照.结果表明:不同土壤条件下,混菌处理(P7YP17、P7P19YP17、P19YP17)对土壤酸性磷酸酶活性影响总体优于单菌(P7、P19、YP17);高浓度和中浓度处理酶的土壤酸性磷酸活性高于低浓度处理.有机解磷菌及其解磷菌群对巨尾桉根际土壤酸性磷酸酶活性的促进作用强于无机解磷菌处理.
解磷细菌; 酸性磷酸酶活性; 巨尾桉
我国南方地区土壤多为红壤,红壤中可利用磷素含量低,加上磷肥利用率较低,土壤磷素利用已成为限制农林业生产发展,影响生态环境安全的重要因素之一[1].土壤有机磷是土壤全磷的重要组成部分,占土壤全磷的20%~50%,但其必须由土壤磷酸酶转化为无机磷后才能被根系及土壤微生物吸收利用[2].解磷细菌产生的磷酸酶在加速有机磷脱磷,促进难溶有机磷转化为可溶性磷的过程中发挥着巨大作用[3].因此,探究解磷菌肥在促进红壤区土壤磷酸酶活性,尤其起主要作用的酸性磷酸酶活性[4],提高土壤磷素利用并降低土壤施肥成本等方面的作用具有重要意义.然而,微生物菌肥的生产应用至今未取得突破性进展,即使解磷菌在实验室条件下溶磷效果良好,将其施于土壤后解磷菌的溶磷效果可能受到定殖能力、土著微生物、土壤环境的影响而大大降低,甚至无效[5],限制了红壤区土壤改良工作开展.
巨尾桉(Eucalyptusgrandis×E.urophylla)属桃金娘科落叶乔木,具有生长迅速、轮伐期短、耐干旱瘠薄、适应性广、抗逆性强、遗传形状稳定、经济价值高等优点,是福建省营造速生丰产林的优良树种[6].福建省土壤有机质、全氮含量水平中等偏上,但有效磷含量较低[7],受磷限制的宜林地占全省宜林地面积的30.59%[8],制约着对磷素需求较大的巨尾桉在福建省的推广,因此研制专门用于巨尾桉且适应能力强的解磷菌肥成为解决土壤有效磷不足的对策之一[9].俞新玲前期从巨尾桉根际土壤中分离筛选出解磷能力较强的解无机磷细菌P7、P19和解有机磷细菌YP17[10],但这3株解磷细菌在田间条件下对土壤酸性磷酸酶活性的影响尚不明了.鉴于此,本试验以3株解磷细菌作为试验菌种,施用于巨尾桉,从酶学角度分析不同土壤环境下各种解磷细菌处理对巨尾桉根际土壤酸性磷酸酶活性的影响,探索解磷细菌对土壤酸性磷酸酶活性影响过程及机制,为巨尾桉解磷菌肥研制提供技术支持和理论指导.
1 材料与方法
1.1 试验材料
1.1.1 供试菌株 2株解无机磷细菌P7、P19和1株解有机磷细菌YP17.其中,P7为芽孢杆菌属(Bacillussp.),P19、YP17为球形赖氨酸芽孢杆菌(Lysinibacillussphaericus),均从福建省永安国有林场巨尾桉根际土壤提取、筛选、鉴定并保存于福建省森林生态过程与经营重点实验室[10].
1.1.2 供试植物 一年生巨尾桉组培苗由福建省林业科学研究院提供,平均株高15 cm,平均地径1.1 cm.
1.1.3 供试土壤 盆栽用土取自福建农林大学南山和北山(119°23′15″—119°24′39″E,26°07′98″—26°09′07″N),相对海拔低于300 m,属于福建省东部褶皱山地地貌,山势狭长.属于亚热带海洋性湿润气候,年平均气温19.6 ℃(最高气温41.1 ℃,最低气温-2.5 ℃),年均降雨量1 342.5 mm.南山和北山土壤类型为红壤,偏酸性[11].根据土壤植被覆盖类型,试验土壤可分为4类:Ⅰ南山阔叶林土壤(soil from south broad-leaved forest,SBL),主要乔木树种为香樟(Cinnamomumcamphora);Ⅱ南山针叶林土壤(soil from south coniferous forest, SC),主要乔木树种为马尾松(Pinusmassoniana);Ⅲ无植被覆盖的南山红壤(south latosol, SL);Ⅳ北山阔叶林土壤(soil from north broad-leaved forest, NBL),主要乔木树种为相思树(Acacia).2012年3月初在上述样地采集土样,每种样地中随机选取3个样方(5 m×5 m),去除表层枯枝落叶,采集0~20 cm土层土壤运回实验室,风干后过1 mm筛,充分混匀,测定土壤的基本理化性质(表1).
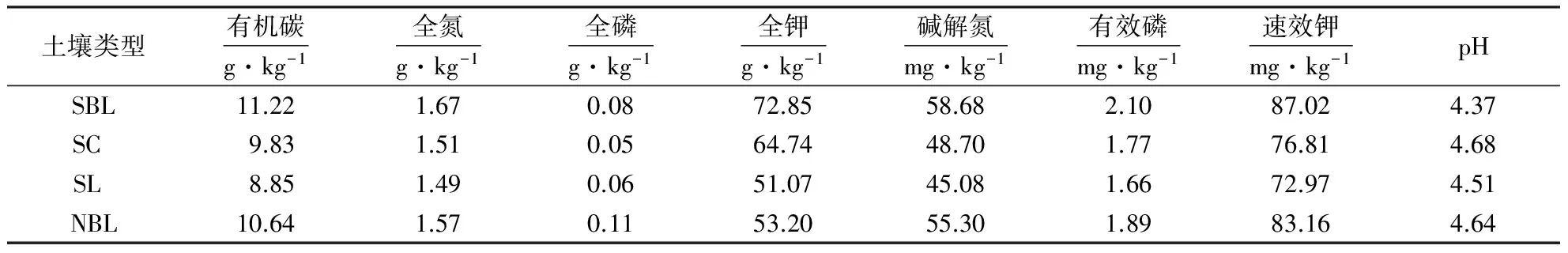
表1 供试土壤基本理化性质Table 1 Basic physical and chemical properties of the soil samples
1.2 试验设计
盆栽试验采用二因素完全随机区组设计,一个因素为低、中、高浓度菌悬浮液;另一因素为PSB组合,共8个处理,用量均为100 mL(表2).
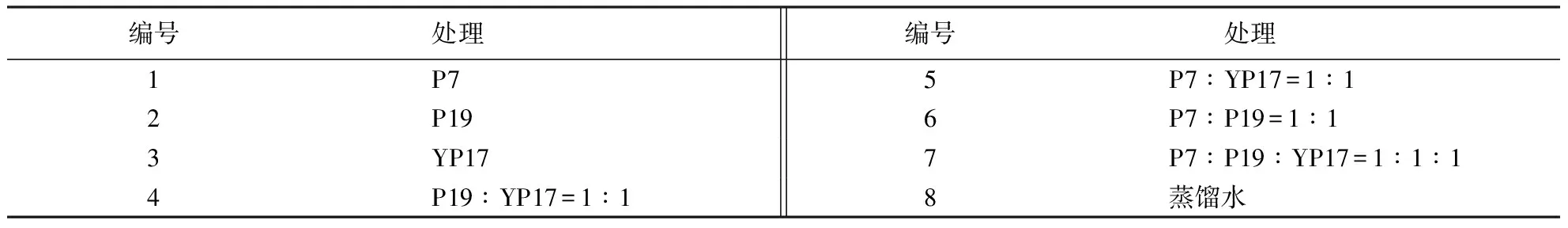
表2 PSB组合设计Table 2 Experimental design for the combination of PSB
1.3 试验方法
1.3.1 幼苗种植 于2012年3月初将巨尾桉幼苗盆栽于福建农林大学森林生态过程与经营重点实验室田间试验地内,所用花盆的规格为高27 cm,上外径30 cm,底外径20 cm,每盆栽种一株巨尾桉幼苗,每组处理设3株重复,幼苗生长期间除进行养护和常规管理外,每周随机轮换盆的位置一次.
1.3.2 菌液制备及接种 菌液制备:将3种解磷细菌在新鲜的牛肉膏蛋白胨培养基平板划线,28 ℃恒温培养至长出形态一致的菌落.用无菌接种环取一环菌均匀涂布在滴有无菌水的载玻片上,自然风干,固定后用草酸铵结晶紫染色液染色,用无菌水水洗涂片后自然风干,在油镜下观察菌体形态是否一致.确定菌体一致即无污染后,挑取新鲜的单菌落接入牛肉膏蛋白胨液体培养基中,在28 ℃恒温振荡培养箱中培养48 h(125 r·min-1).待菌株充分生长后,用紫外分光光度计测定菌株培养液OD660值.当OD660值大于0.5时用无菌水调整各菌液浓度至一致.每个锥形瓶内装有100 mL牛肉膏蛋白胨液体培养基,分别接种上述各菌悬液5 mL,28 ℃、160 r·min-1振荡培养72 h后再次测定OD660值,用超纯水将菌液稀释成1×107、0.5×107、1×106cfu·mL-1(高、中、低浓度)[12-13].
接种:盆栽巨尾桉恢复生长1个月后,在根际土层表面用无菌注射器画圆均匀注射7种菌剂和无菌水,半月浇施一次,共4次.
1.3.3 土样采集 于5月底采集土壤样品,参照剥落分离法[13].将同一处理的土样混合均匀,风干后过1 mm 筛,测定土壤酸性磷酸酶活性.
1.3.4 土壤酸性磷酸酶活性的测定 采用赵兰坡等[14]改进的Hoffman方法.
1.4 数据处理
采用Excel 2013软件进行数据处理和图表绘制,使用SPSS 19.0软件进行单因素方差分析,显著性水平为0.05.
2 结果与分析
2.1 不同解磷细菌处理对SBL土壤酸性磷酸酶活性的影响
SBL土壤中,不同菌液处理下土壤磷酸酶活性表明(图1):在高浓度菌液处理下,除P7、P19YP17处理对土壤磷酸酶活性无影响外,其他菌处理的土壤磷酸酶活性均显著提高,即P7P19>P7YP17>P19>P7P19YP17>YP17>CK>P7>P19YP17;混菌处理的整体效果优于单菌,其中P7P19、P7YP17、P19处理与CK处理差异达极显著水平.

不同小写字母表示显著性差异(P<0.05).图1 不同菌液对SBL土壤酸性磷酸酶活性的影响Fig.1 Effects of bacteria treatments on acid phosphatase activities of SBL soil
在中浓度菌液处理下,除P7P19YP17、P7YP17、P19YP17处理的土壤磷酸酶活性略高于空白,其他菌处理的土壤磷酸酶活性均低于空白,各处理土壤磷酸酶活性为P7P19YP17>P7YP17>P19YP17>CK>P19>YP17>P7P19>P7 ,混菌处理效果优于单菌.除P19与YP17处理间及P7YP17与P19YP17处理间无显著差异外,其他菌处理间差异显著.
在低浓度菌液处理下,各处理土壤磷酸酶活性为P7P19YP17>CK>P19YP17>YP17>P7YP 17>P7P19>P19>P7,除P7P19YP17菌处理的土壤磷酸酶活性显著高于空白,其他菌处理间无显著差异,各菌处理间差异不显著.
方差分析表明,不同菌种、浓度及菌种×浓度之间均存在显著差异(表3).在SBL土壤中,高浓度菌液对土壤酸性磷酸酶活性的促进效果优于中、低浓度,接种菌液浓度较低时解磷细菌无法与土壤微生物在土壤养分竞争上形成优势,因而部分菌株处理在中、低菌浓度下的土壤酸性磷酸酶活性略低于空白(表8).除P7P19YP17处理在3种浓度下都表现出显著促进作用外,其他菌株处理效果较空白差别不显著或略低于空白处理.混菌处理的整体效果优于单菌,可能由于混菌处理更有利于菌株定殖.

表3 不同菌种和浓度下土壤酸性磷酸酶活性的方差分析Table 3 Variance analysis on soil acid phosphatase activities under different bacteria at different concentrations
2.2 不同解磷细菌处理对SC土壤酸性磷酸酶活性的影响
在SC土壤中,不同菌液处理下土壤酸性磷酸酶活性表现如下(图2):在高浓度菌液处理下,各处理土壤酸性磷酸酶活性为P7P19>P7YP17>P7P19YP17>P19>CK>P19YP17>P7>YP17,混菌处理的整体效果优于单菌,各单菌处理对土壤酸性磷酸酶活性的增强效果不显著,P7、YP17菌处理效果略低于空白,混菌处理较空白显著增强了土壤酸性磷酸酶活性.
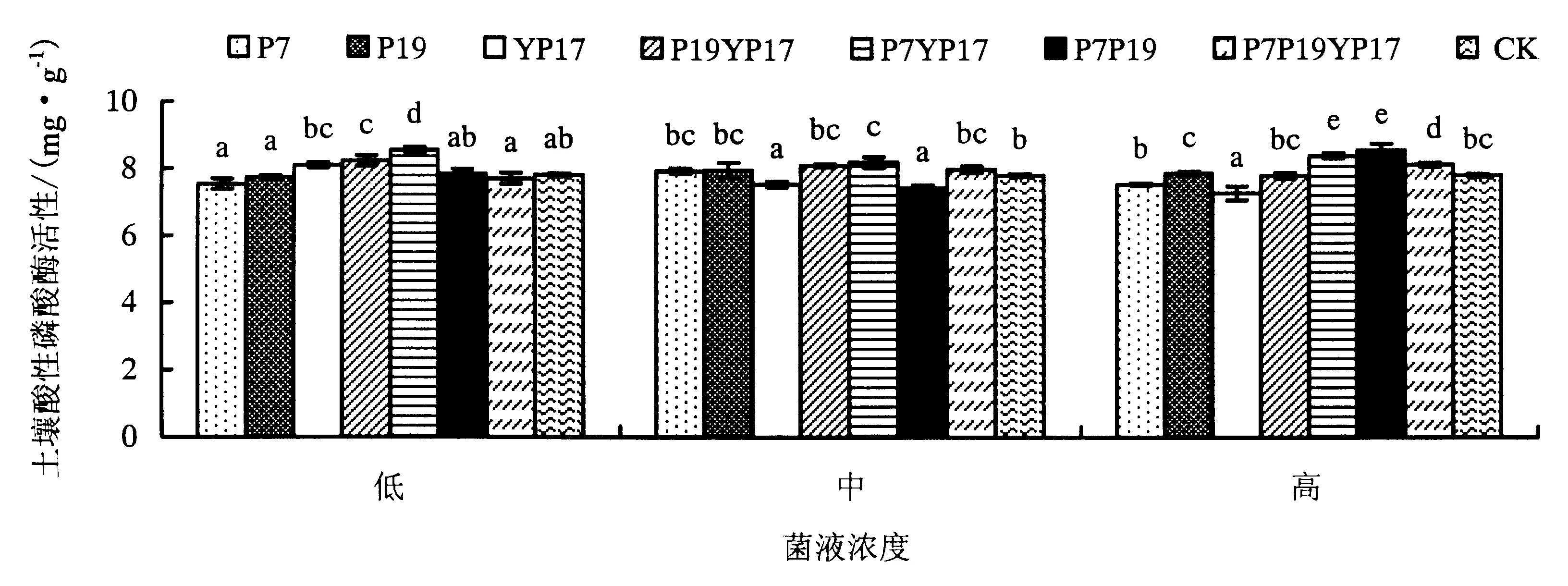
不同小写字母表示显著性差异(P<0.05).图2 不同菌液浇施对SC土壤酸性磷酸酶活性的影响Fig.2 Effects of bacteria treatments on SC soil acid phosphatase activities
在中浓度菌液处理下,各处理土壤酸性磷酸酶活性为P7YP17>P19YP17>P7P19YP17>P19>P7>CK>YP17>P7P19,除单菌YP17与混菌P7P19处理的酸性磷酸酶活性低于空白外,其他菌处理下的土壤酸性磷酸酶活性均有显著提高,混菌处理效果优于单菌.
在低浓度菌液处理下,除单菌P7、P19以及混菌P7P19YP17处理下的土壤酸性磷酸酶活性低于空白处理,其他菌处理都有效提高了土壤酸性磷酸酶活性,各处理土壤酸性磷酸酶活性为P7YP17>P19YP17>YP17>P7P19>CK>P19>P7P19YP17>P7,混菌处理的整体效果优于单菌,尤其是P7YP17、P19YP17菌处理与CK差异显著.
方差分析表明,菌浓度对SC土壤酸性磷酸酶活性的影响差异不显著,不同菌种和菌种×菌浓度的相互影响差异显著(表4).在SC土壤中,高浓度菌液和中浓度菌液对土壤酸性磷酸酶活性的促进效果优于低浓度菌液(表8).混菌处理效果优于单菌,P7YP17处理在各浓度下都表现出较高的土壤酸性磷酸酶活性,其次为P19YP17.

表4 不同菌种和浓度下土壤酸性磷酸酶活性的方差分析Table 4 Variance analysis on soil acid phosphatase activities under different bacteria at different concentrations
2.3 不同解磷细菌处理对SL土壤酸性磷酸酶活性的影响
在SL土壤中,不同菌液处理下土壤酸性磷酸酶活性表现如下(图3):在高浓度菌液处理下,各处理土壤酸性磷酸酶活性为CK>P7YP17>YP17>P7>P7P19YP17>P19YP17>P19>P7P19,各菌处理下的土壤酸性磷酸酶活性略低于CK处理,解磷细菌处理未能提高SL土壤酸性磷酸酶活性.
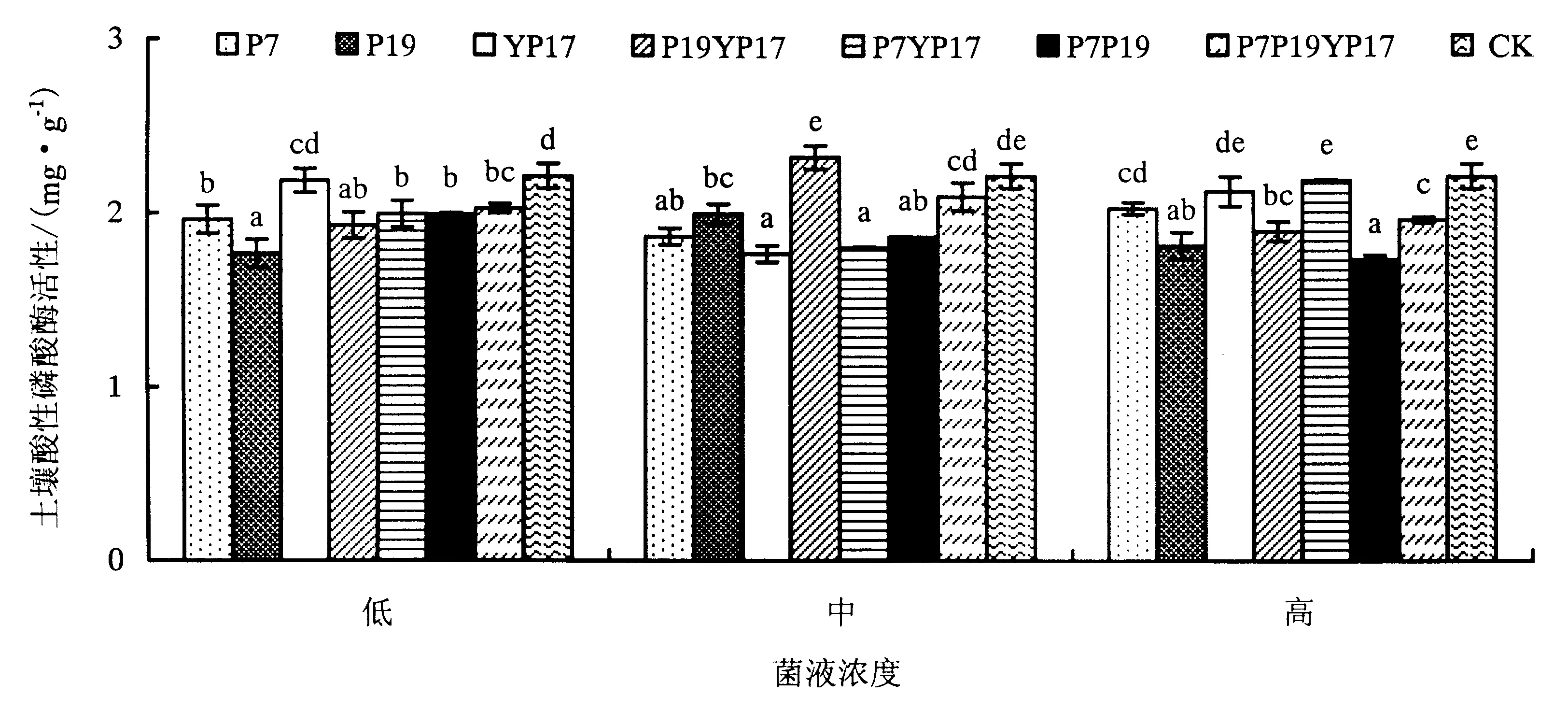
不同小写字母表示显著性差异(P<0.05).图3 土壤中不同菌液对SL土壤酸性磷酸酶活性的影响Fig.3 Effects of bacteria treatments on SL soil acid phosphatase activities
在中浓度菌液处理下,各处理土壤酸性磷酸酶活性为P19YP17>CK>P7P19YP17>P19>P7>P7P19>P7YP17>YP17,除P19YP17菌处理下的土壤酸性磷酸酶活性显著高于CK处理外,其他处理效果均低于CK.在低浓度菌液处理下,各处理土壤酸性磷酸酶活性为CK>YP17>P7P19YP17>P7YP17>P7P19>P7>P19YP17>P19,说明无论单菌还是混菌处理均未能提高SL土壤酸性磷酸酶活性.
方差分析表明,菌浓度对SL土壤酸性磷酸酶活性的影响差异不显著,不同菌种和菌种×菌浓度的相互影响差异显著(表5).在SL土壤中,在各菌液浓度下,大部分菌液处理下的土壤酸性磷酸酶活性低于CK处理(表8),促进土壤酸性磷酸酶活性效果不明显.4种土壤中,SL土壤有机质、氮含量最低,一方面土壤环境不利于诱导酸性磷酸酶的产生,另一方面也可能因土壤中存在某种拮抗微生物,使得解磷细菌无法与根际土壤微生物有效竞争养分和生态位,从而不利于其在SL土壤中发挥解磷作用.

表5 不同菌种和浓度下土壤酸性磷酸酶活性的方差分析Table 5 Variance analysis on soil acid phosphatase activities under different bacteria and different concentrations treatments
2.4 不同解磷细菌处理对NBL土壤酸性磷酸酶活性的影响
在NBL土壤中,不同菌液处理下土壤酸性磷酸酶活性(图4)表现如下:在高浓度菌液处理下,各处理土壤酸性磷酸酶活性为P7YP17>P19YP17>P7P19>P7P19YP17>CK>P19>YP17>P7,混菌处理尤其是菌P7YP17、P19YP17和P7P19处理显著提高土壤酸性磷酸酶活性.
在中浓度菌液处理下,各处理土壤酸性磷酸酶活性为YP17>P7P19YP17>P7>P19YP17>P7YP17>CK>P7P19>P19,各菌处理下的土壤酸性磷酸酶活性差异显著,除P7P19与P19菌处理略低于CK处理外,其他菌处理都增强了酸性磷酸酶活性,尤其是YP17、P7P19YP17、P7与P19YP17菌处理的活性显著高于CK处理.
在低浓度菌液处理下,各处理土壤酸性磷酸酶活性为P7P19YP17>P19YP17>P7YP17>YP17>P7>CK>P19>P7P19,混菌处理的整体效果优于单菌,除P19与P7P19菌处理外,其他菌处理下的土壤酸性磷酸酶活性显著高于CK处理.
方差分析表明,不同菌液浓度、菌种及浓度×菌种之间均具有显著性差异(表6).在NBL土壤中,各菌浓度处理下的土壤酸性磷酸酶活性差异不显著(表8).混菌处理效果优于单菌,混菌P19YP17和P7P19YP17在3种浓度下表现均较优,其次为P7YP17菌.
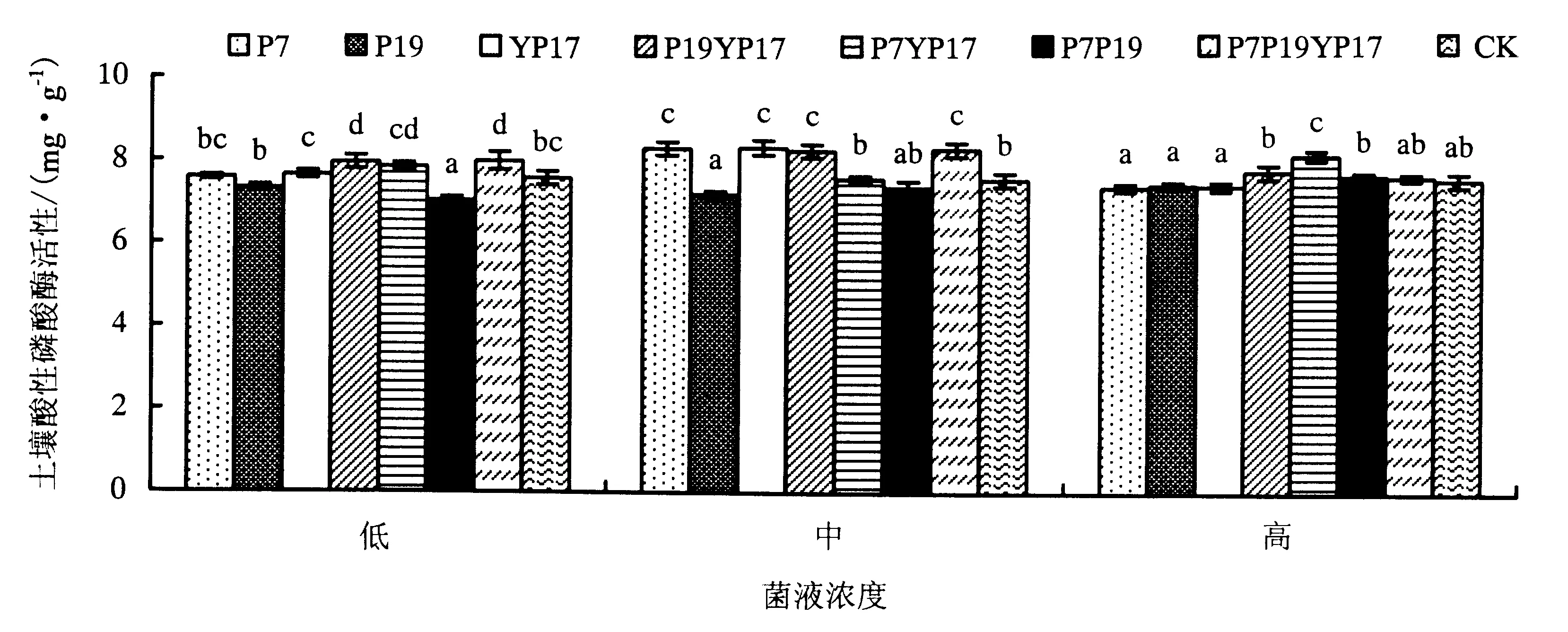
不同小写字母表示显著性差异(P<0.05).图4 不同菌液对NBL土壤酸性磷酸酶活性的影响Fig.4 Effects of bacteria treatments on NBL soil acid phosphatase activities

表6 不同菌种和浓度下土壤酸性磷酸酶活性的方差分析Table 6 Variance analysis on soil acid phosphatase activities under different bacteria and different concentrations treatments
2.5 不同浓度和菌种解磷细菌处理间的交互效应
结果表明,不同土壤和菌种处理对土壤酸性磷酸酶活性影响差异有所不同.在SBL土壤中,除单菌P7与混菌P7P19YP17处理间有显著差异外,其他菌种间的差异均不显著;且除混菌P7P19YP17、P7YP17处理下的土壤酸性磷酸酶活性高于CK处理外,其他菌处理下的土壤酸性磷酸酶活性都低于CK处理.在SC土壤中,除单菌P7、YP17与混菌P7YP17间具有显著差异外,其他菌种之间差异不显著;且除菌P7、YP17处理下的土壤酸性磷酸酶低于CK处理外,其他菌处理下的土壤酸性磷酸酶活性都高于CK处理,其中P7YP17、P19YP17、P7P19及P7P19YP17处理下的效果最佳.在SL土壤中,除菌P19、P7P19与CK处理间有显著差异外,其他菌种间差异都不显著,且所有菌处理下的土壤酸性磷酸酶活性都低于CK处理.在NBL土壤中,除菌P7、P7P19与菌P19YP17、P7P19YP17处理间有显著差异外,其他菌种之间差异都不显著,且除菌P19、P7P19处理下的土壤酸性磷酸酶活性低于CK处理外,其他菌处理下的土壤酸性磷酸酶活性都高于CK处理,其中P19YP17、P7P19YP17、P7YP17处理下的效果最佳(表7).
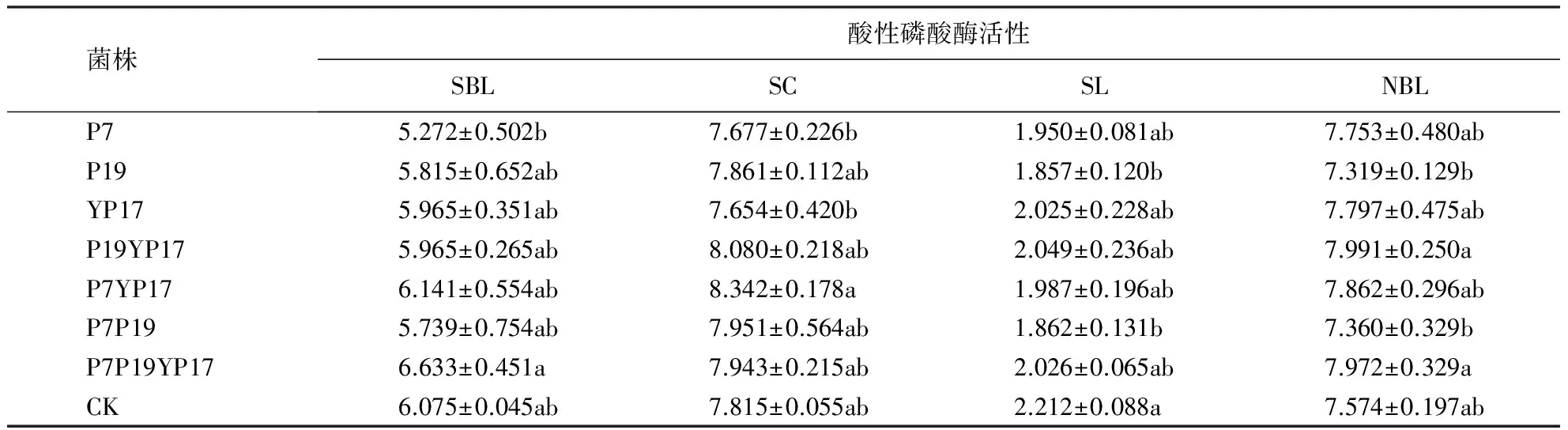
表7 不同菌种对不同土壤酸性磷酸酶活性的影响1)Table 7 Effect of different bacterial treatments on different soil acid phosphatase activity mg·g-1 ·h-1
1)同列内不同字母表示差异显著(P<0.05).
不同土壤条件下不同菌液浓度对土壤酸性磷酸酶活性的影响有所差异.在SBL土壤中,高浓度菌液处理的土壤酸性磷酸酶活性与其他处理间存在显著差异,且高浓度菌液处理下的土壤酸性磷酸酶活性高于其他处理.在SC土壤中,低浓度菌液处理的土壤酸性磷酸酶活性与其他处理间具显著差异,高浓度和中浓度菌液处理下的土壤酸性磷酸酶活性较CK处理略有提高.在SL土壤中,各浓度菌液处理下的土壤酸性磷酸酶活性都显著低于CK处理.在NBL土壤中,各浓度菌液处理间差异不显著,但各浓度菌液处理下的土壤酸性磷酸酶活性都高于CK处理,以中浓度菌液处理下的效果最佳(表8).
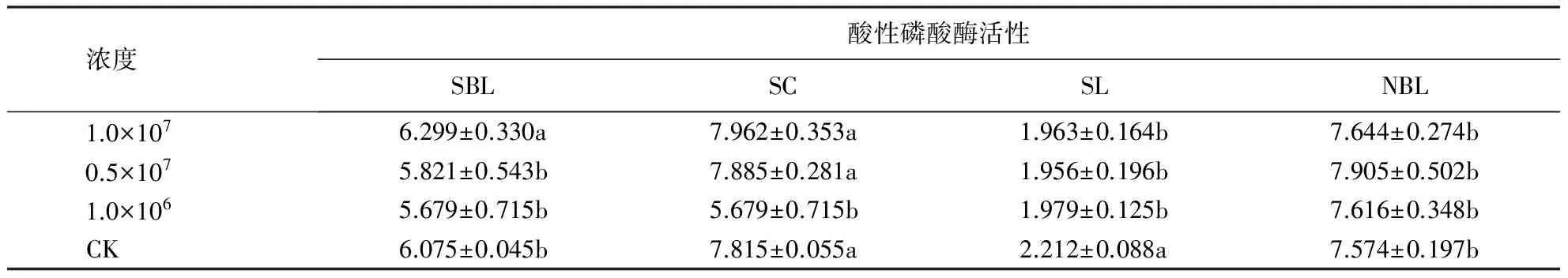
表8 不同菌液浓度对不同土壤酸性磷酸酶活性的影响1)Table 8 Effect of different bacterial concentration treatments on different soil acid phosphatase activity mg·g-1 ·h-1
1)同列内不相同字母表示差异显著(P<0.05).
3 讨论
不同菌种处理对土壤酸性磷酸酶活性的影响结果表明,混菌处理对土壤酸性磷酸酶活性的影响优于单菌,尤其混菌P7YP17、P7P19YP17和P19YP17处理效果最佳.余旋等[13]同样发现混合菌解磷菌剂较单一解磷菌种对美国山核桃根际土壤磷酸酶活性的影响更大.说明从巨尾桉根际土壤筛选出的3株解磷细菌组成的混合菌群适应土壤环境的能力更强,从而能够更好地发挥解磷作用.不同菌剂浓度对土壤酸性磷酸酶活性的影响结果表明,高浓度和中浓度菌液处理下的土壤酸性磷酸酶活性高于低浓度菌液处理.李文华等[15]发现杭州湾潮滩湿地土壤磷酸酶活性与有机磷细菌数量呈显著的正相关(r=0.58,P<0.01),推断有机磷细菌数量是影响磷酸酶活性的主要因素之一,与本试验结论一致.可能是由于在同一磷素水平下,解磷细菌浓度越高,解磷细菌对土壤磷素水平的需求就越高,从而刺激解磷细菌分泌更多的酸性磷酸酶分解有机磷,以满足解磷细菌自身及植物生长需求.
不同菌种以及不同菌浓度处理未能提高SL土壤酸性磷酸酶活性.耿玉清等[16]在研究北京八达岭地区土壤磷酸酶活性与有机质、氮关系时表明,土壤磷酸酶活性与土壤有机碳、氮有显著的相关性(r分别为0.715和0.619).本试验所用SL土壤有机质、氮含量最低,因此SL土壤有机质及氮含量不足,不利于诱导磷酸酶的产生.笔者前期试验发现,施加解磷菌剂未能提高SL土壤有效磷含量[17],可能是因土壤中存在拮抗微生物[5],使得解磷细菌无法与根际土壤微生物有效竞争养分和生态位,不利于其在SL土壤中形成优势菌群,发挥解磷作用[13].
一般认为解有机磷细菌是靠细菌分泌胞外磷酸酶发挥酶解作用[18],当磷成为微生物生长的主要限制因子,而有机磷分子不能透过细胞膜时,微生物会释放胞外磷酸酶,将有机磷转化为可溶性无机磷[19-20].俞新玲[10]发现解有机磷细菌YP17培养液溶磷量与pH值不存在显著相关性(P<0.01,R2=0.444),推测解有机磷细菌YP17主要通过分泌磷酸酶矿化有机磷,有机酸分泌并非其主要的解磷机制.在本试验中,单菌YP17及混菌处理P7P19YP17、P7YP17、P19YP17对土壤酸性磷酸酶活性的促进作用均优于单菌P7、P19及混菌P7P19处理,说明大部分酸性磷酸酶是解有机磷细菌YP17分泌的,而非解无机磷细菌P7、P19分泌的,进一步验证了俞新玲的推断.李文红等[21]在研究西湖沉积物解磷细菌的解磷能力时发现,有机解磷细菌可通过分泌磷酸酶将卵磷脂水解为甘油、脂肪酸、磷酸和胆碱等,因此本试验推断解有机磷细菌YP17的主导解磷机制可能是通过分泌酸性磷酸酶实现的.
一般认为解无机磷细菌的解磷机制是有机酸的螯溶作用或质子的酸溶作用[22-23].课题组前期研究发现解无机磷细菌P7、P19培养液溶磷量与pH值极显著负相关(P<0.01,R2=0.692),且P7(pH=4.26)和P19(pH=4.32)的pH值均比空白(pH=6.73)低2个pH值左右,说明解无机磷细菌的解磷机制与菌体产酸有很大的关系[10].在本试验中,单菌P7、P19及混菌P7P19对土壤酸性磷酸酶活性无显著促进作用,因此推断解无机磷细菌P7、P19的解磷机制是在代谢过程中分泌有机酸或质子通过酸化、螯合和离子交换等过程而使难溶性磷酸盐溶解,并非通过分泌酸性磷酸酶发挥酶解作用.
本试验设计的高浓度(1×107cfu·mL-1)和中浓度(0.5×107cfu·mL-1)混合菌剂 P7YP17、P7P19YP17和P19YP17,在一定程度上提高了土壤有效磷含量,同时增加土壤有机碳、氮含量,更好地诱导酸性磷酸酶的产生.因此,研发巨尾桉微生物菌肥可考虑选择最佳菌株配制成混合菌肥,并加强林间试验,实行动态监测,全面佐证菌株的解磷效果,从而达到推广应用的目的.
[1] 盛荣,肖和艾,谭周进,等.土壤解磷微生物及其磷素有效性转化机理研究进展[J].土壤通报,2010,41(6):1 505-1 510.
[2] 宋勇春,李晓林,冯固.泡囊丛枝(VA)菌根对玉米根际磷酸酶活性的影响[J].应用生态学报,2001,12(4):593-596.
[3] CHEN Y P, REKHA P D, ARUN A B, et al. Phosphate solubilizing bacteria from subtropical soil and their tricalcium phosphate solubilizing abilities[J]. Applied Soil Ecology, 2006,34(1):33-41.
[4] 和文祥,蒋新,余贵芬.生态环境条件对土壤磷酸酶的影响[J].西北农林科技大学学报(自然科学版),2003,31(2):81-83.
[5] 于群英,马忠友,汪建飞,等.磷细菌筛选及其对土壤无机磷转化的影响[J].水土保持学报,2012,26(5):103-107.
[6] 祁述雄,王洪峰,文应乾.桉树栽培实用技术[M].北京:中国林业出版社,2006:15-17.
[7] 福建省土壤普查办公室.福建土壤[M].福州:福建科学技术出版社,1991:107.
[8] 曹榕彬.基于GIS技术的福建省林地适宜性评价[D].福州:福建农林大学,2005.
[9] 侯佳奇,李晔,贾璇,等.解磷微生物肥料的研究与进展[J].再生资源与循环经济,2013,6(12):31-35.
[10] 俞新玲.桉树土壤高效解磷菌的筛选及其对桉树生长的影响[D].福州:福建农林大学,2011.
[11] 叶宝鉴,兰思仁,李明河,等.福建农林大学校园植物区系特征[J].福建农林大学学报(自然科学版),2013,42(1):51-56.
[12] 谢安强.按树内生菌分离筛选及对宿主生长和抗逆性的影响[D].福州:福建农林大学,2010.
[13] 余旋,朱天辉,刘旭.不同解磷菌剂对美国山核桃根际微生物和酶活性的影响[J].林业科学,2012,48(2):117-123.
[14] 赵兰坡,姜岩.土壤磷酸酶活性测定方法的探讨[J].土壤通报,1986,17(3):138-141.
[15] 李文华,邵学新,吴明,等.杭州湾潮滩湿地土壤碱性磷酸酶活性分布及其与磷形态的关系[J].环境科学,2013,33(12):3 341-3 349.
[16] 耿玉清,白翠霞,赵广亮,等.土壤磷酸酶活性及其与有机磷组分的相关性[J].北京林业大学学报,2008,30(S2):139-143.
[17] 崔邢,张亮,林勇明,等.不同土壤条件下解磷菌处理对巨尾桉土壤有效磷含量的影响[J].应用与环境生物学报,2015,21(4):740-746.
[18] 王琛,张学雷,崔龙波,等.印度洋可培养解有机磷细菌的多样性及解磷特性[J].微生物学通报,2015,42(10):1 847-1 857.
[19] 王琛,田欣欣,曲凌云.九龙江口解有机磷细菌的解磷特性[J].海洋环境科学,2013,32(5):736-740.
[20] 卫星,徐鲁荣,张丹,等.一株耐硝酸盐的巨大芽孢杆菌溶磷特性研究[J].环境科学学报,2015,35(7):2 052-2 058.
[21] 李文红,施积炎.西湖沉积物中解磷菌的分离纯化及其解磷能力[J].应用生态学报,2006,17(11):2 112-2 116.
[22] 韩玉竹,赵建军,曾兵,等.多花黑麦草根际解磷菌的分离及解磷能力测定[J].草地学报,2011,19(5):766-770.
[23] HAMEEDA B, REDDY Y H K, RUPELA O P, et al. Effect of carbon substrates on rock phosphate solubilization by bacteria from composts and macrofauna[J]. Current Microbiology, 2006,53(4):298-302.
(责任编辑:苏靖涵)
Effect of phosphate-solubilizing bacteria on soil acid phosphatase activity ofEucalyptusgrandis×E.Urophyllaplantation
CUI Xing1, ZHANG Liang1, LIN Yongming1,2, WU Chengzhen1,2,3, XIE Anqiang1,2, CHEN Can1,2, LI Jian1,2, HONG Tao1,2
(1.College of Forestry, Fujian Agriculture and Forestry University, Fuzhou, Fujian 350002, China; 2.Key Laboratory for Forest Ecosystem Process and Management of Fujian Province, Fuzhou, Fujian 350002, China; 3.College of Ecology and Resource Engineering of Wuyi University, Nanping, Fujian 354300, China)
To investigate the efficacy of phosphate solubilizing bacteria agent on improving soil acid phosphatase activity in the field condition, inorganic phosphate-solubilizing bacteria strains P7, P19 and organic phosphate-solubilizing bacteria strain YP17 were applied individually or in mixture toEucalyptusgrandis×E.urophyllaseedlings which were planted in 4 kinds of forest soil. The bacteria agents were formulated in 3 concentrations, which includied 1×106cfu·mL-1(low), 0.5×107cfu·mL-1(medium), 1×107cfu·mL-1(high), together with water as the control. The results showed that the mixture bacteria (P7YP17, P7P19YP17, P19YP17) accelerated soil acid phosphatase activity better than single bacteria (P7, P19, YP17) for all types of soil. Bacteria agents in medium to high concentrations were generally more effective than those in low concentration. To summarize, mixture of organic and inorganic phosphate-solubilizing bacteria is applicable to improving soil acid phosphatase activity.
phosphate solubilizing bacteria; acid phosphatase activity;Eucalyptusgrandis×E.urophylla
2016-05-01
2016-09-14
高等学校博士学科点专项科研基金(20123515110011);福建省科技厅重大专项(2012NZ001)资助.
崔邢(1991-),女,硕士研究生.研究方向:自然资源管理.Email:cuixinghappy@163.com.通讯作者吴承祯(1970-),男,教授,博士生导师.研究方向:森林生态学.Email:fjwcz@126.com.
S714
A
1671-5470(2017)03-0343-08
10.13323/j.cnki.j.fafu(nat.sci.).2017.03.018

