不同真菌发酵对墨江紫米多酚及其抗氧化性影响的比较
黄士淇,邢晨,蔡圣宝
(昆明理工大学 云南省食品安全研究院,云南 昆明,650500)
不同真菌发酵对墨江紫米多酚及其抗氧化性影响的比较
黄士淇,邢晨,蔡圣宝*
(昆明理工大学 云南省食品安全研究院,云南 昆明,650500)
研究探讨了墨江紫米中花色苷的种类,以及经过5种常用真菌(米曲霉疏展变种2083、米曲霉2011、米根霉3005、米根霉3079以及少孢根霉3152)发酵的墨江紫米中总酚含量、总黄酮含量、花色苷含量以及抗氧化性的变化。墨江紫米中含有4种花色苷,分别是矢车菊素-3,5-二葡萄糖苷、矢车菊素-3-葡萄糖苷、矢车菊素-3-芸香糖苷和芍药花青素-3-葡萄糖苷。墨江紫米的总酚含量、总黄酮含量、花色苷含量以及抗氧化性受到发酵菌株和发酵时间的影响,其中米根霉3005、少孢根霉和米曲霉疏展变种在4天发酵过程中均可以显著提高墨江紫米的上述指标 (P<0.05)。结果表明,墨江紫米,尤其是经真菌发酵一定时间的墨江紫米,可能是一个天然抗氧化剂的良好来源,可以作为一种营养品或功能性食品加以开发利用。
墨江紫米;发酵;花色苷;酚类物质;抗氧化性
在正常生理条件下,体内的自由基产生和清除处于一个动态平衡中。然而,一些外在和内在因素会打破这个平衡,产生过多的自由基,从而导致体内氧化应激的产生[1]。在氧化应激状态下,过多的活性氧(Reactive oxygen,ROS)或活性氮(Nitrogen species,RNS)自由基会攻击体内的生物分子(蛋白质、脂质和DNA),使得这些生物分子失活和突变,从而诱发多种疾病,例如,癌症、神经退行性疾病、心血管疾病和糖尿病等[1-2]。通过饮食补充抗氧化剂可以有效地清除体内过多的自由基,降低相关疾病的发病率[3]。
植物中含有丰富的抗氧化性物质,在这些物质中,植物多酚由于其优异的抗氧化性受到人们的广泛关注。植物多酚种类繁多,包括酚酸类、类黄酮类、芪类、花色苷类、木脂素类以及鞣花酸类[4]。研究表明,这些多酚类物质可以通过提供电子或者氢原子清除多种自由基,包括单线态氧、羟基自由基、过氧自由基以及过氧亚硝酸[5],其作用机理主要是通过清除自由基中断脂质氧化链式反应或者是作为金属螯合剂抑制Fe3+还原从而减少羟基自由基的产生[6]。
墨江紫米是云南省特色珍贵大米,然而目前对于墨江紫米的研究很少,特别是关于其多酚花色苷的研究未见报道。另外,由于墨江紫米种皮较为坚韧,难以煮透,口感不佳,影响了墨江紫米食品的开发。而且,大量研究表明,谷物中的多酚类物质主要存在其种皮中,并且大都数以结合状态存在,较难被人吸收和利用[7]。利用微生物发酵,特别是丝状真菌,不仅可以柔化谷物的种皮细胞壁,而且还可以显著提高谷物的多酚含量和抗氧化性[8-9]。因此,本研究的目的之一是鉴定出墨江紫米中主要的花色苷种类,另一个目的就是探讨5种不同真菌发酵过程中,墨江紫米中多酚含量、黄酮含量、花色苷含量以及抗氧化性的变化规律,以期为墨江紫米食品的开发提供理论基础。
1 材料与方法
1.1 材料与试剂
墨江紫米购自云南省墨江县粮食加工厂。DPPH、ABTS、芦丁、没食子酸购自Sigma-Aldrich公司。色谱乙腈和Folin-Ciocalteu购自Merck公司。其他试剂均为能获得的最高纯度。5株丝状真菌米曲霉疏展变种2083(Aspergillusoryzaevar.effuses2083)、米曲霉2011 (AspergillusOryzae2011)、米根霉3005 (RhizopusOryzae3005)、米根霉 3079 (RhizopusOryzae3079)以及少孢根霉3152 (Rhizopusoligosporus3152)购自中国工业微生物菌种保藏管理中心,这5种真菌在亚洲被广泛应用于发酵食品的生产和加工,其生长和发酵特性可查询官方信息资料。真菌接种到PDA培养基上后,在30 ℃条件下培养5d,使其长出孢子,然后用0.9%NaCl生理盐水洗下孢子制备成孢子悬液。
1.2 墨江紫米发酵及提取物制备
发酵方法参考已有文献[10]并稍加修改,具体如下:将紫米在清水中浸泡8 h后沥干,再用粉碎机打碎后装入500 mL锥形瓶中,每瓶装入30 g,然后于121 ℃灭菌15 min。灭菌结束后于超净台中冷却至室温后,将孢子悬液按照106孢子/g紫米干重的量加入到每瓶样品中并同时加入15 mL灭菌的生理盐水,搅拌均匀后于30 ℃下培养发酵,每隔24 h取样1次,不加孢子悬液的一组样品作为对照组。所有样品冷冻干燥后备用。
样品提取方法参考之前的文献报道[10]并稍加修改。发酵前后的墨江紫米样品先用80%乙醇于40 ℃下,用超声辅助提取30 min,然后用中速滤纸过滤。收集滤液后,滤饼利用相同条件再提取1次,分别合并每个样品的滤液。所有滤液分别利用旋转蒸发仪在45 ℃下减压浓缩后冻干成相应的样品提取物。
1.3 总酚含量测定
发酵前后墨江紫米提取物中总酚含量的测定采用Folin-Ciocalteu法[11]并稍加修改。首先将1.0 mL适当稀释的各提取物与1.0 mL 的Folin-Ciocalteu试剂进行混匀,再加入1.5 mL的 20% Na2CO3,用蒸馏水补足到10.0 mL。混合溶液振荡均匀后放置于70 ℃水浴中反应10 min。反应结束后,将所有反应溶液静置使其冷却至室温,然后利用多功能酶标仪在765 nm波长下分别测定各反应液的吸光值。以没食子酸标准品制作标准曲线,每个样品的总酚含量表示为:mg没食子酸/100 g干紫米质量,重复3次。
1.4 总黄酮含量测定
发酵前后墨江紫米提取物中总黄酮含量的测定方法参考已有文献[8,12]并稍加修改。取1 mL稀释样品和0.3 mL NaNO2分别加入到4 mL的蒸馏水中,然后再分别加入0.3 mL AlCl3和2 mL NaOH (1 mol/L),最后用蒸馏水补足到10 mL,反应液在室温条件下静置30 min。反应结束后,在510 nm下测定反应液的吸光值。以芦丁作为标准曲线,所有样品中的总黄酮含量表示为:mg芦丁/100 g干紫米质量,重复3次。
1.5 总花色苷含量测定
采用pH示差法[13]测定发酵前后墨江紫米中总花色苷的含量。具体操作如下:首先分别用pH1.0的0.03 mol/L KCl和pH 4.5的乙酸钠稀释10倍。然后用分光光度计在520 nm和700 nm下分别测定每个稀释液的吸光值,以蒸馏水为空白对照。样品中的总花色苷含量用以下公式计算,以矢车菊 3-葡萄糖苷含量表示:
矢车菊 3-葡萄糖苷含量(mg/g)=(A×MW×DF×V×103)/(ε×L×m)
(1)
A=(A520-A700)pH = 1- (A520-A700)pH=4.5
(2)
式(1)中:MW为矢车菊 3-葡萄糖苷的摩尔质量,449.2g/mol;DF= 10为稀释因子;V为样品母液的体积,L;ε为矢车菊 3-葡萄糖苷的摩尔消光系数,26L/(mol·cm);L为比色皿的光程长,1 cm;m为待测样品质量,g。所有样品测试重复3次。
1.6 UPLC-ESI-HRMS/MS分析墨江紫米中花色苷种类
采用Thermo Fisher Ultimate 3000 UPLC色谱系统和Thermo Fisher C18(2.1 mm×100 mm, 3μm)色谱柱对墨江紫米的花色苷进行分离。流动相分别为2.0 %甲酸水(A)和乙腈(B),流动相程序为:0~5 min, 5% B; 5~10 min, 5%~15% B; 10~20 min, 15%~20% B; 20~22 min, 20%~85% B; 22~23 min, 85%~5% B; 23~28 min, 5% B。样品进样体积为2 μL,流速为0.2 mL/min,柱温维持在35 ℃。再利用Thermo Fisher的Q-Exactive Orbitrap质谱正离子模式来获得墨江紫米花色苷的ESI-HRMS/MS数据。主要的质谱参数如下:鞘气流速为30 L/min;辅助气流速为8 L/min;离子原温度350 ℃;毛细管温度320 ℃;喷雾电压为3.2 kV;全扫范围为100~1 000 m/z。
1.7 发酵前后墨江紫米的抗氧化性测定
1.7.1 DPPH自由基清除能力测定
DPPH自由基清除能力测定的方法参考已有的文献[12]并稍作修改。首先取0.5 mL 样品,然后加入2.0 mL的DPPH(0.1 mmol/L)试剂后,进行充分混合。混合均匀后的反应液于室温条件下避光静置30 min使其充分反应,然后在517 nm波长下测定反应液的吸光值A1。同时,用0.5 mL 甲醇替代样品加入到2.0 mL DPPH 试剂中,于相同条件下测定其吸光值A2。发酵前后紫米样品对DPPH自由基的清除能力采用以下公式计算:
DPPH自由基清除率/%=[(A2-A1) /A2]× 100
1.7.2 ABTS·+清除能力测定
发酵前后墨江紫米样品对ABTS·+的清除能力测定方法参考已报道的文献[12]并稍作修改。实验前需配制ABTS·+的母液,具体配制方法为:将浓度为7 mmol/L 的ABTS溶液和浓度为2.45 mmol/L 的过硫酸钾进行等体积混合,混合溶液在避光和室温条件下放置12 h从而生成ABTS·+的自由基,备用。每次实验时,先用甲醇将配制好的ABTS·+母液进行适当地稀释从而获得ABTS·+工作液。然后将一定浓度的发酵前后墨江紫米样品(0.3 mL)与ABTS·+工作液(2.7 mL)进行混合,摇匀后在30 ℃下孵育6 min。待孵育结束后在多功能酶标板上于30 ℃和745 nm波长的条件下测定反应液的吸光值A1。另外,用0.3 mL甲醇代替样品,在相同条件下,与2.7 mL的ABTS·+工作液进行反应,并测量其吸光值A2。发酵前后紫米样品对ABTS·+自由基的清除能力采用以下公式计算:
ABTS·+的清除率/%=[(A2-A1) /A2]× 100
1.8 数据统计分析
所有试验操作均重复测定3次,结果表示为平均值±标准偏差,所有结果均利用单因素方差分析(one-way ANOVA)进行显著性分析,P<0.05被认为有显著性差异(采用Tukey 检测),统计学分析和作图均在Origin 8.5软件中完成。
2 结果与讨论
2.1 发酵过程中墨江紫米的总酚含量变化
谷物的种皮中富含多酚类物质,而且这些多酚类物质大多数都是以结合状态存在的[7]。前期已有很多研究报道表明谷物中的结合多酚可以通过微生物发酵的方式释放出来,成为游离态可提取多酚[8-9]。在亚洲,多种丝状真菌被认为是安全的且用来进行发酵食品的生产。本研究中所使用的5种丝状真菌是发酵食品生产中常用的真菌,这些真菌在发酵过程中能够产生多种具有较高活性的水解酶,如酯酶、纤维素酶、淀粉酶以及蛋白酶[14],这些水解酶能够将结合态的多酚水解成游离态,从而可以显著增加可提取和可利用多酚的量。
本试验采用的5种丝状真菌发酵墨江紫米过程中总酚含量变化结果见如图1。如图1所示,不同丝状真菌发酵过程中,墨江紫米的总酚含量变化规律不同。米根霉3005在发酵的4天中,只有第2天和第4天发酵样品中总酚含量有显著上升(P<0.05),但上升幅度不大。而米根霉3079发酵第1天时,墨江紫米中总酚含量还显著下降(P<0.05),在随后的3天发酵过程中,总酚含量逐渐上升,发酵第4天总酚含量上升约为1.9倍。墨江紫米在少孢根霉发酵的前2天总酚含量显著下降(P<0.05),发酵第三天和第四天总酚含量分别上升约1.5倍和2.3倍。另外, 米曲霉发酵前3天,墨江紫米的总酚含量没有显著变化(P>0.05),发酵第4天有显著升高但同样上升幅度不大。对于米曲霉变种来说,在发酵第1天时,紫米总酚含量就有显著升高,随后出现显著下降,但在发酵的第4天时,总酚含量上升了约1.8倍。从本实验结果可以看出,紫米多酚含量的变化与发酵菌种以及发酵时间都有关系,因为不同菌种不同时间段产生的酶的量、种类和活力都是不一样的,这些差异也就造成了不同处理的发酵紫米多酚含量不同。

图1 发酵过程中墨江紫米的总酚含量Fig.1 The total phenolics content of Mojiang purple rice (Oryza sativa L.) during fermentation注:柱状图中不同字母表示具有显著差异(P<0.05)
2.2 发酵过程中墨江紫米的总黄酮含量变化
5种不同丝状真菌发酵过程中,墨江紫米中总黄酮含量变化结果见图2。如图2所示,不同丝状真菌发酵对墨江紫米总黄酮含量的影响不同。对米根霉3005来说,发酵的第2天和第4天可以显著提高墨江紫米总黄酮含量(P<0.05),然而,发酵第3天却显著降低了墨江紫米的总黄酮含量(P<0.05),其原因可能是因为一部分黄酮物质结构遭到微生物破坏,已有研究表明某些微生物的某些酶能破坏黄酮类物质的结构,当原料中黄酮释放的速度低于微生物分解代谢的速度时,总黄酮含量就会出现下降。米根霉3079和少孢根霉均在发酵的第3天和第4天能显著提高墨江紫米总黄酮含量(P<0.05),且少孢根霉发酵4天后,墨江紫米中总黄酮含量最高,约是未发酵墨江紫米总黄酮含量的2.5倍。另外,米曲霉在发酵的第1天和第2天能显著提高墨江紫米的总黄酮含量,但提升的幅度不大,而随后的两天发酵却降低了其总黄酮含量(P<0.05)。米曲霉变种发酵的第1天和第4天可以提高墨江紫米的总黄酮含量,但发酵第3天却显著降低了墨江紫米的总黄酮含量(P<0.05)。总体而言,这5种真菌发酵对墨江紫米总黄酮含量的影响规律与总酚含量变化趋势相类似。已有研究显示,微生物发酵能影响谷物中总黄酮含量,且其影响与发酵的菌种以及发酵时间相关,不同菌株发酵不同时间,既可以提高谷物的总黄酮含量也可以降低谷物中总黄酮含量[9],不同菌种不同时间段产生的酶的量、种类和活力都是不一样的,并且有些微生物产生的酶能破坏黄酮类物质的结构,这些差异也就造成了原料中黄酮含量不同。这些结果与本研究所得的结果相一致。

图2 发酵过程中墨江紫米的总黄酮含量Fig.2 The total flavonoids content of Mojiang purple rice (Oryza sativa L.) during fermentation.注:柱状图中不同字母表示具有显著差异(P<0.05)
2.3 发酵过程中墨江紫米的总花色苷含量变化
墨江紫米的紫色种皮富含花色苷,是其有别于普通大米的主要特征。5种真菌发酵对墨江紫米总花色苷含量的影响结果见图3。如图3所示,发酵对墨江紫米总花色苷含量具有显著的影响,除了米根霉3005发酵第1天,少孢根霉发酵第3天和第4天以及米曲霉变种发酵第1天,第2天和第4天能显著提高墨江紫米总花色苷含量外(P<0.05),其他菌株以及发酵时间段,墨江紫米中总花色苷含量均显著下降(P<0.05),而且米曲霉发酵的墨江紫米总花色苷下降最多。另外,经少孢根霉发酵第4天时,墨江紫米中总花色苷上升最多,约为未发酵墨江紫米的1.6倍。

图3 发酵过程中墨江紫米的总花色苷含量Fig.3 The total anthocyanins content of Mojiang purple rice (Oryza sativa L.) during fermentation.注:柱状图中不同字母表示具有显著差异(P<0.05)
花色苷是一类水溶性的植物色素,本身不够稳定,容易受到多种因素影响从而降解,例如氧气,食品基质,pH,溶剂,酶和蛋白等[15]。到目前为止,关于真菌发酵对花色苷影响的研究较少,有一项关于黑曲霉发酵莓果渣的研究表明:黑曲霉发酵3天能够提升西洋接骨木果渣的花色苷含量,但在发酵前2天以及后续第6天却使得果渣的总花色苷含量下降。另外,矮接骨木果渣在经过黑曲霉发酵6天的过程中,花色苷含量基本都是下降的[16]。总体而言,该项研究的结果与本实验的研究结果基本相一致。
2.4 墨江紫米中花色苷种类的UPLC-ESI-HRMS/MS分析
到目前为止,从不同植物中已发现超过300种不同结构的花色苷[17]。但云南墨江紫米的花色苷组成未见报道,本研究通过UPLC-ESI-HRMS/MS分析鉴定了墨江紫米的花色苷组成,结果见图4。共检测到4种花色苷成分,通过将本研究所得的质谱信息(分子量,碎片离子)与已有的文献报道相比较[18],初步鉴定出这4种花色苷分别为矢车菊素-3,5-二葡萄糖苷([M+H]+= 611.1609, 碎片[M+H]+= 287.0552),矢车菊素-3-葡萄糖苷([M+H]+= 449.1078, 碎片[M+H]+=287.0552),矢车菊素-3-芸香糖苷([M+H]+= 595.1664, 碎片[M+H]+= 287.0553)以及芍药花青素-3-葡萄糖苷([M+H]+= 463.1238, 碎片[M+H]+= 301.0710)。墨江紫米在发酵过程中,花色苷的种类没有出现变化,但是这4种花色苷的含量峰面积出现差异,说明这4种花色苷在发酵过程中含量有变化,并且与发酵的菌种和发酵时间都有关,其具体的变化规律将在后续研究中进行详细深入研究。
2.5 发酵前后墨江紫米的抗氧化性
2.5.1 DPPH自由基清除能力
利用DPPH方法测定了5种真菌发酵各时间段的紫米和未发酵的紫米在1.5 mg紫米/mL浓度条件下的抗氧化性,结果表明,大部分发酵各时间段均能显著提高紫米的抗氧化性(P<0.05),而且发酵4天抗氧化性提高最多(图5)。总的来看,不同处理的墨江紫米对DPPH自由基的清除能力变化规律与总酚和总黄酮含量变化规律类似,说明可能发酵紫米中总酚总黄酮可能是其发挥清除DPPH自由基的主要活性物质。通过对墨江紫米DPPH自由基清除能力与总酚、总黄酮以及总花色苷含量的相关系数分别为:r=0.830,P<0.01;r=0.861,P<0.01和r=0.355,P>0.05。该相关性分析结果表明,发酵前后墨江紫米对DPPH自由基清除能力的大小与总酚和总黄酮含量有关,而与总花色苷含量变化不相关。大量研究表明,谷物具有一定的抗氧化能力,且经过微生物发酵后的谷物抗氧化能力提高,另外,其抗氧化能力主要是来自于谷物中的酚类物质[8-10],这些结论均与本研究的结果相类似。
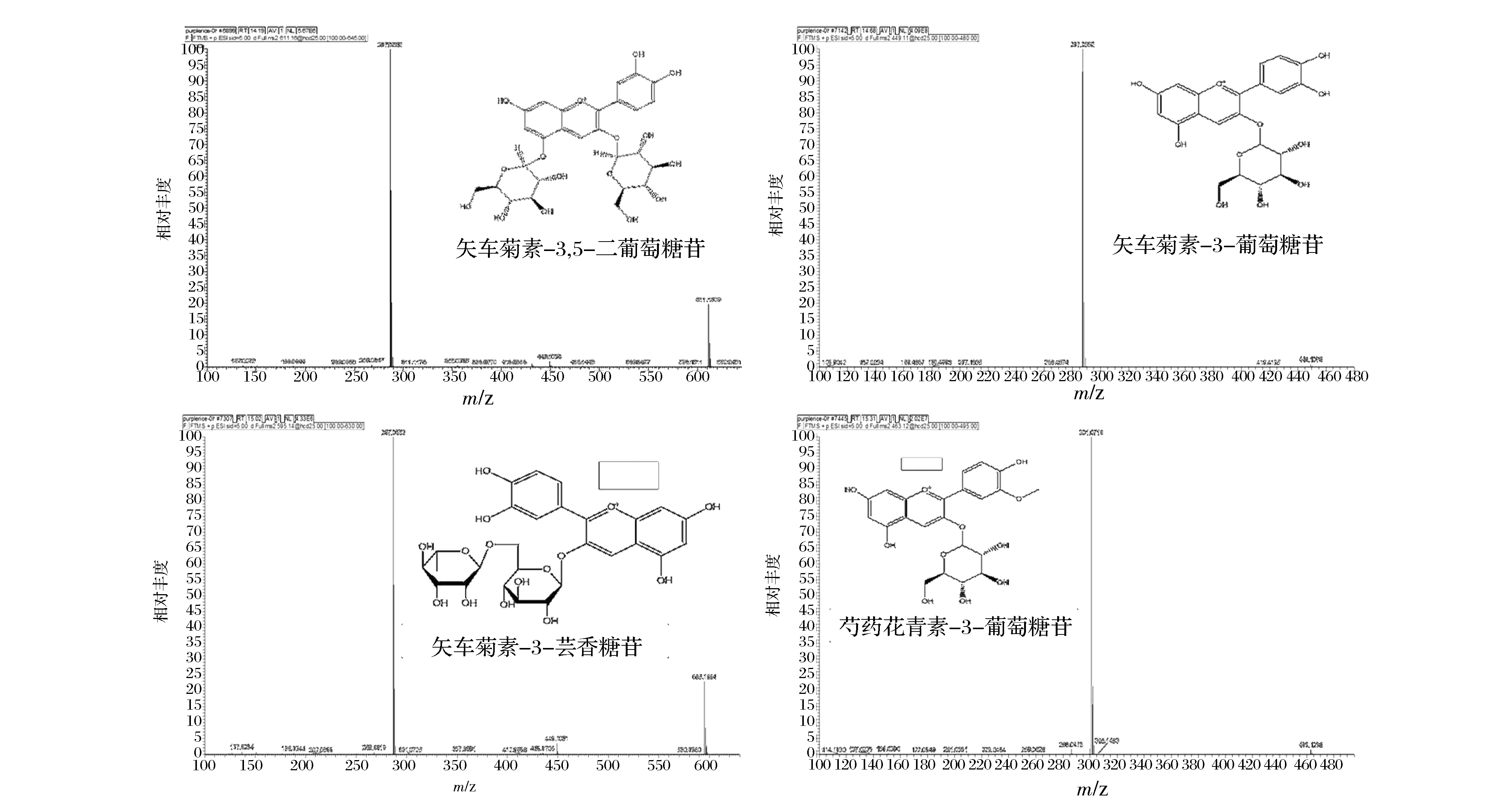
图4 墨江紫米花色苷质谱图Fig.4 The mass spectrum of anthocyanins from Mojiang purple rice (Oryza sativa L.).

图5 发酵前后墨江紫米在1.5 mg干重紫米/mL的浓度下对DPPH自由基清除能力Fig.5 The DPPH radical scavenging ratio of native and fermented Mojiang purple rice (Oryza sativa L.) at 1.5 mg dry weight of purple rice /mL注:柱状图中不同字母表示具有显著差异(P<0.05)
2.5.2 ABTS·+自由基清除能力
本研究采用ABTS·+自由基清除能力方法来作为第2种抗氧化评价方法,发酵前后墨江紫米在1.5 mg干重紫米/mL的浓度下对ABTS·+自由基清除能力结果如图6所示。由图6可以看出,墨江紫米不论发酵与否,其对ABTS·+自由基清除能力要强于对DPPH自由基清除能力(图5),但总体规律相类似,除个别发酵时间段降低了墨江紫米ABTS·+自由基清除能力外,其他发酵时间段均能显著提高其ABTS·+自由基清除能力(P<0.05)。通过相关性分析,墨江紫米的ABTS·+自由基清除能力与其总酚、总黄酮、总花色苷的相关性系数分别为:r=0.621,P<0.05;r=0.574,P<0.05和r=0.224,P>0.05,说明发酵前后墨江紫米对ABTS·+自由基清除能力的大小同样与其总酚和总黄酮含量有关。

图6 发酵前后墨江紫米在1.5 mg干重紫米/mL的浓度下对ABTS·+自由基清除能力Fig.6 The ABTS radical scavenging ratio of native and fermented Mojiang purple rice (Oryza sativa L.) at 1.5 mg dry weight of purple rice /mL注:柱状图中不同字母表示具有显著差异(P<0.05)
3 结论
本研究结果表明,墨江紫米富含多酚类物质,含有4种花色苷,具有较好的抗氧化性。经过5种常见真菌发酵后,墨江紫米的总酚含量、总黄酮含量、花色苷含量以及抗氧化性均受到显著的影响。在4天的发酵过程中,大多数发酵时间段,墨江紫米的各项上述指标均得到显著的提高。因此,墨江紫米,尤其是发酵一定时间的墨江紫米,可能是植物性多酚及抗氧化剂的良好来源,可以开发成一种营养品或功能性食品加以应用。
[1] PISOSCHI A M,POP A.The role of antioxidants in the chemistry of oxidative sress: a review[J].European Journal of Medicinal Chemistry,2015,97:55-74.
[2] SITI H N,KAMISAH Y,KAMSIAH J.The role of oxidative stress, antioxidants and vascular inflammation in cardiovascular disease (a review)[J].Vascular Pharmacology,2015,71:40-56.
[3] ARUOMA O I.Free radicals, oxidative stress, and antioxidants in human health and disease[J].Journal of the American Oil Chemists’ Society,1998,75(2):199-212.
[4] EI GHARRAS H.Polyphenols:food sources, properties and applications-a review[J]. International Journal of Food Science & Technology,2009,44(12):2 512-2 518.
[5] ZHANG Hua,TSAO R.Dietary polyphenols, oxidative stress and antioxidant and anti-inflammatory effects[J].Current Opinion in Food Science,2016,8:33-42.
[6] PERRON N R,BRUMAGHIM J L.A review of the antioxidant mechanisms of polyphenol compounds related to iron binding[J].Cell Biochemistry & Biophysics,2009,53(2):75-100.
[7] ABDEL-AAL E S M,CHOO T M,DHILLON S,et al.Free and bound penolic acids and total phenolics in black, blue, and yellow barley and their contribution to free radical scavenging capacity[J].Cereal Chemistry,2012,89(4):198-204.
[8] CAI Sheng-bao,WANG Ou,WU Wei,et al.Comparative study of the effects of solid-state fermentation with three filamentous fungi on the total phenolics content (TPC), flavonoids, and antioxidant activities of subfractions from oats (Avena sativa L.)[J].Journal of Agricultural & Food Chemistry,2012,60(1):507-513.
[9] BHANJA T,KUMARI A,BANERJEE R.Enrichment of phenolics and free radical scavenging property of wheat koji prepared with two filamentous fungi[J].Bioresource Technology,2009,100(11):2 861-2 866.
[10] 王春丽,黄士淇,孙丹,等.丝状真菌发酵小麦麸皮中酚类物质抑制胰脂肪酶活性和HepG2细胞内甘油三酯沉积的作用[J].食品与发酵工业,2016,42(3):61-66.
[11] SINGLETON V L,ROSSI J A.Colorimetry of total phenolics with phosphomolybdicphosphotungstic acid reagent[J].American Journal of Enology and Viticulture,1965,16(3):144-158.
[12] 孙丹,黄士淇,蔡圣宝.不同加工方式对苦荞中总酚、总黄酮及抗氧化性的影响[J].食品与发酵工业,2016,42(1):141-147.
[13] HOSSEINIAN F S,LI Wen-de,BETA T.Measurement of anthocyanins and other phytochemicals in purple wheat[J].Food Chemistry,2008,109(4):916-924.
[14] YAMANE Y I,FUJITA J,SHIMIZU R I,et al. Production of cellulose-and xylan-degrading enzymes by a koji mold, aspergillus oryzae, and their contribution to the maceration of rice endosperm cell wall[J].Journal of Bioscience & Bioengineering,2002,93(1):9-14.
[15] GALVANO F,LA FAUCI L,LAZZARINO G,et al.Cyanidins: metabolism and biological properties[J].The Journal of Nutritional Biochemistry,2004,15(1):2-11.
[16] DULF F V,VODNAR D C,DULF E H,et al.Total phenolic contents, antioxidant activities, and lipid fractions from berry pomaces obtained by solid-state fermentation of two Sambucus species withAspergillusniger[J].Journal of Agricultural & Food Chemistry,2015,63(13):3 489-3 500.
[17] SUN Dan,HUANG Shi-qi,CAI Sheng-bao,et al.Digestion property and synergistic effect on biological activity of purple rice (Oryza sativa L.) anthocyanins subjected to a simulated gastrointestinal digestioninvitro[J].Food Research International,2015,78:114-123.
[18] HOU Fang-li,ZHANG Rui-fen, ZHANG Ming-wei,et al.Hepatoprotective and antioxidant activity of anthocyanins in black rice bran on carbon tetrachloride-induced liver injury in mice[J].Journal of Functional Foods,2013,5(4):1 705-1 713.
A comparative investigation on the effects of different fungi fermentation on the polyphenols content and antioxidant activity of Mojiang purple rice (OryzasativaL.)
HUANG SHI-qi, XING Chen, CAI Sheng-bao*
(Yunnan Institute of Food Safety, Kunming University of Science and Technology, Kunming 650500, China)
Mojiang purple rice (OryzasativaL.) is a distinctive agricultural product in Yunnan province. However, information about the polyphenols content and antioxidant activity of Mojiang purple rice fermented by different fungi is still limit. Therefore, the purpose of the present work is to comparatively investigate the effects of five fungi fermentation (Aspergillusoryzaevar.effuses2083,Aspergillusoryzae2011,Rhizopusoryzae3005,Rhizopusoryzae3079,Rhizopusoligosporus3152) on the polyphenols content and antioxidant activity of Mojiang purple rice and identify the main anthocyanins. The results showed that four anthocyanins were detected in Mojiang purple rice, namely cyanidin-3, 5-diglucoside, cyanidin-3-glucoside, cyanidin-3-rutinoside and peonidin-3-glucoside. The total phenolics content, total flavonoids content, anthocyanins content and antioxidant activity of Mojiang purple rice strongly depended on fungus type and fermentation time.R.oryzae3005,R.oligosporusandA.oryzaevar.effusescould significantly enhance the parameters mentioned above for Mojiang purple rice during 4 days of fermentation (P<0.05). The results of the present work suggested that Mojiang purple rice, especially the one fermented by fungus for a certain time, might be used as a good source of natural antioxidant and developed as nutraceuticals and functional food.
Mojiang purple rice; fermentation; anthocyanin; phenolic compounds; antioxidant activity
10.13995/j.cnki.11-1802/ts.201704017
硕士研究生(蔡圣宝副教授为通讯作者,E-mail: caikmust2013@163.com)。
国家自然科学基金青年基金(31401503);云南省应用基础研究面上项目(2014FB120);省级人才培养项目(KKK0201405055)
2016-10-08,改回日期:2016-12-05

