鱼源莓实假单胞菌生长动力学与碳源利用分析
郭全友 修艳辉,2 王鲁民 姜朝军 王 磊
(1.中国水产科学研究院东海水产研究所, 上海 200090; 2.上海海洋大学食品学院, 上海 201306)
鱼源莓实假单胞菌生长动力学与碳源利用分析
郭全友1修艳辉1,2王鲁民1姜朝军1王 磊1
(1.中国水产科学研究院东海水产研究所, 上海 200090; 2.上海海洋大学食品学院, 上海 201306)
以鱼源莓实假单胞菌为研究对象,利用BIOLOG获得15、25、33℃下其GEN III板中碳源生长数据,采用修正的Gompertz模型,结合孔平均颜色变化率及利用面积,分析其碳源利用效果,并对3个温度下pH值、NaCl和乳酸钠(NaL)的抑菌效应和生长动力学进行研究。结果表明,25℃时莓实假单胞菌总体碳源利用能力和活性最强,15℃时次之,33℃时最弱。在15~33℃内,碳源利用以糖类、羧酸类和氨基酸类为主。糖类中利用较好的有α-D-葡萄糖、L-岩藻糖等;氨基酸类中利用较好的有L-焦谷氨酸、L-丙氨酸、L-谷氨酸;羧酸类中利用较好的有奎宁酸、D-葡糖酸、糖质酸等。15~25℃下4%~8% NaCl及33℃下1%~8% NaCl对莓实假单胞菌皆有抑制作用。33℃时pH值对莓实假单胞菌生长起抑制作用,1%的NaL对其具有促进作用。通过对莓实假单胞菌抑菌效应和碳源利用分析,可为优化产品配方和保障产品质量提供理论依据。
莓实假单胞菌; 碳源利用能力; 环境因子; 生长动力学
引言
水产品腐败变质主要是由特定腐败菌(Specific spoilage organism,SSO)增殖所造成,研究表明假单胞菌是水产品低温贮藏时优势腐败菌之一[1-3],可在2~35℃范围内生长[4-5],能还原硝酸盐为亚硝酸盐[6],也能引发某些水产品流行性疾病[7]。水产品原料、加工、流通和贮藏条件均会影响其保藏性,腐败菌对胁迫环境(如温度、pH值、NaCl含量等)的耐受性及营养元素利用的差异[8]是影响货架期的重要因素,若胁迫效应超出细菌耐受的正常生理学范围(Normal physiological range,NPR),可能导致细菌生长延缓、失活甚至死亡,同时,微生物进行自我修复过程中,需要不断消耗营养来维持内部平衡[9-10]。多孔平板技术是一种基于氧化还原反应的高通量技术,它使得快速分析胁迫作用下细菌生长动力学及营养利用情况成为可能。
微生物生长和繁殖受物理、化学及生物因子的影响,假单胞菌生长动力学研究表明,在不同环境下其生长动力学参数(最大比生长速率与迟滞期)差异较大,最大比生长速率表示细菌对数期时的生长速率,迟滞期表示细菌适应环境的能力,是描述其生长速率、抑菌效应评价及货架期预测模型的主要指标[11]。郭全友等[12]研究表明:0~10℃假单胞菌迟滞期从59.63 h降至3.95 h,最大比生长速率分别从0.02 h-1增至0.08 h-1,董庆利等[13]研究表明,pH值5.0时铜绿假单胞菌迟滞期约降低至pH值7.5时的1/2。此外,其营养底物利用情况与菌种、初始菌量、底物种类及环境相关,如EBRAHIMI等[14]研究发现:在低pH值时植物乳杆菌能消耗更多谷氨酰胺,鼠李糖乳杆菌则相反;DENG等[15]研究表明:相比纯底物,混合底物更能促进木质素降解菌的代谢活性。
微生物营养利用情况可从能量代谢的角度进行分析,包括微生物的代谢能力与方式。如研究多酚在肠道菌群的能量代谢方式,可为治疗肥胖提供指导意义[16],一些乳酸菌在进行己糖发酵时,达到一定条件便可利用部分额外的NAD(P)H产生赤藓糖醇和甘油,此外果糖、丙酮酸和柠檬酸盐可作为细胞外部电子受体从而增大细菌的生长速率[17]。目前,能量代谢分析方法主要从能量转换和动力学参数及代谢途径进行分析,吴雪楠等[18]采用微量量热法研究了草甘膦对土壤微生物能量代谢的影响,在研究微生物群落分析时,可用动力学参数进行PCA分析,且每个参数包含着不同的生物信息[19],门多萨假单胞菌利用葡萄糖产生中等链长的聚羟基烷酸酯过程中,UDP-D-葡萄糖和DTDP-L-鼠李糖的生物合成途径可能竞争性抑制其合成,而通过阻断支代谢途径及过量表达phaG基因可增强其合成[20]。
本文以源自有氧冷藏大黄鱼的重要腐败菌(莓实假单胞菌)为研究对象,测定15、25、33℃条件下,以71种碳源为底物的莓实假单胞菌生长数据,分析其碳源利用能力,以及不同pH值、NaCl和NaL溶液浓度对其生长的影响,以期为优化产品配方、有效抑菌及保障产品质量提供一定依据,为深入探究在真实水产品中的营养利用和抑菌效应提供基础。
1 材料与方法
1.1 材料与试剂
从冷藏大黄鱼货架期终点,分离出腐败菌并采用16S rRNA鉴定,菌株冻干保藏备用;HCl标准溶液(0.01 mol/L),深圳市博材达科技有限公司;营养琼脂(AR)、营养肉汤(BR),上海市国药集团化学试剂有限公司;胰酪胨大豆肉汤(TSB),上海中科昆虫生物技术开发有限公司。
1.2 试验方法
1.2.1 Biolog试验
取冻干莓实假单胞菌于BR中活化,经两代划线复壮后,划线得到单菌落,取适量接种到Biolog专业接种液中,混匀后静置5 s后调节透光率至95%~98%之间,制备成吸光度约为0.01的菌悬液。然后使用Biolog专用移液器,分别吸取200 μL菌悬液到若干Gen III 96孔板中,分别置于15、25、33℃的培养箱中培养97 h,间隔适当时间经Biolog仪(美国BIOLOG公司)中的Microstation读数仪测定OD值。
1.2.2 总体碳源利用能力分析及模型评价
总体碳源利用能力用孔平均颜色变化率(Average well colour development,AWCD)表示,即用AWCD描述微生物代谢强度及平均活性,AWCD随时间变化的曲线与微生物生长曲线相似,包括变化前期、指数期和稳定期,但观察不到死亡阶段[21],公式为
AWCD=∑(C-R)/n
(1)
式中R——对照孔OD值C——含有碳源孔的OD值n——碳源孔数
此外,传统微生物学预测模型常用Gompertz、Logistic和Baranyi方程对因变量(菌落数对数值)和自变量(时间t)关系进行拟合[22],用修正的Gompertz方程也可对培养时间与细菌OD值间关系进行拟合[23],其动力学参数反映碳源利用速率及迟滞期,方程为
Vt=Aexp(-exp(2.718μmax(λ-t)/A+1))
(2)
式中t——时间,hλ——迟滞期,hVt——t时OD值,即C-R值μmax——颜色变化最大速率,h-1A——颜色变化最大吸光度
采用决定系数R2、准确度Af、精确度Bf对模型进行评价[24],其中R2接近1表明拟合较好,Af接近1,准确性较好,Bf接近1,精确性较好。
1.2.3 不同种类碳源利用能力及环境因子敏感性分析
Gen III板中有71种碳源,参照郑华等[25]分类方法将其分为6类,分别为糖类(25种)、羧酸类(17种)、氨基酸类(10种)、胺/酰胺类(6种)、脂肪酸/脂类(6种)和其他类(7种)。当莓实假单胞菌OD值稳定时,即V0>0.25时[26],判为可利用。
温度对莓实假单胞菌碳源利用模式的影响用碳源利用率表示(Sm/Sz,Sm表示每类碳源的利用面积,Sz表示全部碳源的利用面积)。不同种类碳源及单个碳源利用能力,采用利用面积S及动力学参数(μmax和λ)分析,碳源利用面积公式为
(3)
式中Vti——ti时OD值
环境因子(如化学物质)对莓实假单胞菌敏感性的影响以阳性对照孔(A10)作参考,当试剂孔(OD值)与A10孔接近,显紫色或接近紫色时,判为阳性(+),反之,判为阴性(-),即试剂孔易被该化学物质抑制。当呈现阳性时,生长曲线常呈现“S”型,显示为生长(如μmax>0),即起促进作用。如果不能准确判断,将其判定为“边界值”()。
1.3 数据处理与统计分析
试验数据采用软件SPSS 19.0(美国IBM公司)利用最小二乘算法进行非线性回归求出参数,采用软件Origin 8.0(美国OriginLab公司)制图,采用独立样本t检验进行差异显著性分析。菌株序列采用NCBI 中 BLAST 与 GenBank 数据库中已知16S rRNA序列进行对比,并用 Mega 5.0 软件通过最大似然值法构建发育树[27]。
2 结果与讨论
2.1 莓实假单胞菌来源与总体碳源利用
在有氧冷藏(0~10℃)大黄鱼货架期终点时,分离出腐败希瓦氏菌(Shewanellaputrefaciens)、假单胞菌(Pseudomonasspp.)、缺陷短波单胞菌(Brevundimonasdiminuta)、不动杆菌(Acinetobacterspp.)等腐败菌群[1],经16S rRNA测序确定希瓦氏菌(样品1)和莓实假单胞菌(样品2)为优势菌群,同源性最高分别为98%和100%,如图1所示。同时,假单胞菌也是冷藏淡水鱼(如罗非鱼等)的特定腐败菌,受食品营养组成、质地结构和胁迫条件的影响,其营养代谢和生长速率存在较大差异。本文以源自冷藏大黄鱼的莓实假单胞菌为模式菌株,对不同温度下其碳源利用情况进行探究(图2)。

图1 样品1和样品2菌株16S rRNA的系统发育树Fig.1 Phylogenetic tree of sample 1 and sample 2 strains’ 16S rRNA
图2为不同温度下莓实假单胞菌总体碳源利用状况。贾夏等[28]对微生物群落特征分析得出,240 h培养周期内AWCD曲线“拐点”前后差异显著(p<0.05),而CLASSEN等[29]认为培养时间超过72 h时,细菌板逐渐表现出真菌性增长。本研究得到100 h培养时间内总体碳源利用如图2所示,总体碳源利用曲线呈S型,25℃时μmax最大,AWCD最大值为0.614,表明总体碳源利用能力和活性最强,15℃时次之,AWCD最大值为0.402,33℃时最弱,AWCD最大值为0.198;图2中15℃和25℃时的λ相差不大,33℃时较大,而λ越小意味着适应环境能力越强,进入对数期时间越短,观察到其与活性之间并无直接关系。如铜绿假单胞菌在35℃时活性最大,但其λ在21~42℃范围内随着温度升高而降低[13]。
2.2 不同类型碳源利用能力分析
表1为6类碳源及不同温度下可利用的碳源种类,可看出15℃和25℃可利用碳源总数均为39种,33℃时迅速降至20种。图3a为莓实假单胞菌每类碳源利用面积占总利用面积的百分比,可知:在15~33℃范围内,莓实假单胞菌利用碳源以糖类、羧酸类和氨基酸类为主,利用率均值分别为(29±0.010)%、(29±0.014)%和(20±0.032)%;温度对莓实假单胞菌各类碳源利用率变化不明显。图3b为莓实假单胞菌每类碳源利用面积,可知:25℃时6类碳源利用能力均最高,15℃次之,33℃最低,三者之间差异显著(p<0.05),与总体碳源利用曲线规律类似;温度对莓实假单胞菌各类碳源的利用面积变化明显,这是由于微生物群落中不同微生物种类的环境耐受性差异所致。
图4为不同温度条件下6类可利用碳源的动力学参数。由图4a可看出,每类碳源(除其他类外)25℃时μmax大于或接近于15℃时,33℃时μmax最小,如羧酸类在15、25、33℃时μmax分别为0.015、0.022、0.010 h-1,氨基酸类在15、25℃时μmax为0.021 h-1和0.022 h-1,33℃时降为0.007 h-1;由图4b看出,每类碳源的迟滞期随着温度升高而降低,如糖类λ在15~33℃时由21.7 h降至8.7 h,羧酸类由21.3 h降至10.5 h。Baranyi模型、Logistic模型和Gompertz模型是常见的食品微生物生长模型,修正Logistic方程和修正Gompertz方程可克服传统模型函数渐进值相同进而导致拐点处函数值相同的缺陷,更适用于研究“S”形微生物的生长曲线[22],虽然相同模型针对不同研究对象会出现不同预测结果,但修正的Gompertz方程的预测效果仍被证明较好,并得以广泛应用[30],本文中拟合的模型R2为0.986±0.032,Af为0.946±0.055,Bf为1.047±0.014,表明模型能较好拟合15~33℃范围内莓实假单胞菌碳源利用情况。

表1 碳源分类以及利用情况
注:“+++”等符号代表15、25、33℃下该碳源被利用情况,“+”代表可被利用,“-”代表不可被利用。

图3 不同温度下莓实假单胞菌对6类碳源的相对利用率及利用面积的影响Fig.3 Carbon sources’ utilization proportion and area of Pseudomonas fragi at different temperature

图4 不同温度对莓实假单胞菌各类碳源利用的影响Fig.4 Effect of different temperatures on carbon sources utilization of Pseudomonas fragi
2.2.1 不同温度下糖类利用差异性

图5 莓实假单胞菌利用糖类碳源的动力学参数Fig.5 Kinetic parameters of carbohydrates utilization of Pseudomonas fragi
图5为莓实假单胞菌每种可利用糖类碳源的动力学参数,莓实假单胞菌的碳源利用情况可综合最大比生长速率、迟滞期和利用面积进行评价,如15℃时蜜三糖μmax虽然较大(0.014 h-1),但由于λ长(45.6 h),利用面积最小(11),利用较差;15℃水苏糖μmax最大(0.021 h-1),而λ较长(53.3 h),但由于最大AWCD大,所以利用面积较大(24),利用较好。因此得出结论:15℃时α-D-葡萄糖、L-岩藻糖利用最好;其次为D-半乳糖、D-甘露醇、蔗糖、水苏糖;阿拉伯醇、果糖和蜜三糖利用较差。25℃时利用较好的有蔗糖、L-岩藻糖、D-甘露醇,其次为D-半乳糖、D-甘露糖和α-D-葡萄糖;阿拉伯糖和果糖利用较慢。33℃时L-岩藻糖和蔗糖利用较好,D-阿拉伯醇和D-半乳糖利用较差。此外,D-岩藻糖随温度升高利用面积增大,而水苏糖、蜜三糖随温度升高利用面积变小。在实际应用中,孙俊良等[31]发现几种糖类碳源对黑曲霉产糖化酶活力从大到小依次为:可溶性淀粉、葡萄糖、蔗糖和麦芽糖、乳糖、β-环糊精,基本只能利用前4种。功能菌1-24和B-31分别在葡萄糖和淀粉条件下生长情况最佳,麦芽糖对功能菌ETSA的促进效果最强[32]。
2.2.2 对氨基酸类的利用
莓实假单胞菌对氨基酸类利用能力动力学参数如图6所示。由图6可知,15℃时L-焦谷氨酸利用最好,为0.029 h-1,其次为γ-氨基-丁酸、L-谷氨酸和D-丝氨酸、L-丙氨酸,μmax均值为0.024 h-1,L-丝氨酸利用较差。25℃时利用较好的有D-丝氨酸(0.048 h-1)、L-丙氨酸(0.035 h-1),其次为L-焦谷氨酸、γ-氨基-丁酸、L-天冬氨酸和L-谷氨酸;氨基乙酰脯氨酸利用最慢;33℃时利用较好的有L-谷氨酸,其次为天冬氨酸和焦谷氨酸,D-丝氨酸利用最差。此外,15℃时L-丝氨酸λ长达33.4 h,可看出其适应能力较弱。
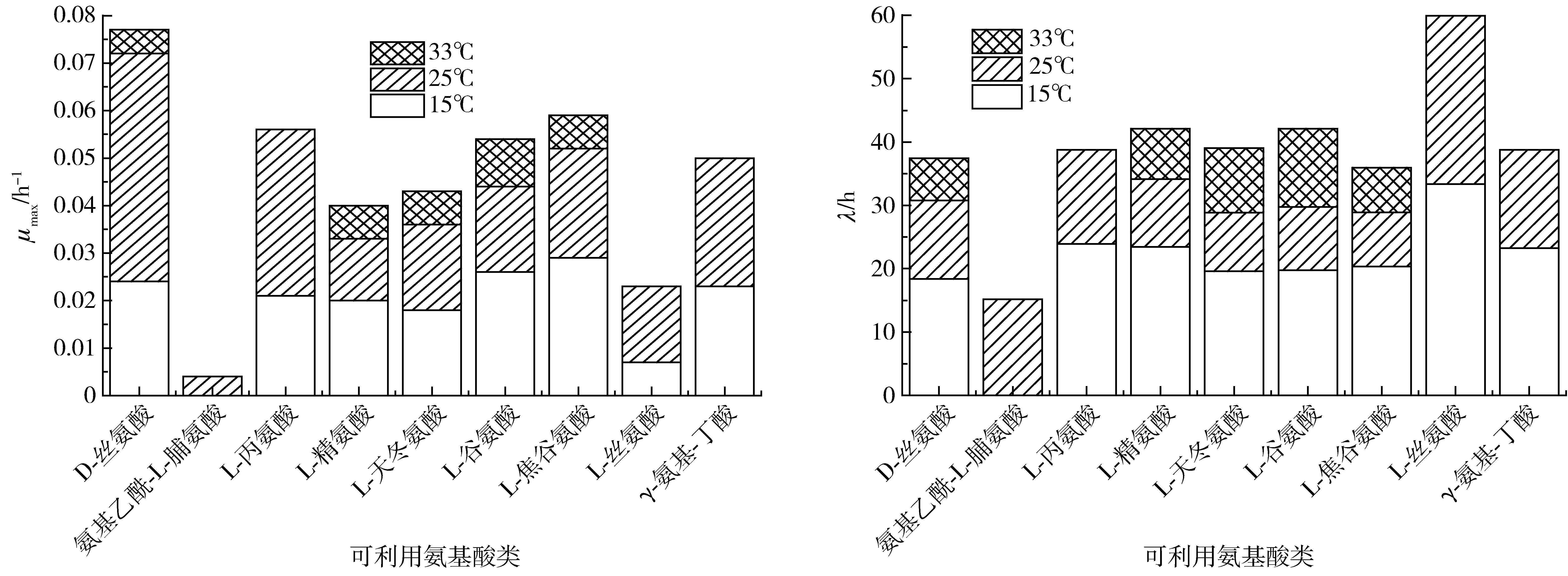
图6 莓实假单胞菌利用氨基酸类碳源的动力学参数Fig.6 Kinetic parameters of amino acids utilization of Pseudomonas fragi
生物体内存在以及可利用的绝大多数为L-氨基酸,D-氨基酸利用少或被分解氧化,D-氨基酸是肽聚糖的重要组成部分,其合成被破坏将导致细胞的死亡[33],也有人发现在细菌生长速率很高时可以释放和消耗D-氨基酸[34]。D-氨基酸对海洋中碳源和能源的循环很重要[35]。
2.2.3 对羧酸类的利用
莓实假单胞菌对羧酸类利用能力动力学参数如图7所示,15℃时奎宁酸、D-葡萄糖酸、D-葡萄糖醛酸、糖质酸、L-苹果酸利用较好。25℃时D-葡萄糖酸、D-葡萄糖醛酸、糖质酸、奎宁酸、L-苹果酸利用较好。33℃时为奎宁酸、糖质酸利用较好。粘酸的利用速率普遍较高,但λ长达55 h以上,且最大AWCD较小,利用较差。羧酸常被作为食品、材料表面等的防腐剂,VZQUEZ等[36]通过二级方程发现羧酸对几株菌的毒性作用随着分子量的增大而降低。本文中看出莓实假单胞菌可利用甲酸、乙酸和丙酸,其利用速率与分子量成正比。

图7 莓实假单胞菌利用羧酸类碳源的动力学参数Fig.7 Kinetic parameters of carboxylic acids utilization of Pseudomonas fragi
2.2.4 对脂肪酸/脂类、胺/酰胺类和其他类的利用
莓实假单胞菌对脂肪酸/脂类、胺/酰胺类和其他类利用能力动力学参数如图8所示,脂肪酸和脂类在15℃和25℃时对丙酮酸甲酯(0.009 h-1)、β-羟基-D,L-丁酸(0.008 h-1)的利用较好,不同的是最大AWCD不同;33℃利用均较差。吐温40μmax虽然与其他差距不大,但其λ长而导致利用能力差。15℃和25℃时对L-组胺利用较好(S为0.037和0.027),33℃时,葡糖醛酰胺利用较好(S为0.011),15~25℃时对肌苷利用最好(S为0.017和0.029),其次是肌醇(S为0.011和0.017),33℃时反之。葡糖醛酰胺只在33℃时被利用,温度越高利用面积越大。本文中莓实假单胞菌并不利用明胶,同属菌株a390T可水解明胶[37]。

图8 莓实假单胞菌利用脂肪酸/脂类、胺/酰胺类和其他类碳源的动力学参数Fig.8 Kinetic parameters of fatty acids/lipids, amines/amides and others utilization of Pseudomonas fragi
2.3 环境因子下莓实假单胞菌敏感性分析
图9为不同温度下pH值、NaCl和NaL对莓实假单胞菌生长的影响。由图9可看出,15℃下pH值6.0和pH值5.0时的最大比生长速率比较接近,均值为(0.088±0.023) h-1,25℃ pH值6.0时最大
比生长速率(0.129 h-1)远大于pH值5.0(0.093 h-1)时,而在33℃时pH值对其起抑制作用。15℃和25℃下1%的NaCl以及1%的NaL能促进生长,4%~8%的NaCl对莓实假单胞菌生长均有抑制作用,33℃只有1%的NaL具有促进作用。

图9 不同温度下pH值以及NaCl和NaL对莓实假单胞菌生长的影响Fig.9 Effect of pH value, NaCl and NaL on growth of Pseudomonas fragi at different temperatures
莓实假单胞菌生长过程中可改变环境的pH值,有研究表明1℃下贮藏20 d的牛肉中莓实假单胞菌菌数由2.2 lg CFU/cm2增加到7.2 lg CFU/cm2时,pH值由5.5增至6.6[38]。而有些物质的产生对pH值的变化比较敏感,如木糖酸的产生对pH值的降低十分敏感[39]。相同温度下,NaCl浓度越高,利用速率越小,这是由于NaCl改变了莓实假单胞菌生长环境的渗透压,高渗条件会引起细胞质质壁分离,细胞生长变慢而停止。NaL促进莓实假单胞菌生长,15℃时尤为明显。NaL在水产品中常作为保鲜剂,常和其他抗菌剂、包装方式[40]、杀菌处理[41]共同抑菌,如SCHELEGUEDA等[42]通过研究无害李斯特氏菌(Listeriainnocua)、腐败希瓦氏菌和嗜冷菌等混合菌株的抗微生物剂释放、细胞表面疏水性和损伤部位的确定,确定最小抑菌剂量以及发现NaL和其他抗菌物质组合的抑菌效果更佳。文献[43]认为1%~2%的NaL在肉制品中也有抑菌效果,在本文中1%NaL对其影响不显著,这可能是抑菌对象不同所造成,如ILHAK等[44]研究发现与单独2% NaL处理的样品相比,0.1%的百里酚与2%NaL的组合没有显示出对李斯特氏菌显著抑制作用,而对Salmonellatyphimurium却表现出协同效应。
3 结论
(1)25℃时莓实假单胞菌总体碳源利用能力和活性最强,15℃时次之,33℃时最弱。在15~33℃范围内,莓实假单胞菌利用碳源以糖类、羧酸类和氨基酸类为主,碳源利用率均值分别为29%、29%和20%。莓实假单胞菌对各类碳源的利用率变化不明显;温度对莓实假单胞菌每类碳源利用率变化明显。
(2)糖类中利用较好的有α-D-葡萄糖、L-岩藻糖、蔗糖和D-甘露醇。氨基酸类中利用较好的有L-焦谷氨酸、D-丝氨酸、L-丙氨酸、L-谷氨酸。羧酸类中利用较好的有奎宁酸、D-葡萄糖酸、D-葡萄糖醛酸、糖质酸、L-苹果酸。脂肪酸/脂类、胺/酰胺类和其他类中利用较好的有丙酮酸甲酯(0.009)、β-羟基-D,L-丁酸、L-组胺、葡萄糖醛酰胺、肌苷、肌醇。
(3)15℃下,pH值6.0和pH值5.0时的最大比生长速率比较接近,25℃ pH值6.0时最大比生长速率远大于pH值5.0时,而在33℃时2个pH值对其起抑制作用。15℃和25℃下1%的NaCl以及1%NaL能促进生长,4%~8%的NaCl对莓实假单胞菌生长均有抑制作用,33℃只有1%NaL具有促进作用。
1 郭全友, 王锡昌, 杨宪时,等. 不同贮藏温度下养殖大黄鱼货架期预测模型的构建[J]. 农业工程学报, 2012, 28(10):267-273. GUO Quanyou, WANG Xichang, YANG Xianshi,et al. Predictive model construction of shelf life for culturedPseudosciaenacroceastored at different temperatures[J]. Transactions of the CSAE, 2012, 28(10): 267-273. (in Chinese)
2 蓝蔚青, 谢晶, 周会,等. 不同时期鲳鱼冷藏期间优势腐败菌的多样性变化[J]. 食品科学, 2015,36(2):226-231. LAN Weiqing, XIE Jing, ZHOU Hui,et al. Diversity of dominant spoilage bacteria in pomfret (Pampusargenteus) from different growing seasons during chilled storage[J]. Food Science, 2015,36(2):226-231.(in Chinese)
3 唐文静, 王楚文, 柳云龙,等. 冷藏海鲈鱼优势腐败菌的筛选和鉴定[J]. 食品科学, 2016, 37(3):170-174. TANG Wenjing, WANG Chuwen, LIU Yunlong,et al. Isolation and identification of specific spoilage organism in chilled sea bass[J]. Food Science, 2016, 37(3):170-174.(in Chinese)
4 ERCOLINI D, CASABURI A, NASI A, et al. Different molecular types ofPseudomonasfragihave the same overall behaviour as meat spoilers[J]. International Journal of Food Microbiology, 2010, 142(1-2):120-131.
5 VASSEUR C, LABADIE J, HÉBRAUD M. Differential protein expression byPseudomonasfragisubmitted to various stresses[J]. Electrophoresis, 1999, 20(11):2204-2213.
6 NISHIMORI E, KITA-TSUKAMOTO K, WAKABAYASHI H.Pseudomonasplecoglossicidasp. nov., the causative agent of bacterial haemorrhagic ascites of ayu,Plecoglossusaltivelis[J]. International Journal of Systematic & Evolutionary Microbiology, 2000, 50(1):83-89.
7 周涛, 张继挺, 王国良. 香鱼假单胞菌SYBR Green Ⅰ荧光定量PCR检测方法的建立[J]. 中国预防兽医学报, 2015, 37(1):35-39. ZHOU Tao, ZHANG Jiting, WANG Guoliang.Development of a SYBR GreenⅠreal-time PCR assay for specific detection ofPseudomonasplecoglossicida[J]. Chinese Journal of Preventive Veterinary Medicine, 2015, 37(1):35-39.(in Chinese)
8 BORGLIN S, JOYNER D, DEANGELIS K M, et al. Application of phenotypic microarrays to environmental microbiology[J]. Current Opinion in Biotechnology, 2012, 23(1):41-48.
9 JULIEN L L,HALIM B, SYLVIE S,et al. Reducing activity, glucose metabolism and acid tolerance response ofBacilluscereusgrown at various pH and oxydo-reduction potential levels[J].Food Microbiology,2015, 46:314-321.
10 NYSTROM T,GUSTAVSSON N.Maintenance energy requirement: what is required for stasis survival ofEscherichiacoli?[J].Biochimica et Biophysica Acta: Bioenergetics,1998,1365(1):225-231.
11 岳晓禹, 李自刚, 郝修振,等. 主要生态因子对贮藏玉米中黄曲霉生长影响的模拟[J]. 农业工程学报, 2013,29(18):269-276. YUE Xiaoyu, LI Zigang, HAO Xiuzhen,et al. Simulation of effect of main ecological factors on radial growth ofAspergillusflavusduring storage period of corn[J]. Transactions of the CSAE, 2013, 29(18): 269-276. (in Chinese)
12 郭全友, 许钟, 杨宪时. 冷藏罗非鱼特定腐败菌的鉴定和生长动力学[J]. 渔业科学进展, 2009, 30(4):117-123. GUO Quanyou, XU Zhong, YANG Xianshi.Identification and growth dynamics of specific spoilage organisms in chilled tilapia[J]. Progress in Fishery Sciences, 2009, 30(4):117-123.(in Chinese)
13 董庆利, 姚远, 赵勇,等. 铜绿假单胞菌的温度、pH值和乳酸钠主参数模型构建[J/OL]. 农业机械学报, 2014, 45(1):197-202.http:∥www.j-csam.org/jcsam/ch/reader/view_abstract.aspx?flag=1&file_no=20140131&journal_id=jcsam.DOI:10.6041/j.issn.1000-1298.2014.01.031. DONG Qingli, YAO Yuan, ZHAO Yong, et al. Modelling establishment of the cardinal parameters model as a function of temperature, pH value and sodium lactate forPseudomonasaeruginosa[J/OL]. Transactions of the Chinese Society for Agricultural Machinery, 2014, 45(1):197-202.(in Chinese)
14 EBRAHIMI P, LARSEN F H, JENSEN H M, et al. Real-time metabolomic analysis of lactic acid bacteria as monitored by in vitro NMR and chemometrics[J]. Metabolomics, 2016, 12(4):1-17.
15 DENG Y J, WANG S Y. Synergistic growth in bacteria depends on substrate complexity[J]. Journal of Microbiology, 2016, 54(1):23-30.
16 肖俊松, 单静敏, 曹雁平,等. 多酚通过肠道菌群调节能量代谢研究进展[J]. 食品科学, 2012,33(3):300-303. XIAO Junsong, SHAN Jingmin, CAO Yanping,et al. Research progress in regulation of energy metabolism by polyphenols via intestinal flora[J]. Food Science, 2012,33(3):300-303.(in Chinese)
17 ZAUNMÜLLER T, EICHERT M, RICHTER H, et al. Variations in the energy metabolism of biotechnologically relevant heterofermentative lactic acid bacteria during growth on sugars and organic acids[J]. Applied Microbiology & Biotechnology, 2006, 72(3):421-429.
18 吴雪楠, 孙菁菁, 罗园园,等. 草甘膦对土壤微生物能量代谢的影响[J]. 化学与生物工程, 2016(4):18-21. WU Xuenan, SUN Jingjing, LUO Yuanyuan, et al. Effect of glyphosate on energy metabolism of soil microorganisms[J].Chemistry & Bioengineering, 2016(4):18-21.(in Chinese)
19 GARLAND J L, MILLS A L, YOUNG J S. Relative effectiveness of kinetic analysisvssingle point readings for classifying environmental samples based on community-level physiological profiles (CLPP)[J]. Soil Biology & Biochemistry, 2001, 33(7-8):1059-1066.
20 WANG Y, ZHAO F, XU F, et al. Enhancement of medium-chain-length polyhydroxyalkanoates biosynthesis from glucose by metabolic engineering inPseudomonasmendocina[J]. Biotechnology Letters, 2016,38(2):313-320.
21 田雅楠, 王红旗. Biolog法在环境微生物功能多样性研究中的应用[J]. 环境科学与技术, 2011, 34(3):50-57. TIAN Ya’nan, WANG Hongqi.Application of Biolog to study of environmental microbial function diversity[J]. Environmental Science & Technology, 2011, 34(3): 50- 57.(in Chinese)
22 朱彦祺,郭全友,李保国,等. 不同温度下腐败希瓦氏菌(Shewanelaputrefaciens)生长动力学模型的比较与评价[J]. 食品科学,2016,37(13):147-152. ZHU Yanqi, GUO Quanyou, LI Baoguo, et al. Comparison and evaluation of models for the growth ofShewanellaputrefaciensat different temperatures[J].Food Science,2016,37(13):147-152.(in Chinese)
23 VERSCHUERE L, FIEVEZ V, VOOREN L V, et al. The contribution of individual populations to the Biolog pattern of model microbial communities[J]. Fems Microbiology Ecology, 1997, 24(24):353-362.
24 邢少华,张小栓,马常阳,等. 波动温度下罗非鱼微生物生长动力学模型[J/OL]. 农业机械学报,2013,44(7):194-198.http:∥www.j-csam.org/jcsam/ch/reader/view_abstract.aspx?flag=1&file_no=20130734&journal_id=jcsam.DOI:10.6041/j.issn.1000-1298.2013.07.034. XING Shaohua, ZHANG Xiaoshuan, MA Changyang, et al. Microbial growth kinetics model of Tilapia under variable temperatures[J/OL].Transactions of the Chinese Society for Agricultural Machinery, 2013,44(7):194-198.(in Chinese)
25 郑华, 陈法霖, 欧阳志云,等. 不同森林土壤微生物群落对Biolog-GN板碳源的利用[J]. 环境科学, 2007, 28(5):1126-1130. ZHENG Hua, CHEN Falin, OUYANG Zhiyun,et al.Utilization of different carbon sources types in Biolog-GN microplates by soil microbial communities from four forest types[J]. Environmental Science, 2007, 28(5):1126-1130.(in Chinese)
26 李志斐, 王广军, 谢骏,等. 草鱼养殖池塘生物膜固着微生物群落碳代谢Biolog分析[J]. 水产学报, 2014, 38(12):1985-1995. LI Zhiwen, WANG Guangjun, XIE Jun,et al.Microbial carbon metabolic characteristics of biofilm communities in the grass carp culture pond based on Biolog-ECO plates[J]. Journal of Fisheries of China, 2014, 38(12):1985-1995.(in Chinese)
27 王虎玄,岳田利,胡仲秋,等. 陕西浓缩苹果汁中高渗酵母的分离鉴定[J/OL]. 农业机械学报,2015,46(4):246-251.http:∥www.j-csam.org/jcsam/ch/reader/view_abstract.aspx?flag=1&file_no=20150436&journal_id=jcsam.DOI:10.6041/j.issn.1000-1298.2015.04.036. WANG Huxuan, YUE Tianli, HU Zhongqiu, et al. Identification of osmotolerant yeast in apple juice concentrate from Shaanxi Province[J/OL].Transactions of the Chinese Society for Agricultural Machinery,2015,46(4):246-251.(in Chinese)
28 贾夏,董岁月,周春娟.微生物生态研究中Biolog Eco微平板培养时间对分析结果的影响[J]. 应用基础与科学学报,2013,21(1):10-19. JIA Xia, DONG Suiyue, ZHOU Chunjuan. Effects of Biolog Eco-plates incubation time on analysis results in microbial ecology researches[J]. Journal of Basic Science and Engineering, 2013,21(1):10-19. (in Chinese)
29 CLASSEN A T, BOYLE S I, HASKINS K E, et al. Community-level physiological profiles of bacteria and fungi: plate type and incubation temperature influences on contrasting soils[J]. Fems Microbiology Ecology, 2003, 44(3):319-328.
30 PIERRE N. A simple selection test between the Gompertz and logistic growth models[J]. Technological Forecasting & Social Change, 2014, 88: 98-105.
31 孙俊良, 李新华, 梁新红,等. 不同碳源对黑曲霉产糖化酶活力的影响[J]. 食品科学, 2008, 29(8):433-436. SUN Junliang, LI Xinhua, LIANG Xinhong,et al.Effects of different carbon sources on activity of glucoamylase produced byAspergillusniger[J]. Food Science, 2008, 29(8):433-436.(in Chinese)
32 徐冰洁. 不同碳源条件下功能菌共代谢降解典型PPCPs的效能与机理[D]. 上海: 东华大学, 2014. XU Bingjie. Efficiency and mechanism of tpyical PPCPs degradation by functional strrains through co-metabolism and different carbon sources[D].Shanghai:Donghua University, 2014.(in Chinese)
33 RADKOV A D, MOE L A. Bacterial synthesis of D-amino acids[J]. Applied Microbiology & Biotechnology, 2014, 98(12):5363-5374.

35 ZHANG Z L, ZHENG Q, JIAO N Z. Microbial D-amino acids and marine carbon storage[J]. Science China Earth Science, 2016,59(1):17-24.
38 BALA K, MARSHALL R T, STRINGER W C, et al. Effect ofPseudomonasfragion the color of beef[J]. Journal of Food Science, 1977, 42(5):1176-1179.
39 BUCHERT J, VIIKARI L, LINKO M, et al. Production of xylonic acid byPseudomonasfragi[J]. Biotechnology Letters, 1986, 8(8):541-546.
40 GAMMARIELLO D, INCORONATO A L, CONTE A, et al. Use of sodium lactate and modified atmosphere packaging for extending the shelf life of ready-to-cook fresh meal[J]. Packaging Technology & Science, 2014, 28(2):101-112.
41 MASANA M O, BARRIO Y X, PALLADINO P M, et al. High pressure treatments combined with sodium lactate to inactivateEscherichiacoliO157:H7 and spoilage microbiota in cured beef carpaccio[J]. Food Microbiology, 2015, 46:610-617.
42 SCHELEGUEDA L I, ZALAZAR A L, GLIEMMO M F, et al. Inhibitory effect and cell damage on bacterial flora of fish caused by chitosan, nisin and sodium lactate[J]. International Journal of Biological Macromolecules, 2015, 83:396-402.
43 BINGOL E B, COLAK H, CETIN O, et al. Effects of sodium lactate on the shelf life and sensory characteristics of cig kofte—a turkish traditional raw meatball: effects of sodium lactate on cig kofte[J]. Journal of Food Processing & Preservation, 2014, 38(3):1024-1036.
44 ILHAK O I, GURAN H S. Combined antimicrobial effect of thymol and sodium lactate againstListeriamonocytogenesandSalmonellatyphimuriumin fish patty[J]. Journal of Food Safety, 2014, 34(3):211-217.
Growth Kinetics and Carbon Utilization Analysis ofPseudomonasfragifrom Fish
GUO Quanyou1XIU Yanhui1,2WANG Lumin1JIANG Chaojun1WANG Lei1
(1.EastChinaSeaFisheriesResearchInstitute,ChineseAcademyofFisherySciences,Shanghai200090,China2.CollegeofFoodScienceandTechnology,ShanghaiOceanUniversity,Shanghai201306,China)
Pseudomonasfragiis one of the specific spoilage organisms (SSOs) in aquatic food, especially in refrigeration stage. Aiming to investigate carbon utilization ofP.fragiat different temperatures and study the effect of pH value, NaCl and sodium lactate on growth ofP.fragibased on the kinetics of colour formation. Firstly, bacterial suspension was inoculated in Biolog GEN III plates, respectively incubating at different temperatures (15℃, 25℃ and 33℃). Then the data were fitted by the modified Gompertz equation and kinetic parameters were estimated. Through kinetic parameters (maximum specific growth rate and lag phase), and combining utilization area (S) and average well colour development (AWCD) value, the effect of carbon source utilization at different temperatures and environment factors onP.fragiwas analyzed. Results showed that at 25℃P.fragihad the highest carbon utilization and activity ability, which was followed by 15℃, and the lowest value was got at 33℃. At 15~33℃,P.fragimainly used carbohydrates, amino acids and carboxylic acids. Moreover, the effect of changes of different temperatures on various kinds of carbon sources utilization was obvious, while the effect of changes of different temperatures on utilization rates was not obvious. In carbohydrates α-D-glucose, L-fucose, sucrose and D-mannitol could be better utilizated. In amino acids L-pyroglutamic acid, D-serine, L-alanine, L-glutamic acid could be better utilized. And in carboxylic acids quinic acid, D-gluconic acid, D-glucuronic acid, D-saccharic acid, L-malic acid were better utilized. At 15℃ the pH value was kept at 6.0 or 5.0, which the color maximum rates of color development were close, while at 25℃, pH value of 6.0 was far greater than at pH value of 5.0, and at 33℃ at any pH value, the growth ofP.fragiwas inhibited. At 15~25℃, 4%~8% NaCl and at 33℃, 1%~8% NaCl or pH value of 6.0 or pH value of 5.0, the growth ofP.fragiwas inhibited, and at 15~25℃, 1% NaCl or pH value of 6.0, pH value of 5.0 and at 33℃, 1% NaL the growth ofP.fragiwas promoted. The antibacterial effect onP.fragiand carbon utilization was analyzed which can provide a theoretical basis for optimizing product formulation and guaranteeing product quality.
Pseudomonasfragi; carbon utilization ability; environmental factors; growth kinetics
10.6041/j.issn.1000-1298.2017.06.042
2016-10-25
2016-11-21
国家自然科学基金项目(31371867)、上海市自然科学基金项目(16ZR1444900)和中国水产科学研究院东海水产研究所基本科研业务费项目(2011M04、2014G02)
郭全友(1974—),男,副研究员,主要从事水产品加工与安全保障研究,E-mail: dhsguoqy@163.com
王鲁民(1963—),男,研究员,主要从事渔业工程材料与设施研究,E-mail: lmwang@ecsf.ac.cn
TS254.4
A
1000-1298(2017)06-0319-09

