中缝背核内5-HT1受体在帕金森病中的调节作用
曹健,张谨,吕书轩,常晋瑞
(1.西安医学院基础医学部生理教研室,陕西西安710021;2.西安交通大学医学部生理学与病理生理学系,陕西西安710061)
中缝背核内5-HT1受体在帕金森病中的调节作用
曹健1,张谨2,吕书轩2,常晋瑞1
(1.西安医学院基础医学部生理教研室,陕西西安710021;2.西安交通大学医学部生理学与病理生理学系,陕西西安710061)
帕金森病主要病理改变是黑质致密部的DA能神经元变性坏死,同时伴随有DRN中5-HT神经元缺失以及5-HT释放量减少。主要是通过相关的5-HT1受体对5-HT能神经元的活动起负反馈抑制作用。也可以通过与5-HT能神经元有突触联系的抑制性的中间神经元,间接促进其功能活动。
5-HT1受体;中缝背核;帕金森病
帕金森病(Parkinson's disease,PD)是一种以运动系统损害为主的神经变性疾病,其主要病理学改变是黑质致密部(substantia nigra pars compacta,SNc)的多巴胺(dopamine,DA)能神经元变性坏死导致纹状体DA含量显著降低,从而引起的基底神经节的功能紊乱[1-2]。PD的主要病理改变是黑质致密部多巴胺(dopamine,DA)能神经元的变性坏死,导致纹状体的DA含量显著减少,进而导致基底神经节环路的功能紊乱,从而引起PD的运动系统症状。其另一重要病理变化是神经元胞质中出现一种嗜酸性包涵体路易小体。路易小体不仅出现在SNc,还可见于其他脑区,包括皮层、下丘脑、杏仁核、蓝斑、嗅球、迷走神经核、外周自主神经系统等[3]。研究表明,这些区域路易小体的出现可能与PD的非运动症状相关[2]。
1 DRN的神经解剖学联系
在脑内,5-羟色胺(5-hydroxytryptamine,5-HT)能神经元主要集中在脑干的中缝核团,其中中缝背核(dorsal raphe nucleus,DRN)是脑内5-HT能神经元的主要聚集地之一,含有大量的密集的5-HT能神经元以及5-HT受体。DRN接受的传入投射复杂多样,它们共同调节DRN内5-HT能神经元的电活动及5-HT的释放。支配调节DRN中5-HT神经元的纤维的主要区域包括有内侧前额叶皮质(the medial prefrontal cortex,mPFC)、外侧缰核(the lateral habenula,LHB)、蓝斑核(locus coreuleus,LC)、一些中脑的区域比如中脑黑质(the substantia nigra,SN)以及中脑导水管周围灰质(the periaqueductal gray matter,PAG)和一些下丘脑(hypothalamic,HTL)部分。主要的神经递质包括来自LC的去甲肾上腺素(noradrenaline,NA)、来自mPFC的谷氨酸(glutamate,Glu)、来自从HTL和PAG投射而来的γ-氨基丁酸(γ-aminobutyric acid,GABA)能神经递质。从SN和腹侧被盖区(ventral tegmental area,VTA)还有纤维投射支配DRN中的DA能神经元[4]。
2 DRN中5-HT1受体的分布
在神经系统内,5-HT是广泛存在于中枢神经系统中的一种单胺类神经递质,主要通过与5-HT受体结合发挥生物学效应。5-HT受体在脑内分布广泛,参与调节机体的多项生理机能。根据其分子结构及药理学特性,可分为七个家族(5-HT1~5-HT7),包括至少14种不同的受体亚型[5-6]。除5-HT3受体为配体门控离子通道型受体外,其余都是七次跨膜的G蛋白耦联受体。其中5-HT1受体分为5-HT1A、5-HT1B、5-HT1D、5-HT1E和5-HT1F五种亚型,与细胞膜上的Gi/o蛋白结合,激活后抑制环磷酸腺苷(cyclic adenosine 3',5'-monophosphate,cAMP)的生成。大量证据表明5-HT1A、5-HT1B、5-HT1D受体对于DRN中5HT的释放起重要的调节作用,而5-HT1E和5-HT1F受体作用尚不明确[7]。
2.15 -HT1A受体5-HT1A受体在脑内分布最为广泛,在DRN内5-HT能神经元和GABA能神经元都有高密度5-HT1A受体,其更多表达于5-HT能神经元的胞体和树突上,作为自身受体调节5-HT能神经元的活动及5-HT的合成和释放。5-HT1A受体可通过G蛋白与K+通道相连,激活5-HT1A受体可使K+通道活动增强而使细胞产生超极化,从而抑制5-HT能神经元的电活动,并减少5-HT纤维末梢在胞体周围及投射区域的释放[8]。研究发现该受体激活后可以缓解焦虑和抑郁的症状。此外还与认知功能、体温、摄食和性行为的调节有关[9-10]。
2.25 -HT1B受体5-HT1B受体在脑内主要表达于苍白球和黑质致密,在DRN中也有大量表达,该受体激活后可抑制突触后电位产生,引起5-HT和乙酰胆碱等递质的释放减少,参与调节情绪、认知功能、体温、疼痛和摄食等功能。在DRN中5-HT1B受体可作为自身受体存在于5-HT能神经元的轴突末梢,也可以以异身受体表达于非5-HT能神经元的突触前膜上[11]。可分别通过5-HT能神经元表面的自身受体或者非5-HT能神经元的异体受体两种途径,调节5-HT以及其他包括乙酰胆碱、去甲肾上腺素、DA、GABA、Glu等神经递质的释放。现有证据表明5-HT1B受体的活动主要更主要是通过与5-HT有突触联系的抑制性的中间神经元,间接促进其功能活动[11-12]。
2.35 -HT1D受体大鼠体内的5-HT1D受体主要分布于SN、苍白球、尾状核、壳核、海马和皮层,在DRN内也有适度表达,受体激活后通过抑制cAMP而减小突触后电位的产生。该受体与5-HT1B受体在功能上有着相似的效应,同时对5-HT1B受体起协同作用。激活5-HT1D受体后可使脑内5-HT、GABA、Glu释放减少。选择性5-HT1D受体激动剂舒马曲坦能有效的抑制DRN中5-HT递质的释放。
3 PD状态下DRN中5-HT1受体的功能变化
DRN内神经元的活动由核团内5-HT递质的释放来调节[13],而5-HT受体可作为自身受体存在于5-HT能神经元对5-HT能神经元的活动起负反馈抑制作用。其中5-HT1A受体主要位于神经元的胞体,而5-HT1B受体则位于神经元的轴突末梢,5-HT1D受体也主要位于轴突末梢也包括部分树突。同时也可以通过存在于非5-HT能的中间神经元上的异身受体进而对5-HT递质的释放产生调控。通过研究发现,三种受体在5-HT与非5-HT能神经元都有所表达,但5-HT1A受体以自身受体为主,而5-HT1B与5-HT1D受体更主要通过异身受体发挥调节作用。
PD主要的病理学变化是SNc内的DA能神经元的变性缺失,此外包括NA、乙酰胆碱和5-HT等递质系统也都受到影响[14-15]。PD状态下,中缝核群的5-HT能神经元丢失,且5-HT能神经元内出现路易小体,最终引起5-HT递质水平的下降[16-17]。尤其是来自mPFC的谷氨酸能神经纤维的投射,对DRN 5-HT能神经元的活动及5-HT递质的释放发挥重要的调节作用[18]。在6-OHDA单侧损毁SNc的PD大鼠,其VTA的DA能神经元可减少,D1、D2受体的下调减弱了DA能传入对mPFC锥体神经元的抑制作用,使mPFC的锥体神经元过度兴奋。mPFC传入活动增强,使DRN中5-HT能神经元的兴奋,增加了DRN中5-HT递质的释放。5-HT递质释放的增多可通过与5-HT1A自身受体结合从而抑制了5-HT能神经元自身或其他5-HT能神经元的活动,同时5-HT递质还可与5-HT能神经元树突及轴突上的5-HT1B和5-HT1D受体结合抑制突触后电位产生,引起5-HT等递质的释放减少。另一方面mPFC兴奋了以GABA能为主的中间神经元,通过与中间神经元存在的5-HT1B、5-HT1D以及GABAA等受体结合,对周围的5-HT能神经元产生抑制作用。此外,5-HT转运体可将细胞间隙的5-HT重摄取,从而降低胞外5-HT浓度,在5-HT神经递质的微调中起重要作用。而在PD早期,患者中缝核团等多个脑区中5-羟色胺转运体水平显著降低[19],5-HT的再摄取活动受到抑制,从而降低了5-HT递质的释放(见图1)。
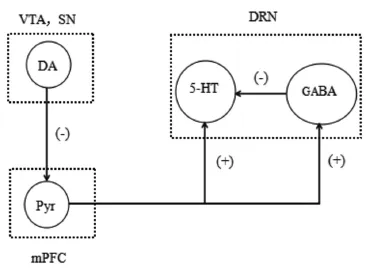
图1mPFC锥体神经元与DRN 5-HT能神经元投射示意图注:Pyr,Pyramidal neurons锥体神经元。
当然,PD状态下,DRN中还出现其他受体的活动变化包括5-HT2、5-HT7和GABAA受体等,均对5-HT递质活动产生重要的调节作用,但5-HT1受体特别是5-HT1A表达量最高,在其中起着关键性的调节作用。
4 展望
PD状态下,DRN内出现5-HT神经元缺失的同时递质释放量减少,相关受体功能活动产生变化,其中5-HT1A、5-HT1B、5-HT1D受体发挥着重要的调节作用,与PD的发生及相关症状的产生密切联系,对5-HT1受体的关注和研究有望对PD的预防与治疗提供新的思路。
[1]Surmeier DJ,Sulzer D.The pathology roadmap in Parkinson disease [J].Prion,2013,7(1):85-91.
[2]Rana AQ,Masroor MS,Khan AS.A review of methods used to study cognitive deficits in Parkinson's disease[J].Neurol Res,2013,35(1):1-6.
[3]Braak H,Braak E,Yilmazer D,et al.Nigral and extranigral pathology in Parkinson's disease[J].J Neural Transm Suppl,1995,46:15-31. [4]Adell A,Celada P,Abellan MT,et al.Origin and functional role of the extracellular serotonin in the midbrain raphe nuclei[J].Brain Res Brain Res Rev,2002,39(2-3):154-180.
[5]Barnes NM,Sharp T.A review of central 5-HT receptors and their function[J].Neuropharmacology,1999,38(8):1083-1152.
[6]Tierney PL,Degenetais E,Thierry AM,et al.Influence of the hippocampus on interneurons of the rat prefrontal cortex[J].Eur J Neurosci,2004,20(2):514-524.
[7]McDevitt RA,Neumaier JF.Regulation of dorsal raphe nucleus function by serotonin autoreceptors:a behavioral perspective[J].J Chem Neuroanat,2011,41(4):234-246.
[8]Blier P,de Montigny C.Modification of 5-HT neuron properties by sustained administration of the 5-HT1A agonist gepirone:electrophysiological studies in the rat brain[J].Synapse,1987,1(5):470-480.
[9]Butt I,Hong A,Di J,et al.The effects of serotonin1A receptor on female mice body weight and food intake are associated with the differential expression of hypothalamic neuropeptides and the GABAA receptor[J].Neuropeptides,2014,48(5):313-318.
[10]Snoeren EM,Veening JG,Olivier B,et al.Serotonin 1A receptors and sexual behavior in female rats:a review[J].Pharmacol Biochem Behav,2014,121:43-52.
[11]Adell A,Celada P,Artigas F.The role of 5-HT1B receptors in the regulation of serotonin cell firing and release in the rat brain[J].J Neurochem,2001,79(1):172-182.
[12]Evrand A,Laporte AM,Chastanet M,et al.5-HT1A and 5-HT1B receptors control the firing of serotonergic neurons in the dorsal raphe nucleus of the mouse:studies in 5-HT1B knock-out mice[J].Eur J Neurosci,1999,11(11):3823-3831.
[13]Samii A,Nutt JG,Ransom BR.Parkinson's disease[J].Lancet,2004, 363(9423):1783-1793.
[14]Miyawaki E,Meah Y,Koller WC.Serotonin,dopamine,and motor effects in Parkinson's disease[J].Clin Neuropharmacol,1997,20(4):300-310.
[15]Scatton B,Javoy-Agid F,Rouquier L,et al.Reduction of cortical dopamine,noradrenaline,serotonin and their metabolites in Parkinson's disease[J].Brain Res,1983,275(2):321-328.
[16]Gai WP,Blessing WW,Blumbergs PC.Ubiquitin-positive degenerating neurites in the brainstem in Parkinson's disease[J].Brain,1995, 118(Pt 6):1447-1459.
[17]Halliday GM,Li YW,Blumbergs PC,et al.Neuropathology of immunohistochemically identified brainstem neurons in Parkinson's disease[J].Ann Neurol,1990,27(4):373-385.
[18]Kish SJ,Tong J,Hornykiewicz O,et al.Preferential loss of serotonin markers in caudate versus putamen in Parkinson's disease[J].Brain, 2008,131(Pt 1):120-131.
[19]Wang JL,Oya S,Parhi AK,et al.In vivo studies of the SERT-selective[18F]FPBM and VMAT2-selective[18F]AV-133 radiotracers in a rat model of Parkinson's disease[J].Nucl Med Biol,2010,37(4):479-486.
Role of dorsal raphe nucleus 5-HT1 receptor in regulating Parkinson's disease.
CAO Jian1,ZHANG Jin2,LV Shu-xuan2,CHANG Jin-rui1.
1.Department of Physiology,School of Basic Medical Science,Xi'an Medical University, Xi'an 710021,Shaanxi,CHINA;2.Department of Physiology and Pathophysiology,Xi’an Jiaotong University Health Science Center,Xi'an 710061,Shaanxi,CHINA
The main pathological change in Parkinson's disease involves the degenerative necrosis of DA neurons in substantia nigra pars compacta,accompanied by the loss of 5-HT neurons in the DRN and a decrease in 5-HT release.It mainly results from the inhibitory feedback control of 5-HT neurons through relevant 5-HT1 receptors,or the indirect functional promotion via a proposed synaptic connection 5-HT-mediated inhibitory interneuronal neurons.
5-HT1 receptor;Dorsal raphe nucleus;Parkinson's disease
R742.5
A
1003—6350(2017)11—1816—03
2017-03-17)
10.3969/j.issn.1003-6350.2017.11.032
陕西省教育厅专项科研计划项目(编号:15JK1616);西安医学院配套基金项目(编号:2016PT05);西安医学院博士科研启动基金项目(编号:2015DOC01);西安医学院学科建设经费
曹健。E-mail:littlegrass123@163.com

