猪轮状病毒与猪传染性胃肠炎病毒混合感染的实验室诊断
方振华 沈振国 孙倩 丁利

摘要[目的]对海南省某猪场腹泻病死仔猪病原进行实验室诊断。[方法]通过临床症状观察与病理剖检,结合RT-PCR方法和病毒的分离培养进行病原鉴定。[结果]经过RT-PCR扩增,获得了PRV和TGEV阳性目的片段;应用MA-104细胞与PK-15细胞分别进行PRV与TGEV的分离培养后,可见典型的细胞病变,经过RT-PCR进一步鉴定最终确诊为PRV和TEGV混合感染。[结论]通过采用紧急接种和保守治疗等综合防治措施,获得了较好的防控效果。
关键词猪轮状病毒;猪传染性胃肠炎病毒;混合感染;实验室诊断
中图分类号S858.28文献标识码A文章编号0517-6611(2017)14-0089-02
Abstract[Objective] To make laboratory diagnosis of dead pigs from a hoggery of Hainan Province.[Method] By using the clinical examination,pathologic autopsy,RTPCR and cell culture methods,the pathogen of dead pigs were separated and identified.[Result] The positive fragments of porcine rotavirus(PRV)and transmissible gastroenteritis virus (TGEV)were obtained by RTPCR.After PRV and TGEV were isolated and cultured in MA104 cells and PK15 cells respectively,the typical cytopathic effect displayed.The mixed infection of PRV and TGEV was further identified by RTPCR.[Conclusion] Better curative effects were obtained after comprehensive treatment measures such as emergent inoculation and conservative treatment were taken.
Key wordsPorcine rotavirus;Transmissible gastroenteritis virus;Mixed infections;Laboratory diagnosis
豬傳染性胃肠炎病毒(Porcine transmissible gastroenteritis virus,TGEV)是冠状病毒科冠状病毒属成员,可导致猪传染性胃肠炎(Transmissible gastroenteritis,TGE)[1-2]。该病是猪的一种高度接触性肠道传染病,各种年龄的猪均可发病,以呕吐、严重腹泻和失水为主要特征,10日龄以内的仔猪病死率很高,可达100%。近几年来,我国该病的发生和流行呈上升趋势,给养猪业造成了极大的经济损失[3-5]。猪轮状病毒(Porcine rotavirus,PRV)属于呼肠病毒科轮状病毒属的成员,是导致仔猪病毒性腹泻的主要病原之一[6-7]。该病毒易感染仔猪,尤其是1~4周龄仔猪的发病率可超过80%,该病在世界范围内均有分布[8-9]。猪传染性胃肠炎和猪轮状病毒感染的发病年龄、流行特点、临床症状及病理变化十分相似,时有混合感染[10]。传统的诊断方法(如临床观察病变、荧光抗体检测、免疫组织化学法等)操作步骤较为繁琐,且较难进行TGEV和PRV鉴别诊断。2016年12月,海南省某猪场哺乳仔猪出现拉稀症状,并迅速波及全群,排黄白色、水样有恶臭味的粪便,病猪呕吐物中有未消化的凝乳块。仔猪体重减轻,脱水严重。10日龄内新生仔猪多在腹泻后2~4 d死亡,病死率达100%。笔者通过临床症状观察和病理剖检,结合RT-PCR和病毒的分离培养进行病原鉴定。
1材料与方法
1.1试验材料动物组织/细胞基因组RNA提取试剂盒和琼脂糖凝胶DNA回收试剂盒均为北京索莱宝科技有限公司产品;反转录试剂盒和PCR SuperMix购自北京全式金生物技术有限公司;病料来自海南某猪场。
1.2试验方法
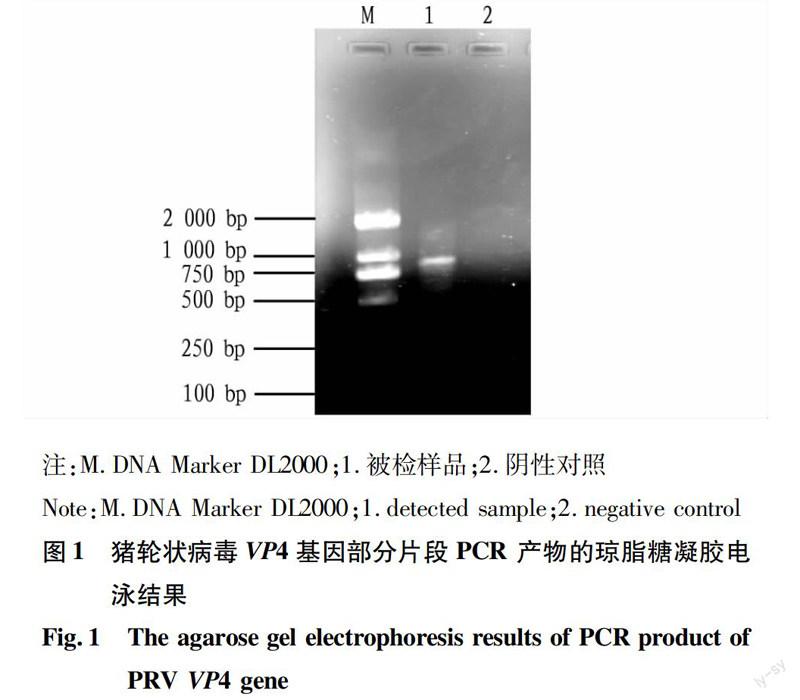
1.2.1PRV VP4 基因引物。根据GenBank 数据库的PRV-VP4 保守序列,设计1 对引物,并由上海生物工程股份有限公司合成。上游引物P1为5′-CACCAAACGCAACAACAGGA-3′;下游引物P2为5′-GATTAGCTGCTGGAAGTCCGT-3′。预计扩增基因片段822 bp。
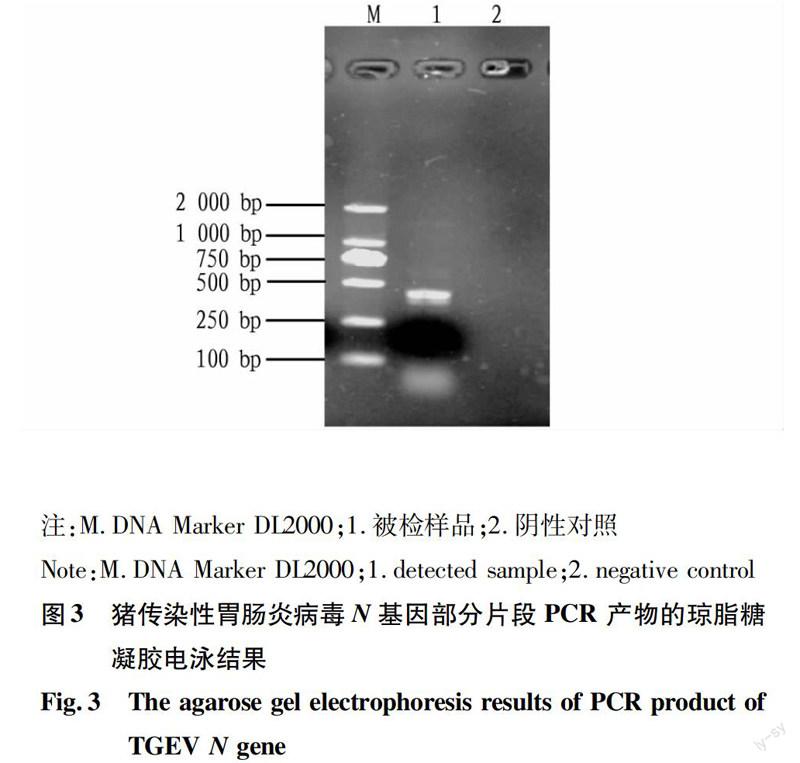
1.2.2TGEV N 基因引物。根据GenBank数据库的TGEV-N 保守序列设计1 对引物。上游引物为5′-AGAGGCAGGCAACAATCCAA-3′,下游引物为5′-GTGACTTCTATCTGGTCGCCAT-3′。预计扩增基因片段386 bp。
1.2.3病毒RNA 的提取。取病猪腹泻粪便0.1 g,加入1.5 mL 离心管中,用生理盐水2倍稀释,反复冻融3次,4 ℃ 5 000 r/min 离心10 min,收集上清液。上清液按照总RNA 提取试剂盒的说明书进行总RNA提取。
1.2.4RT-PCR。
1.2.4.1cDNA合成。以提取的总RNA 为模板,以Oligo(dT)18为引物,进行反转录(RT)反应。反应体系为:总RNA 2 μL、Oligo(dT)18(0.5 μg/μL)1 μL、2×TS Reaction Mix 10 μL、Trans Script RT/RI Enzyme Mix 1 μL、RNase-free Water 6 μL。反应条件为:42 ℃孵育 30 min,85 ℃ 5 min。最后,将反转录产物于-20 ℃下保存,备用。
1.2.4.2PCR。反应体系:模板cDNA 2 μL、SuperMix 12.5 μL、上下游引物(20 μmol/L)各1 μL、用灭菌的ddH2O补至25 μL。反应程序:94 ℃预变性5 min;94 ℃变性30 s,53 ℃退火30 s,72 ℃延伸30 s,共34个循环;循环结束后,72 ℃延伸10 min。反应完毕,PCR产物经过1.0%琼脂糖凝胶电泳进行检测。
1.2.5病毒分离。将上述处理的病料上清经0.22 μm滤膜过滤后接种于MA-104细胞和PK-15细胞,同时设置正常细胞对照,37 ℃下吸附1 h,加入含2%胎牛血清DMEM维持液,置于37 ℃二氧化碳培养箱中培养,并盲传3代,观察细胞病变,并将细胞培养物进行PRV和TGEV的PCR检测。
2结果与分析
2.1PRV检测结果
2.1.1病料PCR检测结果。将采集的病料经过常规方法处理后,以提取总RNA为模板,进行RT-PCR扩增。经扩增,得到1条822 bp 的特异性条带(图1),表明待测样品为PRV阳性。
2.1.2PRV的分离培养及鉴定。将PRV阳性病料过滤后接种于MA-104细胞,经盲传3代后,培养48 h,细胞出现散在的灶状细胞病变;培养72~96 h,细胞变圆,部分细胞脱落(图2)。将细胞培养液进行PRV检测,结果发现所分离病毒为PRV。
2.2TGEV检测结果
2.2.1病料PCR检测结果。将采集的病料经过RT-PCR扩增,得到1条386 bp的特异性条带(图3),表明待测样品为TGEV阳性。
2.2.2TGEV的分离培养及鉴定。将TGEV阳性病料过滤后接种于PK-15细胞,经盲传3代后,培养24 h,部分细胞出现皱缩;培养48~72 h,细胞聚集成团、脱落(图4)。将细胞培养液进行TGEV检测,结果发现所分离病毒为TGEV。
3讨论与结论
猪传染性胃肠炎病毒和猪轮状病毒均是引起仔猪腹泻的重要病原体,近年来,随着我国养猪规模的不断扩大,这2种病原引起的猪病呈上升趋势,且多呈混合感染,给养猪业造成了巨大的经济损失[4,10]。猪轮状病毒和传染性胃肠炎病毒的靶细胞均为猪小肠黏膜上皮细胞[1,11]。病毒混合感染时,感染病猪的小肠黏膜上皮细胞的损伤程度加剧,表现为大量上皮细胞变性、坏死,肠绒毛显著萎缩变短,甚至脱落。由此可见,当2种病毒混合感染时,仔猪的呕吐、腹泻和脱水等病症远较单一病原引起的症状更为严重,病死率远比单一病毒感染引起的高,给养殖场造成的经济损失也会更大。
鉴别与诊断PRV、TGEV的传统方法主要有抗原检测、电镜观察、病毒的分离与鉴定、血清学诊断等[12-13],这些方法大多操作比较繁琐,且周期长,灵敏度不高。RT-PCR技术具有灵敏度高、特异性强、操作简便快捷等优点,可以大大提高检测效率。于晓龙[10]、闫兆吉等[13]对来自各猪场的病料进行了PRV和TGEV调查,认为RT-PCR方法是鉴别诊断TGEV 和PRV 最特异、敏感的方法。在该病例的诊断过程中,在进行临床症状观察及尸体剖检的基础上,选择RT-PCR检测技术作为确诊的依据,并对病料进行病毒的分离和鉴定,进一步验证了RT-PCR结果的准确性。笔者通过深入养殖场调查,发现该养猪场存在饲养管理水平较低、养殖密度高、免疫程序制定不合理等問题,造成了猪只免疫力下降,从而导致疾病的发生。目前,猪轮状病毒和猪传染性胃肠炎病毒感染尚无有效的治疗药物,对于患病猪只应大量补充等渗葡萄糖氯化钠溶液,供给大量清洁饮水,进行紧急接种、保守治疗,淘汰部分发病猪只等,同时养殖场应采取合理的监控措施及免疫程序,加强卫生和饲养管理,提高猪群的抵抗力是最为有效的防治方法。
参考文献
[1] SONG Z H,DAI X J,YE C F,et al.Morphogenesis and proliferative rule of porcine transmissible gastroenteritis virus in porcine intestinal epithelial cells[J].J Virol methods,2016,238(12):6-12.
[2] HU X L,LI N N,TIAN Z G,et al.Molecular characterization and phylogenetic analysis of transmissible gastroenteritis virus HX strain isolated from China[J].BMC Vet Res,2015,11:72.
[3] 王黎,李碧,周远成,等.猪传染性胃肠炎病毒RT-PCR检测方法的建立及临床应用[J].中国兽医学报,2015,35(2):190-194.
[4] 徐静.猪传染性胃肠炎病毒分离及部分特性鉴定[D].哈尔滨:东北农业大学,2015.
[5] 宋林林,王晓红,姜博,等.猪传染性胃肠炎病毒陕西分离株S蛋白抗原位点的真核表达[J].动物医学进展,2016,37(8):6-10.
[6] HULL J J,MARTHALER D,ROSSOW S,et al.Genomic sequence of the first porcine rotavirus group H strain in the United States[J].Genome Announc,2016,4(2):1763-1777.
[7] GHOSH S,NAVARRO R,MALIK Y S,et al.Whole genomic analysis of a porcine G6P[13] rotavirus strain[J].Vet Microbiol,2015,180(3/4):286-298.
[8] MAO X B,LIU M H,TANG J,et al.Dietary leucine supplementation improves the mucin production in the jejunal mucosa of the weaned pigs challenged by porcine rotavirus[J].PLoS One,2015,10(9):137380.
[9] 马士博.猪轮状病毒流行毒株的分离及部分特性鉴定[D].哈尔滨:东北农业大学,2015.
[10] 于晓龙.猪传染性胃肠炎病毒和猪轮状病毒混合感染的PCR 检测[J].中国农学通报,2006,22(8):33-35.
[11] 王静.永生化猪小肠上皮细胞系的建立及豬轮状病毒对其影响的研究[D].杨凌:西北农林科技大学,2014.
[12] 高云航,孙泽威.猪轮状病毒病诊断技术综述[J].吉林农业大学学报,1999,21(S1):77-79.
[13] 闫兆吉,刘婷婷,张惠,等.猪流行性腹泻、猪传染性胃肠炎和轮状病毒混合感染的诊断实例[J].中国猪业,2014(12):49-51.

