中考化学试卷答题必须注意的问题
李汝驿

一、认真审题 解题前提
例1.(南京市)图1中A~I是初中化学常见的物质,且分别是由H、C、O、Na、Al、S、Ca、Cu、Ag中的一种或几种元素组成的。在通常情况下,D与其他物质的状态不同;D、G、H、I均为单质,其中G为紫红色固体,H在空气中表面生成一层致密的氧化膜,具有很好的抗腐蚀性能;B可用来改良酸性土壤;A、F均为由三种元素组成的盐。图中“—”表示两端的物质间能发生化学反应,“→”表示物质间存在转化关系;部分反应物、生成物或反应条件已略去。 [A][B][C][E][F][G][I][C][D][H]
图1
(1)写出化学式:G 。
(2)写出A与C反应的化学方程式:
。
写出D与E反应的化学方程式:
。
写出H→I反应的化学方程式:
。
解析:审析试题可知,G为紫红色的固体单质,应为Cu;H在空气中表面可生成一层致密的氧化膜,具有很好的抗腐蚀性能,应为Al;B可用来改良酸性土壤,应为Ca(OH)2;A为含有三种元素的盐,且能与B[Ca(OH)2]反应,可能为Na2CO3;A还能与C反应,C应是酸,依据题设所给出的元素,可知C应是H2SO4;C能通过反应生成D,又知D与其他物质状态不同,则D应为H2;D可与E反应,E能生成F,F又能生成G(Cu),则E为CuO;C(H2SO4)能生成F,则F应是CuSO4;再有G(Cu)和H(Al)都能生成I,I为单质,则I为Ag。
答案:(1)Cu (2)Na2CO3+H2SO4=Na2SO4+H2O+CO2↑ H2+CuO[]Cu+H2O Al+ 3AgNO3=Al(NO3)3+3Ag
【点悟】这是一道框图推断题,结构紧凑、内涵丰富、关系隐蔽、综合性强,既考查了基本概念和元素化合物知识,又考查了学生的分析推理和判断能力,是中考的重点题型之一。解答此类题可采取“先突后理”的求解原则,即审析试题首先找出“突破口”,而后在此基础上去“理顺”相应转化关系。一些物质的特点,如状态、颜色、用途、反应特点等,往往是突破口,以它作为求解的起点,理顺关系,便是求解的道路,最后则找出“桥”或“船”(联系所学知识),进行解答。
由此题的求解过程可知,审题是解题的关键、基础、前提、保证,通过审题可明确“知”和“求”。如在此题中,依据物质有关特点确定Cu、Al、Ca(OH)2,再依据相互转化的反应关系、特点推出Na2CO3、H2SO4、H2等,进而逐步完成求解。写化学反应方程式相对较容易,但确定是何种物质参加反应就较困难了,不审题就找不出相应关系,挖不出隐含,排不出干扰,也就无法完成解答。在审题时要做到“三清”和“三忌”:“三清”为题意清,设问清,思路清;“三忌”为忌视而不见,忌视而不全,忌视而不明。总之,要做题,先审题;不审题,别做题。
二、联系所学 准确解答
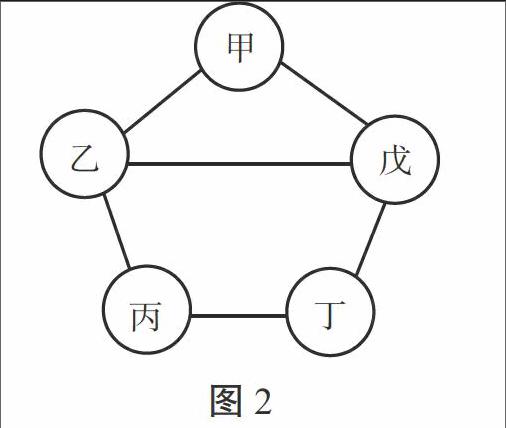
例2.(连云港市)如图2所示,甲、乙、丙、丁、戊五种物质分别是铁、盐酸、氢氧化钙、硫酸铜、碳酸钠中的一种。连线两端的物质间能发生化学反应,甲与戊反应产生的气体能使澄清石灰水变浑浊,丙溶液为蓝色。下列能替代图中丁物质的是( ) [甲][乙][丙][丁][戊]
图2
A.Ag B.BaCl2
C.NaOH D.CuO
解析:审析试题可知,丙溶液为蓝色,应是CuSO4;由甲与戊反应产生的气体可使澄清石灰水变浑浊可知,甲和戊分别是Na2CO3和HCl中的一种,则乙和丁分别是Fe和Ca(OH)2中的一种。由图示可知,乙物质能与甲、丙、戊三种物质发生反应,而丁只能和丙、戊两种物质反应。所以,乙应是Ca(OH)2,丁是Fe,则甲是Na2CO3,戊是HCl。能代替丁物质的必须是能与丙(CuSO4)反应,又能与戊(HCl)反应的物质,只有NaOH符合题意。
答案:C
【点悟】此题难度不大,只要熟悉物质的性质及其相互反应关系就可以顺利求解。所以我们对于平时所学的知识一定要进行深刻地认识和充分地理解,达到融会贯通,并能在实际运用中消化和吸收,使之被牢固掌握。这就要求我们注意对所学知识进行归纳和总结,使之条理化、系统化,形成完整的知识结构,并注意在实际运用中不断提高分析和推理能力,以达准确解题之目的。
三、图像不清 错误易生
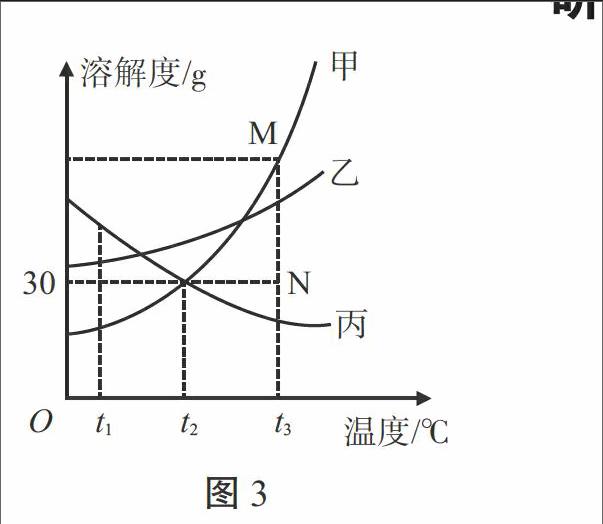
例3.(泰安市)图3是甲、乙、丙三种物质的溶解度曲线。下列叙述正确的是( ) [溶解度/g][30][甲][乙][丙][M][N][O t1 t2 t3][温度/℃]
图3
A.t1 ℃时,等质量的甲、丙两物质的溶液中所含溶质的质量为丙>甲
B.t2 ℃时,20 g丙溶解于50 g水中能形成70 g溶液
C.分别将三种物质的饱和溶液从t3 ℃降温至t2 ℃时,所得溶液溶质质量分数的大小关系为乙>甲=丙
D.若要将组成在N点的甲溶液转变为M点的甲溶液,可采取恒温蒸发溶剂的方法
解析:这是一道有关溶解度曲线的试题。A项,t1 ℃时,等质量的甲、丙两物质的饱和溶液中所含溶质质量为丙>甲,但题设中没有说明溶液是否饱和,错误;B项,t2 ℃时,丙的溶解度为30 g,此时将20 g丙加入50 g水中,只能溶解15 g丙,所得溶液为65 g,错误;C项,由图像可知,甲、乙两物质的溶解度是随温度的升高而增大的,而丙物质的溶解度是隨温度的升高而减小的,当三种物质的饱和溶液从t3 ℃降至t2 ℃,甲、乙两物质的溶解度减小,会有晶体析出,溶液仍饱和,而丙物质的溶解度变大,溶液将变为不饱和溶液,其溶质质量分数不变,由图可知,t2 ℃时乙的溶解度大于甲,又知t2 ℃时甲的溶解度大于t3 ℃时丙的溶解度,所以所得溶液的溶质质量分数应为乙>甲>丙,错误;D项,N点表示t3 ℃时甲物质的不饱和溶液,将此温度下的不饱和溶液变为饱和溶液,可采用恒温蒸发溶剂或添加溶质的方法,正确。
答案:D
【点悟】图像题是将化学知识与图像融为一体的题型,其内涵丰富、综合性强,具有一定的迷惑性,在求解时应做到会识图、会析图、会解图。在解答时可使用“先清后算”的方法,即先看清、看懂题意(题设条件、有关信息、所问问题)和图意(图像中的点、线及其变化的特点),再联系所学知识进行分析推理,进而形成求解思路,最后予以解答。在遇到关于交点的设问时,我们要知道:交点相等是有条件的,并非交点必等。
四、运用技巧 试题速解
例4.(绥化市)现有Na2S、Na2SO3、Na2SO4组成的混合物,经测定,其中硫元素的质量分数为32%,则该混合物中氧元素的质量分数为 。
解析:审析试题可知,题设中氧元素和硫元素之间没有某种直接关系,因而从硫元素的质量分数去求氧元素的质量分数难度很大。分析三种物质的组成,不难发现,三种物质中钠原子和硫原子的个数比都是2∶1。依据元素质量比的计算可知,混合物中钠元素和硫元素的质量比为:(23×2)∶(32×1)=46∶32。硫元素的质量分数为32%,则钠元素的质量分数应为46%,由此可求出氧元素的质量分数为:1-46%-32%=22%。
答案:22%
【点悟】混合物中某一元素质量分数的求解,常规解法是设方程组,但一则烦琐,二则费时费力,而且极易出错,甚至被困扰而无从下手。此时,除了需要准确理解基础知识外,还要进行思考和分析,从中找出捷径。遇到此类试题时,我们可采用“先变后算”的求解方法,即先通过分析和思考,对问题进行变通,把复杂问题通过某种方法变为简单容易的问题,以使它们建立起相关量的关系,再进行有关计算。如在本题中,若直接求氧元素的质量分数难度很大,但分析钠原子和硫原子关系后,我们就可以化繁为简、化陌生为熟知、化难为易,迅速得到解答。“先变后算”的前提是变通,如何进行变通绝非是随手可得的,要思考、要分析,还要去探索和实践,去挖掘它们之间的隐含关系及其共同特点,据此而变。变通时若变得准、变得巧、变得好,解题就会快而准,获得事半功倍之效。
五、实验操作 注意先后
例5.(河南省)除去NaCl溶液中CaCl2、MgCl2、Na2SO4杂质的操作有:①加过量的NaOH溶液;②加过量的BaCl2溶液;③过滤;④加适量的盐酸;⑤加过量的Na2CO3溶液。[提示:Mg(OH)2、BaSO4、BaCO3难溶于水]
(1)以上操作合理的先后顺序为
(数字序号不能重复使用)。
(2)请写出BaCl2溶液与Na2SO4溶液反应的化学方程式: 。
(3)上述试剂中的Na2CO3不能用K2CO3代替,请说明原因: 。
解析:(1)由题设可知,除去NaCl溶液中的CaCl2、MgCl2、Na2SO4杂质选择了过量的NaOH溶液、Na2CO3溶液、BaCl2溶液和适量的盐酸。加入NaOH溶液,可使MgCl2转化为沉淀Mg(OH)2;加入BaCl2溶液,可使Na2SO4转化为沉淀BaSO4;加入Na2CO3溶液,可使CaCl2转化为沉淀CaCO3。因为所加入的NaOH、Na2CO3、BaCl2都是过量的,过量的试剂也要除去才行。分析上述三种试剂发现,NaOH和 BaCl2的加入先后不影响除杂效果,而Na2CO3的加入不能在BaCl2之前,否则过量的BaCl2将无法除去,所以Na2CO3必须在BaCl2之后加入,最后再加入适量的盐酸就可除去过量的NaOH和Na2CO3。故合理操作的先后顺序为①②⑤③④或②①⑤③④或②⑤①③④。(2)加入的 BaCl2与Na2SO4反应的化学方程式为BaCl2+Na2SO4=BaSO4↓+2NaCl。(3)不能用K2CO3代替Na2CO3,是因为K2CO3与CaCl2反应生成CaCO3沉淀的同时,又生成了新的杂质KCl。
答案:(1)①②⑤③④(或②①⑤③④或②⑤①③④) (2)BaCl2+Na2SO4=BaSO4↓+ 2NaCl (3)若用K2CO3代替Na2CO3,则K2CO3与CaCl2反应生成CaCO3沉淀的同时又生成了KCl,最后得到的溶液不是纯净的NaCl溶液
【点悟】化学实验的先后顺序不可颠倒,因为它决定着实验的成败及其安全,不可轻视大意。我们对于实验操作的先与后要理解其原理,并能实际运用。如实验组装顺序要注意“四先四后”:①先下后上;②先左后右(①和②均指仪器的装备顺序);③先长后短(指用洗气瓶除杂时进气管要长,以便杂质被充分吸收,出气管要短,以便导出气体);④先净化后干燥。再如,当验证某气体是否含有CO2和H2O时,要先验H2O后验CO2;而当除去CO2和H2O時,要先除去CO2后除去H2O。
六、计算多陷 注意隐含
例6.(哈尔滨市)实验室有98.5 g碳酸钡样品(杂质既不溶于水,也不与酸反应),与100 g氢元素的质量分数为10%的稀硫酸恰好完全反应。则该样品中碳酸钡的质量分数为 ( )
A.12.5% B.19.7%
C.20% D.25%
解析:审析题意可知,100 g稀硫酸中氢元素的质量分数为10%,其质量为:100 g×10%=10 g。稀硫酸是由H2SO4和水组成的,水中也含有氢元素。设H2SO4的质量为x,则水的质量为100 g-x。由氢元素质量可求出H2SO4的质量,即[298]×x+[218]×(100 g-x)=10 g,解得x= 12.25 g。设样品中BaCO3的质量为y,则:
BaCO3+H2SO4=BaSO4↓+H2O +CO2↑
197 98
y 12.25 g
[197y=9812.25 g] y=24.625 g
则样品中碳酸钡的质量分数为:[24.625 g98.5 g]×100%=25%。
答案:D
【点悟】化学计算中题设陷阱进行干扰是普遍存在的,它的特点是“暗”“隐”,但不一定“深”,若不能发现就必然造成求解失误。因此,我们必须认真审题、勤于思考、善于分析,抓住问题的实质和关键,从而识别并避开陷阱,还要注意思维的灵活性和变通性,增强思维的缜密性,提高审题能力。
七、全面分析 谨防疏漏
例7.(哈尔滨市)除去下列各物质中的少量杂质,所选用的试剂和操作方法均正确的是( )
[选项\&物质(括号内为杂质)\&试剂\&操作方法\&A.\&CaCO3(CaO)\&无\&高温\&B.\&H2O(植物油)\&洗涤剂\&振荡、搅拌\&C.\&CuO(铜粉)\&足量氧气\&灼烧\&D.\&KCl(KClO3)\&二氧化锰\&加热\&]
解析:此题为除杂试题,要求所选用的试剂和操作方法都是正确的。分析各选项:A项,对含有CaO的CaCO3进行高温加热,在高温条件下CaCO3会分解为CaO和CO2,杂质无法除去但需要的物质却会除去,错误;B项,向水和植物油的混合物中加洗涤剂,在洗涤剂的乳化作用下,植物油变为小液滴分散于水中,无法除去,错误;C项,在加热条件下,铜粉可与O2反应生成CuO,而CuO不变,从而使杂质铜粉转化为CuO,正确;D项,KClO3在加热和MnO2的催化作用下分解为KCl和O2,虽除去了KClO3,但MnO2却成了新引入的杂质,错误。
答案:C
【点悟】关于除杂提纯过程中所选的试剂和操作方法,要满足“三不”“三必须”和“三优先”。“三不”指不增减(除杂不引杂,提纯物质不减少);不改变(所加试剂一般只与杂质反应,而不与被提纯物质反应,提纯物质质量及状态不改变);不污染。“三必须”指所选试剂必须过量,过量试剂必须除去;除去较多杂质时,必须考虑所加试剂的顺序合理;所用试剂必须易得,其操作方法必须最佳。“三优先”指优先考虑物理方法;优先考虑除去杂质又能增加提纯物的方法;多种方法可除杂时,优先考虑简单并彻底的方法。
八、解答要准 规范要谨
例8.(厦门市)可用带柄V形玻璃管完成以下实验:
溶液][气球][A][B][C][A][B][图4 图5]
(1)如图4所示,往A处注入H2O2溶液,在B处下方加热使硫粉燃烧,产生的气体通入C处后排放的目的是 。写出A处反应的化学方程式: 。
(2)如图5所示,A处盛浓氨水,B处放滴有无色酚酞溶液的长滤纸条,可观察到的现象是 。若另取一相同V形玻璃管(含相同的实验用品),在A处稍加热,在更短的时间内可观察到上述现象,请从微观角度解释: 。
解析:(1)审析试题可知,首先H2O2在MnO2存在下分解放出O2,而后在加热条件下O2与硫粉反应产生SO2气体,最后SO2通过NaOH溶液后排出。反应生成的SO2会污染空气,当其通过NaOH溶液时就会被吸收,从而防止流入空气中进行污染。(2)浓氨水是氨气的水溶液,属于碱类,遇到酚酞溶液时可使其变红。由图5可知,氨气分子在不断地运动,当从A处运动到B处时遇到滴有酚酞溶液的长滤纸条,使滤纸自左向右逐渐变红。若在A处稍加热,分子运动受温度影响,温度升高分子运动加快,就会在稍短时间内到达B处,使滴有酚酞溶液的滤纸条自左向右迅速变红。
答案:(1)防止二氧化硫污染空气 2H2O2[MnO2] 2H2O+O2↑ (2)滴有无色酚酞溶液的长滤纸条自左向右变红 温度越高,分子运动地越快
【点悟】简答题为中考常考题型之一,其题设内容涉及较多、形式灵活,是对学生思维、分析、推理、归纳、总结及表述等多种能力的考查。回答简答题要求我们不仅“知其然”,还要“知其所以然”,所以回答时语言要准确、严谨、精炼、规范,即要做到:答必所问,言简意赅,避免繁杂的叙述,科学严谨,尤其关注细微之处。如本题中滴有无色酚酞溶液的长滤纸条是“自左向右变红”,不能用“变红”代之。
九、“少”“适”“过”量 绝不一样
例9.(泰安市)某固体可能含有Ca(NO3)2、Na2SO4、Na2CO3、FeCl3、KCl中的一种或几种,现对其进行如下实验:①取少量固体于试管中,加适量蒸馏水,固体完全溶解成无色透明溶液;②取少量上述溶液,加过量稀硫酸,有气泡产生;③取②所得溶液少量,滴加BaCl2溶液,产生白色沉淀。分析以上实验现象,对原固体组成的推断正确的是( )
A.肯定有Na2CO3、Na2SO4,无FeCl3、 Ca(NO3)2
B.肯定有Na2CO3,无FeCl3、Ca(NO3)2
C.肯定有Na2CO3、Na2SO4,无FeCl3
D.肯定有Na2CO3,無FeCl3、KCl
解析:审析试题可知,①取少量固体溶于水,固体完全溶解形成无色透明溶液,可说明原固体中无FeCl3,因为FeCl3溶液呈黄色;②当取少量上述溶液加入过量的稀硫酸时有气泡产生,说明该固体中一定有Na2CO3,则该固体中一定无Ca(NO3)2,因为Na2CO3与Ca(NO3)2会反应生成CaCO3沉淀;③再取②所得少量溶液滴加BaCl2溶液产生了白色沉淀,白色沉淀应是BaSO4,它是由②中加入过量稀硫酸引起的,原固体中是否含有Na2SO4无法确定。所以,该固体中一定含有Na2CO3,无FeCl3和 Ca(NO3)2,无法确定是否含有Na2SO4和KCl。B项符合题意。
答案:B
【点悟】此题极易选A项,因为取②所得少量溶液滴加BaCl2溶液有白色沉淀生成,肯定含有[SO2-4],确定含有Na2SO4,这是对加入过量稀硫酸的疏忽。此题中“过量”蕴含着陷阱,在审题时审清、审准极其重要。在各类试题中对所加试剂的“量”要关注,不能忽视。除杂题中除去杂质所选试剂必须过量,过量的部分必须除去;计算题中过量试剂引发的溶质种类变化也要注意。总之,要关注“量”的情况,不能视而不见,粗心大意,以防止“差之毫厘谬以千里”。
十、遇到“一定” 千万慎重
例10.(无锡市)一包固体粉末可能含有NaNO3、CaCO3、NaOH、CuCl2、Ca(NO3)2和 NaCl中的一种或几种。为确定其组成,某同学设计了图6实验方案:
下列判断正确的是( )
A.蓝色溶液B中阳离子只有Cu2+
B.无色溶液A中一定有NaOH
C.原固体粉末一定有NaCl
D.原固体粉末一定有CaCO3、NaOH、 NaNO3、CuCl2和Ca(NO3)2
解析:此题为推断型选择题,我们可以从所给的物质性质和他们之间相互反应所显示的现象、特征等进行判断。依据蓝色溶液B可判断,该固体粉末中一定含有CuCl2和NaOH,因为他们之间相互反应可生成Cu(OH)2沉淀和NaCl;该沉淀遇稀HNO3后有气体放出,可知固体粉末中一定含有CaCO3。所以,在蓝色溶液B中一定存在由CaCO3和Cu(OH)2分别与稀HNO3反应生成的Ca(NO3)2和 Cu(NO3)2。在无色溶液A中一定存在由CuCl2和NaOH反应生成的NaCl,还可能有没反应的过量的NaOH;一部分溶液A通入CO2生成白色沉淀,可知其中必有Ca(OH)2,Ca(OH)2是由NaOH和Ca(NO3)2反应生成的,因此固体粉末中一定有Ca(NO3)2。无色溶液A另一部分加入稀HNO3和AgNO3溶液产生白色沉淀,说明A溶液中有Cl-,但无法确定Cl-是来自于反应生成的NaCl还是原有的NaCl。另外,NaNO3与上述实验均无关,故也不能确定它的存在。所以,原固体粉末中一定有CaCO3、NaOH、CuCl2和Ca(NO3)2,无法确定NaCl和NaNO3的存在,C、D两项错误;溶液B中一定有Cu(NO3)2和 Ca(NO3)2,A项错误。
答案:B
【点悟】当题设给出“一定”是什么,“一定”不是什么时,要慎重处理,要在对实验现象所呈现的实际情况、物质性质特征等进行深入思考和分析推理后再作出判断。总之,要做到有理有据地说明,不可轻易判断。
十一、重视类推 不可亂推
例11.(襄阳市)推理是学习化学的一种重要方法。下列推理正确的是( )
A.氧化物中含有氧元素,所以含有氧元素的化合物都是氧化物
B.溶液中有晶体析出时,溶质质量减小,所以溶质的质量分数一定减小
C.碱性溶液能使紫色石蕊溶液变蓝,所以能使石蕊溶液变蓝的溶液一定呈碱性
D.碳酸盐与盐酸反应放出气体,所以与盐酸反应放出气体的物质一定是碳酸盐
解析:审析试题后分析各选项:A项,氧化物是只含有两种元素且其中一种元素是氧元素的化合物,因此含有氧元素的化合物不一定是氧化物,如KClO3,错误;B项,当某溶液降温结晶时,溶质质量会减小,溶质质量分数也会减小,但当恒温蒸发饱和溶液结晶时,溶质质量减小,溶剂质量也会减小,其溶质质量分数不变,错误;C项,碱性溶液可使紫色石蕊溶液变蓝,使紫色石蕊溶液变蓝的溶液一定显碱性,正确;D项,与盐酸反应放出气体的物质不一定是碳酸盐,也可以是金属,错误。
答案:C
【点悟】逻辑推理是化学学习中一种常见的学习方法,它往往是依据两个不同物质在某些方面(如特征、变化)类同之处去推测它在其他地方类同之处,或是根据已有知识和经验进行举一反三或迁移其他类似的事物。此类试题在近几年的中考试题中不断出现,学生常因概念不清、条件把握不准、分析不透,只注重表面而忽略其原理、条件等实质而在类推时出现错误。我们在做此类题时应“先析后理”,即对给出的论断抓住问题实质,依据化学原理进行分析,从而作出正确的判断,要类推而不乱推。
十二、做信息题 先学后仿
例12.(株洲市)硫是一种比较活泼的非金属元素,硒(Se)的化学性质与硫相似。在加热条件下,硫可与NaOH溶液反应生成硫化钠(Na2S)、亚硫酸钠(Na2SO3)和水,硒也能与NaOH溶液发生类似反应。请写出在加热条件下硒与NaOH溶液反应的化学方程式:
。
解析:审析试题可知,硒(Se)的化学性质与S相似,S在加热条件下可与NaOH反应生成Na2S、Na2SO3和H2O,那么硒(Se)与NaOH反应就可生成Na2Se、Na2SeO3和H2O。由此可顺利地完成其化学方程式:3Se+6NaOH[]2Na2Se+Na2SeO3+3H2O。
答案:3Se+6NaOH[]2Na2Se+Na2SeO3+3H2O
【点悟】此题为信息题,信息题的一个重要特点是具有“新意”,题设中所给出的多半是我们所不知道的“新知识”“新方法”“新情景”。“新意”对同学们来讲是陌生的,但不都是解题所必需的关键所在。在做题时,我们可以“先学后仿”,即先现场自学,从中理解和领悟题设的“新意”,而后联系、类比、推理等进行迁移,模仿着去解答。

