NAC对河南华溪蟹卵巢镉氧化损伤的缓解作用
陈红苗,许 鹏,吴中强,井维鑫,王 兰
(山西大学生命科学学院,太原 030006)
NAC对河南华溪蟹卵巢镉氧化损伤的缓解作用
陈红苗,许 鹏,吴中强,井维鑫,王 兰*
(山西大学生命科学学院,太原 030006)
采用慢性镉暴露同时加入不同浓度N-乙酰半胱氨酸(NAC)的方法,以河南华溪蟹卵巢组织镉含量,超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GPx)活性,脂质过氧化水平(MDA含量)和卵巢组织细胞结构的变化为指标,探究了NAC对河南华溪蟹(Sinopotamon henanense)卵巢镉氧化损伤的缓解作用。实验设置对照组、镉(0.725 mg·L-1)单一作用组、镉(0.725 mg·L-1)和NAC(0.1、0.2、0.4 g·L-1)联合作用组,结果显示:镉单一作用下,卵巢组织镉含量和MDA含量显著高于对照组;SOD、CAT和GPx活性在不同时间点显著升高;组织显微结构出现不同程度损伤。NAC和镉联合作用下,卵巢组织镉含量在14 d和28 d显著降低;SOD活性于14 d显著降低;CAT、GPx活性和MDA含量均在28 d降低,并逐渐恢复到正常水平;随着时间的延长和NAC浓度的增加,卵巢组织细胞损伤程度出现改善,核膜逐渐完整,仅有少量染色质凝集,细胞内及细胞核内空泡化现象基本消失,卵巢组织结构趋于正常化。实验结果表明,NAC对镉诱导的河南华溪蟹的生殖毒性具有缓解作用,同时进一步证实了氧化损伤是镉生殖毒性的重要机制之一。
河南华溪蟹;卵巢;N-乙酰半胱氨酸(NAC);氧化损伤;镉
重金属污染已成为全球面临的主要问题之一,其中镉作为典型的重金属污染物广泛存在于水体环境中[1-2],对水生生物的毒害作用引起了广泛关注[3-4]。有研究显示,镉对雌性生殖系统具有明显的毒理效应,可直接作用于卵巢引起卵巢皮质区变薄,卵母细胞损害或缺失,生长及成熟卵泡减少或空泡化,甚至产生降低排卵和受精能力等生殖功能障碍[5-6]。
甲壳动物具有富集污染物的特点[7-8],其中河南华溪蟹(Sinopotamon henanense)是我国特有的淡水蟹种,易采易养,营底栖生活,体内更易富集底栖环境中的重金属等污染物[9-12]。本研究拟在建立镉诱导河南华溪蟹卵巢氧化损伤模型的基础上,选用一种相关的保护剂探究对生殖毒性的缓解作用。课题组前期就镉对河南华溪蟹卵巢抗氧化系统的影响研究显示,0.725 mg·L-1镉溶液处理28 d对河南华溪蟹卵巢损伤较大[13]。N-乙酰半胱氨酸(N-acetylcysteine,NAC)是机体合成还原型谷胱甘肽(GSH)的原料,具有还原性巯基(-SH),可通过抑制和清除一些活性氧和自由基直接对抗过氧化性损伤,增加机体抗氧化能力,保护细胞[14],是一种广泛应用于临床和实验的抗氧化剂。鉴于此,本实验将NAC和镉同时作用于河南华溪蟹,研究了卵巢组织中超氧化物歧化酶(Superoxide dismutase,SOD)、过氧化氢酶(Catalase,CAT)和谷胱甘肽过氧化物酶(Glutathione peroxidase,GPx)活性,丙二醛(Malondialdehyde,MDA)含量以及卵巢组织细胞显微结构的变化,旨在为水生动物重金属污染防治提供科学依据。
1 材料与方法
1.1 实验材料
1.1.1 实验动物
2015年9 月于太原市五龙口海鲜市场购买河南华溪蟹(以下简称“溪蟹”),在实验室水族缸(130 cm×50 cm×60 cm)中用曝气48 h以上自来水暂养两周以上。
1.1.2 实验试剂
氯化镉(CdCl2·5H2O,分析纯,天津市博迪化工有限公司);标准镉溶液(1000 mg·L-1,国家环境保护总局标准样品研究所);硝酸、高氯酸(优级纯);NAC(纯度99%,北京索莱宝科技有限公司);苏木素、伊红(Amersco公司);超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GPx)、丙二醛(MDA)和蛋白含量测定试剂盒(南京建成生物工程研究所)。
1.2 实验方法
1.2.1 实验设计
根据课题组前期工作[13]以及冯玉杰等[15]方法,设置清水组(作为阴性对照组)、0.725 mg·L-1Cd2+单一作用组(作为NAC缓解镉毒性效应的阳性对照组)以及Cd2+(0.725 mg·L-1)与不同浓度的NAC(0.1、0.2、0.4 g·L-1)联合作用组共五组。随机选取大小基本一致,体重(20.7±1.5)g的性成熟雌蟹置于处理缸,每组30只,加入曝气48 h的自来水,各处理组加入相应的镉溶液及NAC。染毒期间两天换一次水并喂食,每天定时检查溪蟹的健康状况并除去死蟹及残肢。
1.2.2 样品制备
在暴露7、14、28 d时从各组随机选取5只进行活体解剖,快速取出卵巢组织,部分组织用于组织切片,剩余组织迅速称量后液氮冷冻,-80℃冰箱保存。
卵巢组织经硝酸和高氯酸置于电热板上完全消化,定容后采用原子吸收光谱仪测定[16]。按组织质量∶体积1∶4加入磷酸缓冲液(PBS,pH=7.4),匀浆,4℃、2500 r·min-1离心10 min,取上清液。按照试剂盒说明书测定SOD、CAT、GPx活性,MDA和蛋白含量。取出的卵巢组织放入10%的甲醛溶液固定24 h,经酒精脱水、二甲苯透明、浸蜡、包埋切片后进行HE染色,中性树胶封片,光镜下观察。
1.2.3 数据处理
用SPSS 15.0进行数据处理,用单因素方差分析(One-Way ANOVA)进行统计分析,结果用平均值±标准差(Mean±SD)表示。*表示与对照组相比,镉单一处理组存在显著性差异(P<0.05);#表示与镉单一处理组相比,加NAC处理组存在显著性差异(P<0.05)。
2 结果与分析
2.1 NAC对镉在溪蟹卵巢组织中积累量的影响
如图1所示,在镉单一作用下,随着时间的延长,卵巢中镉的积累量逐渐增加,14 d和28 d出现显著性差异。与镉单一处理组相比,镉和NAC联合作用组卵巢中镉的积累量呈现下降趋势,并在7 d 0.725 mg· L-1Cd2++0.4 g·L-1NAC处理组,14 d 0.725 mg·L-1Cd2++(0.1、0.4)g·L-1NAC处理组,28 d 0.725 mg·L-1Cd2++(0.2、0.4)g·L-1NAC处理组显著下降。
2.2 镉及NAC对溪蟹卵巢组织抗氧化酶活性及脂质过氧化水平的影响
2.2.1 对溪蟹卵巢组织SOD的影响
由图2a可知,与对照组相比,镉单一作用下,随着染毒时间的延长卵巢SOD活力呈现先升后降的趋势,14 d SOD的活力显著升高;与镉单一作用相比,镉和NAC联合作用,14 d时随着NAC浓度的增加SOD活性呈现逐渐下降趋势,且0.725 mg·L-1Cd2++(0.2、 0.4)g·L-1NAC组显著性降低。
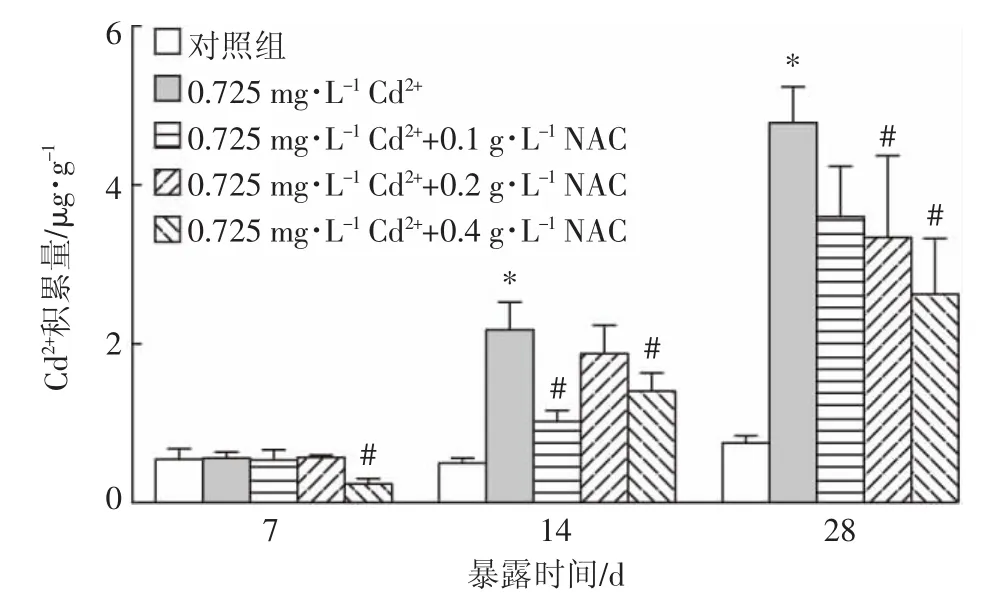
图1 NAC对镉在溪蟹卵巢组织中积累量的影响(n=5)Figure 1 Effect of NAC on the accumulation of cadmium in ovarian tissue of S.henanense(n=5)
2.2.2 对溪蟹卵巢组织CAT的影响
图2b显示,镉单一作用下,卵巢CAT的活力随时间延长呈现升高趋势,28 d显著性升高;与镉单一作用相比,镉和NAC联合作用下,随着时间的延长,同一NAC浓度组CAT活力呈现先升后降的趋势。其中28 d CAT活力显著下降,且接近对照组。

图2 镉及NAC对溪蟹卵巢组织抗氧化酶活性及脂质过氧化水平的影响(n=5)Figure 2 Effects of Cd2+and NAC on antioxidant enzyme activities and lipid peroxidation level in ovary tissue of S.henanense(n=5)
2.2.3 对溪蟹卵巢组织GPx的影响
由图2c观察到,与对照组相比,镉单一作用下,28 d时GPx的活性显著升高;与镉单一作用相比,14 d时随着NAC浓度增加,GPx呈现梯度下降的趋势,28 d时各NAC组均有所下降,其中0.725 mg·L-1Cd2++(0.2、0.4)g·L-1NAC组GPx活力显著下降。
2.2.4 对溪蟹卵巢组织MDA含量的影响
由图2d可知,与对照组相比,镉单一作用下,卵巢MDA含量随着时间的延长逐渐升高,其中,14 d和28 d时MDA含量显著升高;与镉单一作用相比,NAC处理组卵巢组织MDA含量随着处理时间的延长呈现逐渐下降的趋势,14 d 0.2 g·L-1NAC组和28 d各NAC组的MDA含量显著下降。
2.3 镉及NAC对溪蟹卵巢组织显微结构的影响
由图3对照组可知,正常溪蟹卵细胞为卵圆形,细胞内大量被染成粉红色和红色的颗粒是卵黄颗粒,中心细胞核染色较浅,核膜完整,形状规则,内含核仁和染色质;细胞外有一层排列紧密的滤泡细胞,细胞核较大且染色较深,呈深紫色。镉单一作用下,随着处理时间的延长,卵巢出现了不同程度的损伤,镉处理组卵细胞核发生染色质不规则凝集和固缩(图a1、图b1),部分核膜消失,结构不明显(图a1箭头所示),细胞质出现空泡化(图a1、图b1、图c1白色球形结构),细胞核出现空泡化肿胀,形状异常(图c1细胞核所示)。NAC处理组,随着NAC浓度的增加和处理时间的延长,14 d和28 d时卵巢细胞的损伤得到有效缓解,结构趋于正常化,细胞核膜逐渐完整(图b3、图c3),仅有少量染色质凝集(图b2、图b3、图c2、图c3),细胞内及细胞核内空泡化现象基本消失(图b4、图c4)。
3 讨论
镉单一胁迫条件下,溪蟹卵巢组织中镉的富集量随着染毒时间的延长逐渐增加,与相关报道一致[17-18],说明镉在溪蟹卵巢组织中的富集量可以作为检测水环境中镉污染程度的有效指标。本研究结果显示,NAC处理组卵巢中镉的积累量相比镉单一处理组有所降低,28 d效果最显著,说明NAC能够有效降低镉在溪蟹卵巢中镉的积累量,保护机体免受镉的损伤。NAC富含巯基,与镉具有高度的亲和力[19],可以直接螯合游离的镉离子,同时还是体内GSH的前体物质,能提高GSH在细胞内的水平,而GSH也能与镉离子结合,推测NAC可能通过发挥这两个方面的功能抑制镉在溪蟹卵巢组织中的积累,从而削弱镉的毒性作用[20]。
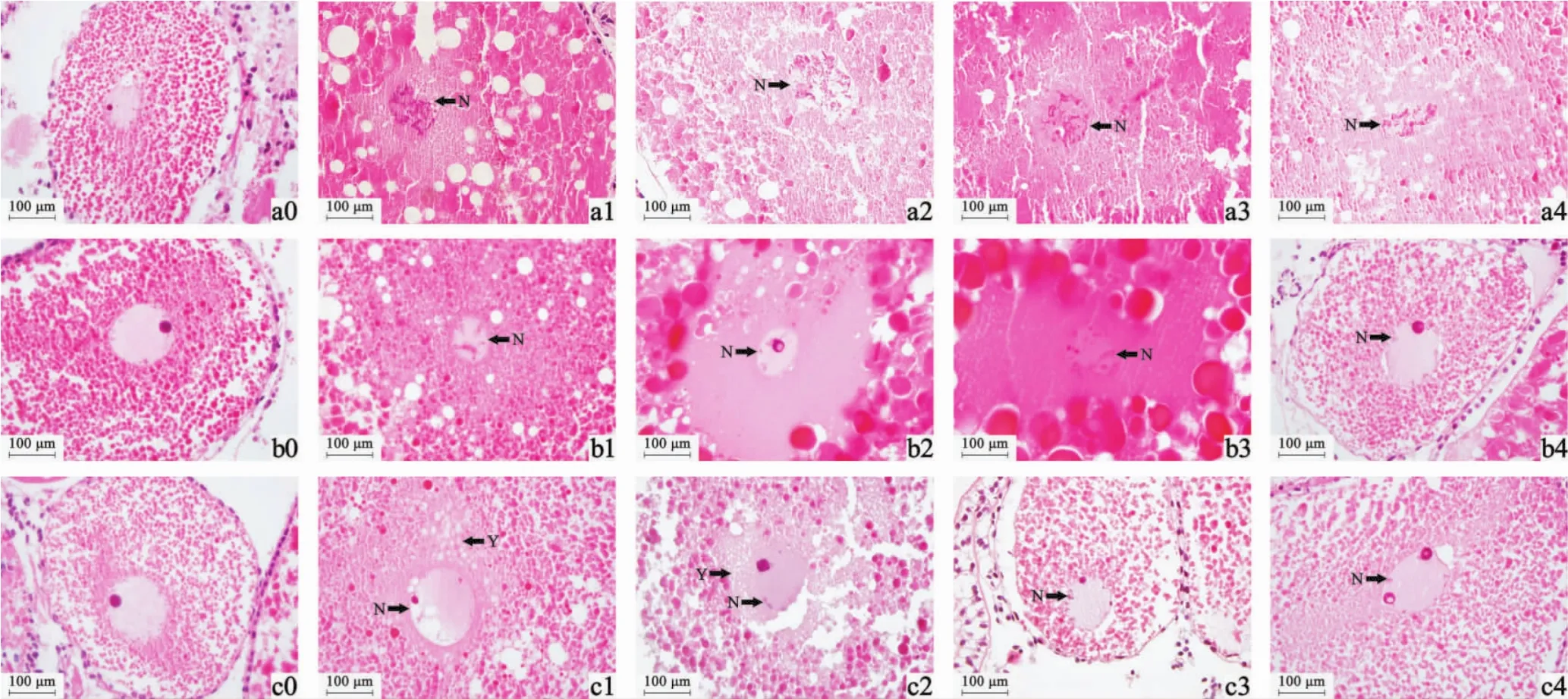
图3 镉及NAC对溪蟹卵巢组织显微结构的影响Figure 3 Effects of Cd2+and NAC on the microstructure in ovary tissue in S.henanense
一系列研究结果显示,氧化损伤是镉毒性作用的主要机制之一,其具体内容包括抗氧化酶活性的改变等[21-23]。SOD、CAT和GPx是生物体内主要的抗氧化酶,能够把对机体有害的活性氧自由基(ROS)转化成无害的H2O和O2,使机体免受氧化损伤[24]。本研究发现,镉胁迫后SOD、CAT和GPx活性显著升高,并且它们在不同的时间点被诱导,可能与它们对活性氧的不同生理功能有关。镉造成机体氧化损伤,产生自由基和超氧阴离子,SOD把高反应性和具潜在毒性的超氧阴离子转化为H2O2,当H2O2积累到一定浓度时,CAT和GPx把H2O2转化为H2O和O2[25],因而SOD活性先于CAT和GPx升高。这与马京津等研究铅对溪蟹卵巢抗氧化酶活力的结果一致[26],且与我们的前期研究结果[13]相吻合。
与抗氧化酶SOD、CAT和GPx功能类似,NAC含巯基,可直接抗过氧化,清除体内的活性氧自由基[27]。目前已有研究显示,NAC对镉所致的动物组织器官或细胞氧化损伤具有一定的缓解作用[28]。本研究显示,NAC处理组与镉处理组相比,SOD、CAT和GPx活性均随着浓度的升高和时间的延长而逐渐降低并接近对照组的水平。可能因为NAC与抗氧化酶共同作用清除机体内活性氧,减少了机体抗氧化酶的氧化应激反应,从而使SOD、CAT、GPx活性在各不同时间段得到显著降低,逐渐恢复到正常水平。
镉诱导机体产生的ROS会引发机体脂质过氧化,MDA作为脂质过氧化反应的终产物,可导致细胞膜变性,功能缺失,还可引起蛋白质、核酸等生命大分子的交联聚合,且具有细胞毒性,其含量可以指示机体氧化损伤的程度[29]。镉单一作用下,随着时间的延长,溪蟹卵巢MDA含量相比对照组显著升高,说明卵巢产生了严重脂质过氧化损伤。镉与NAC联合作用下,处理28 d时卵巢MDA含量显著下降,说明NAC处理有效缓解了镉致溪蟹卵巢产生的脂质过氧化损伤。NAC可以通过螯合机体中的镉而减少镉在组织内的积累,同时NAC还可作为抗氧化剂清除镉诱导产生的ROS,缓解脂质过氧化,降低MDA的含量,从而保护机体免受氧化损伤。
镉对动物生殖系统的毒性作用很大,镉致细胞产生的自由基积累会抑制卵巢的发育,对膜系统及细胞的正常形态产生影响[30]。NAC不仅能够干扰自由基生成,还可以清除已经生成的自由基[19],缓解镉对机体造成的氧化损伤。本研究发现,镉单一处理组卵巢组织细胞出现严重损伤,细胞核内染色质出现不规则固缩边集化、部分核膜结构不明显甚至消失,细胞核及细胞质内出现大量空泡化现象。NAC作用组,随着处理时间的延长和NAC浓度的增加,卵巢的损伤得到有效的缓解,细胞核膜逐渐完整,仅有少量染色质凝集,细胞及核内空泡化现象基本消失,结构趋于正常化,说明NAC对镉引起的溪蟹卵巢组织细胞显微结构损伤的缓解作用效果显著。
4 结论
NAC可以有效缓解镉对溪蟹卵巢造成的氧化损伤,证明了氧化损伤是镉毒性作用的主要机制之一,同时也说明NAC能够保护水生动物,降低镉污染对其造成的危害。
[1]崔玉静,黄益宗,朱永官.镉对人类健康的危害及其影响因子的研究进展[J].卫生研究,2006,35(5):656-659.
CUI Yu-jing,HUANG Yi-zong,ZHU Yong-guan.Adverse health effects of cadmium and related factors[J].Journal of Hygiene Research, 2006,35(5):656-659.
[2]吴婷婷,魏 华,郭 敏,等.镉诱导鲫肝细胞内Ca2+-ATP酶与金属硫蛋白的表达[J].水产学报,2011,35(6):824-830.
WU Ting-ting,WEI Hua,GUO Min,et al.Ca2+-ATPase and metallothionein expressing induced by cadmium in the primary cultured hepatocytes of crucian carp(Carassius auratus)[J].Journal of Fisheries of China,2011,35(6):824-830.
[3]Bai J H,Xiao R,Zhang K J,et al.Arsenic and heavy metal pollution in wetland soils from tidal freshwater and salt marshes before and after the flow-sediment regulation regime in the Yellow River Delta,China[J]. Journal of Hydrology,2012,s450/451(11):244-253.
[4]Lin S,Hsieh I J,Huang K M,et al.Influence of the Yangtze River and grain size on the spatial variations of heavy metals and organic carbon in the East China Sea continental shelf sediments[J].Chemical Geology, 2002,182(2/3/4):377-394.
[5]李 育,马 红,王明艳.镉对体外大鼠卵巢颗粒细胞凋亡影响[J].中国公共卫生,2010,26(9):1171-1172.
LI Yu,MA Hong,WANG Ming-yan.Effect of cadmium on apoptosis of ovarian granulosa cells in vitro[J].Chinese Journal of Public Health, 2010,26(9):1171-1172.
[6]Thompson J,Bannigan J.Cadmium:Toxic effects on the reproductive system and the embryo[J].Reproductive Toxicology,2008,25(3):304-315.
[7]毕士川,于慧娟,蔡友琼,等.重金属Cd在不同水产品中的含量及污染状况评价[J].环境科学与技术,2009,32(4):181-185.
BI Shi-chuan,YU Hui-juan,CAI You-qiong,et al.Assessment on cadmium pollution of aquatic products in Shanghai′s Market[J].Environmental Science&Technology,2009,32(4):181-185.
[8]Poynton H C,Taylor N S,Hicks J,et al.Metabolomics of microliter hemolymph samples enables an improved understanding of the combined metabolic and transcriptional responses of Daphnia magna to cadmium. [J].Environmental Science&Technology,2011,45(8):3710-3717.
[9]Wang L,Xu T,Lei W W,et al.Cadmium-induced oxidative stress and apoptotic changes in the testis of freshwater crab,Sinopotamon henanense[J].PLoS One,2011,6(11):e27853.
[10]Qin Q,Qin S J,Wang L,et al.Immune responses and ultrastructural changes of hemocytes in freshwater crab Sinopotamon henanense,exposed to elevated cadmium[J].Aquatic Toxicology,2012,106/107(1):140-146.
[11]Liu D M,Yang J,Li Y J,et al.Cd-induced apoptosis through the mitochondrial pathway in the hepatopancreas of the freshwater crab Sinopotamon henanense[J].PLoS One,2013,8(7):e68770-e68770.
[12]Sun M,Li Y T,Liu Y,et al.Transcriptome assembly and expression profiling of molecular responses to cadmium toxicity in hepatopancreas of the freshwater crab Sinopotamon henanense[J].Scientific Reports, 2016,6:19405.
[13]Xu P,Chen H M,Xi Y,et al.Oxidative stress induced by acute and sub-chronic cadmium exposure in the ovaries of the freshwater crab Sinopotamon henanense(Dai,1975)[J].Crustaceana,2016,89(9):1041-1055.
[14]Chen J M,Reheman A,Gushiken F C,et al.N-acetylcysteine reduces the size and activity of von Willebrand factor in human plasma and mice[J].Journal of Clinical Investigation,2011,121(2):593-603.
[15]冯玉杰,徐羊阳,张 龙,等.N-乙酰半胱氨酸对急性乙醇暴露致小鼠睾丸损伤的保护作用[J].安徽医药,2014(11):2044-2048.
FENG Yu-jie,XU Yang-yang,ZHANG Long,et al.N-acetylcysteine protects against acute ethanol-induced testicular injury in mouse[J]. Anhui Medical and Pharmaceutical Journal,2014(11):2044-2048.
[16]马文丽,王 兰,何永吉,等.镉诱导华溪蟹不同组织金属硫蛋白表达及镉蓄积的研究[J].环境科学学报,2008,28(6):1192-1197.
MA Wen-li,WANG Lan,HE Yong-ji,et al.Cadmium accumulation and metallothione in biosynthesis in the fresh-water crab Sinopotamon henanense[J].Acta Scientiae Circumstantiae,2008,28(6):1192-1197.
[17]Ma D D,Hou Y H,Du L J,et al.Oxidative damages and ultrastructural changes in the sperm of freshwater crab Sinopotamon henanense exposed to cadmium[J].Ecotoxicology&Environmental Safety,2013,98(12):244-249.
[18]季相山,赵 燕,丁 雷,等.海湾扇贝对海水中镉的富集规律研究[J].水产学报,2006,30(6):801-805.
JI Xiang-shan,ZHAO Yan,DING Lei,et al.Research on cadmium bioaccumulation in Argopecten irradians[J].Journal of Fisheries of China,2006,30(6):801-805.
[19]曹 瑾.镉对大鼠肾小管上皮细胞的毒性作用及NAC的保护效应[D].扬州:扬州大学,2009:7-8.
CAO Jin.Toxic effect of cadmium on renal tubular epithelial cells in rats and the protective effect of NAC[D].Yangzhou:Yangzhou University,2009:7-8.
[20]Kadima W,Rabenstein D L.Nuclear magnetic resonance studies of the solution chemistry of metal complexes.26.Mixed ligand complexes of cadmium,nitrilotriacetic acid,glutathione,and related ligands[J].Journal of Inorganic Biochemistry,1990,38(4):277-288.
[21]Ferreira L F,Reid M B.Muscle-derived ROS and thiol regulation in muscle fatigue[J].Journal of Applied Physiology,2008,104(3):853-860.
[22]卞建春,王 林,陈大伟,等.铅镉联合暴露对大鼠肾脏的氧化损伤[J].中国兽医学报,2009,29(12):1617-1619.
BIAN Jian-chun,WANG Lin,CHEN Da-wei,et al.Effects of exposure to lead and cadmium on the oxidative damage of kidney in rats[J].Chinese Journal of Veterinary Science,2009,29(12):1617-1619.
[23]Lassen N,Black W J,Estey T,et al.The role of corneal crystallins in the cellular defense mechanisms against oxidative stress[J].Seminars in Cell&Developmental Biology,2008,19(2):100-112.
[24]边平江,邱成功,徐善良,等.盐度对暗纹东方鲀生长、非特异性免疫和抗氧化酶活力的影响[J].水生生物学报,2014,38(1):108-114.
BIAN Ping-jiang,QIU Cheng-gong,XU Shan-liang,et al.Effects of salinity on growth,activity of non-specific immune and antioxidant enzymes in obscure puffer Takifugu obscure[J].Acta Hydrobiologica Sinica,2014,38(1):108-114.
[25]Lawniczak M,Romestaing C,Roussel D,et al.Preventive antioxidant responses to extreme oxygen level fluctuation in a subterranean crustacean[J].Comparative Biochemistry&Physiology Part A Molecular& Integrative Physiology,2013,165(2):299-303.
[26]马京津,徐 团,轩瑞晶,等.铅对河南华溪蟹卵巢抗氧化酶活力和脂质过氧化水平的影响[J].环境科学学报,2012,32(9):2346-2352.
MA Jing-jin,XU Tuan,XUAN Rui-jing,et al.Effects of lead on ovaries lipid peroxidation level and antioxidant enzyme activity in freshwater crab Sinopotamon henanense[J].Acta Scientiae Circumstantiae, 2012,32(9):2346-2352.
[27]Maheswari E,Saraswathy G R L,Santhranii T.Hepatoprotective and antioxidant activity of N-acetyl cysteine in carbamazepine-administered rats[J].Indian Journal of Pharmacology,2014,46(2):211-215.
[28]Wang J C,Zhu H L,Liu X Z,et al.N-acetylcysteine protects against cadmium-induced oxidative stress in rat hepatocytes[J].Journal of Veterinary Science,2014,15(4):485-493.
[29]Rio D D,Stewart A J,Pellegrini N.A review of recent studies on malondialdehyde as toxic molecule and biological marker of oxidative stress[J].Nutrition Metabolism&Cardiovascular Diseases,2005,15(4):316-328.
[30]洪 峰.镉与氧化损伤研究进展[J].国外医学(医学地理分册),2002, 23(3):97-103.
HONG Feng.Research progress of cadmium and oxidative damage[J]. Foreign Medical Sciences(Section of Medgeography),2002,23(3):97-103.
Alleviation of cadmium-induced oxidative stress in Sinopotamon henanense ovarian tissue by N-acetylcysteine
CHEN Hong-miao,XU Peng,WU Zhong-qiang,JING Wei-xin,WANG Lan*
(School of Life Science,Shanxi University,Taiyuan 030006,China)
The aim of this study was to investigate the effects of N-acetylcysteine(NAC)on alleviation of cadmium-induced oxidative stress in Sinopotamon henanense ovarian tissue using the following six indicators:the tissue accumulation of Cd;the activities of antioxidant enzymes superoxide dismutase(SOD),catalase(CAT),and glutathione peroxidase(GPx);the content of malonyldialdehyde(MDA);and the changes in the microstructure of ovarian tissue.The experiment included three groups:the control group,the Cd2+(0.725 mg·L-1)group,and the group of Cd2+(0.725 mg·L-1)combined with NAC at three different levels of concentration(0.1,0.2,or 0.4 g·L-1).The results showed that under the action of cadmium alone,with increasing Cd2+concentration the accumulation of Cd and the content of MDA significantly increased as compared to that in the control group.The activities of SOD,CAT,and GPx increased at different time-points.The microstructure of ovarian tissue was damaged at different levels.For the group of Cd2+combined with NAC at three different levels of concentration,the content of Cd in ovarian tissue decreased significantly on the 14th and the 28th days.The activity of SOD decreased significantly onthe 14th day.The activities of CAT,GPx,and the content of MDA had a significant decrease on the 28th day,and returned to normal levels gradually.With the extension of time and the increase in NAC concentration,the damage to ovarian tissues was alleviated.That is,nuclear membranes were gradually repaired,and there was only a small quantity of chromatin agglutinate.The vacuolation in cells and nuclei almost disappeared,with the structure of ovarian cells returning to normal conditions.The results indicated that NAC could alleviate the cadmiuminduced reproductive toxicity in Sinopotamon henanense.The results of our study support the argument that oxidative stress is one of the important underlying mechanisms of reproductive toxicity of cadmium.
Sinopotamon henanense;ovary;N-acetylcysteine(NAC);oxidative damage;cadmium
X171.5
A
1672-2043(2017)06-1087-06
10.11654/jaes.2016-1545
2016-12-02
陈红苗(1991—),女,山西晋中人,硕士研究生,从事动物生殖毒理学研究。E-mail:1627182584@qq.com
*通信作者:王 兰 E-mail:lanwang@sxu.edu.cn
国家自然科学基金项目(31672293);高等学校博导类基金项目(20111401110010);山西省特色学科重点项目(2011-SXDX-SWX-003);山西省高等学校科技创新项目(113548901027)
Project supported:The National Natural Science Foundation of China(31672293);The Research Fund for the Doctoral Program of Higher Education(20111401110010);The Special Subject and Key Project of Shanxi Province(2011-SXDX-SWX-003);The University Technological Innovation Project of Shanxi Province(113548901027)
陈红苗,许 鹏,吴中强,等.NAC对河南华溪蟹卵巢镉氧化损伤的缓解作用[J].农业环境科学学报,2017,36(6):1087-1092.
CHEN Hong-miao,XU Peng,WU Zhong-qiang,et al.Alleviation of cadmium-induced oxidative stress in Sinopotamon henanense ovarian tissue by N-acetylcysteine[J].Journal of Agro-Environment Science,2017,36(6):1087-1092.

