葡萄灰霉病无公害防治研究进展
柯 杨, 马 瑜, 朱海云, 李 勃, 李 燕, 孙 超
(陕西省微生物研究所, 西安 710043)
葡萄灰霉病无公害防治研究进展
柯 杨, 马 瑜, 朱海云, 李 勃, 李 燕, 孙 超
(陕西省微生物研究所, 西安 710043)
葡萄灰霉病是葡萄生产中最常见、危害最严重的病害之一,主要由灰葡萄孢菌(BotrytiscinereaPers.)引起。概述了葡萄灰霉病病原菌发病规律及侵染特征,重点阐述了葡萄灰霉病无公害防治的研究进展,并对当前研究与应用中存在的问题进行了探讨,以期为该病害的深入研究和有效防治提供参考。
葡萄灰霉病;灰葡萄孢菌;发病规律;无公害防治
葡萄灰霉病是葡萄生产中最常见、危害最严重的病害之一,该病害主要由灰葡萄孢菌(BotrytiscinereaPers.)引起。由于灰葡萄孢菌具有寄主范围广、遗传变异快、传播快等特点使得其在栽培期及采后运输、储藏等不同时期均有发生,给葡萄产业带来严重损失[1]。近年来,我国葡萄种植面积快速增长,但由于单一品种的大面积连片种植、管理水平落后等问题,葡萄灰霉病日趋严重,已成为制约葡萄产业可持续发展的障碍。
多年以来,葡萄灰霉病的防治主要依赖于使用化学合成农药,如多菌灵、乙霉威等。然而,长期广泛应用化学农药使得病原菌对药物的抗性逐渐增强,最终难以有效控制病害发生。与此同时,由于公众对农药安全性的日益关注以及农药污染对生态环境带来的负面影响逐渐凸显,世界各国对葡萄农药残留限制愈发严格,极大限制了葡萄园常规管理过程中对农药的使用。因此,开发新型、高效、低毒的病害防治技术已成为研究人员和产业界人士所共同关注的问题。本文对葡萄灰霉病病原菌及其发病症状、侵染规律、生活史和近年来相关无公害防治研究进行系统总结,以期为葡萄灰霉病的研究及防治提供参考。
1 病原菌的主要特征及发病规律
1.1 葡萄灰霉病特征
1.1.1 葡萄灰霉病病原菌
灰葡萄孢菌(BotrytiscinereaPers.)是富氏葡萄孢盘菌(Botryotiniafuckeliana)的无性世代,属半知菌亚门(Deuteromycotina)丝孢目(Hyphomycetales)葡萄孢属(Botrytis)。B.fuckeliana在分类学上属子囊菌亚门(Ascomycotina)柔膜菌目(Helotiales)孢盘菌属(Botryotinia)。B.cinerea分生孢子梗细长,有分枝,无色、褐色或浅灰色,顶端细胞膨大成球形,其上着生许多小梗;分生孢子为单胞,着生于小梗上,聚集成葡萄穗状,无色或灰色,椭圆形,大小(9~16) μm×(6~10 )μm。在不利的环境条件下,菌丝可以形成(2~4 )mm×(1~3) mm的黑色、坚硬菌核,3℃~27 ℃萌发,产生分生孢子梗和分生孢子。
灰葡萄孢菌的生活史不具有固定周期,可感染生长过程中不同时期、不同组织的植物,并为后续感染果实及灰霉病病症的出现提供条件。因此,采后灰霉病可能是在成熟期直接感染,也可能是由早期果实潜在感染导致,这些都极大地增加了对该病害的防治难度。
1.1.2 葡萄灰霉病发病规律及特征
B.cinerea的生长对温度要求较低,发病温度为5℃~31 ℃,最适宜发病温度为20℃~23 ℃;对湿度的要求较高,在空气相对湿度达90%以上时发病严重。葡萄灰霉病在田间主要危害花序、幼果和成熟的果实,亦可侵染新梢、叶片、果柄等。早春,灰霉病症状最初出现在嫩芽和嫩枝上,受感染的嫩枝和芽出现褐变甚至干枯。开花前,叶片上出现大而不规则的红褐色坏死斑块,这些斑块主要位于叶片边缘。此时的叶片上不一定能观察到灰霉病病症。当灰葡萄孢入侵到开花前的花序时,可使花变干脱落,通常这一阶段的感染可导致巨大的产量损失[2]。病原菌进一步转移侵染果穗后,可在果穗和穗轴上形成由褐转黑的斑块。至成熟期,这些病灶可围绕整个穗轴,导致所感染果实枯萎、脱落。葡萄坐果、着色和成熟期间,病原菌可通过表皮或伤口感染葡萄果粒,进而侵染整串果实。成熟果实上最初出现小褐色斑点或果皮在小刮擦时极易脱落,这种感染往往开始于中心区域进而扩散到整串果实。这种受到灰霉病感染的果实,在气候干燥时干枯,在气候湿润时果面出现明显的灰色霉层。最终,腐烂的果实从葡萄树上萎缩掉落[3]。冬季,B.cinerea附着在植物残体上或留存在土壤表层中以休眠菌丝体和菌核的形态存活(图1),在此阶段,病原可通过受感染土壤和植物残体传播。冬末初春时节,休眠菌丝体和菌核所产生的分生孢子成为春季葡萄灰霉病的传播主体,其分生孢子极易在潮湿的空气中释放并随风扩散。灰葡萄孢菌的分生孢子很少直接侵染组织,主要通过伤口进行侵染。而一旦孢子萌发,菌丝体生长活跃,病原菌可直接侵染花瓣和枝叶。
1.1.3 葡萄灰霉病抗药性研究
目前,对葡萄灰霉的防治主要依赖于化学农药,但农药长期、连续的使用导致灰霉病菌对多种杀真菌剂产生了耐药性。研究发现,在我国葡萄灰霉病对苯并咪唑类(多菌灵)、二甲酰亚胺类(腐霉利)和氨基甲酸酯类(乙霉威)杀菌剂均存在抗药性,且这几种药剂之间存在交互抗性,其中,病原菌对多菌灵的抗药性显著,抗性菌株高达83.5%[6]。进一步研究发现,我国不同葡萄产区灰霉病菌对嘧霉胺也具有抗药性,抗性频率为22.22%~62.5%[7]。国外的研究也发现,德国自2004年起在葡萄园使用啶酰菌胺后,灰霉病病原菌抗性频率显著增加,仅2006—2007年病原菌抗性频率从2%增加到8.3%,2008年增至12.2%,截至2009年高达26.7%[8]。Leroch等在2006—2009年期间对德国葡萄酒主产区的葡萄灰霉病对不同杀菌剂的抗性研究表明,在此期间灰霉病对嘧菌环胺的抗性分别为5.4%、7.0%、21.9%和16.0%,而病原菌对多菌灵和异菌脲这两种在德国不常用的杀菌剂的抗性频率分别为12.2%、10.5%、8.6%、9.3%和6.1%、2.8%、1.1%、3.3%,而当咯菌腈与嘧菌环胺混合使用时未发现葡萄灰霉菌对其产生抗性[8]。
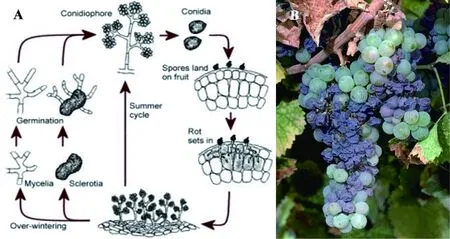
图1 葡萄灰霉病的生活周期及症状[4-5]
A: life cycle ofBotrytiscinerea; B: infection symptoms of grape gray mold
上述研究表明,葡萄灰霉病对不同类别的化学杀菌剂形成的抗药性特点不同,专性杀菌剂比较容易产生抗性,而同类药剂间易产生交互抗性,用药方式及用药时间与抗药性频率存在相关性。因此,在灰霉病的防治过程中,应将不同杀菌剂合理复配或轮用。
2 葡萄灰霉病无公害防治
在实际生产中,为有效防治葡萄灰霉病,应优先选用抗病性好的植株,配方施肥,使树体强健,以增强植株自身抗病能力。建园时选择通风良好的地块,搭建高度适宜的棚架保证通风和采光,来预防、减轻灰霉病的发生。生长季节可通过抬高结果部位或覆盖地膜等方式减少病原菌对果实的侵染;及时修剪并清除发病的部位,防止二次侵染。果实成熟前期,注意控水以减轻发病程度。田间病残枝叶及病果,应集中烧毁或深埋,从根本上减少病菌来源。此外,葡萄采收及采后运输过程中,应注意减少碰伤,降低发病率。
为有效控制灰霉病的发生,满足消费者对食品安全的要求,多种低毒或无毒制剂被用来替代传统化学农药,可将其分为以下几类:1)生物防治(Biological control agents,BCAs);2)天然产物防治(Natural products);3)安全化合物防治(Generally recognize as safe,GRAS);4)物理防治;5)将上述几种方式联合使用。
2.1 生物防治
在生态环境中,微生物可通过拮抗(Antibiosis)、寄生(Parasitism)、诱导抗性(Induced resistance)、竞争(Competition)、促生(Growth-promoting)等一种或多种机制联合来抑制其他微生物的生长。目前,已有多种微生物应用于植物病原菌的生物防治研究中。如Ilhan等连续2年将Bacillusmegateriumand、Pseudomonasvesicularis和Pseudomonasfluorescens应用于草莓灰霉病的田间防治,结果表明这3种微生物单独使用与使用合成农药的效果相当[9]。与田间使用硫酸镁的对照相比较,BacillussubtilisPTA-271、PseudomonasfluorescensPTA-CT2和PantoeaagglomeransPTA-AF2 3种微生物单独或者两两混合在田间使用,均可降低葡萄灰霉病发生率,并且这些菌株的使用对果实产量都没有负面影响[10]。目前,已有商业化的产品应用在植物病原菌的生物防治上,如哈茨木霉T39菌株制成菌剂Trichodex 可防治番茄灰霉病;枯草芽孢杆菌制成的菌剂萎菌净可防治棉花枯萎病;短小芽孢杆菌制成的菌剂YieldShield可用于防治大豆纹枯病。
在葡萄灰霉病的生物防治中,木霉菌、酵母菌、芽孢杆菌、假单胞菌及菠萝泛菌等均对B.cinerea有抑制作用。早在1978年,Dubos等就将木霉属(Trichodermaspp.)用于葡萄灰霉病的生物防治研究[11]。康萍芝等研究发现不同木霉菌种对葡萄灰霉病菌的拮抗作用不同,其中,哈茨木霉(Trichodermaharzianum)、绿色木霉(Trichodermaviride)、长枝木霉(Trichodermalongibrachiatum)及康氏木霉(Trichodermakoningii)表现出较强的竞争优势,对葡萄灰霉病菌的抑菌率达到61.8%~77.6%,进一步研究发现,木霉菌可通过缠绕或穿入病原菌菌丝生长,导致病原菌菌丝断裂、消解及细胞原生质浓缩[12]。Parafati等研究显示酵母菌可通过产生挥发性化合物来抑制B.cinerea的生长,其中一些酵母菌株也可通过在伤口定殖来抑制B.cinerea[13]。枯草芽胞杆菌BacillussubtilisKS1可通过形成伊枯草菌素A(iturin A)抑制葡萄灰霉病的生长[14]。通过研究假单胞菌PseudomonasfluorescensCHA0和Pseudomonasaeruginosa7NSK2对葡萄灰霉病的抗性作用发现,二者均可诱导植株细胞氧化裂解,加速叶片产生植物抗毒素对B.cinerea产生抗性;同时研究发现,其粗提物也可诱导植物细胞产生大量植物抗毒素来抵御病原菌[15]。Muzammil通过研究放线菌SaccharothrixalgeriensisNRRL B-24137对B.cinerea的抑制作用发现,S.algeriensis可在葡萄根部表面定植或内生定植,通过增强植株系统防御能力来抑制病原菌,降低其对植株的感染[16]。此外,Ulocladiumatrum可诱导叶片中几丁质酶活性升高,激发植物的防御机制,增强植株对灰霉病的抵抗能力,菌株U.atrum13亦可定殖在葡萄幼苗上并促进其生长[17]。菠萝泛菌PantoeaananatisBLBT1-08可降低B.cinerea的发病率[18]。
2.2 天然产物及安全化合物防治
目前,用于防治葡萄灰霉病感染的天然产物及安全化合物主要有各种盐类、几丁质、那他霉素、植物油、植物提取物、堆肥茶以及蛋白水解物。在灰霉病高发区,应用1%(W/V)的山梨酸钾(PSo)、碳酸氢钾(PB)、钙螯合物(CCh)溶液处理葡萄均可有效降低采后灰霉病的发生[19]。不同的几丁质酸溶液处理感染B.cinerea的葡萄可有效降低因灰霉病引起的果品腐烂率(60%~78%)[20]。肉桂叶油作为天然杀菌剂和抗氧化剂,在不影响果实抗氧化性的同时可降低由B.cinerea引起的腐烂,利用肉桂叶油蒸汽或涂膜可控制灰葡萄孢菌引起的葡萄腐烂并提高葡萄的抗氧化能力,提升果实的风味[21]。小地榆(Sanguisorbaminor)提取物处理可以显著抑制B.cinerea孢子萌发和萌发管伸长。花叶滇苦菜(Sonchusasper)提取物处理采后葡萄,可降低灰霉病发病率及感染率[22]。Evans等应用堆肥茶也可降低葡萄的灰霉病发生率[23]。Lachhab等研究了蛋白水解物对于灰霉病的防治效果。与水对照相比较, 大豆蛋白水解物(SoyA)和酪蛋白水解物(Cas)喷施使得葡萄灰霉病的田间发病率分别降低了65%和92%。田间使用和采后喷施联用SoyA及Cas 分别使储藏期的灰霉病发生率降低了56%和40 %[1]。
2.3 物理防治
葡萄灰霉病的物理防治方法包括UV-C辐照及气调方法。UV-C单独处理可诱导葡萄产生白藜芦醇,诱发植物防御反应,显著降低灰霉病的发生,同时减轻灰霉病病情[24]。40%CO2气体储前处理或进行环境气调(12%O2+12%CO2)都可在不影响到葡萄的感官品质的同时显著降低葡萄采后灰霉病的发生,而环境气调效果优于单独使用CO2气体储前处理效果[25]。不同浓度的臭氧气体处理葡萄后也可有效抑制果品灰霉病的发生[26]。Ozkan等进一步研究浓度为200~350 μL/L的臭氧在不同相对湿度条件下(35%、75%和95%)对B.cinerea的抑制能力发现,当环境相对湿度较高时,臭氧对B.cinerea分生孢子的致死率高,同时,臭氧气体处理可降低鲜食葡萄灰霉病的感染率(45%~85%)[27]。Romanazzi等将葡萄在1.5 atm下处理24 h后可减少葡萄对B.cinerea的感染[28]。
2.4 多种方式联合
UV-C与几丁质联合使用对灰霉病的抑制效果优于二者单独使用[24]。果品冷藏前,在20℃用UV-C与几丁质联合处理葡萄24 h,不仅可以保持果实风味,还降低了腐烂率[29]。隋莎莎等的研究显示,纳他霉素结合柠檬酸处理对葡萄采后灰霉菌的抑制活性起到协同增效作用,对孢子萌发和菌丝生长的抑制率提高,显著抑制活体损伤接种病原菌葡萄果实表面的病斑增长[30]。本研究室前期利用普鲁兰糖和乙醇复合处理对鲜食葡萄采后灰霉病的防治效果显示,当使用相同剂量时,两种物质混合使用的防治效果明显优于单独使用的,且混合使用能够更好地延缓果实水分、维生素C含量和可溶性固形物的丧失,降低在贮藏期内果实的呼吸强度,在有效降低普鲁兰糖及乙醇使用剂量的同时起到有效的防病保鲜效果。同时研究发现,纳他霉素与普鲁兰糖复合涂膜处理也能有效抑制储藏期鲜食葡萄采后灰霉病的发生[31-32]。Chervin等在葡萄浆果着色期开始至葡萄成熟采摘期,用16%的乙醇+1% CaCl2水溶液喷施植株来替代化学农药,其结果显示,与无喷施对照相比较,到收获时葡萄灰霉病引起的腐烂下降了10%,果实商品率达95%(仅有5%腐烂)。葡萄采后储存6个星期,腐烂率较对照降低了50%[33]。Guerra等将几丁质和薄荷精油混合应用于防治葡萄采后病害,研究结果表明,与空白对照相比较,不同浓度的几丁质和薄荷精油混合物组合均可在室温和低温下延缓灰霉病的发生时间以及降低灰霉病的发生率[34]。
3 问题与展望
葡萄种植可带来巨大的经济效益,因此产业界和学者对于葡萄灰霉病的防治尤为关切。目前,化学农药在灰霉病的防治中仍占主导地位,随着葡萄栽种面积的不断扩大,利用新型可替代策略来控制病害的发生已成为产业界的迫切需求,安全、环保、经济、可行等特点使无公害防治手段日益受到重视。
目前,已经报道的葡萄灰霉病无公害防治手段,特别是生物防治手段,绝大多数局限于实验室或田间防效试验,仅有少部分获得商业化应用。首先,利用微生物发酵制备的生防菌剂,在田间使用时易受外界环境的影响,防效不稳定;其次,利用生防菌代谢产生的抗菌活性物质进行葡萄灰霉病防治时,存在发酵时间长、活性成分少、成本高等问题。因此在研究过程中应更多地考虑后续实际应用,如:筛选对不良环境耐受性好的菌株;采用多菌复配联用,提高稳定性;或利用基因工程技术优化菌株发酵提取工艺,可在提高有效成分的同时降低生产成本。此外,在生产实际中,基于鲜果自身易受损伤的特点,鲜食葡萄采后应及时包装以减少人为损伤,加强果实采前、采后防治处理。最后,对病原菌侵染机制的深入研究,选育抗病新品种,加强田间管理,将多种防治手段联合管控,才能有效地防控葡萄灰霉病的发生。
[1]LACHHAB N, SANZANI S M, BAHOUAOUI M A, et al. Effect of some protein hydrolysates against gray mould of table and wine grapes[J]. European Journal of Plant Pathology, 2016, 144(4): 821-830.
[2]HILTON J. Botrytis Bunch Rot [EB/OL]. http://fruit.cfans.umn.edu/grapes/pest/grapeipmguide/disease/botrytis-bunch-rot/, 2007-01-17.
[3]昌云军, 王夕叶. 美国红提葡萄栽培图册 [M]. 北京: 台海出版社, 2000: 93-94.
[4]Bunch rots-Botrytiscinereaand other factors [EB/OL]. http://www.ipm.ucdavis.edu/PMG/GARDEN/FRUIT/DISEASE/bunchrots.html, 2014-04-25.
[5]What is Botrytis or Gray Mold? [EB/OL]. http://www.alchimiaweb.com/blogen/botrytis-gray/, 2015-02-13.
[6]严 红, 燕继晔, 王忠跃, 等. 葡萄灰霉病菌对3 种杀菌剂的多重抗药性检测 [J]. 果树学报, 2012, 29(4):625-629.
[7]张 玮, 乔广行, 黄金宝, 等. 中国葡萄灰霉病菌对嘧霉胺的抗药性检测[J].中国农业科学, 2013, 46(6): 1208-1212.
[8]LEROCH M, KRETSCHMER M, HAHN M. Fungicide resistance phenotypes ofBotrytiscinereaisolates from commercial vineyards in South West Germany [J]. Journal of Phytopathology, 2011, 159(1): 63-65.
[9]ILHAN K, KARABULUT O A. Efficacy and population monitoring of bacterial antagonists for gray mold (BotrytiscinereaPers. ex. Fr.) infecting strawberries[J]. BioControl, 2013, 58(4): 457-470.
[10]AZIZ A, VERHAGEN B, MAGNIN-ROBERT M, et al. Effectiveness of beneficial bacteria to promote systemic resistance of grapevine to gray mold as related to phytoalexin production in vineyards[J]. Plant and Soil, 2016, 405(1): 141-153.
[11]DUBOS B, BULIT J, BUGARET Y, et al. The possibilities of usingTrichodermaviridefor the biological control ofBotrytiscinereaandPhomopsisviticolaon grapevines [J]. Comptes Rendus des Seances de l’Academie d’Agriculture de France, 1978, 14: 1159-1168.
[12]康萍芝, 张丽荣, 沈瑞清. 11种木霉菌对葡萄灰霉病菌的拮抗作用 [J]. 中国农学通报, 2007, 23(8): 392-395.
[13]PARAFATI L, VITALE A, RESTUCCIA C, et al. Biocontrol ability and action mechanism of food-isolated yeast strains againstBotrytiscinereacausing post-harvest bunch rot of table grape [J]. Food Microbiology, 2015, 47: 85-92.
[14]FURUYA S, MOCHIZUKI M, AOKI Y, et al. Isolation and characterization ofBacillussubtilisKS1 for the biocontrol of grapevine fungal diseases [J]. Biocontrol Science and Technology, 2011, 21(6): 705-720.
[15]VERHAGEN B W M, TROTEL-AZIZ P, COUDERCHET M, et al.Pseudomonasspp.-induced systemic resistance toBotrytiscinereais associated with induction and priming of defence responses in grapevine [J]. Journal of Experimental Botany, 2010, 61(1): 249-260.
[16]MUZAMMIL S.SaccharothrixalgeriensisNRRL B-24137: biocontrol properties, colonization and induced systemic resistance towardsBotrytiscinereaon grapevine andArabidopsisthaliana[D]. Toulouse: Laboratoire de G nie Chimique, 2012.
[17]RONSEAUX S, CLЁMENT C, BARKA E A. Interaction ofUlocladiumatrum, a potential biological control agent, withBotrytiscinereaand grapevine plantlets [J]. Agronomy, 2013, 3(4): 632-647.
[18]GASSER F, CARDINALE M, SCHILDBERGER B, et al. Biocontrol ofBotrytiscinereaby successful introduction ofPantoeaananatisin the grapevine phyllosphere [J]. Int J Wine Res, 2012, 4(1): 53-63.
[19]YOUSSEF K, ROBERTO S R. Applications of salt solutions before and after harvest affect the quality and incidence of postharvest gray mold of Italia′table grapes [J]. Postharvest Biology and Technology, 2014, 87: 95-102.
[20]ROMANAZZI G, GABLER F M, MARGOSAN D, et al. Effect of chitosan dissolved in different acids on its ability to control postharvest gray mold of table grape [J]. Phytopathology, 2009, 99(9): 1028-1036.
[21]MELGAREJO-FLORES B G, ORTEGA-RAM REZ L A, SILVA-ESPINOZA B A, et al. Antifungal protection and antioxidant enhancement of table grapes treated with emulsions, vapors, and coatings of cinnamon leaf oil [J]. Postharvest Biology and Technology, 2013, 86: 321-328.
[22]GATTO M A, IPPOLITO A, LINSALATA V, et al. Activity of extracts from wild edible herbs against postharvest fungal diseases of fruit and vegetables [J]. Postharvest Biology and Technology, 2011, 61(1): 72-82.
[23]EVANS K J, PALMER A K, METCALF D A. Effect of aerated compost tea on grapevine powdery mildew, botrytis bunch rot and microbial abundance on leaves [J]. European Journal of Plant Pathology, 2013, 135(4): 661-673.
[24]ROMANAZZI G, GABLER F M, SMILANICK J L. Preharvest chitosan and postharvest UV irradiation treatments suppress gray mold of table grapes [J]. Plant Disease, 2006, 90(4): 445-450.
[25]TELES C S, BENEDETTI B C, GUBLER W D, et al. Prestorage application of high carbon dioxide combined with controlled atmosphere storage as a dual approach to controlBotrytiscinereain organic Flame Seedless′ and Crimson Seedless′ table grapes [J]. Postharvest Biology and Technology, 2014, 89: 32-39.
[26]GABLER F M, SMILANICK J L, MANSOUR M F, et al. Influence of fumigation with high concentrations of ozone gas on postharvest gray mold and fungicide residues on table grapes [J]. Postharvest Biology and Technology, 2010, 55(2): 85-90.
[27]OZKAN R, SMILANICK J L, KARABULUT O A. Toxicity of ozone gas to conidia ofPenicilliumdigitatum,Penicilliumitalicum, andBotrytiscinereaand control of gray mold on table grapes [J]. Postharvest Biology and Technology, 2011, 60(1): 47-51.
[28]ROMANAZZI G, NIGRO F, IPPOLITO A. Effectiveness of a short hyperbaric treatment to control postharvest decay of sweet cherries and table grapes [J]. Postharvest Biology and Technology, 2008, 49(3): 440-442.
[29]FREITAS P M, L PEZ-G LVEZ F, TUDELA J A, et al. Postharvest treatment of table grapes with ultraviolet-C and chitosan coating preserves quality and increases stilbene content [J]. Postharvest Biology and Technology, 2015, 105: 51-57.
[30]隋莎莎, 李志文, 张 平, 等. 纳他霉素结合柠檬酸处理对葡萄采后灰霉菌的抑制活性 [J]. 食品科学, 2013, 34(24): 299-303.
[31]马 瑜, 张晓瑞, 李宝庆,等. 乙醇与普鲁兰糖复合处理对鲜食葡萄采后灰霉病的防治效果 [J].果树学报, 2014 (5): 906-911.
[32]杨建华, 马 瑜, 柯 杨, 等. 纳他霉素与普鲁兰糖复合处理对鲜食葡萄采后灰霉病的防治 [J].陕西农业科学, 2015, 61(3): 41-45.
[33]CHERVIN C, LAVIGNE D, WESTERCAMP P. Reduction of gray mold development in table grapes by preharvest sprays with ethanol and calcium chloride [J]. Postharvest Biology and Technology, 2009, 54(2): 115-117.
[34]GUERRA I C D, DE OLIVEIRA P D L, SANTOS M M F, et al. The effects of composite coatings containing chitosan andMentha(piperitaL. orxvillosaHuds) essential oil on postharvest mold occurrence and quality of table grape cv. Isabella[J]. Innovative Food Science & Emerging Technologies, 2016, 34: 112-121.
Research progress in nuisanceless control techniques of grape gray mold
KE Yang, MA Yu, ZHU Hai-yun, LI Bo, LI Yan, SUN Chao
(Shaanxi Microbiology Institute, Xi’an 710043, China)
Grape gray mold is one of the very common and main diseases distributed on the production of grape worldwide. The disease is mainly caused byBotrytiscinerea. The study summarized the pathological features and infectious regularity of the grape gray mold pathogen. The research achievements of nuisanceless control techniques on grape gray mold were emphasized at the same time. Furthermore, the problems existed in current research and application were also discussed, which will provide references for the further research and effective control of this disease.
grape gray mold;Botrytiscinerea; epidemic regularity; nuisanceless control
2016-07-11;
2016-08-22
陕西省农业攻关计划项目(2015NY029, 2015NY038, 2015NY042); 陕西省科学院应用基础研究专项(2015K-11); 西安市现代农业创新计划项目〔NC1314(2), NC1404(3)〕
柯 杨, 硕士, 助理研究员, 主要从事植物真菌病害的生物防治研究, Email: keyang-bio@163.com
马 瑜, 副研究员, 主要从事植物病害的生物防治研究,Email: wefly@ms.xab.ac.cn
S436.631
A
2095-1736(2017)03-0087-05
doi∶10.3969/j.issn.2095-1736.2017.03.087

