紫苏油乳液的制备及其稳定性研究
杜 艳 殷丽君 韩清华 刘海杰
(北京食品营养与人类健康高精尖创新中心;中国农业大学食品科学与营养工程学院1,北京 100083)(中国农业机械化科学研究院2,北京 100083)
紫苏油乳液的制备及其稳定性研究
杜 艳1殷丽君1韩清华2刘海杰1
(北京食品营养与人类健康高精尖创新中心;中国农业大学食品科学与营养工程学院1,北京 100083)(中国农业机械化科学研究院2,北京 100083)
针对紫苏油不饱和脂肪酸含量高,在储存过程中易氧化等特点,以Tween 80和Span 80作为乳化剂,采用高压均质法制备紫苏油乳液。通过激光粒度仪和TURBISCAN稳定性分析仪来探究乳化剂用量、油水比例、高压均质的压力和循环次数及HLB值对紫苏油乳液稳定性的影响,从而提供一种紫苏油乳液制备方法,拓宽紫苏油在食品中的应用范围。结果表明,紫苏油乳液粒径主要分布在300~670 nm。当乳化剂质量分数由0.2%增加至1.2%时,乳液粒径下降,稳定性提高;此时,乳液平均粒径(d=513 nm)最小。随油水比增加,紫苏油乳液稳定性下降;高压均质过程对乳液的稳定性有显著影响,压力越大,循环次数越高,乳液越稳定。与单一乳化剂(HLB=15)相比,复配乳化剂(HLB=8~14)可制得更稳定的乳液,且当HLB值为11时,紫苏油乳液的平均粒径(d=374 nm)最小。运用优化条件制备紫苏油乳液,将其与紫苏油同时置于50 ℃恒温贮藏2周,比较二者过氧化值(POV)变化。结果表明,经过11 d的加速氧化,紫苏油乳液的POV值仅为31.43 mmol/kg,远小于纯紫苏油的POV值(88.76 mmol/kg)。
紫苏油 乳液 稳定性 过氧化值
紫苏(PerillafrutescensL Brit.)又名红苏、苏子、苏麻等,系唇形科紫苏属一年生草本植物,主要分布于喜马拉雅山,在南亚、东亚以及美国、俄罗斯和欧洲也有所种植,于2 000多年前被引入我国并作为中药材广泛使用[1]。紫苏油是紫苏的精华,营养成分丰富,不仅含维生素E、植物甾醇、鲨烯等脂溶性功能成分,也是迄今为止发现的α-亚麻酸含量最高的植物油[2],具有明显的抑菌、抗过敏、抗衰老、降血脂等功能[3]。
紫苏油中含大量不饱和脂肪酸,在工业生产、贮存及烹饪过程中,极易受到光照、温度等因素影响,产生氧化变质问题,使产品不易保存,限制其在食品中的应用。因此,紫苏油的缓释对其在食品中的深度开发具有重要意义。
缓释技术是指在一个特定的体系内,采取某些措施来减小某种目标物质的释放速度,从而在某段时间内,体系中的目标物质可以维持有效浓度,以实现缓慢释放或定时释放,保持长效或减轻相互作用的目的。常见的缓释系统有微胶囊系统、常规乳液系统和特殊乳液系统等。目前,对紫苏油的缓释主要集中在微胶囊化研究,而将其制备为乳状液形式以提高功能性成分的稳定性却鲜有报道。
乳状液是一类由2种互不相溶的液体及表面活性剂组成的热不稳定多分散体系,其中一相由液滴(分散相)组成,另一相称为分散介质(连续相),分散相粒子直径一般在0.1~10 μm之间[4]。一般将乳状液划分为水包油和油包水型两大类,不同类型的乳状液在食品、化工、医药、农药、化妆品和石油开采领域都有广泛的应用。
本研究拟选用食品中常用的非离子表面活性剂Span80和Tween80,通过高压均质法制备水包油型紫苏油乳液,以期提高紫苏油的氧化稳定性和利用价值;并研究不同制备条件对紫苏油乳液稳定性的影响,为适于食品烹制的紫苏油产品研发提供借鉴。
1 材料与方法
1.1 材料与试剂
紫苏油:吉安市华美香料油提炼厂,密度为0.917 7 g/cm3;Tween 80:北京北化永能化工有限公司,黄色黏稠液体,含水量≤1.0%;Span 80:天津市致远化学试剂有限公司,棕色油状液体,含水量≤1.0%。
1.2 仪器与设备
ESB-500实验室高剪切均质乳化机:上海易勒机电设备有限公司;NS 1001L高压均质机:意大利GEA Niro Soavi公司;TURBISCAN LAB Expert浓缩体系稳定性分析仪:法国Formulaction公司;LS230激光颗粒粒度分析仪:美国贝克曼仪器公司。
1.3 试验方法
1.3.1 紫苏油乳液的制备
将适量乳化剂分别溶解于去离子水和紫苏油;将油相转入水相,边加边搅拌,待完全加入后,使用高剪切均质乳化机于11 000 r/min,均质2 min,得到粗乳液;经高压均质机进一步均质乳化,制得紫苏油乳液。本试验采用二级加压,二级均质压力与总压力的比值为1∶10。
1.3.2 试验条件
1.3.2.1 乳化剂用量的选择
改变Tween 80的质量分数分别为0.2%、0.4%、0.6%、0.8%、1.0%、1.2%,在均质压力为60 MPa,循环次数为2次,油水比为1∶9的条件下对紫苏油乳化,并进行稳定性的检测。
1.3.2.2 油水比的确定
根据优选的乳化剂用量,改变油水比分别为1∶9、2∶8、3∶7、4∶6、5∶5,在均质压力为60 MPa,循环次数为2次的条件下对紫苏油乳化,并进行稳定性的检测。
1.3.2.3 均质压力与循环次数的选择
根据上述优选的乳化条件,分别改变均质压力为50、60、70 MPa,循环次数为0、1、2、3,对紫苏油乳化,并进行稳定性的检测。
1.3.2.4 紫苏油乳化最佳HLB值的确定
用Span 80与Tween 80按照一定比例复配为HLB值分别为8、9、10、11、12、13、14的乳化剂,与单独使用Tween 80进行对比,在均质压力为60 MPa,循环次数为2次,乳化剂质量分数为1%,油水比为1∶9的条件下对紫苏油乳化,并进行稳定性的检测。
1.3.3 紫苏油乳液稳定性检测
1.3.3.1 乳液粒径变化评价
利用贝克曼LS230激光颗粒粒度分析仪对新制的紫苏油乳液进行粒径分析。粒径大小以d(diameter,单位μm)表示。试验重复3次,取平均值。
1.3.3.2 TURBISCAN LAB Expert检测样品物理稳定性
取制备的紫苏油乳液20 mL放入TURBISCAN的圆柱形玻璃测试室中,温度设定为25 ℃,每30 min扫描1次,扫描6 h。测得稳定性扫描图谱,并用ΔBS(t)值表示其稳定性。其中ΔBS(t)反映样品的差值背散射光(Backscattering)量随时间的动态变化[5]。
1.3.4 加速氧化过程中油脂POV值测定
1.3.4.1 紫苏油的POV值测定
根据GB/T 5538—2005描述的方法测定:准确称取1~2 g紫苏油于250 mL锥形瓶;加入50 mL乙酸-异辛烷(3∶2)溶液,盖上盖子摇动至样品溶解;加入0.5 mL碘化钾饱和溶液,盖上盖子混匀1 min后置于暗处反应5 min;立即加入30 mL蒸馏水;用0.010 1 mol/L的硫代硫酸钠标准溶液进行滴定,用力振摇至黄色几乎消失时,加入0.5 mL淀粉溶液,继续滴定至蓝色消失为终点。空白不加样品。
过氧化值以毫摩尔每千克(mmol/kg)表示,计算公式如下:
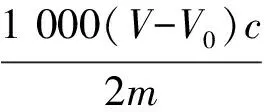
式中:V为用于测定的硫代硫酸钠标准溶液的体积/mL;V0为用于空白的硫代硫酸钠标准溶液的体积/mL;c为硫代硫酸钠标准溶液的浓度/mol/L;m为试样的质量/g。
1.3.4.2 乳液中紫苏油的提取
根据GB/T 5009.168—2003 描述的方法,稍加修改:取40 mL乳液于500 mL烧杯中,按照1∶4的比例加入正己烷;置于磁力搅拌器上搅拌24 h;再于4 000 r/min的条件下离心破乳10 min;合并上清液并于60 ℃旋转蒸发,备用。
1.3.5 数据统计与处理
所有试验均重复3次,所有测试均进行3次以上平行。采用SPSS 20.0软件进行方差分析,试验数值间以Duncan法(P<0.05)进行差异显著性分析。
2 结果与分析
2.1 乳化剂用量对平均粒径的影响
据文献[6],Tween 80在25 ℃下的临界胶束浓度为0.014 g/L,即为Tween 80分子在水中缔合形成胶束的最低质量浓度;且在GB 2760—2014[7]中规定,Tween 80在复合调味料中的最大使用量为10%。因此选用质量分数分别为0.2%、0.4%、0.6%、0.8%、1.0%、1.2%的Tween 80,研究紫苏油乳液粒径随乳化剂质量分数的改变情况,结果如图1所示。

图1 乳化剂质量分数对Tween80制备的紫苏油乳液粒径的影响
由图1可知,当Tween 80的质量分数从0.2%依次增加至0.8%,乳液粒径越来越小,且具有显著性差异(P<0.05),而Tween 80的质量分数达0.8%以上时,其粒径虽然仍呈现下降趋势,但差异性并不显著。
这与Roland等[8]的研究结果一致,表明了在乳化剂结构相同的情况下,乳化剂浓度对于乳液的形成及其稳定性有显著影响。该现象与乳液制备时分散相液滴表面界面膜的紧密程度和强度有关。若乳化剂浓度过低,其液滴界面难以达到饱和吸附,不能形成紧密的界面膜,可能造成小型乳液颗粒聚集,从而获得较大的粒径[9]。
将制备好的乳液按要求装入TURBISCAN分析仪专用的样品瓶中,控制测量室温度为(25+0.5)℃,进行背散射光随时间变化情况的测量,结果如图2所示。
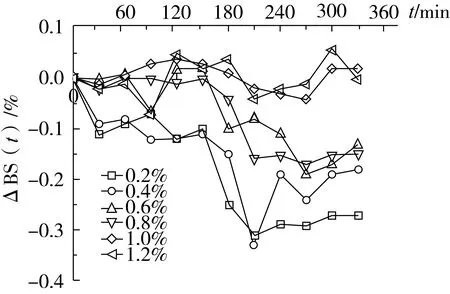
图2 乳化剂用量不同对紫苏油乳液ΔBS(t)与时间的关系
由图2可见,乳化剂质量分数为0.2%与0.4%时,乳液的ΔBS整体上波动较大,在0~30 min呈增大趋势,在30~150 min内呈现不稳定的上下浮动,而在150~210 min内迅速下降,210 min后又略有回升;其他各组在0~60 min内均比较稳定,仅有少量的变化;质量分数为0.6%与0.8% 2组,在60 min之后出现明显的波动,整体呈下降趋势;而质量分数为1.0%及1.2% 2组波动范围较小,整体上较为稳定。
在一定时间内ΔBS可以反映乳液的稳定性。ΔBS越小,表示乳液越稳定,其变化规律也可以反映乳液稳定性的变化规律[9]。由此可知,紫苏油乳液的稳定性随着乳化剂质量分数的增加逐渐提高,质量分数为0.2%和0.4%稳定性最差,而质量分数为1.0%和1.2%时稳定性相差不多,均较其他组好。结合图1和图2可知,紫苏油乳液平均粒径的大小与其稳定性在一定程度上呈负相关,因此选择乳化剂质量分数为1.0%进行后续研究。
2.2 油水比对平均粒径的影响
不同油水比例制得的紫苏油乳液的粒径大小如图3所示。由图3可以看出,在乳化剂浓度一定的条件下,油相在整个体系中的比例越高,紫苏油新制乳液的平均粒径越大。而油水比为1∶9和2∶8时,两者平均粒径并无显著性差异(P<0.05)。这与通过肉眼观察的乳液稳定性也是相符的。油水比为5∶5、4∶6及3∶7的3组,分别在乳液制备完成后的10 min、30 min、1 h之内,出现明显的破乳现象,表面有油珠浮出,表明这3种状况下的乳液并不稳定。

图3 油水比例对紫苏油乳液粒径的影响
发生该现象的原因可能与Tween 80的分子结构有关。Tween 80即失水山梨醇单油酸酯聚氧乙烯醚,其亲油基为碳链—C17H33,亲水基为3个醚基—(OCH2CH2)xOH。油水比例越大,则分散相浓度越高,一方面使得原有用量的乳化剂不足以将全部的油相包埋;另一方面也使乳液颗粒之间距离较近,易于发生碰撞而合并,又由于油的密度比水小,从而发生上浮,不利于乳液的稳定。
2.3 均质压力及循环次数对平均粒径的影响
图4显示了不同的均质压力和循环次数下紫苏油乳液的平均粒径情况。由此可见,高压均质过程对紫苏油乳液的粒径具有很大的影响:不同均质压力下的紫苏油乳液随着循环次数的增高粒径减小显著(P<0.05)[10]。选取均质压力为60 MPa,循环次数为3次即可制得理想的乳液。
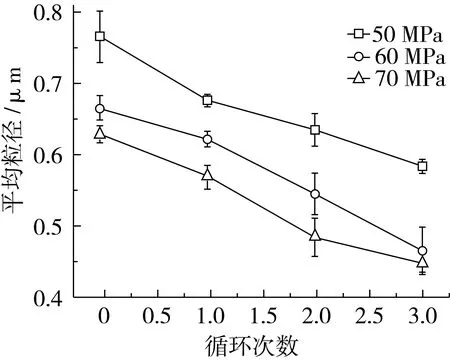
图4 均质压力和循环次数对紫苏油乳液粒径的影响
2.4 HLB值对平均粒径的影响
HLB值即为乳化剂的亲水-亲油平衡值,它是以表面活性剂分子中亲水基团与亲油基团的相对百分比为基础的,通常在0~20之间。HLB值越大,表示乳化剂的亲水性越强[4]。不同应用目的所需的HLB值范围如下表1所示。

表1 表面活性剂HLB范围及应用类型
在乳化剂浓度、油水比、均质压力和循环次数均相同的情况下,使用Span 80与Tween 80复配出不同HLB值的乳化剂,制得的紫苏油乳液粒径大小如图5所示。
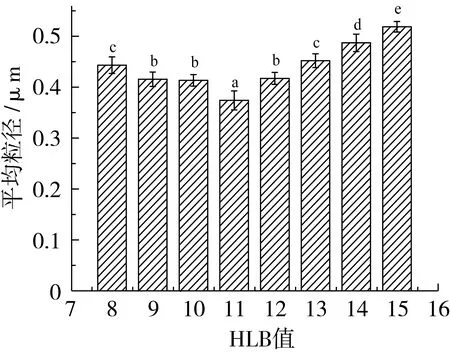
图5 HLB值对紫苏油乳液粒径的影响
从图5中可以看到,HLB值对紫苏油乳液的平均粒径有影响;首先,在乳化剂浓度相同的条件下,使用单一乳化剂Tween 80(HLB=15)和使用Tween 80与Span 80复配乳化剂得到的乳液粒径大小有显著性差异(P<0.05)。HLB值为8~11时,乳液粒径随着HLB值的增加,呈现减小的趋势;HLB值为11,平均粒径达到最小;在HLB值为11~15的范围内,粒径随着HLB值的增加而增大,各组之间差异性显著(P<0.05)。
这与Tween 80及Span 80的分子结构有关:Tween 80是由Span 80与环氧乙烷在碱催化下发生加成反应而得到的衍生物,两者结构相似。因此在混合使用时,其碳氢分子链会相互吸引,使得小分子Span 80插入到大分子Tween 80当中,在界面上吸附形成排列紧密、强度较高的膜,能很好地防止乳滴颗粒聚结,从而提高乳液的稳定性[11]。
使用TURBISCAN分析仪对紫苏油乳液稳定性的评价结果与以上结论相符,如图6所示。

图6 HLB值不同对紫苏油乳液ΔBS(t)与时间的关系
根据图6可知,HLB值为15时乳液的ΔBS波动范围远大于其他各组;这表明,乳化剂复配比使用单一乳化剂对乳液稳定性的提高具有显著作用。
HLB值为11的复配乳化剂制备的紫苏油乳液在6 h内,经TURBISCAN扫描得到的透射光和背散射光随时间的动态变化可反映乳液的稳定性,结果如图7所示。
从图7可见,在0~6 h之内,样品中部的透射光和背散射光均无明显变化,仅在样品瓶的顶部和底部分别出现了上升和下降的现象。这表明,在整个存放过程中,紫苏油乳液仅发生了由分散相与连续相的密度差引起的颗粒上浮现象,并未发生粒径上的变化。这可能是由于Tween 80和Span 80均为非离子乳化剂,在乳液中不存在因电荷作用引起的颗粒之间的吸附或排斥[12]。因此在后续的试验中可以考虑加入阿拉伯胶等多糖作为增稠剂,增加空间位阻,以提高乳液的稳定性。
a 透射光扫描图

b 背散射光扫描图
图7 复配乳化剂制备的紫苏油乳液TURBISCAN扫描图
2.5 紫苏油及其乳液在50 ℃贮藏期间POV值变化
对紫苏油及其乳液在50 ℃恒温条件下进行加速氧化试验[13],每隔2 d测定1次样品的POV值,0~14 d POV值随时间的变化如图8所示。
由图8可以看出,加速氧化2周内,紫苏油乳液的POV从13.33 mmol/kg增加到38.89 mmol/kg,仍符合GB 2716—2005国家食用植物油卫生标准中对POV值的规定;而紫苏油的POV值迅速上升,11 d内已由13.33 mmol/kg增加到88.76 mmol/kg,接着稍有下降。可见,将紫苏油作为油相乳化之后,紫苏油的氧化稳定性可以提高1倍以上。
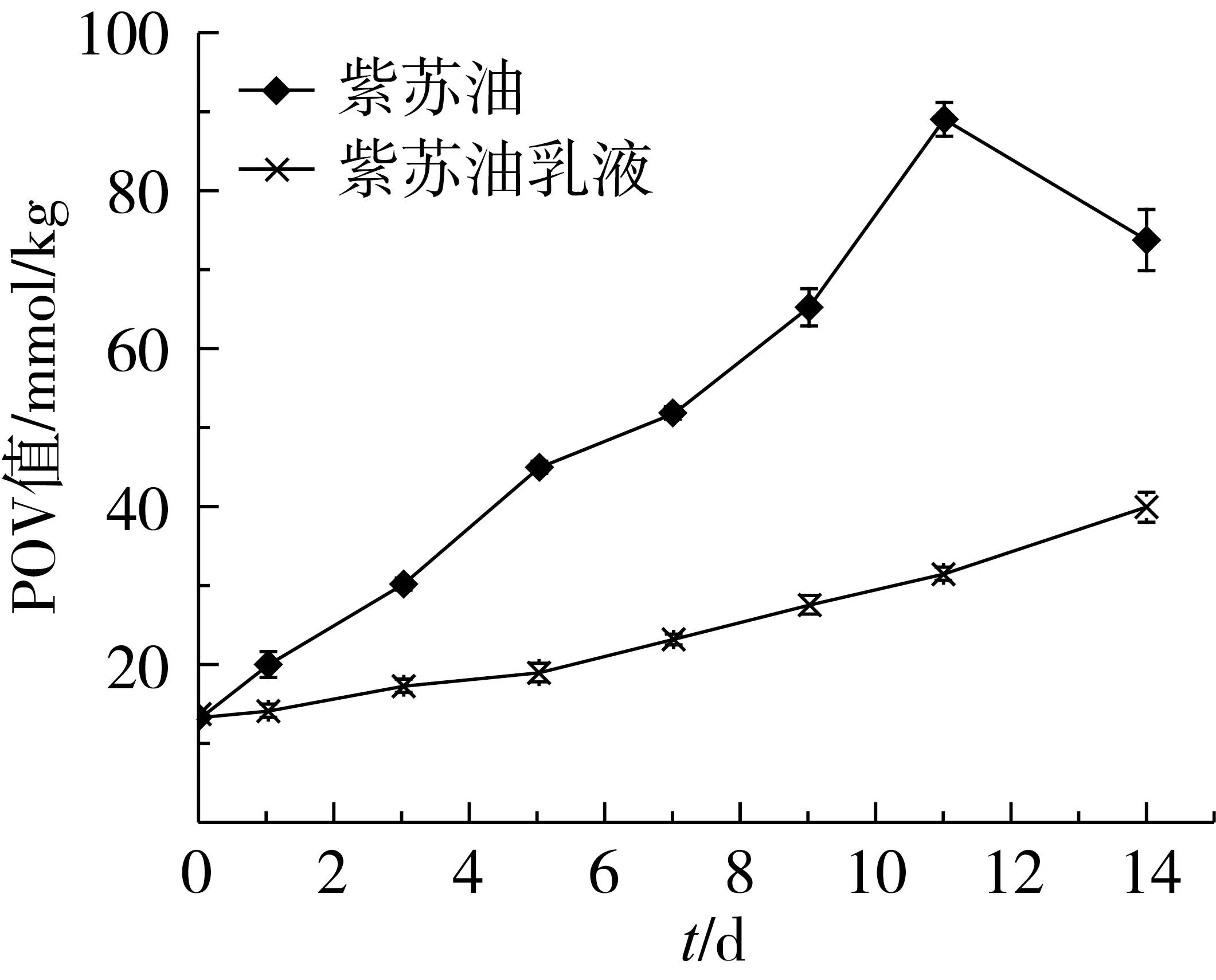
图8 紫苏油及其乳液在50 ℃贮藏过程中过氧化值的变化
3 结论
本研究表明,乳化剂用量、油水比、均质压力和循环次数对紫苏油乳液的粒径大小和稳定性均有影响。随Tween 80用量增加,乳液粒径呈现下降趋势,增至0.8%以上,粒径减小不明显;油水比为1∶9及2∶8时,制得的乳液稳定性高于其他各组,平均粒径随着油水比增加而增加;平均粒径随着均质压力和循环次数的增加而下降,稳定性也相应提高。在此基础上,Tween 80与Span 80复配后制备的紫苏油乳液稳定性均高于单独使用Tween 80时制得的;当复配乳化剂的HLB值为11时,制备的乳液最稳定。对紫苏油乳液在6 h内的TURBISCAN扫描图进行分析,得出紫苏油乳液失稳的主要原因是密度差引起的上浮,对进一步改善紫苏油乳液的稳定性提供了依据。最后根据优选的条件制备紫苏油乳液,并对比该乳液与紫苏油在50 ℃贮藏条件下POV值的变化情况,表明将紫苏油制备成乳液可以使紫苏油的氧化稳定性大幅提高。
[1]Seungduk U, Shiva R B, Nam-Hoon K, et al. Characterization of lipophilic nutraceutical compounds in seeds and leaves of Perilla frutescens[J]. Korean Journal of Horticultural Science and Technology, 2013, 31(2): 231-238[2]Suk Hoo Yoon·Siwon Noh. Positional distribution of fatty acid in Perilla (PerillafrutescensL.) oil [J]. Journal of the American Oil Chemists’ Society, 2011, 88: 157-158
[3]Li Taoyi, Jing Li, Di Geng, et al. Essential oil of Perilla frutescens-induced change in hippocampal expression of brain-derived neurotrophic factor in chronic unpredictable mild stress in mice [J]. Journal of Ethnopharmacology, 2013, 147: 245-253
[4]梁文平. 乳状液科学与技术基础[M]. 北京: 科学出版社, 2001 Liang Wenping. Science and technology of emulsions[M]. Beijing: Science Press, 2001
[5]Menguai O, Meunier G, Cayre I, et al. TURBISCAN MA 2000: multiple light scattering measurement for concentrated emulsion and suspension instability analysis[J]. Talanta, 1999, 50: 445-456
[6]刘程, 李江华, 刘博, 等. 表面活性剂应用手册[M]. 北京: 化学工业出版社, 1995 Liu Cheng, Li Jianghua, Liu Bo, et al. Surfactants application manual[M]. Beijing : Chemical Industry Press, 1995
[7]GB 2760—2014,食品添加剂使用标准[S] GB 2760—2014, National Food Safety standards and Food Additives Standards[S]
[8]Roland I, Piel G,Daletirel B L,et al. Systematic characterization of oil-in-water emulsions for formulation design [J]. International Journal of Pharmaceutics, 2003(263):85-94
[9]孙术国, 高彦祥, 麻成金, 等. TURBISCAN分析仪快速评价β-胡萝卜素乳状液的稳定性[J]. 食品科学, 2008, 29 (10): 93-96 Sun Shuguo, Gao Yanxiang, Ma Chengjin, et al. Rapid evaluation on stability of β-carotene emulsion by TURBISCAN Analyzer[J]. Food science, 2008, 29 (10): 93-96[10]Floury, J.Desrumaux, A. Lardi eres, J. Effect of high-pressure homogenization on droplet size distributions and rheological properties of model oil-in-water emulsions[J]. Innovative Food Science and Emerging Technologies, 2000, 1: 127-134
[11]鲍艳,吴成兰,马建中.乳化方式及助乳化剂对蓖麻油乳化液性能的影响[J].日用化学工业.2012,42 (1):39-42 Bao Yan, Wu Chenglan, Ma Jianzhong. Effect of emulsion method and co-emulsifier on performance of castor oil emulsion[J]. China Surfactant Detergent & Cosmetics, 2012, 42, (1): 39-42
[12]毛立科, 许朵霞, 杨佳, 等. 不同乳化剂制备β-胡萝卜素纳米乳液研究[J]. 食品工业科技, 2008(4): 64-67 Mao Like, Xu Duoxia, Yang Jia, et al. Research on preparation of β-carotene nanoemulsions with different emulsifiers[J]. Science and Technology of Food Industry, 2008(4): 64-67
[13]Yun Shao, Chuan Hetang. Characteristics and oxidative stability of soy protein-stabilized oil-in-water emulsions: Influence of ionic strength and heat pretreatment[J]. Food Hydrocolloids, 2014, 37: 149-158.
Factors Affecting the Preparation ofPerillaOil Emulsion and Its Stability
Du Yan1Yin Lijun1Han Qinghua2Liu Haijie1
(Beijing Advanced Innovation Center for Food Nutrition and Human Health;College of Food Science and Nutritional Engineering, China Agricultural University1, Beijing 100083)(Chinese Academy of Agricultural Mechanization Sciences2, Beijing 100083)
Aiming at the high content of unsaturated fatty acid and being oxidized easily in the storage process features of perilla oil, the perilla oil emulsions were produced by using Tween 80 and Span 80 as emulsifier with the method of high pressure homogenization. In order to explore the effects of emulsifier concentrations, oil-water ratios, high homogenization pressures, numbers of circulation and HLB values on the stability of perilla oil emulsions by means of laser particle analyzer and TURBISCAN, thus, provided a preparation method of perilla oil emulsion and expanded the applied rang of the perilla oil in food industry. The test results showed that perilla oil emulsion particle diameter are mainly distributed between 300 ~ 670 nm and the stability of emulsions was improved with the mass fraction of emulsifier increased from 0.2% to 1.2%. and the decreased emulsion particle diameter. By this time, the average particle diameter (d=513 nm) of emulision was the smallest. With increasing oil-water ratio, the stability of perilla oil emulsion decreases; high pressure homogeneous process has an obvious influence on the stability of emulsion.With a higher pressure and more numbers of circulation, the emulsions tended to be more stable. Compared with single emulsifier (HLB=15), composite emulsifier (HLB=8~14) could produce more stable emulsion and when HLB equaled to 11, the average particle diameter (d=347 nm) of perilla oil emulsion was the smallest. The optimized condition was used to prepare perilla oil emulsions, and stored it together with perilla oil at constant temperature 50 ℃ for 2 weeks,and then compared with the changes of their peroxide value (POV). The results showed that, after an accelerated oxidation process, the POV ofperillaoil emulsion was only 31.43 mmol/kg at 11 d, which was far lower than the POV value (88.76 mmol/kg) of pureperillaoil.
perilla oil, emulsions, stability, peroxide value
“十二五”国家科技支撑计划(2014BAD04B00)
2015-09-28
杜艳,女,1992年出生,硕士,食品科学与工程
刘海杰,女,1973年出生,副教授,食品科学与工程
TS 225.6
A
1003-0174(2017)04-0087-06

